发酵桔梗活性成分分析及抗氧化能力研究△
张月,赵崇杰,韩先磊,孙杨,罗学刚,霍金海,张同存,王伟明,王楠*
1.天津科技大学 生物工程学院 教育部工业发酵微生物学重点实验室,天津 300457;
2.天津市微生物代谢与发酵过程控制工程研究中心,天津 300457;
3.黑龙江省中医药科学院 中药研究所,黑龙江 哈尔滨 150036
桔梗(Platycodonis Radix)为桔梗科桔梗属植物桔梗Platycodon grandiflorum(Jacq.)A.DC.的干燥根,属于药食同源的中药材[1]。桔梗种植广泛,在我国主要产于安徽、河南、湖北、辽宁、吉林等地,以东北、华北产量最高[2]。桔梗始载于《神农本草经》,性微温,味甘、苦、辛,入肺经,具有宣肺利咽、祛痰排脓之功效[1]。由于其含有丰富的黄酮、多酚、皂苷、多糖类物质,因此具有较强的抗氧化、抗肿瘤、抗炎、降血糖、调血脂等功效[3-5]。除了富含这些药效物质外,鲜桔梗中还含有蛋白质、脂肪、碳水化合物等营养成分及钙、磷、铁等矿物质[6]。
近年来,越来越多的研究报道了桔梗提取物的抗氧化作用[7-10]。孙晓春等[7]对安徽、吉林和陕西3个产地桔梗水提物、醇提物和桔梗多糖中主要成分的含量进行测定,分析不同提取物的抗氧化活性,发现桔梗醇提物中总黄酮含量与多糖含量均为安徽>吉林>陕西,同时对1,1-二苯基-2-三硝基苯肼(DPPH)自由基和羟自由基的清除率也为安徽>吉林>陕西。刘华丽等[8]采用正交设计法优化桔梗多酚的提取工艺,并测定了其抗氧化作用。王晓林等[9]优化了利用大孔吸附树脂纯化桔梗茎总黄酮的工艺条件,同时检测了其体外抗氧化活性。李根等[10]通过酶解法制备桔梗汁,对出汁率和多酚含量进行测定,并评价其抗氧化活性,证实酶解工艺制备的桔梗汁具有较强的体外抗氧化活性。
发酵中药成分经微生物发酵转化是其发挥药理作用的关键过程[11]。微生物发酵中药具有提高有效成分含量、增强疗效、扩大适应证、减少不良反应、产生新的药用资源等作用[12]。然而,目前关于微生物发酵桔梗的研究中针对适用菌种的研究较少。因此,本研究选用多个菌株对桔梗进行发酵,对比发酵前后桔梗提取液中总多酚、总黄酮、总多糖含量变化,筛选出优势菌株并分析发酵液的抗氧化活性,为桔梗的进一步开发利用提供参考。
1 材料
1.1 菌株
巨大芽孢杆菌Bacillus megateriumZY2104 和人参芽孢杆菌B.ginsengisoliZY2103 来源于新鲜桔梗根部土壤;类肠膜魏斯菌Weissella paramesenteroidesZY2101 和绿色魏斯菌W.viridescensZY2102 来源于桔梗泡菜;鼠李糖乳杆菌Lactobacillus rhamnosussw01 和枯草芽孢杆菌B.SubtilisRZ001 为本实验室自有菌株;啤酒酵母Saccharomyces pastorianusS5、酿酒酵母S.CerevisiaeAY12 和S.CerevisiaeBY14 由天津科技大学现代酿造课题组馈赠;菌株均保藏于天津科技大学工业微生物菌种资源平台。
1.2 试药
干燥桔梗药材购于河北安国药材基地,由天津科技大学王楠教授鉴定为桔梗科桔梗属植物桔梗Platycodon grandiflorum(Jacq.)A.DC.的干燥根;对照品芦丁(批号:A27GB146690,纯度≥98%)、MRS 培养基、琼脂粉、七叶苷、总抗氧化能力(TAOC)检测试剂盒、福林酚(北京索莱宝科技有限公司);R2A液体培养基(青岛高科技工业园海博生物技术有限公司);蛋白胨、酵母提取物(赛默飞世尔科技公司);对照品没食子酸(批号:C10271829,纯度≥99%)、K3[Fe(CN)5](上海麦克林生化科技有限公司);邻苯三酚、Al(NO3)3、浓硫酸、NaNO2、C2HCl3O2(天津市江天化工技术股份有限公司);柠檬酸铁、水杨酸(上海阿拉丁生化科技有限公司);苯酚(上海生工生物工程有限公司);无水乙醇(天津市立元化工有限公司);对照品桔梗皂苷D(批号:414K024,纯度≥98%,上海源叶生物科技有限公司);FeSO4(天津市北方天医化学试剂厂);H2O2(山东利尔康医疗科技股份有限公司);FeCl3(天津渤化化学试剂有限公司);DPPH(上海吉至生化科技有限公司);HCl、NaOH(天津市科密欧化学试剂有限公司)。
1.3 仪器
TMC 型恒温孵育器(合肥艾本森科学仪器有限公司);S.VS-840U型超净工作台(上海跃进医疗器械厂);SPX-150 型生化培养箱(上海精天仪器有限公司);S30408 型立式压力蒸汽灭菌器(上海博讯实业有限公司医疗设备厂);Hybrid Technology™型多功能酶标仪(美国伯腾仪器有限公司);JIDI-18D型离心机(广州吉迪仪器有限公司)。
2 方法
2.1 培养基配制
MRS液体培养基:蛋白胨10 g、牛肉粉5 g、酵母粉4 g、葡萄糖20 g、聚山梨酯-80 1 mL、磷酸氢二钾2 g、乙酸钠5 g、柠檬酸三铵2 g、硫酸镁0.2 g、硫酸锰0.05 g,加蒸馏水至1 L。调节pH 至7.0,121 ℃高压蒸汽灭菌20 min,用于乳酸菌活化和培养。
MRS琼脂固体培养基:在MRS液体培养基的基础上添加琼脂15 g·L-1,121 ℃高压蒸汽灭菌20 min。用于乳酸菌的分离和纯化。
YPD 培养基:蛋白胨20 g、葡萄糖20 g、酵母提取物10 g。加蒸馏水至1 L。调节pH 至7.0,121 ℃高压蒸汽灭菌20 min。用于酵母的活化和培养。
YPD 琼脂固体培养基:在YPD 液体培养基的基础上添加琼脂15 g·L-1,121 ℃高压蒸汽灭菌20 min。用于乳酸菌的分离和纯化。
E-R2A固体培养基:R2A液体3.2 g、琼脂20 g、七叶苷1 g、柠檬酸铁0.5 g,加蒸馏水至1 L。用于判断微生物的β-D-葡萄糖苷酶活力。
2.2 桔梗发酵液中多酚、黄酮、多糖含量测定
2.2.1 发酵桔梗的制备 将桔梗片粉碎,过40 目筛,精确称量桔梗粉末2.5 g 和蒸馏水50 mL,充分混匀后于121 ℃灭菌20 min,按2%的接种量分别向其中接入各菌种,未发酵组加入等量蒸馏水作为对照组。于37 ℃发酵72 h,将对照组和发酵液组离心后,取全部上清液,用蒸馏水定容到50 mL,灭菌后于4 ℃保存,用于后续实验。
2.2.2 总多酚含量的测定 采用福林酚测定法[13]测定多酚的含量。精确称取没食子酸对照品5 mg,用蒸馏水溶解并定容至50 mL 量瓶中,配制成质量浓度为0.1 mg·mL-1的没食子酸对照品溶液。分别将没食子酸对照品溶液0、1、2、3、4、5、6、7 mL置于试管中,并加入蒸馏水至10 mL,配成0、10、20、30、40、50、60、70 μg·mL-1的系列没食子酸对照品溶液。分别从上述系列对照品溶液中吸1.0 mL于试管中,分别加入蒸馏水5 mL、福林酚试剂1 mL、Na2CO3溶液(0.075 g·mL-1)3 mL,振荡显色1 h后,在760 nm 波长下测定吸光度(A)并绘制标准曲线。将待测样品稀释后取1 mL,按照上述步骤分别加入各种试剂测定A,进行3 次重复实验取平均值,由标准曲线计算出样品中的总多酚含量。
2.2.3 总黄酮含量的测定 用硝酸铝分光光度法[14]测定样品中总黄酮含量。精密称取对照品芦丁5 mg,用70%乙醇溶解并定容在25 mL 量瓶中,配制成0.2 mg·mL-1芦丁对照品溶液。分别吸取芦丁对照品溶液0、0.1、0.2、0.3、0.4、0.5、0.6、0.7 mL置于试管中,分别加入70%乙醇至2 mL,再加入5%的NaNO2溶液0.3 mL,摇匀、静置6 min 后再加入10%的Al(NO3)3溶液0.3 mL,摇匀、静置6 min,加入4%NaOH溶液2 mL,摇匀、静置10 min后,于510 nm 波长下测定A并绘制标准曲线。取待测样品溶液1 mL加入70%乙醇1 mL,如果A过高,则将样品倍数稀释,再按照上述步骤测定,每个样品测3次取平均值。由标准曲线计算出样品中的总黄酮含量。
2.2.4 总多糖含量的测定 采用苯酚-硫酸法[15]测定多糖的含量。称取葡萄糖50 mg 放入100 mL 量瓶中,加水将葡萄糖溶解;再分别吸取葡萄糖溶液0.1、0.2、0.3、0.4、0.5、0.6、0.7 mL,加蒸馏水至2.0 mL,分别加入6%苯酚1.0 mL 和浓硫酸5.0 mL,振荡摇匀,沸水浴中加热15 min 显色,冷却后用紫外分光光度计测490 nm 波长处的A,用水作为空白对照,制得标准曲线,将样品倍数稀释后,按照上述步骤测定,根据标准曲线计算多糖的含量。
2.3 桔梗发酵液皂苷含量、体外抗氧化能力测定
2.3.1 七叶苷显色平板法确定产酶菌 分别取不同微生物,采用三区划线方法接种于含有E-R2A 固体培养基的平板上,37 ℃倒置培养48 h。利用七叶苷显色原理,根据颜色变化(变黑)评估其β-D-葡萄糖苷酶的活性。
2.3.2 菌株生长曲线 取活化后的巨大芽孢杆菌ZY2014 在37 ℃培养24 h,每隔2 h 取1 次样品,以空白培养基为对照,600 nm 下测得样品的A。以生长时间为横坐标,A为纵坐标绘制生长曲线。
2.3.3 皂苷含量的测定 采用香草醛-浓硫酸法[16],精密称取桔梗皂苷D 对照品3 mg,溶于70%甲醇1 mL,充分溶解。分别吸取对照品溶液0、0.1、0.2、0.3、0.4、0.5、0.6 mL,水浴蒸发至干燥,分别加入10%香草醛甲醇溶液0.5 mL 和60%硫酸5 mL,60 ℃水浴加热15 min,冰水浴冷却3 min。于472 nm 波长测定A并绘制标准曲线。取待测样品1 mL,按照上述步骤测定,根据标准曲线计算出样品中桔梗皂苷D的含量。
2.3.4 T-AOC 的测定 桔梗发酵液的T-AOC 检测方法参照试剂盒说明书进行。
2.3.5 DPPH 自由基清除率测定 加入稀释0、2、4、8 倍样品4 mL 和0.15 mmol·L-1DPPH-乙醇溶液4 mL,混匀避光后静止30 min。以蒸馏水为空白组,于517 nm 处测A,按照公式(1)计算DPPH 自由基清除率。

式中A0为空白组吸光度,A1为样品吸光度,A2为对照组吸光度(以乙醇代替DPPH-乙醇溶液)。
2.3.6 羟自由基清除率测定 配制稀释0、2、4、8 倍样品,取2 mL 置于试管中,加入6 mmol·L-1FeSO4溶液和6 mmol·L-1H2O2溶液各2 mL,室温下静置10 min后,再加入6 mmol·L-1水杨酸溶液2 mL,摇匀;室温下静置30 min,于510 nm 处测A。以蒸馏水为空白组,按照公式(2)计算羟自由基清除率。

式中A0为空白组吸光度,A1为样品吸光度,A2为对照组吸光度(以蒸馏水代替水杨酸)。
2.3.7 Fe3+还原能力测定 配制不同质量浓度的样品,分别取1 mL 于试管中。加入pH 6.6 的磷酸盐缓冲液2.5 mL,摇匀后加入K3[Fe(CN)5] 水溶液2.5 mL,充分混匀后于50 ℃反应20 min。再加入10%三氯乙酸溶液2.5 mL,3000 r·min-1离心10 min(离心半径为4 cm)。取上清液5 mL,加入蒸馏水5 mL 和0.1% FeCl3溶液1 mL。反应30 min 后,于700 nm 处测定A,以蒸馏水作为空白组,每个样品测3次取平均值,按照公式(3)计算还原能力。

式中A为样品的吸光度,A0为空白组吸光度。
2.4 数据处理
3 结果
3.1 桔梗发酵前后提取液中总多酚含量
微生物发酵对桔梗提取液中总多酚含量的影响如图1 所示,其中巨大芽孢杆菌ZY2104 发酵组总多酚质量浓度最高,为(5.06±0.05)mg·mL-1,其次是枯草芽孢杆菌RZ001、啤酒酵母S5 发酵组,分别为(4.83±0.01)、(4.37±0.01)mg·mL-1,而其他发酵组总多酚质量浓度与对照组比较差异无统计学意义。
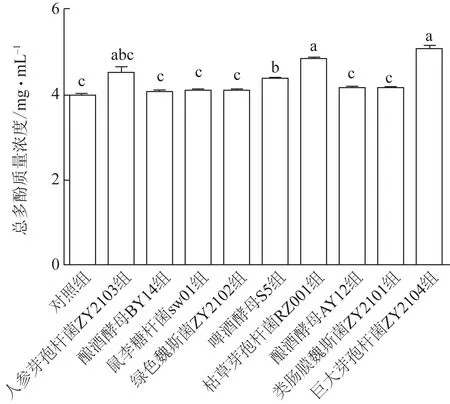
图1 不同菌株发酵前后桔梗提取液中总多酚质量浓度变化(,n=3)
3.2 桔梗发酵前后提取液中总黄酮含量
微生物发酵对桔梗提取液中总黄酮含量的影响如图2 所示,其中巨大芽孢杆菌ZY2104 发酵组的总黄酮质量浓度最高,为(5.83±0.06)mg·mL-1,其次是酿酒酵母AY12、类肠膜魏斯菌ZY2101、枯草芽孢杆菌RZ001、人参芽孢杆菌ZY2103发酵组,总黄酮质量浓度分别为(5.66±0.03)、(5.65±0.01)、(5.60±0.05)、(5.57±0.06)mg·mL-1,而酿酒酵母BY14、鼠李糖杆菌sw01、绿色魏斯菌ZY2102、啤酒酵母S5 发酵组总黄酮含量与对照组相比差异无统计学意义。

图2 不同菌株发酵前后桔梗提取液中总黄酮质量浓度变化(,n=3)
3.3 桔梗发酵前后提取液中总多糖含量
微生物发酵对桔梗提取液中总多糖含量的影响如图3 所示,其中鼠李糖杆菌sw01 发酵组的多糖质量浓度最高,为(11.84±0.87)mg·mL-1,其次是酿酒酵母AY12、酿酒酵母BY14、类肠膜魏斯菌ZY2101发酵组,分别为(10.95±0.37)、(10.89±0.49)、(10.85±1.02)mg·mL-1。而巨大芽孢杆菌ZY2104发酵组多糖质量浓度为(8.96±0.14)mg·mL-1,也显著高于对照组 [(5.55±0.43)mg·mL-1]。枯草芽孢杆菌RZ001 发酵组多糖含量与对照组相比差异无统计学意义。
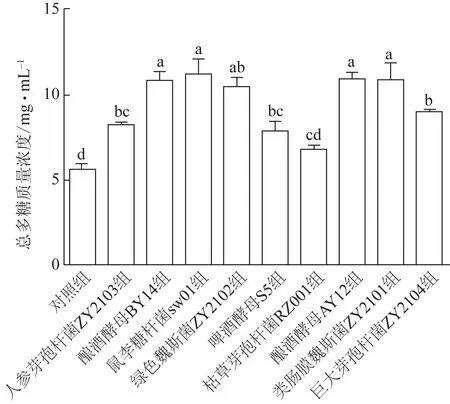
图3 不同菌株发酵前后桔梗提取液中总多糖质量浓度变化(,n=3)
相对于对照组及其他微生物发酵组,巨大芽孢杆菌ZY2104发酵组总多酚、总黄酮含量均最高,总多糖含量也处于较高水平。有研究报道[5,7],桔梗皂苷是桔梗中的主要成分,具有抗氧化作用,因此后续实验测定了对照组及发酵组中桔梗皂苷D的含量,并对巨大芽孢杆菌ZY2104是否具有β-D-葡萄糖苷酶活性进行了验证,同时也对巨大芽孢杆菌ZY2104发酵桔梗提取液进行抗氧化活性测定。
3.4 巨大芽孢杆菌ZY2104的基本形态和生长曲线
菌落呈圆形、灰白色,表面光滑湿润(图4A)。革兰染色呈紫色,棒状杆菌,单个或呈短链排列(图4B)。巨大芽孢杆菌ZY2104 的生长曲线如图5所示,培养至18 h时,菌体生长进入稳定期。

图4 巨大芽孢杆菌ZY2104的形态

图5 巨大芽孢杆菌ZY2104的生长曲线
3.5 巨大芽孢杆菌ZY2104 产β-D-葡萄糖苷酶活性检测
利用七叶苷显色培养基对生物菌株产β-D-葡萄糖苷酶的情况进行分析,发现巨大芽孢杆菌ZY2104 可以在七叶苷显色培养基中产黑色水解斑,且颜色较深,说明其β-D-葡萄糖苷酶活性较强(图6)。
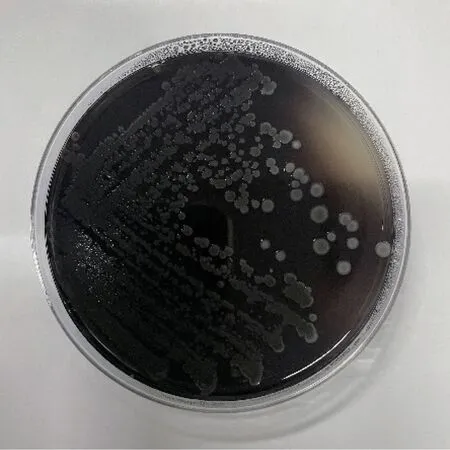
图6 七叶苷显色培养基中的巨大芽孢杆菌ZY2104
3.6 巨大芽孢杆菌ZY2104 发酵前后桔梗提取液中桔梗皂苷D含量
对照组桔梗提取液中桔梗皂苷D 质量浓度为(34.07±1.47)μg·mL-1,巨大芽孢杆菌ZY2104 发酵后桔梗提取液桔梗皂苷D 质量浓度降至(26.70±1.57)μg·mL-1(P<0.05)。
3.7 发酵前后桔梗提取液抗氧化活性
巨大芽孢杆菌ZY2104发酵前后桔梗提取液的抗氧化能力变化情况见表1。不同的稀释倍数下,发酵组T-AOC、DPPH 自由基的清除率与对照组比较均显著提高(P<0.05);发酵组羟自由基清除率与对照组比较均提高。在未稀释情况下,发酵组TAOC、还原能力与对照组比较显著提高(P<0.05),其他稀释倍数下均有提高的趋势。说明巨大芽孢杆菌ZY2104发酵能够提高桔梗的抗氧化能力。
表1 发酵对桔梗提取液抗氧化能力的影响(,n=3)

表1 发酵对桔梗提取液抗氧化能力的影响(,n=3)
注:同列不同字母代表与相同稀释倍数的对照组比较P<0.05。
4 讨论
中药发酵主要是指在一定的环境条件下(如湿度、温度等)借助微生物的作用使中药的药性、活性成分和功效应用均发生了变化,从而达到增强疗效、减少不良反应、扩大用药品种,适应临床用药的需要[17]。微生物发酵可以提高中药有效成分的溶出,同时模拟体内微生物转化过程,在体外把药物转化为人体能迅速吸收的有效成分,并产生丰富的次生代谢产物。
微生物含有多种丰富酶系,可以利用中药中的蛋白质、多糖、微量元素、维生素等多种营养成分对中药成分进行转化。微生物可以通过利用降解苷类物质产生的糖类作为碳源,为其发酵生长提供能量。微生物发酵也可以提升多种中药中黄酮、多酚类物质的含量。刘锋等[18]研究表明,淡豆豉发酵过程中总黄酮和多糖含量随发酵时间累积呈上升趋势,总黄酮含量在发酵9 d 达到最高,多糖含量在发酵13 d 达到峰值。曾玲等[19]发现利用贝莱斯芽孢杆菌和库德里阿兹威毕赤酵母菌株2 种菌株发酵桔梗提取液后,总黄酮、总酚含量均显著升高,同时发酵液的抗氧化活性也显著提升,其中贝莱斯芽孢杆菌菌株发酵后的体外抗氧化能力最强。Wang 等[20]利用鼠李糖乳杆菌217-1发酵桔梗根,制备的发酵液中桔梗皂苷D、类黄酮和多酚的质量浓度均显著增加,同时DPPH 自由基清除率显著提高,并且这种桔梗根发酵液可以降低葡聚糖硫酸钠诱导的小鼠溃疡性结肠炎的发生。
本研究中筛选出的活性较好的巨大芽孢杆菌ZY2104 是从新鲜桔梗的土壤中获得,属于植株内生菌。与其他菌株相比,其发酵桔梗提取液显示了较高的多酚、黄酮和多糖含量。同时七叶苷平板实验中也展示了巨大芽孢杆菌ZY2104 具有较高的β-D-葡萄糖苷酶活性。巨大芽孢杆菌ZY2104 发酵桔梗后,提取液中桔梗皂苷D 质量浓度从(34.07±1.47)μg·mL-1下降到(26.70±1.57)μg·mL-1。已有研究报道,五环三萜皂苷类成分由于口服吸收较差及机体代谢作用致使其生物利用度普遍较低[21-22]。大多数皂苷主要经各种酶系、菌群等转化为次级苷、苷元及氧化还原产物等而产生生物活性[23-25]。已知β-D-葡萄糖苷酶可以将桔梗中桔梗皂苷E 依次通过去掉1 个葡萄糖基分别生成桔梗皂苷D3和桔梗皂苷D,而桔梗皂苷D 在β-D-葡萄糖苷酶的作用下继续生成去糖基化桔梗皂苷D[26-27]。桔梗皂苷D 在细胞酶PCL5 的作用下也可以通过去除1 个芹糖基和1 个木糖基分别生成去芹糖桔梗皂苷D 和脱脂木糖桔梗皂苷D[28]。本研究发现,在巨大芽孢杆菌ZY2104 发酵桔梗后提取液中桔梗皂苷D 的含量降低,可能是由于其在β-D-葡萄糖苷酶或其他酶的作用下继续转化生成了其他有功能活性的物质。
巨大芽孢杆菌具有广泛的应用价值。李秀颖等[29]将提取完皂苷后的黄姜药渣、沸石粉、豆饼、过硫酸钙等制成的固体培养基为原料,通过添加巨大芽孢杆菌、胶质芽孢杆菌、圆褐固氮菌等多种益生菌进行发酵,得到的生物有机肥料不仅生产成本低,还减少了药渣对环境的污染。刘虎等[30]筛选出的1 株巨大芽孢杆菌具有高产β-D-葡萄糖苷酶能力,该酶可选择性地将甜菊苷转化,进而使甜菊糖(RA)的纯度得到提高。本研究中也发现巨大芽孢杆菌ZY2104 显著提高了桔梗发酵液的T-AOC、DPPH自由基清除率、羟自由基清除率和还原能力。
综上所述,本研究利用多种不同来源的微生物对桔梗提取物进行发酵,结果发现内生菌巨大芽孢杆菌ZY2104是发酵桔梗的优势菌种,可以显著提高桔梗提取物中有效成分的含量,提高其抗氧化活性,为桔梗发酵研究与应用开发提供参考。
——辨别味之苦甜

