单纯性肺栓塞的临床特点和发病危险因素
吴济强,雷丰丰,王红娟,陈其章,范临夏
单纯性肺栓塞的临床特点和发病危险因素
吴济强,雷丰丰,王红娟,陈其章,范临夏
甘肃省人民医院呼吸与危重症医学科干部病区,兰州 730000
总结单纯性肺栓塞的临床特点,分析发生单纯性肺栓塞的危险因素。肺栓塞患者477例,根据有无合并深静脉血栓(DVT)分为单纯性肺栓塞组187例和肺栓塞合并DVT组290例。收集并比较两组患者的年龄、性别、肺栓塞发生部位、临床表现、合并症等临床资料。以患者是否为单纯性肺栓塞为因变量,以单因素分析中差异有统计学意义的指标为自变量,采用回归分析法分析发生单纯性肺栓塞的危险因素。单纯性肺栓塞组患者年龄、肺栓塞发生部位和气短、胸闷、咳嗽、下肢肿胀、下肢疼痛等临床表现,以及合并高血压、合并COPD、合并冠心病、近期手术史等资料与肺栓塞合并DVT组相比,均<0.05。年龄大、合并高血压、合并COPD、合并冠心病是发生单纯性肺栓塞的独立危险因素。单纯性肺栓塞主要发生在肺段动脉,临床表现以胸闷、气短、咳嗽多见,常合并高血压、COPD、冠心病。年龄大、合并高血压、合并COPD、合并冠心病是发生单纯性肺栓塞的独立危险因素。
单纯肺栓塞;肺栓塞;静脉血栓栓塞;深静脉血栓
静脉血栓栓塞(VTE)包括肺栓塞和深静脉血栓(DVT),肺栓塞是急诊入院的常见病因和住院患者的常见并发症,是心血管疾病中第三大致死原因,仅次于冠状动脉粥样硬化性心脏病和脑卒中。DVT是指血液在深静脉内凝结引起静脉回流障碍,最常见于下肢,发病率高,严重影响患者生活质量甚至可导致死亡。既往认为,肺栓塞和DVT是VTE的两种不同表现,是同一疾病的两个不同阶段。但是在临床中有部分急性肺栓塞患者,经各种有创或无创检查后并未发现DVT,这种肺栓塞称为单纯性肺栓塞[1],说明肺栓塞和DVT可以单独发生,也可能同时发生。最近的一项研究[2]表明,肺栓塞患者中高达50%的病例没有发现DVT。因DVT本身很少危及生命,所以VTE的预后在很大程度上取决于肺栓塞的存在与否[3]。本研究总结了单纯性肺栓塞的临床特点,分析发生单纯性肺栓塞的危险因素,现将结果报告如下。
1 资料与方法
1.1临床资料选取2018年12月—2022年1月在甘肃省人民医院经CT肺动脉造影(CTPA)诊断为肺栓塞的患者477例,根据有无合并DVT分为单纯性肺栓塞组187例和肺栓塞合并DVT组290例。纳入标准:①所有患者已行CTPA检查,符合肺栓塞的诊断标准;②所有患者已行下肢静脉超声检查;③临床资料完整;④年龄>18岁。排除标准:①慢性血栓栓塞性肺动脉高压患者;②既往诊断肺栓塞的患者;③接受抗凝治疗的VTE患者;④缺乏完整的临床、下肢静脉超声、CTPA资料的患者。本研究获医院伦理委员会批准,患者及家属均知情同意。
1.2两组患者年龄、性别、肺栓塞发生部位、临床表现、合并症等资料收集收集并比较两组患者的年龄、性别、肺栓塞发生部位、临床表现、合并症等临床资料。

2 结果
2.1两组患者年龄、性别、肺栓塞发生部位、临床表现、合并症等资料比较单纯性肺栓塞组男95例、女92例,年龄(63.8 ± 13.9)岁,肺栓塞发生在肺动脉主干或左、右肺动脉干28例(15.0%)、肺叶动脉37例(19.8%)、肺段动脉122例(65.2%),临床表现为气短109例(58.3%)、胸闷43例(23.0%)、咳嗽39例(20.9%)、下肢肿胀17例(9.1%)、下肢疼痛2例(1.1%)、咯血6例(3.2%)、晕厥4例(2.1%)、发热5例(2.6%),合并恶性肿瘤15例(8.0%)、糖尿病20例(10.7%)、房颤12例(6.4%)、感染(炎症)52例(27.8%)、自身免疫疾病2例(1.1%)、瘫痪0例、妊娠1例(0.5%)、高血压63例(33.7%)、COPD 34例(18.2%)、哮喘8例(4.3%)、冠心病25例(13.4%)、近期手术史2例(1.1%)。
肺栓塞合并DVT组男134例、女156例,年龄(60.6 ± 14.8)岁,肺栓塞发生在肺动脉主干或左、右肺动脉干82例(28.3%)、肺叶动脉84例(29.0%)、肺段动脉124例(42.8%),临床表现为气短124例(42.8%)、胸闷44例(15.2%)、咳嗽40例(13.8%)、下肢肿胀103例(35.5%)、下肢疼痛46例(15.9%)、咯血11例(3.8%)、晕厥4例(1.4%)、发热6例(2.1%),合并恶性肿瘤16例(5.5%)、糖尿病28例(9.7%)、房颤17例(5.9%)、感染(炎症)59例(20.3%)、自身免疫疾病8例(2.8%)、瘫痪3例(1.0%)、妊娠2例(0.7%)、高血压60例(20.7%)、COPD 15例(5.2%)、哮喘6例(2.1%)、冠心病18例(6.2%)、近期手术史17例(5.9%)。
其中,单纯性肺栓塞组患者年龄、肺栓塞发生部位和气短、胸闷、咳嗽、下肢肿胀、下肢疼痛等临床表现,以及合并高血压、合并COPD、合并冠心病、近期手术史等资料与肺栓塞合并DVT组相比,均<0.05。
2.2发生单纯性肺栓塞的危险因素分析结果Logistic回归分析结果显示,年龄大、合并高血压、合并COPD、合并冠心病是发生单纯性肺栓塞的独立危险因素,见表1。
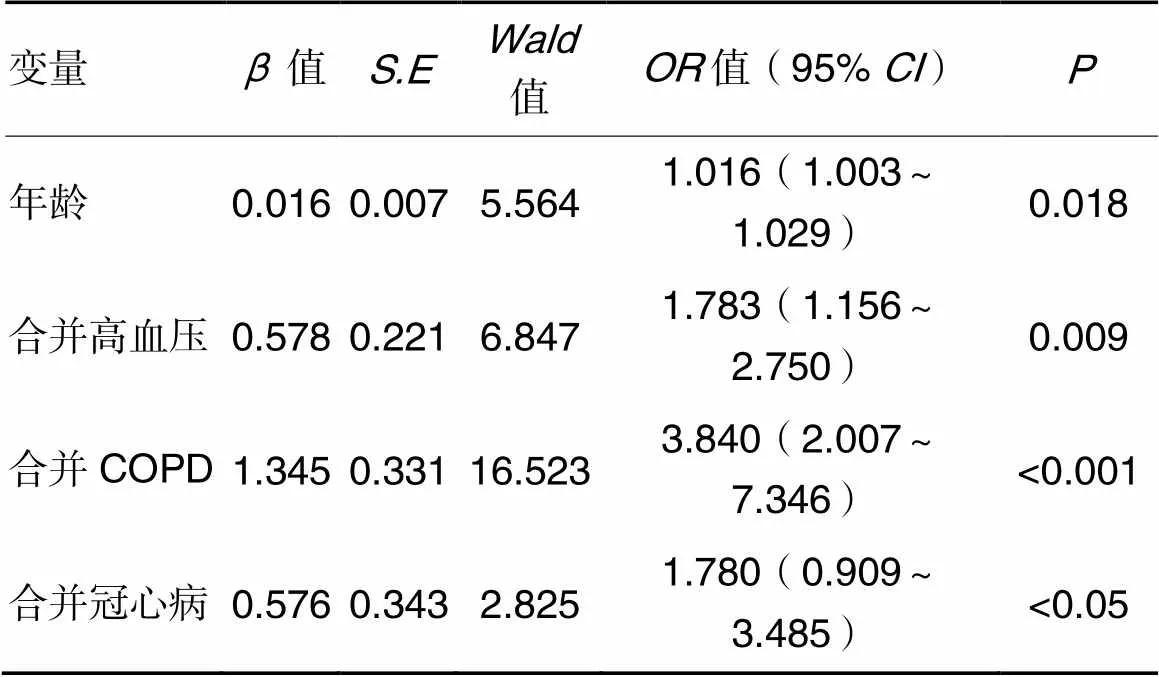
表1 发生单纯性肺栓塞的影响因素Logistic回归分析结果
3 讨论
VTE包括肺栓塞和DVT,VTE发病率随着患者年龄的增长而增高,而且相关的死亡率也在不断上升。肺栓塞和DVT是VTE的两种临床表现,是全球心血管疾病的主要负担之一。既往认为肺栓塞起源于DVT,当深静脉血栓脱落,栓子沿血管移动,并滞留在肺动脉中,导致肺动脉血流受阻、远端肺组织缺血和坏死。然而,在临床上相当一部分诊断为肺栓塞的患者中,并没有发现DVT存在,这种肺栓塞称为单纯性肺栓塞[1]。既往研究发现,单纯性肺栓塞通常是位于肺段动脉或肺亚段动脉的小血栓,大多是偶然发现的[4-6]。近年来研究[3,7]表明,单纯性肺栓塞的发病率并不低,在病因、病理生理、临床表现方面不同于VTE的其他表型。
DVT通常大多发生在腿部静脉,较少发生在内脏、手臂等静脉。本研究通过加压超声(CUS)检查诊断下肢DVT,结果显示,单纯性肺栓塞占所有肺栓塞的39.2%,60.8%的肺栓塞患者存在DVT。在一项研究中,对428例肺栓塞患者进行静脉超声检查,70.6%患者合并DVT,29%患者DVT超声检查呈阴性[8]。SANE等[4]分析了63例急性肺栓塞患者的临床资料,发现50.8%的患者没有DVT。由于不同研究对肺栓塞和DVT诊断标准的异质性,新诊断急性肺栓塞患者的DVT患病率差异较大。
DVT的诊断金标准是静脉造影,但其对小腿静脉血栓诊断不足。由于静脉造影的侵入性和相关的缺点、不良反应,在临床上不是下肢DVT的常规检查方法,并已被CUS所取代。CUS是目前诊断DVT的首选方法,对症状性近端DVT的敏感性为96%,特异性为98%。但CUS的一个缺点是,当涉及膝关节平面以下静脉血栓或盆腔血栓时,其敏感性为73%[9]。磁共振直接血栓成像(MRDTI)是一种高灵敏度的DVT检查技术,与超声检查或静脉造影相比,MRDTI的敏感性为95%,特异性为100%[10]。有报道,即使行全身MRI,56%的肺栓塞患者也没有发现DVT[9]。在临床中,肺栓塞患者虽然行各种检查,但仍未能发现DVT存在,可能的原因包括下肢深静脉的完全栓塞、不常见部位(肝静脉、肾静脉、卵巢静脉、颈部静脉或上肢静脉)的DVT可能会遗漏、肺栓塞假阳性诊断、DVT静脉超声呈假阴性、肺动脉原位血栓形成、短时间抗凝治疗后DVT完全溶解等[11]。
VTE是一种多病因疾病,是由多种刺激因素之间的相互作用触发的,这些因素可以是单一的,也可以多因素协同的。VTE通常与创伤、制动、手术、高龄、妊娠、心肌梗死、充血性心力衰竭、激素替代治疗、DVT形成和癌症等危险因素有关。我们的结果显示,单纯性肺栓塞患者的年龄大于肺栓塞合并DVT患者,恶性肿瘤、糖尿病、房颤、炎症在单纯性肺栓塞患者的发病率高于肺栓塞合并DVT患者。VTE的刺激因素可能是暂时的,也可能是持久性的。一些危险因素很强,在没有其他危险因素的情况下可能导致VTE发生。强烈的暂时性危险因素如大手术和严重创伤,约占所有VTE事件的20%。最常见的持续性危险因素是活动性癌症,约占VTE事件的20%。然而,大多数VTE事件是由较弱的危险因素引起的,或者没有明显的危险因素[12]。PALARETI等发现,年龄>75岁、女性、心力衰竭、癌症和使用避孕药是单纯性肺栓塞的危险因素[1]。LEE等研究发现,在1 012例患者中,322例(31.8%)表现为单纯性肺栓塞,690例(68.2%)表现为DVT相关的肺栓塞,在多变量分析后发现,女性是单纯性肺栓塞的独立因素,而癌症、腿部疼痛或肿胀与单纯性肺栓塞呈负相关[13]。肺栓塞危险因素与DVT危险因素在很大程度上是重叠的,但一些危险因素如COPD、肺炎导致肺栓塞形成的风险高于DVT,甚至这些因素对DVT形成几乎没有影响。因而,在临床中需要注意VTE危险因素对肺栓塞和DVT形成的不同影响。
我们的研究结果显示,年龄、合并恶性肿瘤、糖尿病、房颤、炎症、高血压、COPD、支气管哮喘、冠心病在单纯性肺栓塞患者中的发病率高于肺栓塞合并DVT患者。多变量分析表明,年龄大、合并高血压、合并COPD、合并冠心病是发生单纯性肺栓塞的独立危险因素。TEN等[3]研究发现,COPD、外周动脉疾病、心房颤动和冠状动脉疾病在单纯性肺栓塞患者中的发生率显著升高。呼吸系统慢性炎症性疾病,尤其是支气管哮喘和COPD与肺栓塞风险增加有关,在支气管哮喘和COPD急性加重期肺栓塞形成风险最高,但与DVT无关[2,14-15]。KELLER等[16]研究发现,与单纯性肺栓塞相比,合并DVT的肺栓塞患者较年轻,女性较少,VTE危险因素(手术、癌症)以及心血管和肺部疾病的发病率较低。这些研究表明单纯性肺栓塞和肺栓塞合并DVT的危险因素存在差异。
单纯性肺栓塞形成可能存在以下原因,一是由于深静脉血栓检查方法的局限性,下肢DVT可能被遗漏,未发现存在的DVT;二是其他潜在来源包括来自腹腔静脉、颈静脉的栓子,不易被发现;三是炎症性呼吸道疾病(包括哮喘和COPD)、肺癌、胸外科手术、传染性呼吸道疾病,在持续炎症或内皮细胞活化的情况下导致肺原位血栓形成,而非栓子[6-7]。
肺栓塞的栓子分布在两个区域,即中央型肺动脉(主肺动脉、左或右肺动脉和肺叶动脉)和周围型肺动脉(肺段动脉或肺亚段动脉)栓塞。CTPA是目前诊断肺栓塞的最常用检查方法,它可以清晰地显示肺动脉的小分支,进一步提高肺栓塞的诊断准确性,但目前关于肺栓塞部位分布的研究较少。在我们的研究中,所有患者均以CTPA作为肺栓塞的诊断方法。结果显示,单纯性肺栓塞患者的血栓主要发生在肺段动脉水平,肺栓塞以周围型为主;而肺栓塞合并DVT患者多出现中央型肺栓塞,与单纯性肺栓塞相比,血栓更容易出现在肺动脉近端。LEE等[13]同样发现,中央肺栓塞与单纯性肺栓塞呈负相关。
DVT形成的临床体征和症状包括下肢疼痛、肿胀、凹陷性水肿、局部压痛等。肺栓塞缺乏典型的临床表现,最常见的体征和症状包括呼吸困难、胸痛、呼吸短促、咯血、发热和咳嗽;也可出现严重的血流动力学损害,如猝死、休克、低血压、晕厥等。我们的研究结果显示,单纯性肺栓塞患者的下肢肿胀、下肢疼痛发生率明显低于肺栓塞合并DVT患者,但胸闷、气短症状发生率高于肺栓塞合并DVT患者,这可能与单纯性肺栓塞患者的合并症如冠心病、房颤、高血压、呼吸系统疾病的发生率高于肺栓塞合并DVT患者有关。但二组间晕厥、发热的发生率无明显差异。CHEN等[17]发现,患有冠心病、COPD、心律失常等基础疾病的肺栓塞患者更容易出现临床症状。
理论上肺栓塞血栓体积越大,右心室扩张的发生率越高,严重者发生右心衰竭,与死亡率相关。DVT对肺栓塞患者生存率的影响存在争议。BECATTINI等在急性肺栓塞的系统回顾和荟萃分析显示,有DVT的肺栓塞患者30天全因死亡率为6.2%,无DVT的肺栓塞患者30天全因死亡率为3.8%,肺栓塞合并DVT患者30天内死亡风险增加[18-19]。其他研究表明,DVT的存在并没有影响肺栓塞的死亡率。STOEVA等[19]发现,与无DVT的患者相比,肺栓塞合并DVT的患者肺动脉血栓负荷更高,临床表现更严重,但一个月死亡率相似。KELLER等[16]在下肢深静脉或浅静脉血栓形成对肺栓塞患者生存率的影响发现,与单纯性肺栓塞患者相比,合并DVT的肺栓塞患者的生存率显著增高,不良住院事件发生率显著降低,具有较低的住院死亡率风险和不良住院事件风险。合并DVT对肺栓塞生存率、死亡率的影响,进一步大需要样本、前瞻性研究。
综上,单纯性肺栓塞占所有肺栓塞的39.2%,肺栓塞主要发生在肺段动脉。与肺栓塞合并DVT患者相比,单纯性肺栓塞患者合并症如COPD、冠心病、高血压病发病率高,临床症状如胸闷、气短、咳嗽更多见。年龄大、合并高血压、合并COPD、合并冠心病是发生单纯性肺栓塞的独立危险因素。
[1] PALARETI G, ANTONUCCI E, DENTALI F, et al. Patients with isolated pulmonary embolism in comparison to those with deep venous thrombosis. Differences in characteristics and clinical evolution[J]. Eur J Intern Med, 2019,69:64-70.
[2] MARONGIU F, MAMELI A, GRANDONE E, et al. Pulmonary thrombosis: a clinical pathological entity distinct from pulmonary embolism[J]. Semin Thromb Hemost, 2019,45(8):778-783.
[3] CATE VTEN, EGGEBRECHT L, SCHULZ A, et al. Isolated pulmonary embolism is associated with a high risk of arterial thrombotic disease: results from the VTEval study[J]. Chest, 2020,158(1):341-349.
[4] SANE M A, LAUKKANEN J A, GRANER M A, et al. Pulmonary embolism location is associated with the co-existence of the deep venous thrombosis[J]. Blood Coagul Fibrinolysis, 2019,30(5):188-192.
[5] KLOK F A, HUISMAN M V. Management of incidental pulmonary embolism[J]. Eur Respir J, 2017,49(6):1700275.
[6] KING C S. A new way of looking at an old problem[J]. Chest, 2020,158(1):31-32.
[7] CATE VTEN, PROCHASKA J H, SCHULZ A, et al. Protein expression profiling suggests relevance of noncanonical pathways in isolated pulmonary embolism[J]. Blood, 2021,137(19):2681-2693.
[8] HIRMEROVA J, SEIDLEROVA J, CHUDACEK Z. The prevalence of concomitant deep vein thrombosis, symptomatic or asymptomatic, proximal or distal, in patients with symptomatic pulmonary embolism[J]. Clin Appl Thromb Hemost, 2018,24(8):1352-1357.
[9] VAN LANGEVELDE K, SRAMEK A, VINCKEN P W, et al. Finding the origin of pulmonary emboli with a total-body magnetic resonance direct thrombus imaging technique[J]. Haematologica, 2013,98(2):309-315.
[10] YUSOF N N M, MCCANN A, LITTLE P J, et al. Non-invasive imaging techniques for the differentiation of acute and chronic thrombosis[J]. Thromb Res, 2019,177:161-171.
[11] BECHER M, HELLER T, SCHWARZENBOCK S, et al. Negative venous leg ultrasound in acute pulmonary embolism: prevalence, clinical characteristics and predictors[J]. Diagnostics (Basel), 2022,12(2):520.
[12] KHAN F, TRITSCHLER T, KAHN S R, et al. Venous thromboembolism[J]. Lancet, 2021,398(10294):64-77.
[13] LEE Y H, CHA S I, SHIN K M, et al. Clinical characteristics and outcomes of patients with isolated pulmonary embolism[J]. Blood Coagul Fibrinolysis, 2021,32(6):387-393.
[14] ALEVA F E, VOETS L W L M, SIMONS S O, et al. Prevalence and localization of pulmonary embolism in unexplained acute exacerbations of COPD: a systematic review and meta-analysis[J]. Chest, 2017,151(3):544-554.
[15] KERAMIDAS G, GOURGOULIANIS K I, KOTSIOU O S. Venous thromboembolic disease in chronic inflammatory lung diseases: knowns and unknowns[J]. J Clin Med, 2021,10(10):2061.
[16] KELLER K, HOBOHM L, MUNZEL T, et al. Impact of concomitant deep or superficial venous thrombosis of the legs on survival of patients with pulmonary embolism[J]. Int J Cardiol, 2020,315:92-98.
[17] CHEN X, LIU X, LIU J, et al. Pulmonary embolism secondary to deep venous thrombosis: A retrospective and observational study for clinical characteristics and risk stratification[J]. Phlebology, 2021,36(8):627-635.
[18] BECATTINI C, COHEN A T, AGNELLI G, et al. Risk stratification of patients with acute symptomatic pulmonary embolism based on presence or absence of lower extremity DVT: systematic review and meta-analysis[J]. Chest, 2016,149(1):192-200.
[19] STOEVA N, STANEVA M, KIROVA G, et al. Deep venous thrombosis in the clinical course of pulmonary embolism[J]. Phlebology, 2019,34(7):453-458.
10.3969/j.issn.1002-266X.2022.33.018
R563.5
A
1002-266X(2022)33-0071-04
兰州市科技计划项目(2020-ZD-22)。
范临夏(E-mail: fanlinxia6@qq.com)
(2022-07-05)

