纯水和二甲基亚砜溶液中冰晶生长特性可视化研究
潘平安 张宏彬 黄永华 韩 厦 陈 威 李 铮
(1 上海交通大学制冷与低温工程研究所 上海 200240;2 上海交通大学附属第一人民医院泌尿外科中心男科 男性健康评估中心 上海 200080)
生物样本的低温冻存是指通过降低温度的方式抑制细胞代谢活动,实现样品长期保存,并在需要时复温解冻样本,使其恢复到正常生理状态的技术。低温冻存技术的出现,消除了获取和使用生物样本之间的时间、空间差距[1-2],缓解了生物样本在辅助生殖、干细胞治疗、再生医学等生物医学应用中的供需矛盾[3],在推进临床医学、生物科学等学科发展的同时,也创造了可观的社会价值和经济价值。以辅助生殖为例,精子、卵母细胞等人类配子的成功冻存成为不孕不育辅助生殖治疗的重要手段,有效缓解了全球范围内因人类不孕率升高所带来的各类社会问题[4],其全球市场价值预计在2025年超过454亿美元[5]。在细胞低温冻存过程中,冰晶生长被认为是导致细胞受损甚至死亡的主要影响因素之一[6]。冰晶生长造成的冷冻损伤主要可分为两类[7-9]:1)胞内冰晶损伤,在快速降温过程中,细胞外溶液生成的冰晶尖端刺破细胞膜造成机械损伤;2)溶质损伤,在缓慢降温过程中,由于细胞内外溶液的凝固温度不同,细胞外溶液因水分结晶浓度增大而产生较大的内外渗透压,使细胞膜发生破裂。因此,对细胞冻存技术而言,通过研究细胞内外冰晶的生长特性从而降低冷冻损伤尤为重要。
配子冻存操作通常将细胞置于冷冻保护剂溶液中,以液滴或冷冻麦管的形式进行冷冻保存,因此必然涉及水、冷冻保护剂及细胞内液的冰晶生长过程。为深入研究冰晶生长机制,研究者们利用各种类型的生物低温显微镜系统,对不同细胞的冷冻过程进行了可视化实验研究。K. R. Diller等[10-11]研制了早期的生物低温显微镜系统,以低温氮气为冷源,样品冷却速率约达100 ℃/min;K. R. Diller等[12-14]还利用该系统观察了兔肾皮质细胞、人体红细胞冻结过程中的胞内结晶现象。孙仲秋等[15]开发了类似的系统并研究了降温及复温速率对奶牛胚胎存活率的影响。郝保同等[16]研制了用于观察方向性冰晶的定向固化冷冻平台,并用显微镜观察了不同浓度MeSO2低温保护剂在不同降温速率下的冰晶生长情况。T. Buttersack 等[17]利用声波悬浮装置,观察了不同过冷度时纯水液滴冻结时树枝状冰的生长过程并对其进行了参数化研究。A. A. Shibkov等[19]结合冰晶生长动力学,研究了过冷纯水薄层的冰晶生长过程中冰晶尖端生长速率、半径等主要特征参数的变化情况。
上述研究中的冷却速度通常无法达到大于等于1 000 ℃/min的快速冷冻条件,且在同等工况下,对某种冷冻保护剂与纯水冰晶形成规律的对比研究较少。
本文研制了基于瞬态接触法的快速冷冻新型低温显微成像系统,对纯水、二甲基亚砜(DMSO)溶液分别以平板面自由液滴和模拟冻存管槽道内冰晶生长特征进行了可视化研究,并对比了鼠生精小管在纯水和质量分数为10% DMSO溶液中的冰晶形成特性。
1 实验系统及控温方法
1.1 实验系统
考虑到生殖细胞实际冻存过程中样本通常以液滴和冻存管形式冻存,设计了图1中的部件11薄片载物台。该载物台为蓝宝石玻璃材质,低温下的导热系数在600 W/(m·K)以上,上表面布置了直径为2 mm和0.5 mm的两条半圆管槽来模拟冻存管环境;另一个侧边槽用于嵌接热电偶温度计。载物台密封压接在环境舱底部中心处,其底面相比环境舱底面微凸0.1 mm,使得在接触瞬间来自液氮热沉的冷量可以集中传递到载物台而不是环境仓底面。
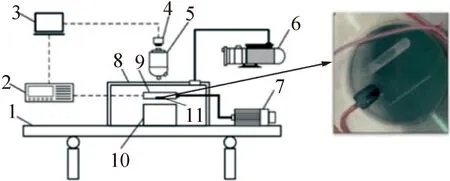
1 气浮隔震平台;2 数据采集仪;3 控制计算机;4 相机;5 金相显微镜;6 真空泵;7 步进电机;8 真空腔体;9 环境舱;10 液氮热沉;11 蓝宝石载物台。图1 基于瞬态接触法的新型低温显微成像系统Fig.1 A new cryomicroscopy system based on the instant contact method
实验系统主要由温度测量系统、压力测控系统和显微成像系统组成。温度测量系统主要包含精度为0.1 K的TT-36-T型热电偶温度传感器(头部直径约为0.5 mm)、Keithley 2700六位半数据采集仪以及基于LabVIEW环境搭建的采集程序。压力测控系统通过执行机构和设置的应变片(位于图1中部件7和部件9之间)形成负反馈PID控制载物台与液氮热沉之间的压强。显微成像系统主要包括光学显微镜和CCD相机两部分,光学金相显微镜的最高放大倍率为50倍,高速工业相机有效像素为130万,最高分辨率为1 280×1 024、帧率为211帧/s。
1.2 控温方法
上述低温显微成像系统主要通过控制环境舱底部载物台与液氮热沉之间的压强来控制样品的降温速率。不同压强条件下载物台的降温曲线如图2所示(对应压力分别为150、100、50 N)。在室温220~300 K这一跨越液体结冰点的关键温度区间内,当压强超过3.2×105Pa时,载物台的降温速率平均约达1 600 K/min,远高于文献报道的对流型相关设备或实验台数据[19-23],克服了对流型设备在冷却初期液氮进入载物台前受热汽化,携带冷量小的问题。而冷冻操作启动的最初几秒时间正是影响冷却效果最关键的部分。由图2可知,载物台在60 s内温度可降至约100 K;当压强减小后,载物台的降温速率减小。
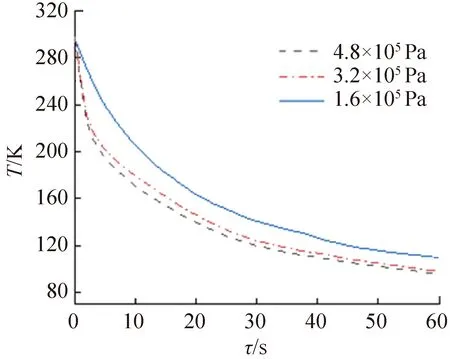
图2 不同压强条件下载物台的降温曲线Fig.2 Cooling rates of the stage under different pressures
2 结果与分析
基于上述瞬态接触法低温显微成像系统,开展了自由平板面和半圆管内纯水、DMSO溶液液滴在不同液滴直径、液滴过冷度条件下的冰晶生长过程特性可视化研究。
2.1 平板面纯水及DMSO溶液过冷液滴冰晶生长
纯水液滴的冻结一般可分为两个阶段[24-26],第一阶段由于液体过冷状态不稳定,冰晶的冻结前端会产生一些小的隆起并不断发展形成树枝状冰网,该阶段持续时间非常短,当冰网最终布满整个液滴时进入第二阶段,第二阶段中冰网间隙剩余的液态水继续冻结,整个过程由相对稳定的传热主导,可视为持续时间较长的准等温过程。本实验系统捕捉到的一个直径为2 mm纯水(杂质质量分数小于10 mg/kg)液滴的典型冻结过程如图3所示。拍摄图像中的亮斑是由于液滴凸面反射光源形成,通过对比0 ms和33 ms的瞬时图像可知,液滴整体亮度瞬间发生显著变化。这是由于树枝状冰网的产生改变了冰水混合物的折射率及密度,被树枝状冰网覆盖的区域在视觉上呈现出变暗的特点,此时液滴内已经形成较为完整的树枝状冰网,而这一过程仅发生在33 ms内。

图3 直径为2 mm纯水液滴冻结过程Fig.3 Freezing process of a pure water droplet with 2 mm diameter
图3中132 ms时已经可以看到清晰的冻结前端由外向内的推进过程。该由外向内的冻结过程指的并不仅是水平方向从液体边缘到液体中心,事实上,由于局限于单一的俯视观测方向,实验仅能观察到液滴投影范围内的明暗变化,而实际是水平和垂直两个维度的特征叠加。理论上,冻结过程应该是由热通量的负方向即液滴底面与载物台接触的部分开始向液滴顶部进行。图3中167 ms时冻结的第二阶段已经完成,从此角度观察并未发现液体边缘冻结前后的位移变化,故推测液滴冻结时体积的膨胀主要发生在垂直方向,期间液滴的表面张力起到了关键作用。
对3种不同直径(2、3、4 mm)的纯水液滴在不同过冷度条件下进行了冻结实验,冰晶生长的平均速率(定义为单位时间内冰晶边缘移动的位移)如图4所示。由图4可知,3个直径规格的纯水液滴冰晶平均生长速率均随过冷度的增加呈现先增后减的趋势,且均在15~20 ℃的过冷度范围内达到最大值。出现该现象的原因是由于纯水的黏度随温度的降低而增加,在-15 ℃时其黏度已达到0 ℃时的3倍,黏度的增加在一定程度上阻碍了剩余水分子的移动,从而导致冰晶生长速率变缓。
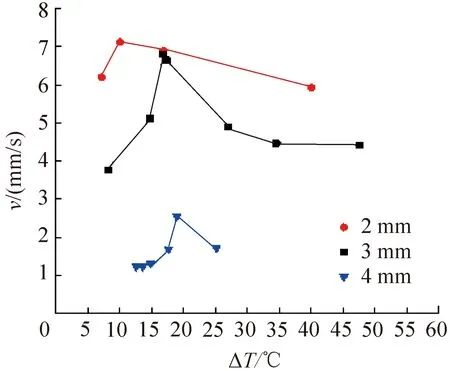
图4 纯水液滴在不同过冷度条件下的冰晶生长速率Fig.4 Ice formation rates of pure water droplets under different degree of subcooling conditions
不同直径纯水液滴的冰晶平均生长速率差异显著,总体上在一定直径范围内冰晶生长速率随液滴直径的减小显著提升。从传热学角度分析可得:当液滴直径较小时,冻结过程由导热主导,可近似于一维固化过程。当忽略液滴与周围气体的自然对流换热时,冰晶生长速率较大程度上取决于液体的热扩散系数及与载物台的换热量[16]。其中换热量与液滴底面积即液滴直径的平方成正比,液滴冻结所需的冷量又与液滴体积即液滴直径的三次方成正比,即冰晶的平均生长速率与液滴直径成反比。因此,选用直径较小的液滴在约20 ℃过冷度条件下进行细胞冷冻可获得较高的冷冻速率从而减少细胞损伤。
对3种不同直径(2、3、4 mm)的DMSO溶液液滴也进行了类似冷冻实验,不同过冷度条件下的冰晶生长速率如图5所示。由图5可知,在实验过冷度范围内,3个尺度的DMSO溶液液滴冰晶生长速率与过冷度的依变关系无明确的规律,且存在同一直径的液滴,在相近的过冷度范围内冰晶生长速率也具有显著差异的现象。但与纯水相比,DMSO溶液的冰晶生长速率显著低于纯水。因此,若要达到相同级别的冰晶生长速率,DMSO溶液总体趋势上需要更大的过冷度。
在1970年代,美国地质调查局首先使用先进的测量技术来测定圣安德烈斯断层系上应变积累的位置和速率。今天,许多研究小组每年使用足够精确的全球卫星定位接收器进行几个月的连续观测来采集应变数据,以便确定每年几厘米的长期水平应变积累速率。
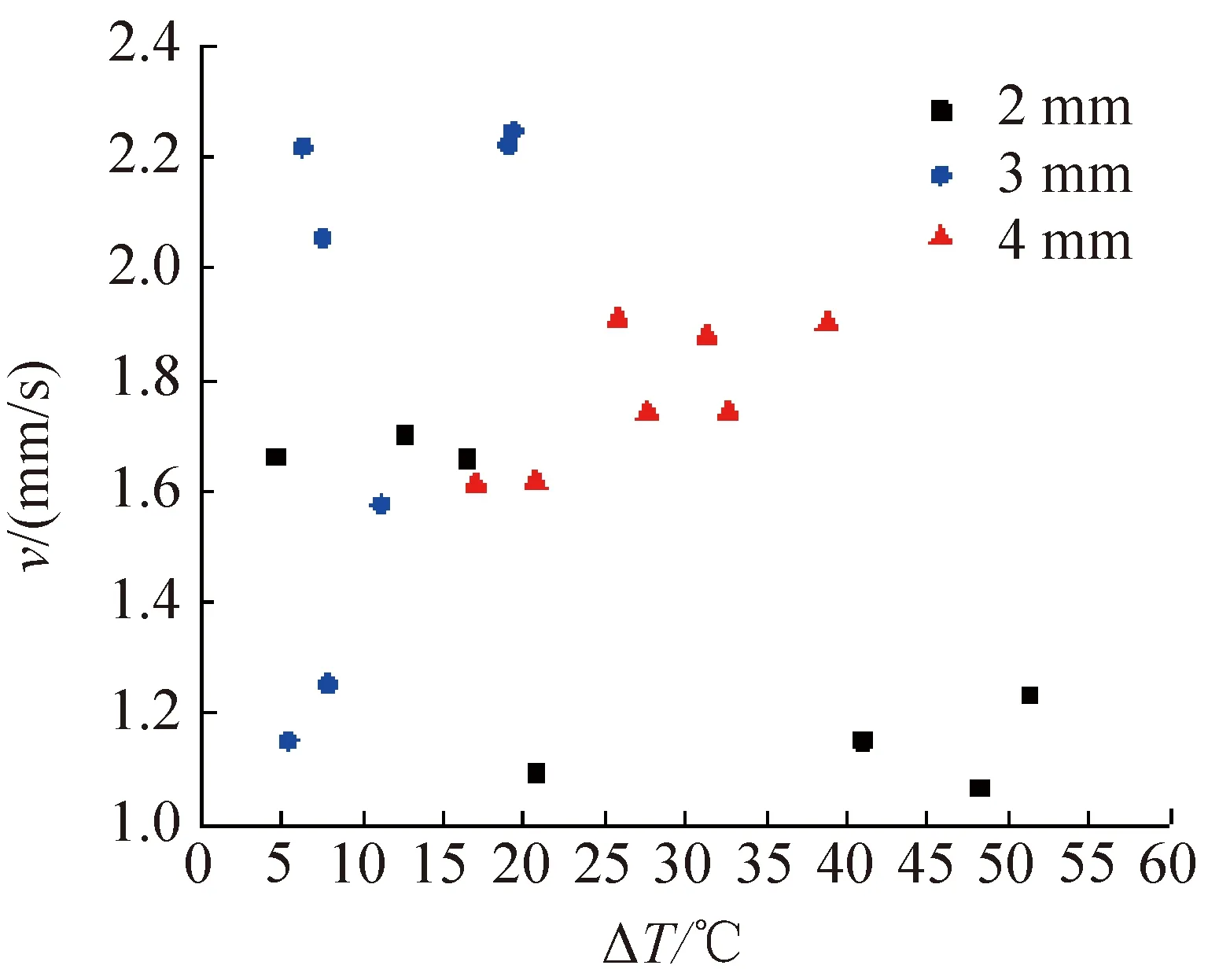
图5 DMSO溶液液滴在不同过冷度条件下的冰晶生长速率Fig.5 Ice formation rates of DMSO solution droplets under different undercooling conditions
通过对比直径为2 mm的DMSO溶液在过冷度为7~8 ℃范围内冰晶的生长过程可知,该冰晶生长速率的巨大差异是由DMSO溶液液滴独特的结晶方式引起的。图6和图7所示分别为液滴在过冷度为7.8、7.5 ℃两个非常接近工况下的冻结过程。不同于纯水液滴的结晶方式,DMSO溶液液滴结晶不再由液滴底部均匀开始,而是在液滴整体区域内的随机位置发生。由图6可知,过冷度为7.8 ℃工况下,29 ms时液滴区域内首次出现点状晶核,随后冰晶不断扩散生长,496 ms时在另一位置出现晶核,随后两者进入同步并行生长过程。由图7可知,过冷度为7.5 ℃工况下,点状晶核出现在液滴中心位置附近,并向四周扩散推进,并在251 ms已基本处于生长末期。

图6 过冷度为7.8 ℃,直径为2 mm DMSO溶液液滴的冻结过程Fig.6 Freezing process of DMSO solution droplet with 2 mm diameter when degree of subcooling is 7.8 ℃

图7 过冷度为7.5 ℃,直径为2 mm DMSO溶液液滴的冻结过程Fig.7 Freezing process of DMSO solution droplet with 2 mm diameter when degree of subcooling is 7.5 ℃
综上所述,DMSO溶液液滴中冰晶的生长过程相比纯水液滴具有诱发点随机性强的特点。冰晶生长初期,晶核在DMSO溶液液滴底部温度最低处随机生成,随后呈辐射状向三维空间内生长,在此过程中有可能与其他位置的冰晶发生交汇,导致相同情况下的DMSO溶液液滴中冰晶生长速率差异较大。此外,DMSO溶液液滴中冰晶的生长速率显著低于纯水液滴,表明采用DMSO保护剂有助于减小冰晶对溶液中细胞的损伤。
2.2 半圆槽道内纯水冰晶生长
临床应用中的精子样本通常置于冷冻管载体中进行冻存,因此有必要进行液体在圆管内的冷冻实验。为消除细管自身的透明度及对光学观察的影响,本实验采用半圆槽道的载体进行液体装载。图8所示为直径为2 mm半圆槽道(图1部件11)内纯水在不同过冷度条件下的冰晶生长速率。由图8可知,过冷度在0~10 ℃时,冰晶生长速率基本与过冷度呈线性相关,但冰晶生长较慢。主要原因是槽内纯水沿槽道方向也有分布,其体积和热容远大于上述液滴,结晶前端推进单位长度所需的冷量一般是液滴的数倍。同时圆形槽道壁面也对冰晶在水平方向的扩展起到限制作用。

图8 不同过冷度条件下半圆槽道内纯水的冰晶生长速率Fig.8 Ice formation rates of pure water in groove under different degree of subcooling conditions
槽道内纯水的冰晶生长一般由壁面开始。图9~图11所示为在不同过冷度条件下,冰晶生长的形貌变化。过冷度在0~4 ℃时,冻结前端呈现宽大圆润的无分叉冰枝形态,冰晶生长平均速率为24 μm/s。单个冰枝的形态宽度和生长方向均无显著规律,该结论与A. A. Shibkov等[19]在薄层水冻结实验中观察到冻结尖端的分裂即分叉的树枝状冰晶现象不同。当过冷度进一步升至4~6 ℃时,冰枝尖端显著变尖且整体变窄,冰枝的分布更均匀,冰晶生长的平均速率为86 μm/s;当过冷度超过6 ℃时,冰枝已经形成极窄的细针状,在一定范围内具有一致的生长方向。无论从冰晶生长速率还是冰枝形态来看,低过冷度下纯水的冰晶生长过程较温和,而高过冷度条件下冰晶生长不仅具有更大的动量,且其尖端更锋利,应力更集中,更容易穿透细胞膜并对细胞造成损伤,此时冰晶生长平均速率已达到240 μm/s。因此,推测A. A. Shibkov等[19]的测试结果可能是在过冷度较大的条件下获得。

图9 0.5 ℃过冷度条件下槽道内纯水冻结过程Fig.9 Freezing process of pure water in groove when degree of subcooling is 0.5 ℃

图10 4.3 ℃过冷度条件下槽道内纯水冻结过程Fig.10 Freezing process of pure water in groove when degree of subcooling is 4.3 ℃

图11 9.5 ℃过冷度条件下槽道内纯水冻结过程Fig.11 Freezing process of pure water in groove when degree of subcooling is 9.5 ℃
2.3 生精小管的冰晶生长
在上述实验的基础上,进一步开展了鼠生精小管的冷冻实验,过冷度设定为20 ℃。鼠生精小管在纯水和质量分数为10% DMSO溶液中的冻结过程如图12、图13所示。由图12和图13可知,纯水中生精小管的冻结分为小管内外两部分,管外的纯水冰晶呈细针状快速生长,在达到管壁后,管内靠近壁面部分也开始结晶,呈现零散的黑色点状区域。在管内冰晶生长的同时,管壁的另一侧也观察到细针状冰晶从管壁处开始生长。但在质量分数为10%DMSO溶液中,水分子通过与DMSO的作用使溶液黏性增加,冰点降低,显著弱化了管外的冰晶生长,使其不再具有窄长细针状的形态,降低了其对生精小管的机械损伤风险,使生精小管得以维持较完好的生理形态。

图12 生精小管在纯水中冷冻实验Fig.12 Freezing process of seminiferous tubules in pure water

图13 生精小管在质量分数为10%DMSO溶液中冷冻实验Fig.13 Freezing process of seminiferous tubules in 10% DMSO solution
3 结论
本文研制了一套基于瞬态接触冷却方法的新型低温显微成像系统,观察了平板面和圆形槽道内纯水、DMSO溶液及鼠生精小管的冰晶形成现象,分析了水和冷冻保护剂在不同过冷度条件下的冰晶生长特征,得到结论如下:
1)在平板面上的液滴冷冻实验中,冰晶由纯水液滴的热通量负方向开始较均匀地生长,而DMSO溶液液滴内的冰晶生长则呈现随机性多点生长特征;DMSO溶液液滴内的冰晶生长速率显著低于纯水,表明采用DMSO保护剂有助于减小冰晶对溶液中细胞的损伤。
2)在槽道内的液滴冷冻实验中,纯水冰晶生长速率随过冷度增加近似呈线性增长,生长形态总体上为无分叉的树枝状冰晶,但其几何形貌随过冷度不同而呈现显著差异。低过冷度时,冰枝尖端圆润且间隔较宽,高过冷度时,冰枝呈细针状。
3)在生精小管冷冻实验中,由于水分子与DMSO作用弱化了冰晶生长,鼠生精小管外的冰晶即使在大过冷度下也未出现在纯水实验中观察到的细针状形态,降低了冰晶对生精小管的机械损伤风险,使生精小管得以维持更为完好的生理形态。
本文受上海市科委创新行动计划(20S31903400)、上海市申康促进创新能力三年行动计划 (SHDC2020CR3077B)和上海交通大学医工交叉研究基金(YG2021QN86)项目资助。(The project was supported by Innovation Action Plan of Shanghai Science and Technology Commission(No.20S31903400), Three-year Action Plan of Shanghai Shenkang to Promote Innovation Ability(No.SHDC2020CR3077B) and Biomedical Engineering Interdisciplinary Fund of Shanghai Jiao Tong University (No.YG2021QN86).)

