三叶苷对下肢缺血再灌注小鼠肾损伤的保护作用
王 磊,白艳辉,王 鹏,李爱军,张冬芹,史 坚,王秀丽
(1.河北医科大学第三医院麻醉科,石家庄 050051;2.保定市第一中心医院麻醉科,保定 071000;3.保定市第一中心医院老年科,保定 071000;4.保定市第一中心医院心外科,保定 071000)
下肢缺血再灌注(lower-limb ischemia reperfusion,LIR)是肾损伤的主要原因之一,其机制可能是缺血缺氧致线粒体功能受损,使细胞肿胀坏死,再灌注过程中炎性级联反应使损伤进一步加重[1-2]。研究[3]发现,近端肾小管线粒体的改变是肾脏疾病发生、发展的重要标志。沉默信息调节因子3(SIRT3)位于线粒体内,参与线粒体的多种生物调节功能,如抗氧化应激、能量合成代谢、细胞裂变融合等多个过程[4-5]。通过上调SIRT3可抑制氧化应激,以减轻器官缺血再灌注损伤[6]。超氧化物歧化酶2(superoxide dismutase 2,SOD2)是一种特定位于线粒体内的SOD,属于抑制线粒体活性氧的清除酶。研究[7]发现,SIRT3通过上调线粒体内的SOD2表达,可提高线粒体清除活性氧的能力。三叶苷(trilobatin,TLB)是从多穗柯叶中提取的一种天然甜味剂,具有抗炎、抗氧化、抗肿瘤、抗病毒等作用[8-9]。TLB通过抗炎、抗氧化作用可缓解脑缺血再灌注所致的神经损伤[10],目前TLB是否对LIR所致肾损伤有保护作用尚不清楚。本研究旨在探讨预处理TLB对小鼠LIR所致肾损伤的保护作用及其机制。
1 材料与方法
1.1 实验动物及材料、设备
1.1.1 实验动物8~10周龄雄性C57BL6小鼠60只,均由中国医学科学院放射医学研究所提供(动物许可证编号:2021002),并由医院伦理委员会批准(2021036)。
1.1.2 主要材料及设备TLB购自成都普瑞法科技开发有限公司(批号:PRF15092821);沉默信息调节因子3(silent information regulator 3,SIRT3)选择性抑制剂购自美国Selleck生物科技有限公司(批号:S862801,纯度99.90%);丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、二氢乙啶(dihydroethidium,DHE)试剂盒均购自上海碧云天生物技术有限公司;BCA蛋白浓度测定试剂盒购自北京索莱宝科技有限公司;抗体SIRT3、抗体SOD2购自美国Abcam公司;抗体GAPDH购自美国Proteintech Group公司;彩色多普勒超声(型号Vevo2100)购自加拿大VisualSonics公司;石蜡切片机(型号RM2235)购自德国Leica公司;酶标仪(型号ELX-800)购自美国BioTek公司;凝胶成像系统(型号WD-9413B)、双垂直蛋白电泳仪(型号DYCZ-24DN)购自北京六一生物科技有限公司。
1.2 方法
1.2.1 模型制备 参照文献[11]行LIR模型制备,采用巴比妥钠对小鼠进行麻醉后,用止血带结扎双后肢根部造成后肢缺血,缺血3 h后松解止血带,并对双后肢进行按摩以加速血流复灌,再灌注3 h后处死小鼠进行实验研究,见图1A。整个制备过程使用彩色多普勒超声探测血流以保证模型制备成功。
1.2.2 动物分组 将60只小鼠采用随机数表法分为4组(n=15),即对照组:小鼠建立假手术前3 d,给予等量生理盐水,在模型制备过程中仅行麻醉,不进行双后肢根部止血带的结扎;损伤组:造模前3 d,给予小鼠等量生理盐水,行LIR模型制备;预处理组:造模前3 d,通过灌胃方式给予小鼠TLB 15 mg·kg-1,2次/d,连续3 d,之后行LIR模型制备;抑制剂组:造模前3 d,一次性经腹腔注射SIRT3选择性抑制剂(3-TYP)50 mg·kg-1,后续操作同预处理组,见图1B。

图1 动物实验流程图
1.3 检测指标
1.3.1 检测血清血肌酐(serum creatinine,Scr)、尿素氮(blood urea nitrogen,BUN)浓度 抽取小鼠外周血,离心、留取上清,采用Beckman AU5800全自动生化分析仪检测。
1.3.2 苏木精-伊红(hematoxylin-eosin staining,HE)染色观察小鼠肾组织病理形态及病理损伤评分 取小鼠肾组织,经固定、修剪、脱水、透明、浸蜡、包埋、切片、脱蜡、至水、染色、封片处理后,显微镜下观察肾组织形态。参照文献[12]进行肾脏病理损伤评分,1分:肾间质炎性细胞浸润;1分:肾间质充血;1分:细胞核固缩;1分:肾小管腔内脱落、坏死的细胞;1分:上皮细胞颗粒变性;1分:肾小管显著扩张、细胞扁平;0分:正常肾小管。
1.3.3 DHE染色检测小鼠肾组织中活性氧(reactive oxygen species,ROS)水平 处死小鼠取新鲜肾组织,将部分肾组织置于样本托上,使用OCT包埋剂包埋样本,用切片机将肾组织切成10 μm的薄片,将组织薄片吸附于载玻片上。晾干后于-70℃冰箱中保存。滴加DHE试剂,37℃避光孵育30 min。胶头滴管滴加抗荧光淬灭剂,盖玻片封片。
1.3.4 小鼠肾组织MDA、SOD测定 处死小鼠取部分肾组织进行研磨,加入裂解液(肾组织重量占裂解液的比例为10%)进行裂解,于4℃、14 000 r·min-1离心10 min,留取上清待测。样品准备完毕后用BCA蛋白浓度测定试剂盒测定蛋白浓度。用MDA检测试剂盒测定小鼠血浆MDA水平,严格按照说明书进行操作,酶标仪检测532 nm各孔吸光值;用SOD检测试剂盒测定小鼠血浆SOD水平,严格按照说明书进行操作,酶标仪检测550 nm各孔吸光值。
1.3.5 Western blot法检测小鼠肾组织SIRT3表达 取部分肾组织进行研磨,加入细胞裂解液和蛋白酶抑制剂PMSF冰上裂解2 h后,低温离心后取上清,95℃变性10 min,PAGE电泳分离后转至PVDF膜,分别加入一抗(抗SIRT3、抗体SOD2、内参抗体GAPDH)置摇床孵育2 h,弃一抗,TBST漂洗后加入辣根过氧化酶标记的山羊抗鼠二抗(北京索莱宝科技有限公司),孵育1 h,弃二抗,TBST漂洗,用化学发光法曝光显影,采用Quantity one软件进行分析,以各目的蛋白条带灰度值与GAPDH条带灰度值的比值反映各目的蛋白表达。
1.4 统计学方法
采用SPSS 26.0统计学软件进行数据分析,正态分布的计量资料以均数±标准差(±s)表示,多组间比较采用方差分析,组间两两比较采用LSD-t法。P≤0.05为差异有统计学意义。
2 结果
2.1 TLB对LIR肾损伤小鼠肾功能的影响
与对照组相比,损伤组小鼠血清中Scr、BUN水平升高(P均<0.05);与损伤组比较,预处理组血清Scr、BUN水平降低(P均<0.05);与预处理组比较,抑制剂组血清Scr、BUN水平升高(P均<0.05),见表1。
表1 各组间小鼠肾功能指标比较(±s)
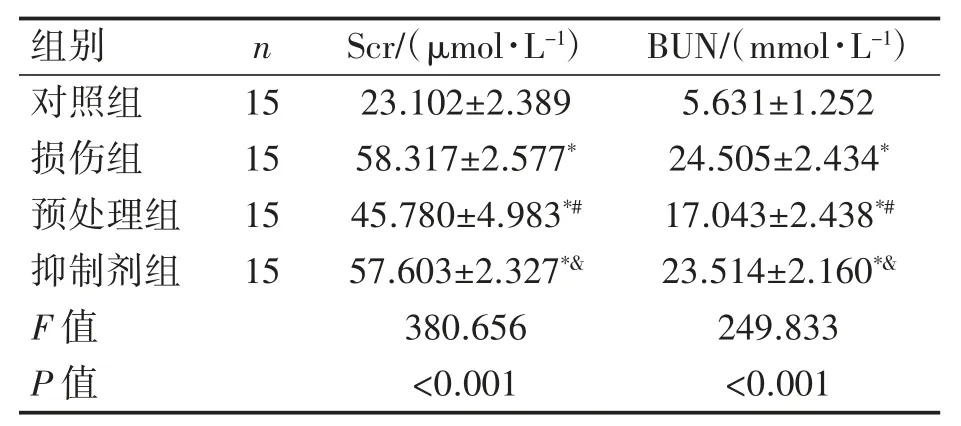
表1 各组间小鼠肾功能指标比较(±s)
与对照组比较*P<0.05;与损伤组比较#P<0.05;与预处理组比较&P<0.05。
?
2.2 TLB对LIR肾损伤小鼠肾组织形态及损伤评分的影响
光镜下观察,对照组小鼠肾小管上皮细胞结构完整,肾小球及间质无明显病理学改变,未见炎性细胞浸润;与对照组比较,损伤组小鼠可见肾小球毛细血管扩张充血,并伴有大量炎性细胞浸润,肾小管上皮细胞肿胀坏死,肾损伤评分增高(P<0.05);与损伤组比较,预处理组小鼠肾小球毛细血管扩张充血较轻,偶见炎性细胞浸润、肾小管上皮细胞坏死脱落表现,损伤评分降低(P<0.05);与预处理组比较,抑制剂组小鼠光镜下表现同损伤组,且损伤评分增高(P<0.05),见图2、表2。

图2 各组小鼠肾组织结构变化(HE×400,bar=100 μm)
表2 各组间小鼠肾组织病理评分比较(±s,分)

表2 各组间小鼠肾组织病理评分比较(±s,分)
与对照组比较*P<0.05;与损伤组比较#P<0.05;与预处理组比较&P<0.05。
?
2.3 TLB对LIR肾损伤小鼠氧化应激指标的影响
与对照组相比,损伤组小鼠肾组织中ROS、MDA含量升高,SOD活性下降(P<0.05);与损伤组比较,预处理组小鼠肾组织中ROS、MDA含量降低,SOD活性提高(P<0.05);与预处理组比较,抑制剂组小鼠肾组织中ROS、MDA含量升高,SOD活性下降(P<0.05),见图3、表3。
表3 各组小鼠氧化应激指标比较(±s)

表3 各组小鼠氧化应激指标比较(±s)
与对照组比较*P<0.05;与损伤组比较#P<0.05;与预处理组比较&P<0.05。
?

图3 各组小鼠下肢缺血再灌注后肾组织中ROS水平(DHE×200,bar=100 μm)
2.4 TLB对LIR肾损伤小鼠SIRT3/SOD2通路的影响
与对照组相比,损伤组小鼠SIRT3、SOD2蛋白相对表达下调(P<0.05);与损伤组相比,预处理组小鼠SIRT3、SOD2蛋白相对表达上调(P<0.05);与预处理组比较,抑制剂组小鼠SIRT3、SOD2蛋白相对表达下调(P<0.05),见图4、表4。
表4 各组间小鼠SIRT3/SOD2通路蛋白相对表达比较(±s)

表4 各组间小鼠SIRT3/SOD2通路蛋白相对表达比较(±s)
与对照组比较*P<0.05;与损伤组比较#P<0.05;与预处理组比较&P<0.05。
?
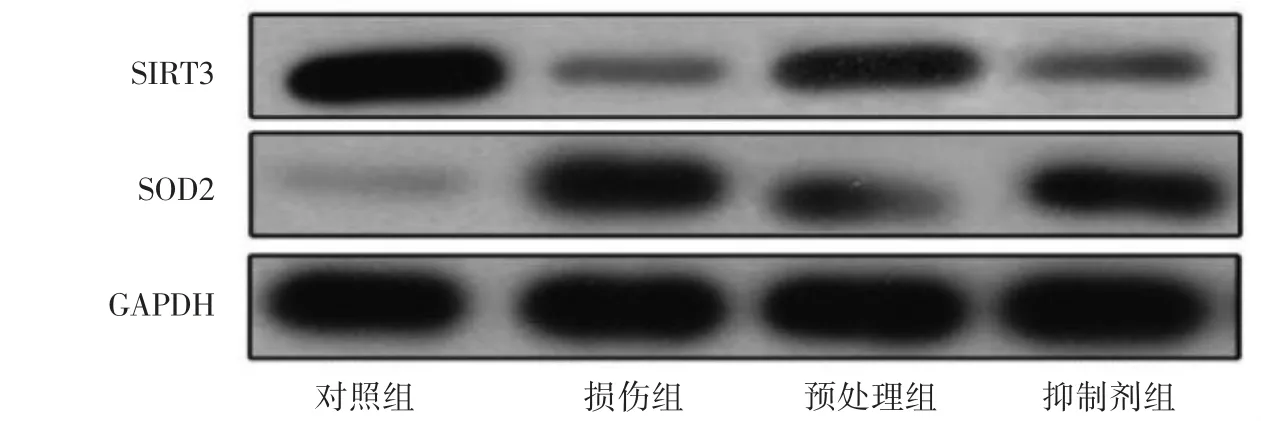
图4 Western blot检测肾组织SIRT3/SOD2通路的蛋白相对表达情况
3 讨论
肢体长时间缺血后突然再灌注,远隔组织如心脏、肺脏、肾脏等器官会出现不同程度的受损,严重者甚至出现多脏器功能衰竭和休克[13-14]。在探讨LIR肾损伤的发生发展过程中,动物模型作为损伤研究的基础,可模拟其发病原因、病理过程和临床特征,为进一步研究其发病机制及治疗预后提供基础。在模型制备完成后,光镜下可见对照组小鼠肾小管结构完整,无炎性细胞浸润,而损伤组小鼠肾组织形态结构发生改变,提示LIR肾损伤模型制备成功。
TLB是从多穗柯叶中提取的二氢查耳酮类化合物,具有抗炎、抗氧化等作用。研究[15]发现,TLB可通过提高SOD活性,降低脂质过氧化产物MDA及乳酸脱氢酶含量,减轻氧化应激损伤,从而对缺氧缺糖诱导的心肌细胞起到保护作用。本研究进一步证实,LIR所致的肾损伤中肾组织氧化应激因子中氧化剂(ROS)及产物(MDA)的生成与抗氧化剂(SOD)防御之间的失衡,预处理组TLB可改善上述指标变化,提示预处理TLB可通过抑制氧化应激反应改善小鼠LIR肾损伤,而抑制剂组通过抑制SIRT3的表达,可减弱TLB在氧化应激方面的保护作用,从而加重小鼠LIR所致的肾损伤。
哺乳动物Sirtuins家族共有7个成员(包括SIRT1-7),其中SIRT3主要定位在线粒体基质中,作为主要的应激反应蛋白去乙酰化酶,参与机体炎性、氧化应激的调节,在缺血再灌注损伤中起着至关重要的作用[16-17]。Wang等[18]发现,过表达SIRT3可抑制炎症,对抗氧化应激损伤,减少肾小管上皮细胞凋亡,改善体内外肾缺血再灌注损伤具有重要作用。敲除SIRT3会加重小鼠肾损伤、氧化应激以及凋亡[19]。这与本实验结果基本一致。
SIRT3调控线粒体功能主要表现为增加SOD2活性、降低细胞ROS水平和提高机体抗氧化应激能力[20]。本研究发现,预处理组小鼠TLB通过上调SIRT3蛋白表达,致SOD2表达增强。值得注意的是,抑制剂组小鼠由于阻断了SIRT3表达,从而削弱了TLB改善LIR肾损伤的作用,推测其机制可能是TLB通过上调线粒体内的SIRT3表达,使SOD2活力增强,进而抑制超氧化物生成,减轻氧化应激反应,从而改善LIR所致的肾损伤。肾损伤作用机制十分复杂,并非由单一细胞因子起决定性作用,还有其他细胞因子和炎性介质的相互作用、相互制约,共同调节肾损伤的发生发展,这也是本课题组进一步的研究方向。
综上所述,TLB可减轻氧化应激反应,改善小鼠LIR所致的肾损伤,其部分机制可能与SIRT3/SOD2信号通路激活有关。

