前循环血管取栓再通后恶性脑水肿的危险因素
项良旭 李美英 凤兆海 徐 竞 郑颖炜 李志德
马鞍山市人民医院,安徽 马鞍山 243000
血管内血栓切除术(endovascular thrombectomy,EVT)对前循环大血管闭塞性脑卒中患者的疗效和安全性取得里程碑式的突破。然而,恶性脑水肿(malignant brain edema,MBE)在EVT 术后患者并不少见。MBE是急性大血管闭塞性脑卒中(acute large vascular occlusion stroke,ALVOS)严重的并发症,占所有急性缺血性脑卒中(acute ischemic stroke,AIS)患者的10%~78%[1],且MBE 患者病死率接近80%[2]。目前,临床尚无有效的监测指标和治疗手段,仅早期去骨瓣减压术(decompressive craniectomy,DC)可以降低发病率和病死率。因此,早期识别及干预MBE患者具有非常重要的意义。
中性粒细胞/淋巴细胞计数比值(neutrophil-lym⁃phocyte ratio,NLR)作为炎性标志物已被证明与脑梗死严重程度、出血转化和不良临床预后相关。纤维蛋白原/白蛋白比值(fibrinogen to albumin ratio,FAR)也是一种新型炎症标志物,已广泛应用于肠道肿瘤诊断、宫颈癌诊断、冠状动脉相关疾病的严重程度判定。NLR及FAR作为简单易得的炎症标志物,目前对于前循环大血管闭塞性脑梗死早期EVT后出现MBE的相关临床研究较为缺乏。本研究希望通过检测前循环大血管闭塞性缺血性脑卒中行EVT治疗患者术前NLR、FAR水平,评估术前NLR、FAR对于早期识别EVT术后血管再通发生MBE的价值。
1 资料与方法
1.1 一般资料回顾性连续纳入2018-08—2022-05就诊于马鞍山市人民医院早期血管内治疗后血管成功再通的前循环ALVOS 患者62 例。根据是否发生MBE对62例患者进行分组,发生MBE的患者为观察组(n=23),未发生MBE患者为对照组(n=39)。
1.2 纳入及排除标准纳入标准:(1)年龄>18岁;(2)符合急性缺血性脑卒中的诊断标准[3];(3)经CT血管造影(CT angiography,CTA)或数字减影血管造影(digital subtraction angiography,DSA)证实存在颈内动脉(internal carotid artery,ICA)、大脑中动脉(middle cerebral artery,MCA)闭塞,包括大脑中动脉M1段及M2段;(3)发病时间在6 h以内、部分发病时间在24 h 内患者通过CT 灌注成像(CT perfusion imaging,CTP)评估符合DEFUSE-3 或DAWN 研究入组 患 者;(4)术 前Alberta 卒 中 项 目 早 期CT 评 分(Alberta stroke program early CT score,ASPECTs)≥6分;(5)术前美国国立卫生研究院卒中量表(National Institute of Health stroke scale,NIHSS)评分≥6 分;(6)术前改良Rankin 量表(modified Rankin scale,mRS)评分<2分;(7)所有患者和(或)家属均知情同意手术并签署知情同意书。排除标准:(1)术后无头颅影像资料;(2)术后造影见改良脑梗死溶栓分级(modified thrombolysis in cerebral infarction,mTICI)<2b 级;(3)合并慢性阻塞性肺病、严重心脏疾病、血液系统疾病及恶性肿瘤等患者;(4)入院前1 周内有感染史。本研究设计方案获得马鞍山市人民医院医学伦理委员会批准(马人医伦审〔2019〕001号-027)。
1.3 研究方法
1.3.1 收集临床资料:收集所有患者的相关人口学资料,包括年龄、性别、既往史(如有无高血压、心房颤动、糖尿病、卒中史、吸烟等),术前患者NIHSS 评分、TOAST分型[4]。高血压、糖尿病的诊断分别参照《中国高血压防治指南2021》《中国2 型糖尿病防治指南2021》。TOAST 分型主要分为大动脉粥样硬化型、心源性栓塞型。
1.3.2 治疗方法:患者发病处于静脉溶栓时间窗内,符合静脉溶栓指征且无禁忌证,家属同意静脉溶栓治疗及EVT,给予桥接治疗;患者发病超过静脉溶栓时间窗,符合DEFUSE-3 或DAWN 研究入组患者,无EVT禁忌证,家属同意EVT,直接行EVT治疗。不论静脉溶栓或EVT,均需家属签字同意。EVT 方式不限,主要包括抽吸取栓(如ACE 抽吸导管、Sofia 抽吸导管)、支架取栓(如Solitaire FR)、急诊支架植入。所有病人通过全脑血管造影确定病变血管,然后在微导丝的引导下,将微导管穿过闭塞血管,抽吸或释放取栓支架,取出血栓。应用mTICI分级标准评估血流再通情况,以mTICI分级2b或3级定义为血管成功再通[5]。术后头颅CT 排除出血,直接EVT 患者术后即可给予抗栓或抗凝、他汀类药物治疗,桥接患者静脉溶栓24 h 后给予抗栓或抗凝、他汀类药物治疗。积极控制血压,避免引起过度灌注,严密监测患者意识情况及生命体征,积极复查头颅CT,发生脑水肿时及时给予甘露醇降颅压治疗(图1)。
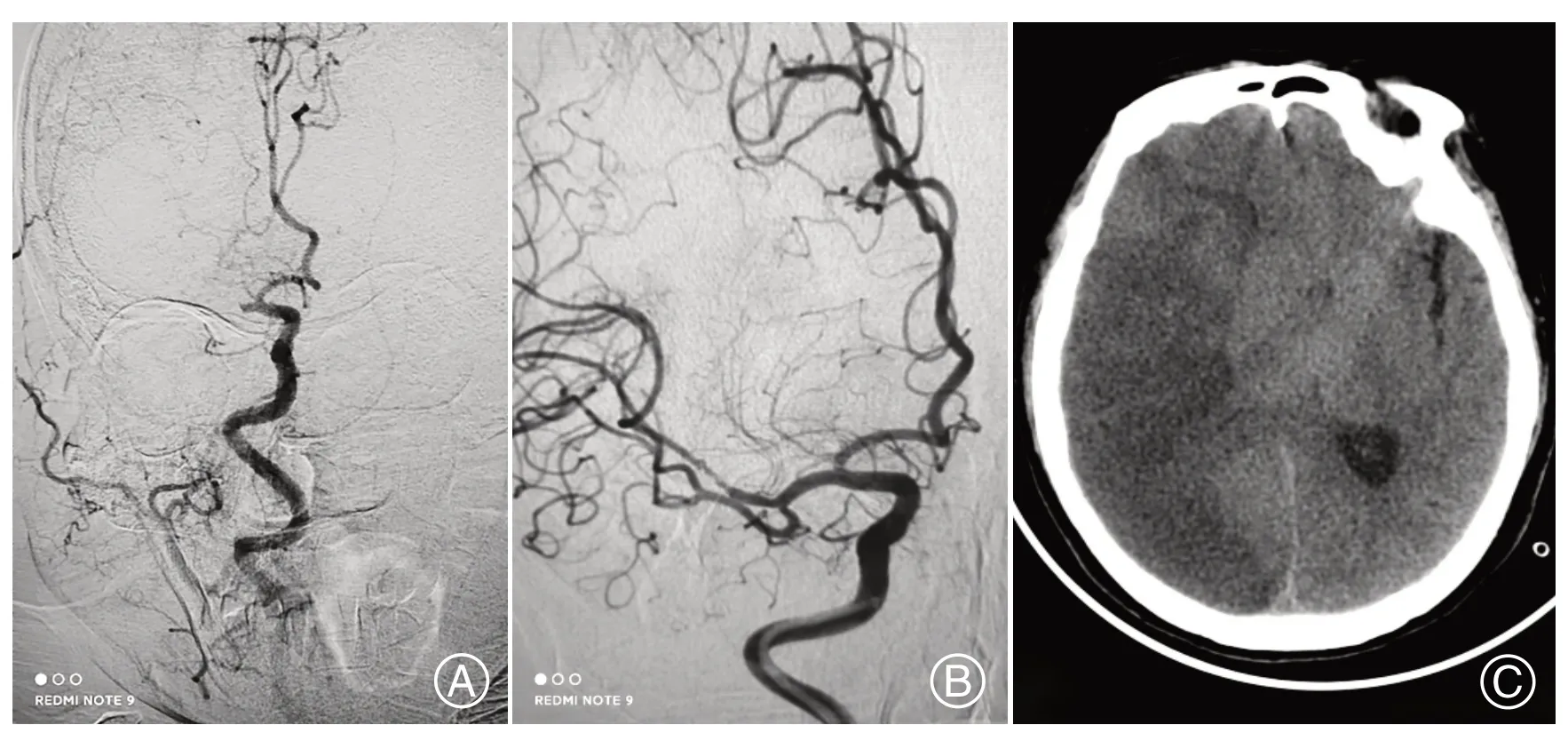
图1 患者 女,71岁,急性前循环大血管闭塞脑梗死。A:造影见右侧大脑中动脉闭塞;B:机械取栓后右侧大脑中动脉血流通畅,TICI分级3级;C:右侧大脑半球大面积脑梗死伴恶性脑水肿Figure 1 Female,71 years old. Vascular occlusion cerebral infarction acute anterior circulation. A:Angiography of right middle cerebral artery occlusion. B:After the machine should chang on the right side of the brain blood circulation,TICI 3. C:The right hemisphere large area cerebral infarction associated with malignant brain edema
1.4 分组情况参照既往研究,恶性脑水肿表现为大面积脑梗死后脑水肿进展,颅内压迅速增高,引起脑组织移位导致脑疝,临床常表现为意识水平及神经功能恶化,影像学可见颅内占位征象,头颅CT 可见中线移位超过透明隔5 mm,脑室受压或闭塞[6-7]。
1.5 血液指标的测定采集患者术前静脉血,使用全自动血常规分析仪(希森美康X-n550)分析白细胞计数(white blood cell,WBC)、中性粒细胞计数(neutrophil,N)、淋巴细胞计数(lymphocyte,L),计算NLR。使用全自动生化分析仪(强生干湿V-4600)分析白蛋白(albumin,ALB),使用全自动凝血分析仪(希森美康CS-5100)获得纤维蛋白原(fibrinogen,FIB),计算FAR。采集入院第2 天静脉血,使用全自动生化分析仪测定总胆固醇(total cholesterol,TC)、三 酰 甘 油(triacyl glycerol,TG)、低 密 度 脂 蛋 白(low-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白(hgih-density lipoprotein cholesterol,HDL-C)、空腹血糖(fasting plasma glucose,FPG)。
1.6 统计学方法采用SPSS 26.0 统计分析软件对数据进行整理、统计和分析。采用率(%)对计数资料进行描述;采用Shapiro-Wilk test 方法检验数据的正态性,采用均数±标准差(±s)对正态分布的计量资料进行描述,采用M(P25,P75)对非正态的计量资料进行描述;采用χ2检验对比分析2 组间率的差异情况,两独立样本t检验对比分析2组间正态指标差异情况,Mann-Whitney U 检验对比分析2 组间非正态指标差异情况,二分类多因素Logistic回归方法分析预后的影响因素,Medcalc 软件绘制ROC曲线分析术前NLR和FAR预测恶性脑水肿的敏感性和特异性。检验水准α=0.05。
2 结果
2.1 基线资料共纳入62例患者,男、女分别为34 例(54.8%)、28例(45.2%);恶性脑水肿组23例(37.1%);有高血压史33例(53.2%),糖尿病史16例(25.8%),脑卒中史22 例(35.5%),吸烟者23 例(37.1%);年龄(67.47±9.48)岁。对NIHSS、mRS评分和临床指标进行描述,见表1。

表1 非恶性水肿组和恶性水肿组基础资料比较Table 1 Comparison of demographics and clinicalcharacteristics between patients with MBE and without MBE
2.2 血管再通患者非恶性水肿组与恶性水肿组实验室检验结果比较与非恶性水肿组相比,恶性水肿组患者的NIHSS 评分、mRS 评分、中性粒细胞计数、纤维蛋白原、NLR、FAR 值均高于非恶性水肿组,白蛋白、淋巴细胞计数低于非恶性水肿组(P<0.05),卒中史、房颤史比例高于非恶性水肿组(P<0.05)。性别构成、高血压患病率、糖尿病患病率、吸烟和年龄在2组间均无统计学差异(均P>0.05)。见表2。
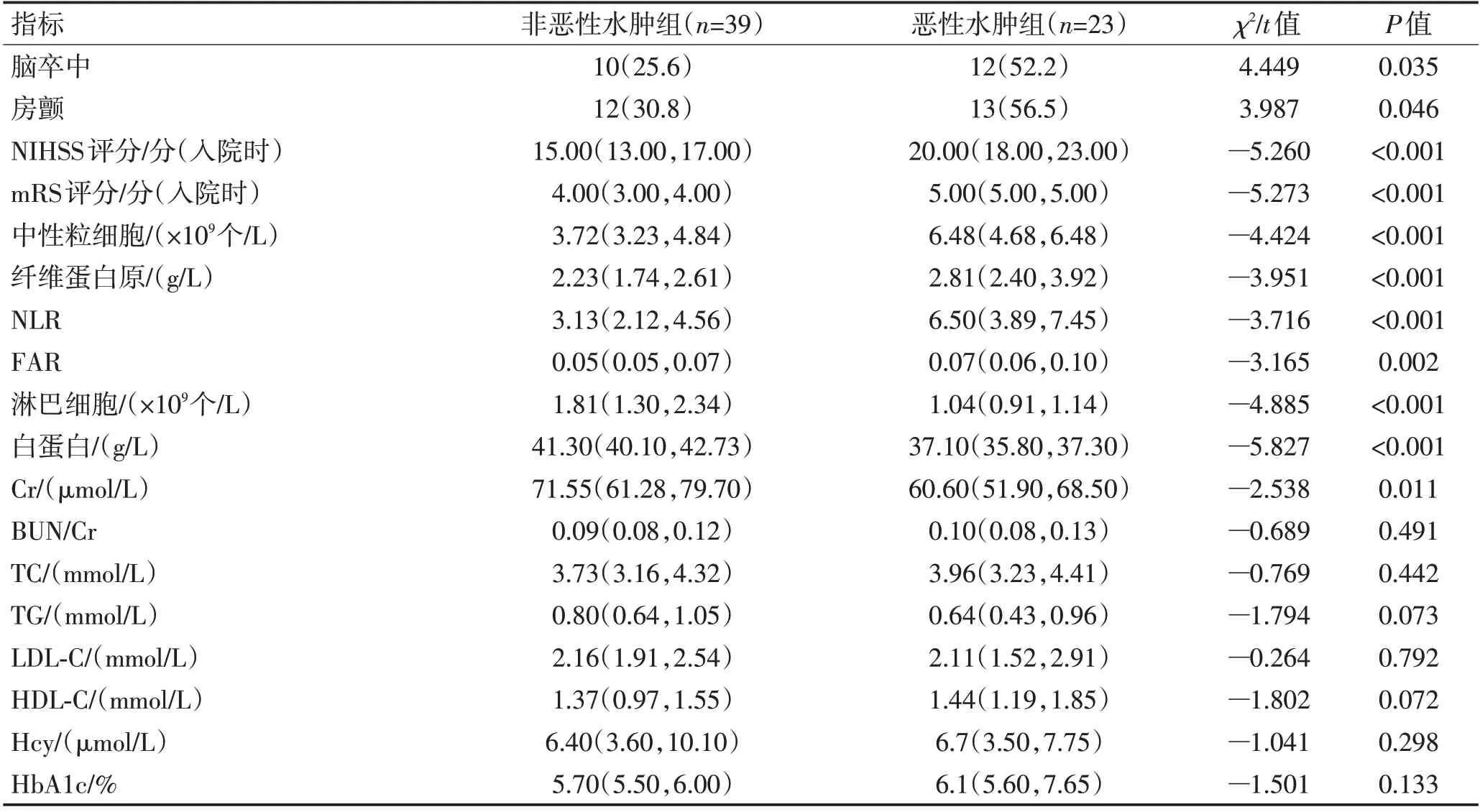
表2 非恶性水肿组和恶性水肿组临床治疗单因素分析Table 2 Patients with MBE and without MBE single factor analysis of clinical treatment
2.3 血管再通患者恶性水肿的多因素Logistic 回归分析二分类多因素Logistic 回归分析显示,有卒中史的患者出现恶性水肿概率高于无卒中史者(OR=184.461,95%CI:2.565~13 263.614);房颤患者出现恶性水肿概率高于无房颤者(OR=435.610,95% CI:4.181~45 388.026);入院时NIHSS得分越高,患者出现恶性水肿的概率越高(OR=2.239,95%CI:1.379~7.607);NLR 值越高,患者出现恶性水肿的概率越大(OR=3.481,95% CI:1.264~9.585)。卒中史、房颤、入院时高NIHSS 评分、高NLR 为患者出现恶性水肿的危险因素。见表3。
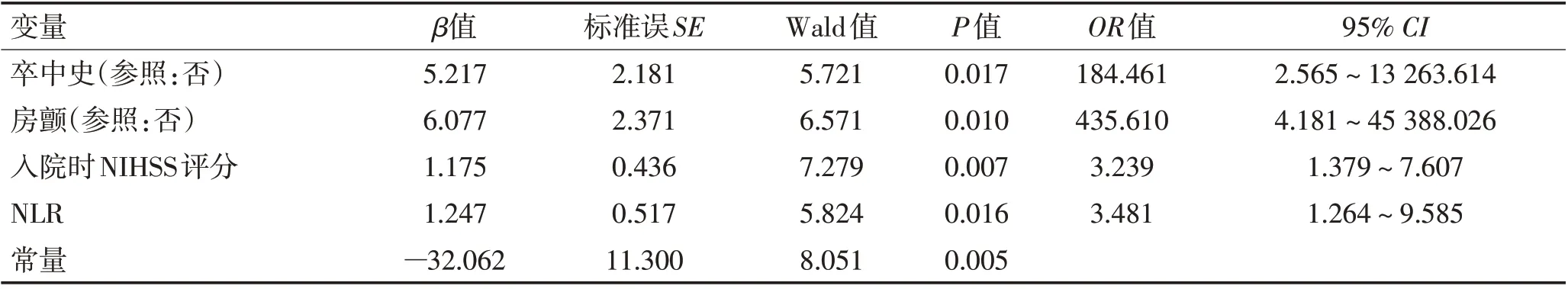
表3 恶性水肿的二分类多因素Logistic回归分析Table 3 Binary classification of malignant edema multiariable Logistic regression analysis
2.4 入院时NLR、FAR 及NLR 联合FAR 对ALVOS患者血管再通后出现恶性水肿的预测NLR和FAR 的AUC 分别为0.784 和0.739,均高于0.700,NLR 的灵敏度和特异度分别为82.61%和74.36%,FAR的灵敏度和特异度分别为65.22%和74.36%。当NLR和FAR两个指标进行联合预测时ACU为0.816,大于NLR 和FAR 单独预测时的AUC,联合预测的灵敏度和特异度分别为69.57%和87.18%。见表4、图1。

表4 恶性水肿与NLR、FAR的ROC曲线分析Table 4 Malignant edema and NLR,FAR of ROC curve analysis

图4 患者出现恶性脑水肿与NLR、FAR的ROC曲线分析Figure 4 The patients with malignant brain edema and NLR,FAR of ROC curve analysis diagram
3 讨论
本研究表明,即使早期ALVOS患者血管再通,仍有37.1%的患者出现恶性脑水肿;卒中史、房颤、高NIHSS评分及高NLR为患者出现恶性水肿的危险因素;术前NLR 和FAR 增高可用于预测急性前循环血管闭塞患者取栓再通后恶性脑水肿,当两个指标联合预测时效果更佳。
大血管闭塞所占的急性缺血性脑卒中并不少见[8]。越来越多的研究表明,血管内血栓切除术可能是最合理和最有效的方法,尽早建立灌注,抢救缺血半暗,减少脑梗死体积,是治疗急性缺血性脑卒中的关键步骤[9]。缺血性脑卒中后MBE是最严重的并发症,可导致颅内压升高,神经系统迅速恶化和脑疝。尽管最近的研究表明,血管成功再通可能减轻脑水肿,但MBE 在EVT 患者中并不少见[10-12]。不同研究对于急性大血管闭塞性缺血性脑卒中发生MBE的结果有差异,即使成功再通患者中也有>20%的患者发展为MBE[7],甚至高达44%的患者出现中线移 位[10]。然 而EVT 后 发 生MBE 的 数 据 有 限,FUHRER 研究[13]显示,血管内治疗可有效降低MBE的发生率。尽管患者发生MBE 的具体机制不清楚,但早期临床识别对于治疗很重要。
急性缺血性脑卒中可引起一系列的炎性反应和免疫抑制状态,脑组织缺血或缺血后再灌注可能通过氧化应激和兴奋性毒性导致血-脑屏障(blood brain barrier,BBB)破坏,增加血管通透性,导致细胞毒性水肿、血管源性水肿以及出血转化。NLR 是一种客观的、易于获得的炎症标志物,已被证实与脑梗死的严重程度及预后相关。既往研究发现,高NLR是EVT 后出现症状性颅内出血、死亡的独立预测因子[14-16]。中性粒细胞和淋巴细胞对维持血-脑屏障完整性起重要作用。中性粒细胞是脑缺血后最先出现炎症反应的细胞之一[17],可在梗死组织周围浸润、聚集,同时可引发神经毒性作用,加重脑组织损害。中性粒细胞通过释放基质金属蛋白酶-9(matrix metallopeptidase 9,MMP-9)促进BBB分解,研究表明血清MMP-9 增加与BBB 损伤呈正相关,与恶性脑水肿有关[18]。相反,淋巴细胞(T细胞和B细胞)通过抑制炎症和维持BBB 完整性,在卒中发作后具有神经保护功能[19]。有学者指出,调节性T淋巴细胞能够分泌抗炎因子从而抑制炎症反应,并可以通过抑制炎症因子的表达对缺血的脑组织进行保护。NLR是外周中性粒细胞和淋巴细胞计数的复合标志,既可反映AIS 早期中性粒细胞激活诱导炎症反应导致脑损害加重,又反映了淋巴细胞在急性期的凋亡,在反映机体炎症水平方面更为可靠。PETRONE研究提出,中性粒细胞计数高而淋巴细胞计数低,被认为是脑卒中预后不良的预测因子[20]。
美国一项9 427名参与者的队列研究发现,健康成人的平均NLR 为2.15(95%CI 2.11~2.19)[21]。中国健康人群相对较低,在60~69 岁患者中,男性为1.51±0.64,女性为1.71±0.68[22]。本研究中NLR 中位数偏高,其中非恶性脑水肿组为3.13(2.12,4.56),恶性脑水肿组为6.50(3.89,7.45),可能与本研究中的卒中患者相对严重有关,也证实了NLR 与卒中严重程度相关。本研究选择NLR 作为研究指标,结果提示ALVOS 患者术前高NLR 是血管再通后发生MBE的独立危险因素。然而,NLR 与脑侧支循环的研究并不多见,SEMERANO 等[23]研究发现,对接受EVT的大血管闭塞脑卒中患者,术前高NLR 可能出现脑血管侧支循环不良。因此,MBE 的发生可能与高NLR所致炎症反应、侧支循环不良相关。
本研究发现,出现恶性脑水肿的患者FIB 增高,而血清蛋白降低。FAR是一种新的炎症标志物,目前已用于胃肠道肿瘤诊断、宫颈癌诊断、冠状动脉疾病的严重程度判断。纤维蛋白原能够通过受损BBB,导致神经元损伤、神经炎症和免疫细胞聚集[24]。研究表明,在AIS患者中降低FIB可以减少患者神经损害并改善生活质量[25]。也有研究发现,高FIB可能会增加rt-PA溶栓治疗AIS患者发生出血转化的风险[26]。然而,目前缺乏ALVOS 患者发生MBE 的相关研究。FIB造成脑水肿的可能原因:(1)FIB能够通过通透的BBB 进入中枢神经系统脑组织,导致神经系统神经元损伤,也可与小胶质细胞相结合,刺激并分泌促炎细胞因子和趋化因子,加重BBB破坏[27]。(2)FIB亦可直接作用于脑组织内皮细胞增加BBB 通透性,而血清蛋白由血液进入脑组织,加重脑水肿。(3)高浓度FIB 可激活内皮MMP-9,进一步增加恶性脑水肿风险。(4)血清白蛋白(serum albumin,ALB)可以通过抗氧化、抗炎、调节血管通透性,从而对脑组织发挥神经保护作用,同时由于白蛋白分子量高,可直接降低BBB的通透性。研究认为,较低ALB浓度的AIS患者不良结局风险增加[28]。近年来也有研究发现,白蛋白较高的AIS患者给予静脉溶栓治疗后,其出血转化比例也较低[29]。本研究发现,FAR 作为一种新型的炎症标志物,可以预测AVLOS患者EVT治疗后发生MBE 的风险,灵敏度和特异度分别达65.22%和74.36%,因此认为FAR可以较好地预测ALVOS患者EVT后恶性脑水肿的发生。
本研究也发现较高基线的NIHSS评分也是发生MBE 的另一个危险因素。研究发现,NIHSS 评分较高的患者EVT 后发生出血转化的风险增加,这可能与较高的NIHSS评分意味着侧支循环不良和更大的核心梗死有关[30]。最近的一项系统评价表明,卒中后MBE 的主要决定因素是NIHSS 评分较高、脑组织低密度区较大和高灌注[31],与本研究一致。因此,高NIHSS评分是EVT后MBE的独立预测因子。
房颤是诱发心源性脑栓塞的主要原因,PASTUSZAK 等[32]发现住院患者房颤发生率达24%。房颤相关的缺血性脑卒中预后不良很常见[33],并给中国社会带来了相当大的临床和经济负担[34]。本研究发现,房颤引起的缺血性脑卒中患者发生MBE 的风险高于大动脉粥样硬化性患者,主要原因可能是心源性栓塞患者未能形成良好的侧支循环。侧支循环可改善缺血脑组织的血流灌注,延缓神经损伤的发生,减小脑梗死的范围[35]。由于心源性栓塞患者发病急骤,未能建立起良好的侧支循环,其梗死面积大,神经功能受损更严重,因此发生MBE的风险增高。
即使血管再通的ALVOS患者,术前高NLR、FAR可有效预测患者出现恶性脑水肿,NLR 联合FAR 预测准确性最高。一旦出现恶性脑水肿,急诊开颅清除病灶并去骨瓣减压手术能彻底降低颅内压,减压充分,改善脑部血液灌注,减少神经组织损伤,从而提高救治率。血常规、肝肾功能、凝血功能是急诊常见的检测方法,NLR 和FAR 简单易获得。临床医师可以综合NLR、FAR水平预测MBE的发生,尽早做好MBE的预防,加入干预措施,做好早期去骨瓣减压的准备,对提高患者生活质量有重要意义。
本研究也存在一定局限性:本文为小样本回顾性研究,仍需多中心大样本前瞻性试验证实;本研究未能动态监测NLR、FAR 的演变,日后将补充病例数,深入分析NLR 及FAR 对ACI 患者出现恶性脑水肿的预测价值。

