牛卵巢黄体细胞增殖和孕酮分泌相关基因的筛选及其表达研究
赵园园,孟金柱,伍春亚,潘春威
(铜仁学院 贵州省梵净山地区生物多样性保护与利用重点实验室,贵州 铜仁 554300)
黄体是哺乳动物卵泡成熟排卵后卵泡壁上的膜层细胞以及颗粒层细胞分化形成的一个暂时性的腺体样的组织结构。卵泡在排卵前出现的黄体生成素(LH)峰会导致一系列应答反应[1]。排卵后,卵泡膜层细胞和颗粒层细胞在黄体生成素的调控作用下分别分化形成小黄体细胞(SLC,直径12~25µm)和大黄体细胞(LLC,直径大于25µm)[2]。前人研究表明,奶牛和绵羊卵巢LLC 和SLC 均有分泌孕酮的能力,但LLC 的基础孕酮分泌量较SLC 最高可达20 倍[3-4],然而调控这2 种细胞分泌孕酮的机制尚不清楚。孕酮是一种类固醇激素,是大多数物种维持妊娠所必需的。然而在牛和羊中,SLC 含有大量黄体生成素受体(LHCGR),而LLC 主要表达前列腺素F2α 受体(PTGFR)[4]。高度血管化的黄体将孕酮转运到临近组织及器官,从而抑制黄体生成素的分泌,阻止排卵[5]。当受精卵成功植入子宫时,母体对妊娠的识别会使黄体得以维持,从而在支持胚胎发育方面发挥关键作用[6]。此外,孕体分泌的一些信号分子会导致LLC 和SLC 中的基因表达发生变化,从而抑制黄体分解[7]。在反刍动物中,干扰素刺激基因15(ISG15)在LLC 和SLC 中的表达可促进孕体分泌干扰素-tau(IFNT)[7]。可见,卵巢黄体细胞在动物生殖过程中起着至关重要的作用。
思南黄牛是贵州省的一个优良地方黄牛品种,身躯强健,特别适宜山地养殖[8]。近30 a 来,由于放牧导致的近亲繁殖以及与外来品种的杂交加剧了该品种的退化[9]。因此,对思南黄牛遗传资源的保护及利用尤为重要。目前,关于思南黄牛卵巢LLC和SLC 不同功能的研究主要来自免疫组织化学、小规模转录分析和基于细胞培养的试验,不能够对SLC 和LLC 中的差异表达基因进行全面评估。为此,利用GEO 数据库中的GSE83524芯片数据集,寻找出LLC 和SLC 之间表达水平存在差异的基因,借助生物信息学方法分析这些基因的功能,筛选黄体细胞增殖和孕酮分泌的特征性基因并通过思南黄牛加以验证,以扩展这些细胞在地方黄牛品种卵巢生理学中的功能作用,同时也为思南黄牛的保护和开发、利用提供参考。
1 材料和方法
1.1 试验动物及样品采集
本研究涉及到的动物试验都征得了铜仁学院伦理委员会的同意(TRU2020019)。在铜仁万山肉牛屠宰场采集5头健康且处于黄体期的青年母思南黄牛的双侧卵巢,置于4 ℃灭菌生理盐水中,并迅速运回铜仁学院动物生理学实验室。通过淘洗法[8]收集每对卵巢的黄体细胞,并经30µm 孔径细胞筛将LLC 和SLC 进行分离,置于-80 ℃冰箱中保存,用于实时荧光定量PCR(qRT-PCR)检测。
1.2 主要试剂
Trizol(TransZol,ET101-01)、反 转 录 试 剂 盒(EasyScript®One-Step gDNA Removal and cDNA Synthesis SuperMix,AE311-03)、实时荧光定量PCR试剂盒(PerfectStart®Green qPCR SuperMix,AQ601-03)均购自北京全式金生物技术有限公司。
1.3 试验方法
1.3.1 芯片数据的选取 通过检索NCBI GEO 数据库(http:www.ncbi.nlm.nih.gov/geo),获取3 头牛卵巢LLC 和SLC 样本的GSE83524 芯片数据集(Bovine Gene 1.0 ST Array)。
1.3.2 差异表达基因筛选及功能富集分析 以|log2(差异倍数)|≥1、校正后的P<0.01作为过滤条件,使用R 软件limma 包对芯片数据集在LLC 和SLC 样本中表达的基因进行分析并筛选出差异基因。使用在线软件DAVID(https://david.ncifcrf.gov/)对寻找出的表达水平存在差异的基因进行功能注释(Gene ontology,GO),利 用KEGG(Kyoto encyclopedia of genes and genomes)数据库进行信号通路分析。使用 在 线 软 件String(https://cn.string-db.org/)结 合Cytoscape 软件构建蛋白质-蛋白质相互作用(Protein-protein interaction,PPI)网络,并将其可视化。最后使用Cytoscape 软件中的Cyto-Hubba 插件,筛选其中节点度最高的10个关键(Hub)基因。
1.3.3 总RNA 分离、反转录和引物合成 解冻存放于-80 ℃冰箱中的LLC 和SLC 样品,用Trizol 法获取总RNA,经核酸蛋白质测定仪(NanoDrop 2000)质检符合要求后,根据试剂盒操作说明将RNA 反转录合成cDNA。以GenBank 中牛属(Bos taurus)的目的基因和参照基因序列为模板,使用Primer Premier 5.0设计引物(表1),送北京华大基因公司合成。

表1 供试引物序列Tab.1 Primer sequences
1.3.4 qRT-PCR 检测 按照试剂盒操作说明构建20µL PCR 反应体系:上、下游引物各0.5µL,cDNA模板4µL,ddH2O 5µL,SYBR Mix 10µL。5个样本重复,4个技术重复,通过LightCycler 480平台运行。基因的相对表达量以2-ΔΔCT计算结果表示,并使用SPSS 25.0 软件选择单因素方差分析(One-way ANOVA)判断差异显著性,结果表示为平均值±标准误。
2 结果与分析
2.1 牛卵巢LLC与SLC中差异表达基因的筛选
为了获得LLC 与SLC 中的差异表达基因,通过R 软件limma 包分析并检测到226 个差异表达基因(下调表达基因214 个,上调表达基因12 个),其中细胞色素P450 家族19 亚家族成员A(CYP19A1)、细胞色素P450 家族17 亚家族成员A(CYP17A1)、骨形态生成蛋白2(BMP2)、催乳素受体(PRLR)等基因与黄体细胞增殖和孕酮分泌密切相关(图1)。通过对LLC 与SLC 中的差异表达基因进行聚类分析,发现LLC 和SLC 样本中的基因表达模式差异较大(图2),表2中列出了差异倍数最大的20个基因,其中卵泡抑素(FST)和PRLR都属于促进黄体孕酮分泌的基因。
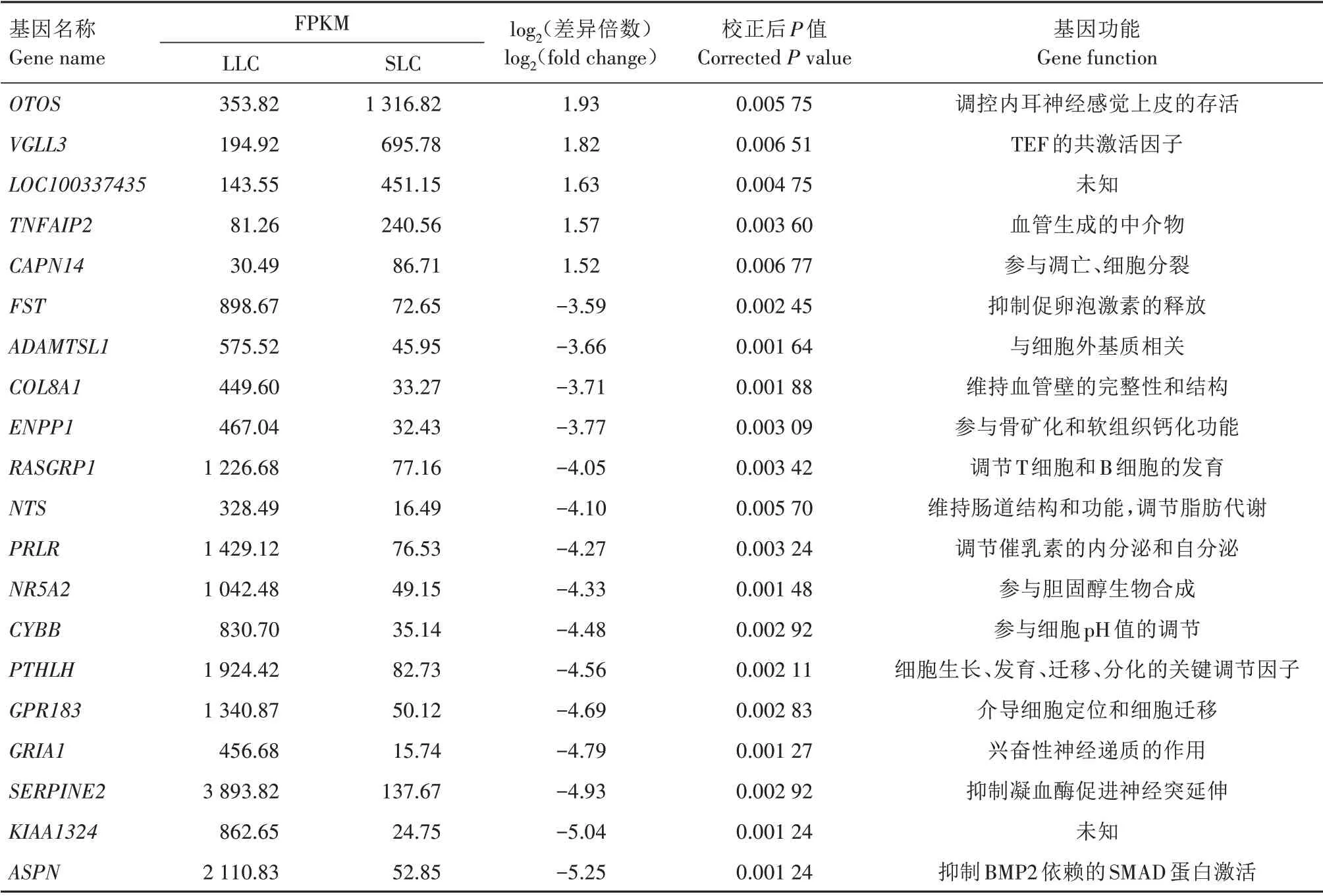
表2 牛卵巢LLC与SLC中差异倍数最高的20个基因及其功能Tab.2 Top 20 highly differentially expressed genes and their functions in LLC and SLC of bovine ovary
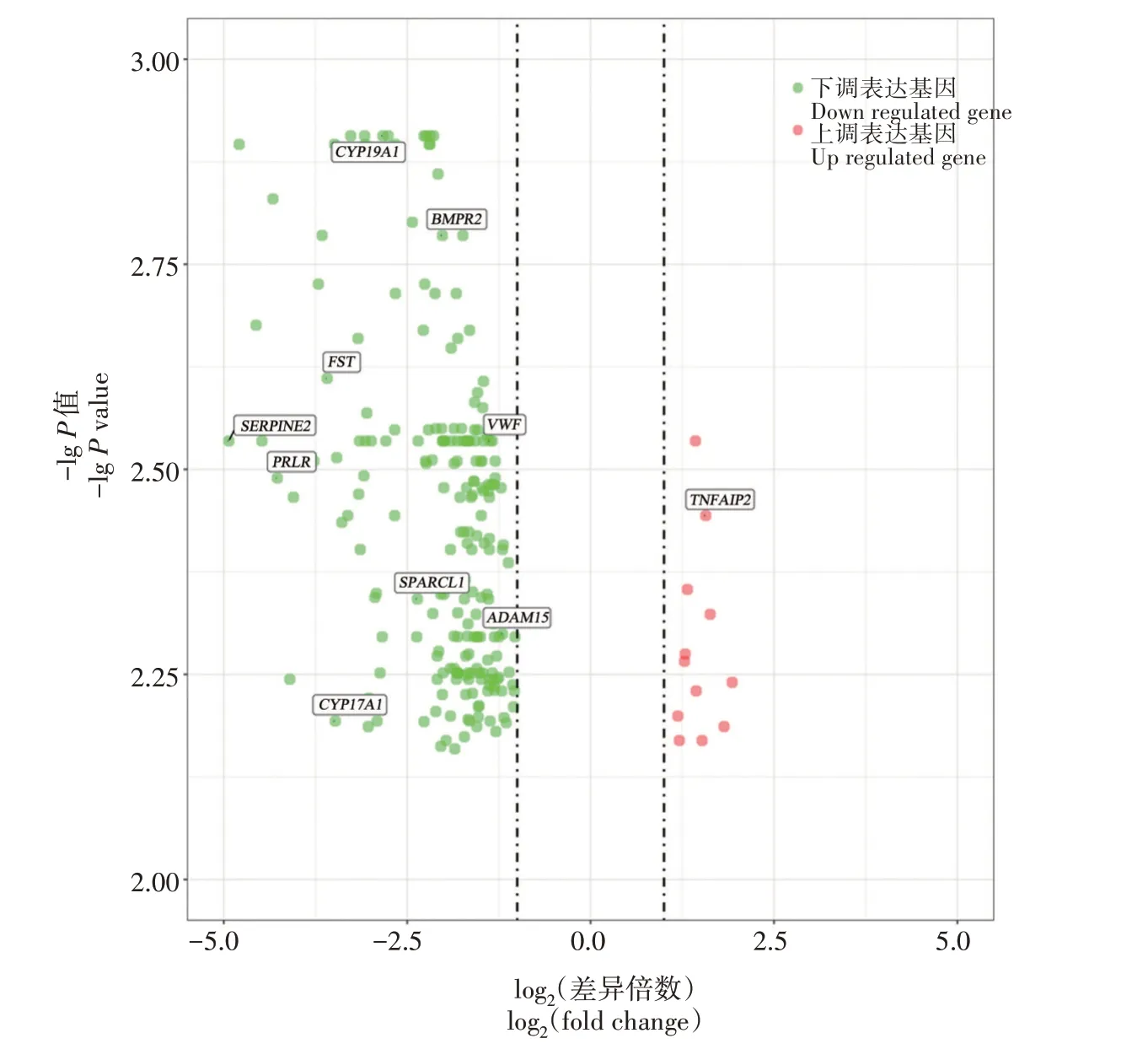
图1 牛卵巢LLC和SLC差异表达基因火山图Fig.1 Volcanic plot of differentially expressed genes in LLC and SLC of bovine ovary
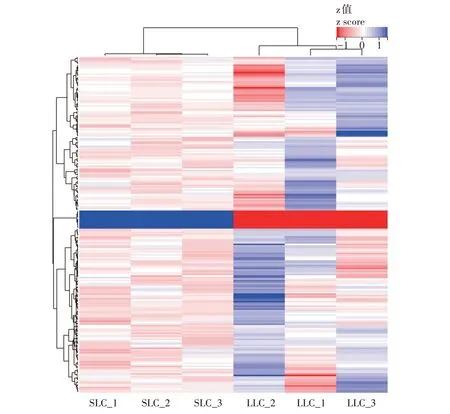
图2 牛卵巢LLC和SLC差异表达基因聚类热图Fig.2 Cluster heat map of differentially expressed genes in LLC and SLC of bovine ovary
2.2 牛卵巢LLC与SLC中差异表达基因功能注释
利用在线软件DAVID 进行差异基因的GO 分析,结果显示,共注释到39 组(3 个类别),其中属于生物学过程的有22 组,其中参与负调控RNA 聚合酶Ⅱ启动子转录、炎症反应、血管生成及细胞黏附等功能的基因最多;属于细胞组分的有9组,主要富集在膜的必需成分、等离子体膜及细胞外空间;属于分子功能的有8组,主要参与等钙离子结合、肝素结合和生长因子活性(表3)。

表3 牛卵巢LLC与SLC差异表达基因GO分析Tab.3 GO analysis of differentially expressed genes in LLC and SLC of bovine ovary
2.3 牛卵巢LLC与SLC中差异表达基因KEGG信号通路分析
为了进一步获得与牛卵巢黄体细胞增殖和孕酮分泌相关候选基因,在KEGG 上进行差异表达基因的信号通路分析,结果表明,有25 条通路显著富集(P<0.05)。其中图3 展示了富集最为集中的20条通路,在这些通路中,磷脂酰肌醇3 激酶-蛋白激酶B(PI3K-Akt)信号通路(图4)与黄体细胞增殖和孕酮分泌密切相关,参与此通路的基因有12 个,原癌基因配体(KITLG)、细胞周期蛋白D2(CCND2)、血管性血友病因子(VWF)、肌腱蛋白N(TNN)、整合素亚基Alpha 2(ITGA2)、肝细胞生长因子(HGF)、整合素亚基Alpha 11(ITGA11)、血小板衍生生长因子亚基A(PDGFA)、血清/糖皮质激素调节激酶1(SGK1)、MET 原癌基因(MET)、PRLR和胎盘生长因子(PGF)。
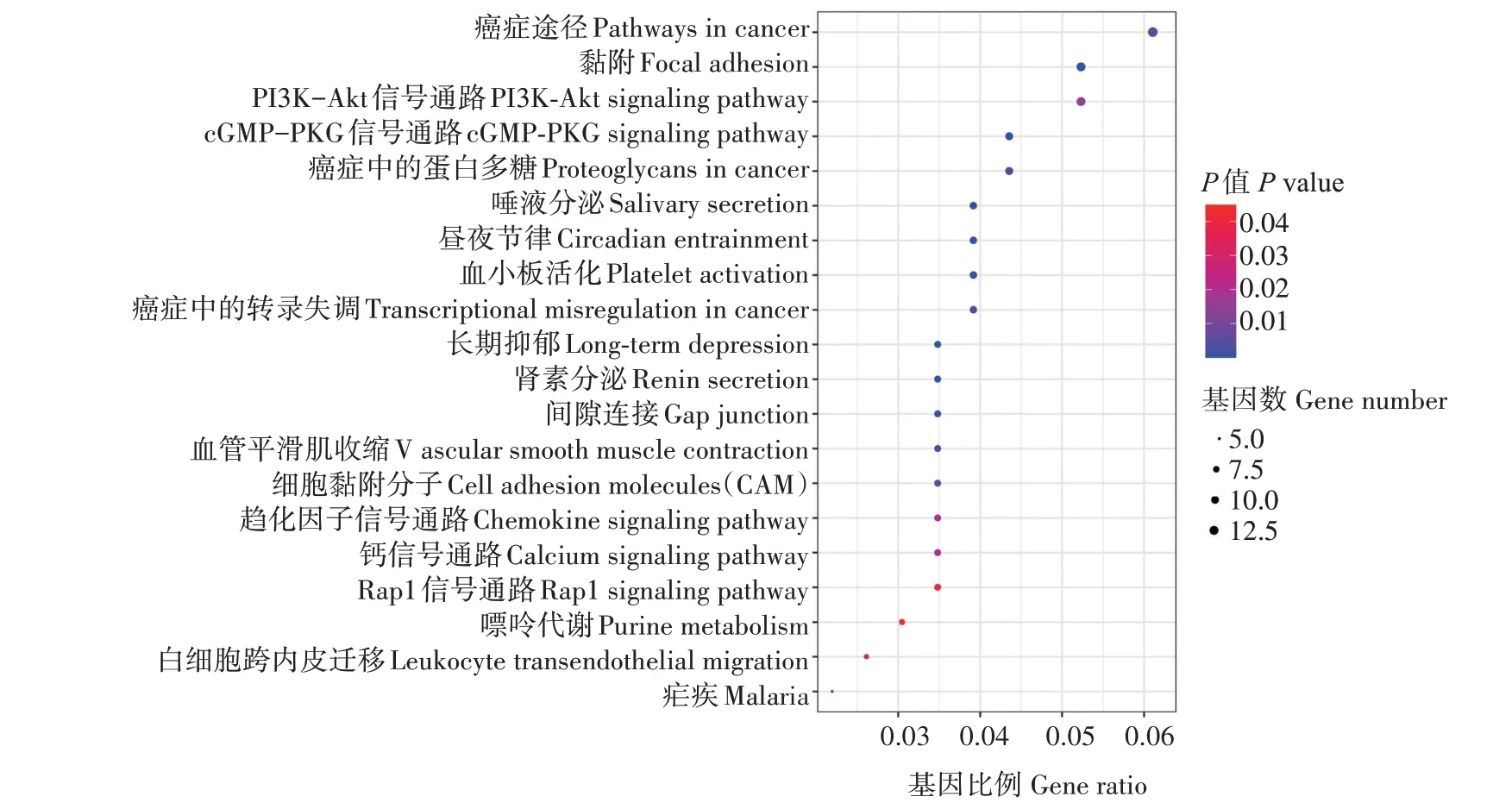
图3 牛卵巢LLC与SLC差异表达基因KEGG通路分析Fig.3 KEGG pathway analysis of differentially expressed genes in LLC and SLC of bovine ovary

图4 PI3K-Akt 信号通路Fig.4 PI3K-Akt signaling pathway
2.4 牛卵巢LLC与SLC差异表达基因PPI网络分析
为了明确卵巢黄体细胞差异表达基因之间的互作关系,使用在线String 软件进行互作分析,结果显示,共有64个基因之间存在互作关系,图5A 为通过Cytoscape 软件可视化后的互作结果。应用Cytoscape 软件中Cyto-Hubba 插件筛选出了10 个节点度最高的的关键基因,根据节点度的高低排名:蛋白激酶CGMP 依赖性1(PRKG1)、蛋白激酶CGMP依赖性2(PRKG2)、鸟苷酸环化酶1 可溶性亚基Alpha 3(GUCY1A3)、鸟苷酸环化酶1 可溶性亚基Beta 3(CUCY1B3)、VWF、细胞绒毛蛋白(EZR)、血小板和内皮细胞黏附分子1(PECAM1)、HGF、瞬态受体电位阳离子通道亚科C 成员6(TRPC6)、骨形态生成蛋白受体2型(BMPR2)(图5B)。
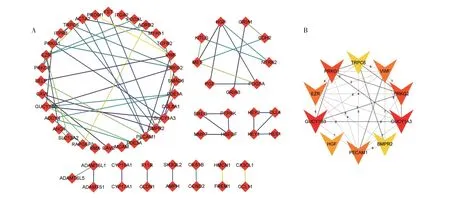
图5 牛卵巢LLC与SLC差异表达基因(A)及关键基因(B)的PPI网络分析Fig.5 PPI analysis of differentially expressed genes(A)and Hub genes(B)in LLC and SLC of bovine ovary
2.5 思南黄牛卵巢LLC和SLC中黄体细胞增殖和孕酮分泌相关基因的表达分析
根据GO 功能分析、KEGG 信号通路分析及PPI网路互作分析结果,结合gene card 功能筛选,筛选出与黄体细胞增殖和孕酮分泌最为密切相关的5个差异表达基因VWF、CYP19A1、CYP17A1、BMPR2、PRLR进行qRT-PCR 验证。结果显示,VWF、CYP19A1、CYP17A1、BMPR2、PRLR在思南黄牛卵巢LLC 和SLC 中的表达趋势与GEO 芯片数据结果一致(图6)。

图6 思南黄牛卵巢LLC与SLC中黄体细胞增殖和孕酮分泌相关基因的相对表达水平Fig.6 Relative expression of genes related to luteal cell proliferation and progesterone secretion in LLC and SLC of Sinan yellow cattle ovary
3 结论与讨论
GEO 数据库是一个公共的功能基因组学数据源,其中包含了基于微阵列和序列的数据,能够为研究人员提供基因表达信息[10]。本研究通过对GEO 数据库芯片数据进行分析,在牛LLC 与SLC 中共获得差异表达基因226 个。前人研究表明,CYP19A1、CYP17A1、BMP2、PRLR等基因与黄体细胞增殖和孕酮分泌密切相关[11-12]。PRLR 对反刍动物孕酮的分泌以及黄体的维持起着至关重要的作用[13]。由垂体分泌的PRL经血液循环直接作用于子宫内膜,在动物妊娠过程中产生作用[14]。卵泡排卵后,卵泡膜细胞向SLC 的分化,导致CYP17A1的表达下降,而细胞CYP19A1的表达增加,从而为后期妊娠及维持提供适宜的激素条件[15]。在人卵巢黄体化的颗粒细胞中,BMP2 通过负调控间隙连接蛋白基因(Connexin 43)的表达来调控细胞之间信息传递[16]。此外,在牛和鸡卵巢颗粒细胞中的研究结果表明,BMP2 能够促进E2 的合成,同时抑制孕酮分泌[17-18]。在调控哺乳动物卵泡发育和黄体形成的过程中,BMP2 起着至关重要的作用。本研究鉴定的CYP19A1、CYP17A1、BMP2、PRLR等基因在LLC 中的表达水平均高于SLC,这可能是LLC 孕酮分泌量高于SLC的原因之一。
在原始卵泡发育成为初级卵泡过程中,PI3KAkt 信号通路可能是一条关键分子信号通路[19-20]。体外试验研究表明,PI3K 能够诱导内源性雌激素受体(ER)残基磷酸化,从而使其转录活性和稳定性升高[21]。在腔前卵泡内,促卵泡素(FSH)可以激活PI3K-Akt 信号通路[22-23]。PI3K/Akt 信号通路在哺乳动物生殖轴(HPG 轴)中发挥重要作用[24]。KEGG 信号通路分析发现,共有12 个基因富集于PI3K-Akt信号通路,而该通路与黄体细胞增殖和孕酮分泌密切相关。
本研究在牛卵巢LLC 与SLC 中获得226 个差异表达基因,其中VWF、CYP19A1、CYP17A1、BMPR2、PRLR等基因与黄体细胞增殖和孕酮分泌密切相关,这些特征性基因在思南黄牛卵巢LLC 和SLC 中的表达趋势与GEO 芯片数据结果一致,这些结果扩展了LLC 和SLC 在地方黄牛品种卵巢生理学中的功能作用,同时也为思南黄牛的保护和开发、利用提供参考。

