胸腺结外边缘区黏膜相关淋巴组织淋巴瘤的MRI特征分析
肖刚,王圣中, 马宇卉, 胡玉川, 崔光彬
材料与方法
1.一般资料
搜集2013年11月-2021年7月在本院明确诊断为胸腺MALT淋巴瘤且符合研究要求的19例患者的病例资料。纳入标准:①经手术病理及免疫组化确诊为胸腺MALT淋巴瘤;②有完整的临床资料,术前2周内行胸部MRI检查;③既往无淋巴瘤病史。排除标准:①MR图像上呼吸及心动伪影明显,图像质量不佳;②MRI检查前在外院有相关治疗史。
19例中,男3例,女16例;年龄29~68岁,平均(46.5±12.3)岁。主要临床表现:因体检或其它疾病偶然发现13例,胸闷、胸痛及呼吸困难3例,咳嗽、咳血1例,进食哽咽1例,重症肌无力1例。13例患者既往有自身免疫性疾病史,其中干燥综合征10例、类风湿性关节炎2例、系统性红斑狼疮1例。所有患者行纵隔肿瘤切除术,术后6例进行化疗、4例进行放疗、2例为放疗联合化疗。治疗后随访时间3~91个月,19例中2例失访、17例治疗后均存活。
2.MRI检查方法
19例患者均行胸部MRI平扫及DWI检查,11例同时行动态增强扫描。使用GE Discovery MR750 3.0T扫描仪和体部相控阵线圈。扫描序列及参数如下。①横轴面SE T1WI:屏气扫描,TR 857.0 ms,TE 9.0 ms,层厚4.0 mm,层间距0.5 mm,矩阵288×160,视野400 mm×400 mm~440 mm×440 mm。②横轴面、冠状面及矢状面FSE T2WI:自由呼吸扫描,TR 4000.0 ms,TE 80.0 ms,层厚4.0 mm,层间距0.5 mm,矩阵288×288,视野400 mm×400 mm~460 mm×460 mm。③横轴面抑脂短时反转恢复序列T2WI:自由呼吸扫描,TR 10000.0 ms,TE 74.0 ms,层厚4.0 mm,层间距0.5 mm,矩阵320×320,视野400 mm×400 mm~440 mm×440 mm。④横轴面单次激发EPI-DWI:自由呼吸扫描,b=0、1000 s/mm2。⑤采用三维容积内插快速扰相梯度回波序列行多期动态增强扫描:屏气扫描,TR 3.80 ms,TE 1.25 ms,层厚2.5 mm,无间距,视野400 mm×400 mm~440 mm×440 mm,矩阵260×260。对比剂使用钆喷酸葡胺,剂量0.15 mmol/kg,流率2.0 mL/s,在注射对比剂后16、38和55 s及2 min分别行动脉早期、动脉晚期、静脉期及平衡期扫描。
3.图像分析
由2位具有丰富胸部诊断经验的放射科医师采用双盲法独立阅片,主要观察病灶的以下特征。①大小:测量肿瘤的最长径和最短径;②形态:根据肿瘤的最长径和最短径,设定最长径/最短径≤1.5为形态规则、>1.5为形态不规则;③生长方式:设定肿瘤中心点位于胸骨侧缘内为两侧对称生长,位于胸骨侧缘外为偏侧生长;④边界:判断是清晰还是模糊;⑤瘤周水肿:将瘤周水肿定义为肿瘤周围出现的索条状影且T1WI呈低信号、压脂T2WI呈高信号;⑥信号均匀性:均匀或不均匀;⑦囊变程度:将肿瘤内部T1WI低信号、T2WI高信号的囊状影定义为囊变,囊变范围<1/2肿瘤体积为轻度囊变,≥1/2肿瘤体积为明显囊变;⑧强化方式;⑨肿大淋巴结:淋巴结短径≥1 cm为肿大淋巴结;⑩包绕血管:分析肿瘤是否完全包绕血管;邻近血管、心包、肺或胸壁是否受侵;有无胸腔积液或心包积液;有无胸膜或心包转移瘤。
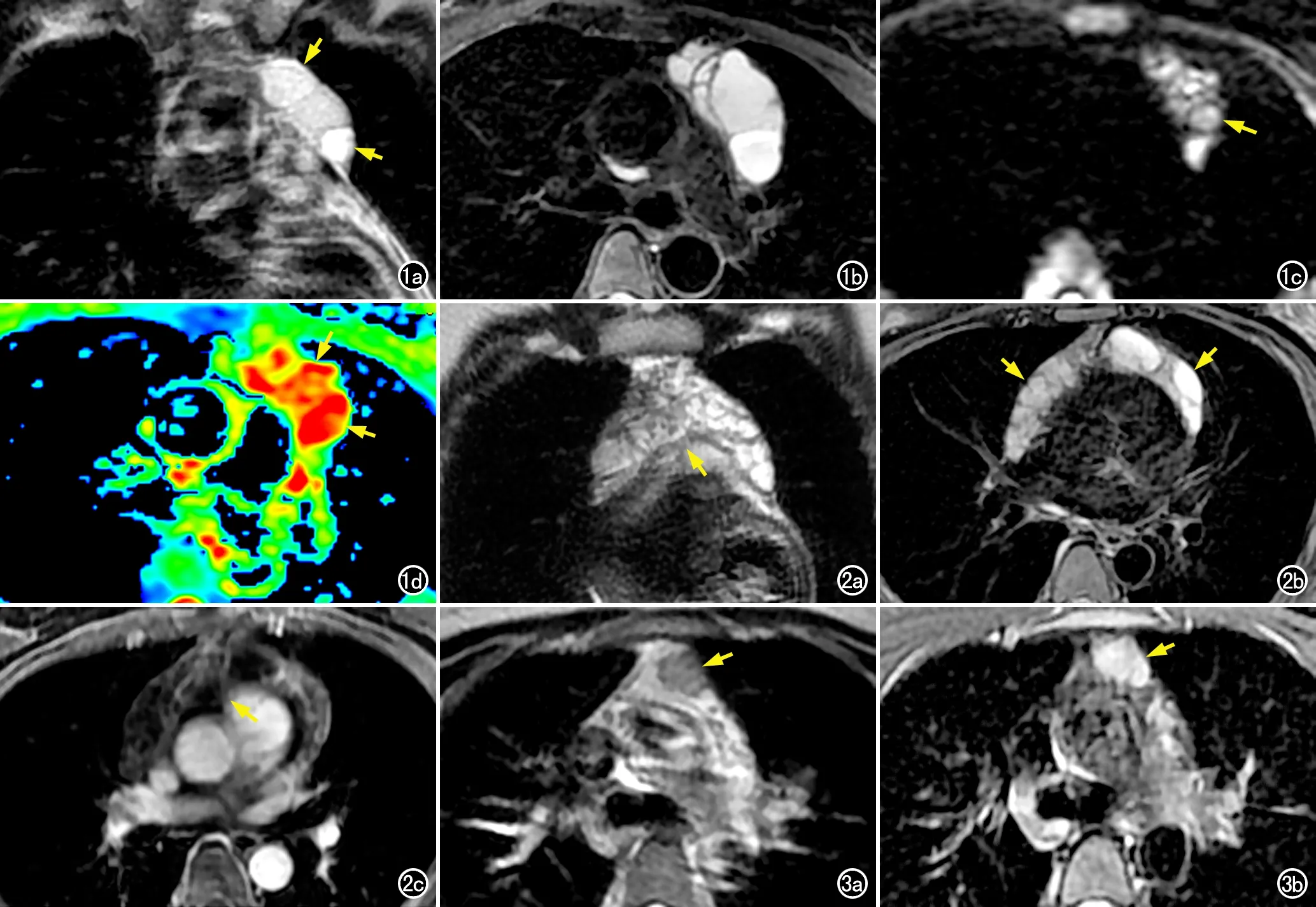
图1 女,51岁,胸腺MALT淋巴瘤。a)冠状面T2WI,病灶表现为长梭形高信号(箭),偏侧生长,边界清楚,内部有明显囊变;b)横轴面压脂T2WI,病灶呈长梭形,内部可见多房囊腔,无瘤周水肿;c)横轴面DWI图,病灶内囊性区域呈高信号(箭);d)横轴面ADC伪彩图,病灶囊性区域呈高信号(红色区域,箭)。 图2女,34岁,胸腺MALT淋巴瘤。a)冠状面T2WI,病灶呈不均匀高信号,沿胸腺区蔓延生长,形态不规则,呈箭头状,并侵犯邻近心包(箭);b)横轴面压脂T2WI,病灶呈两侧对称生长(箭),形态不规则,呈箭头状,其内可见多房囊腔;c)横轴面增强T1WI,病灶呈明显不均匀强化,侵犯邻近心包(箭)。 图3女,31岁,胸腺MALT淋巴瘤。a)横轴面T2WI,病灶呈高信号(箭),体积较小,长径约2.3cm,边界清楚,形态规则;b)横轴面压脂T2WI,病灶呈高信号(箭),内部信号较均匀,边界清楚,无瘤周水肿。
ADC值的测量采用GE公司Functool 9.4.07软件包中的ADC软件。在DWI高信号且ADC低信号的肿瘤实性区域处选取ROI,避开出血、坏死、囊变及伪影等,ROI大小保持一致,面积约80 mm2。
4.统计分析
使用SPSS 22.0软件进行统计分析。计量资料以均数±标准差表示,计数资料以频数和百分比表示。计量和计数资料的观察者间一致性分析分别使用Kappa检验和组内相关系数(intra-class correlation coefficient,ICC)。设定Kappa或ICC值<0.4为一致性较差,0.4≤Kappa或ICC值<0.6为一致性中等,0.6≤Kappa或ICC值<0.8为一致性较强,Kappa或ICC值≥0.8为一致性强。
结 果
1.一致性分析
两位医师评估胸腺MALT淋巴瘤MRI特征的观察者间一致性较强或强,计量资料的Kappa值为0.776~1.000,计数资料的ICC值为0.716~0.865(P均≤0.001)。计量资料取2位医师测量结果的平均值,对计数资料,两位医师的诊断意见不同时经讨论达成一致结果再进行下一步分析。
2.形态特征
肿瘤均位于前纵隔,最大径2.3~13.9 cm,平均(7.0±3.2) cm;呈偏侧生长(图1)12例(63.2%),两侧对称生长(图2)7例(36.8%)。3例(15.8%)肿瘤形态规则、呈类圆形(图3),体积均较小,最大径分别为例呈偏侧生长者表现为长梭形或泪滴状(图1),7例沿胸腺区蔓延生长而呈箭头状(图2)。19例肿瘤均边界清楚,未见瘤周水肿(图1b、3b)。2.3、2.9和3.6 cm;16例(84.2%)肿瘤形态不规则,其中9例呈偏侧生长者表现为长梭形或泪滴状(图1),7例沿胸腺区蔓延生长而呈箭头状(图2)。19例肿瘤均边界清楚,未见瘤周水肿(图1b、3b)。
本文简单介绍了基于Mesh架构的无线传感器网络的概念和原理,并利用ZigBee,ARM,VC++等技术研发构建了基于MESH架构的无线传感器网络监控系统,实现对育苗温室群内环境信息的精确采集、实时监测和远程调控等功能。本文详细介绍了基于MESH架构的无线传感器网络监控系统的结构、无线传输节点的元器件选型及开发原理、总控计算机的选型、系统管理软件的设计思路及开发原理,并对搭建的无线传感器网络监控系统进行实际运行测试。测试结果表明,系统能够准确完成工厂化育苗过程中温室环境的远程无线监测与自动调控。
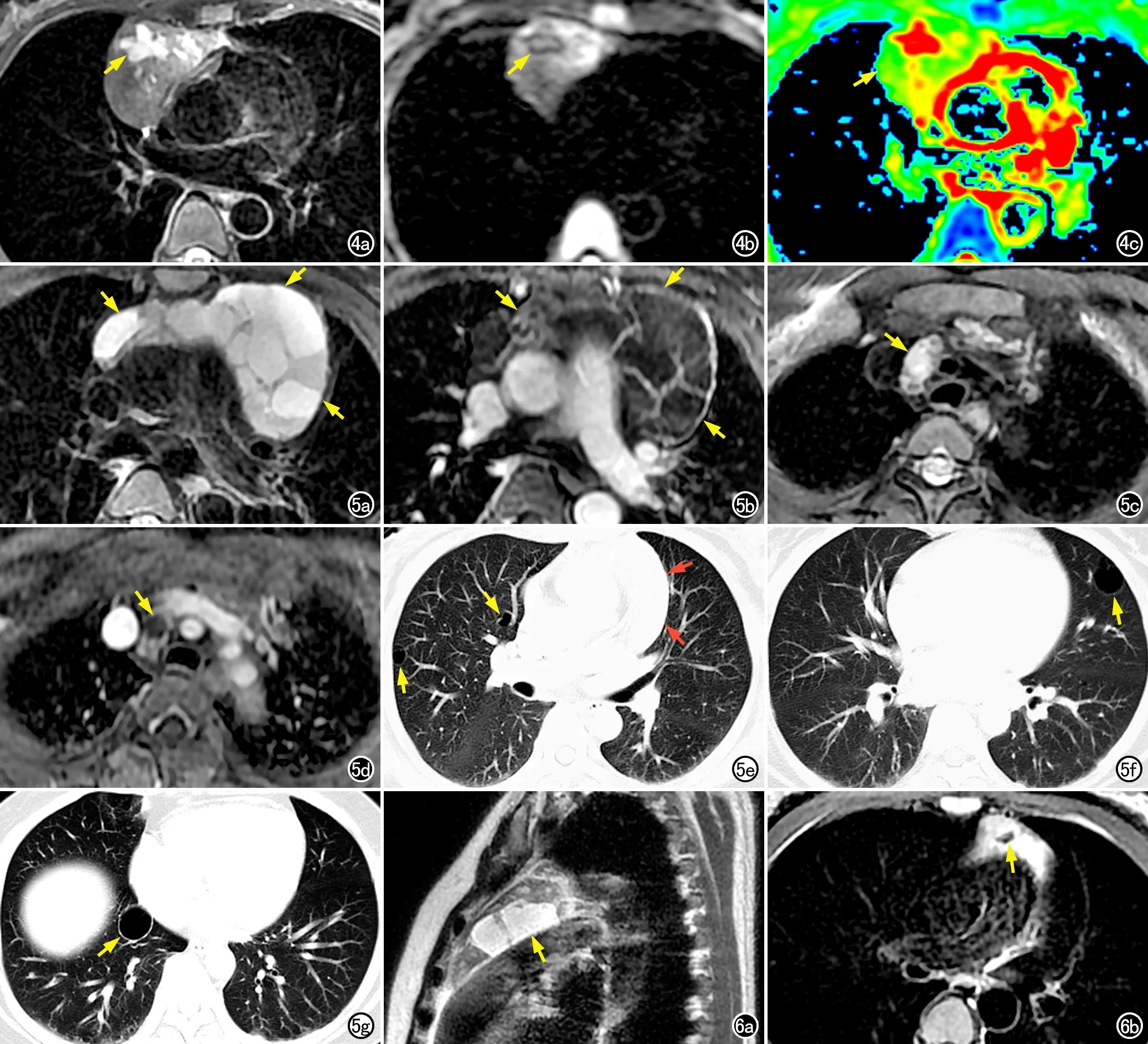
图4 女,49岁,胸腺MALT淋巴瘤。a)横轴面压脂T2WI,病灶呈偏侧生长,内部信号不均匀,有轻度囊变(箭);b)横轴面DWI,病灶实性区域呈不均匀高信号,囊性区域呈低信号(箭);c)横轴面ADC伪彩图,病灶实性区域呈低信号(绿色区域,箭),其ADC值为1.45×10-3mm2/s。 图5女,43岁,胸腺MALT淋巴瘤。a)为横轴面压脂T2WI,病灶沿胸腺区生长(箭),内部可见多房囊腔,囊腔内液体信号不同;b)横轴面增强T1WI,病灶呈明显不均匀强化(箭);c)横轴面压脂T2WI,上腔静脉-气管间隙内可见肿大淋巴结(箭),内部信号不均匀;d)横轴面增强T1WI,肿大淋巴结呈囊性改变(箭);e~g)横轴面CT肺窗图像,显示双肺多发大小不等肺大泡(黄箭),肿瘤压迫邻近的左肺上叶、瘤周界面光滑(红箭)。 图6女,39岁,胸腺MALT淋巴瘤。a)矢状面T2WI,病灶位于前纵隔,其内可见囊性变(箭);b)横轴面压脂T2WI,病灶后部可见结节状低信号钙化灶(箭)。
3.常规MRI信号特征
肿瘤内部信号均匀(图3),T1WI呈等信号、T2WI呈稍高信号者2例(10.5%),体积均较小,最大径分别为2.3和2.9 cm;信号不均匀17例(89.5%),均伴有不同程度的囊性变(图1b、2b),可呈单囊或多囊,以多囊为主,囊壁光滑锐利,囊腔大小不一,不同囊腔内囊液信号可稍有差别;其中,4例(21.1%)为轻度囊变(图4),13例(68.4%)为明显囊变(图1、2、5)。1例肿瘤内可见钙化灶,其在T1WI和T2WI上均呈低信号(图6b)。11例患者行MRI动态增强扫描,显示肿瘤实性部分和囊壁均呈明显不均匀强化(图2c、5b),囊内无强化。
4.邻近结构侵犯及转移情况
3例(15.8%)肿瘤周围可见肿大淋巴结(图5c),其中2例肿大淋巴结呈囊性改变(图5d)。2例(10.5%)肿瘤侵犯心包(图2a、c),其余17例(89.5%)未见心包及邻近结构受累。19例肿瘤均未见肿瘤包绕血管、瘤周水肿、胸腔或心包积液及胸膜或心包转移瘤等。
5.DWI信号特征
肿瘤实性区域在DWI(b=1000 s/mm2)上呈高信号,在ADC图上呈低信号(图4b、c);15例肿瘤内囊性区域在DWI上呈低信号、ADC图上呈高信号(图4b、c),2例肿瘤囊性区域在DWI和ADC图像上均呈高信号(图1c、d)。本组中肿瘤实性区域的ADC值为1.01×10-3~1.97×10-3mm2/s,平均(1.76±0.31)×10-3mm2/s。
讨 论
胸腺MALT淋巴瘤是一种惰性生长的低级别结外淋巴瘤,发病率极低,发病机制尚不明确[4]。Inagaki等[5]认为自身免疫性疾病引起的慢性炎症因子不断刺激胸腺上皮细胞,导致胸腺内部出现获得性黏膜相关淋巴组织,其长期异常增殖所致;也有学者认为与基因克隆性重排和融合使得不同趋化因子高风险异常表达干扰了B细胞的平衡有关[6]。
1.胸腺MALT淋巴瘤的临床和病理特征
胸腺MALT淋巴瘤多见于亚洲人,女性明显好发,发病年龄50~70岁,常无临床症状,多为体检或其它检查偶然发现,与胸腺其它类型淋巴瘤的临床表现明显不同。超过一半患者伴有干燥综合征、类风湿性关节炎和系统性红斑狼疮等自身免疫性疾病,且自身免疫性疾病的出现至发生胸腺MALT淋巴瘤的间隔时间多数为7~10年[7]。本研究中患者的临床表现与文献报道基本一致。
胸腺MALT淋巴瘤的包膜大多完整,内部常含有大小不等的囊腔。镜下可见正常胸腺结构消失,由致密的淋巴样细胞替代,其内可见散在分布的淋巴滤泡;囊腔内衬鳞状及柱状上皮细胞,且伴有淋巴上皮样病变,内部可见粉染物及钙化灶[4]。病灶内部不同病理改变导致其不同的MRI表现。
本病的治疗方式以手术切除为主,部分患者需联合化疗或放疗,通常患者的预后良好,治愈率和生存期明显高于其它类型的胸腺淋巴瘤[3]。本组病例中,除2例失访外,其余患者治疗后均存活。
2.胸腺MALT淋巴瘤的MRI特征
MRI是纵隔囊性肿瘤首选的影像学检查方法,具有多序列、多参数成像和软组织分辨率高等优点,能清楚显示肿瘤的囊实区域、囊液信号、囊腔分隔等影像特征[8],但由于胸腺MALT淋巴瘤发病率极低且胸部MRI检查普及率不高[9,10],国内尚无其MRI特征的研究报道。
本组胸腺MALT淋巴瘤中,肿瘤大小不等(2例肿瘤长径小于3.0 cm,而最大肿瘤的长径达13.9 cm),这一特点与肿瘤常无临床症状而为偶然发现、肿瘤的生长时间长短不一有关。肿瘤体积较小时,形态规则呈类圆形;体积较大时,可偏侧生长呈长梭形或泪滴状,或沿胸腺区双侧蔓延生长呈箭头状。胸腺MALT淋巴瘤的边界均较清楚,无瘤周水肿,这与肿瘤常具有完整包膜、侵袭性相对较低的特点相对应[11]。
本组病例中,除2例较小肿瘤内部信号均匀,其余17例肿瘤内部均含有不同程度囊性变,其中4例肿瘤完全囊变,呈多房囊性肿块。11例行增强MRI检查,显示肿瘤均呈明显不均匀强化。有学者推测囊腔的形成可能与肿瘤在胸腺组织生长时,哈氏小体等髓管上皮衍化结构囊性转化有关,并认为肿瘤内部掺杂多发大小不等囊腔是胸腺MALT淋巴瘤不同于其它类型淋巴瘤的特征性改变之一[12]。此外,本组1例胸腺MALT淋巴瘤内含有钙化灶,这是由囊壁明显增多的哈氏小体退变、沉积形成钙化小球所致[4]。
胸腺MALT淋巴瘤多为Ann Arbor早期肿瘤,病灶周围常无肿大淋巴结,本组中只有3例肿瘤周围伴有肿大淋巴结,其中2例淋巴结呈囊性改变,这一特殊影像学征象可能对胸腺MALT淋巴瘤的诊断具有提示作用。同时,除2例肿瘤侵犯心包外,其余17例均无邻近结构侵犯,19例肿瘤均无包绕血管、胸腔积液、心包积液、胸膜或心包转移瘤等,这些都符合其惰性生长的生物学行为。
DWI从宏观成像中反映机体水分子微观扩散运动,从而能在分子水平提供病灶内部细胞微结构信息。胸腺MALT淋巴瘤实性区域呈DWI高信号,高于同层面胸大肌的信号,其平均ADC值约1.76×10-3mm2/s,可能与肿瘤内部大量淋巴样细胞使水分子扩散受限有关[13]。大多数囊性区域呈DWI低信号、ADC图高信号,少数呈DWI高信号、ADC图高信号,这是由于T2通透效应所致。
3.鉴别诊断
胸腺MALT淋巴瘤的MRI表现具有一定特征性,需与多房性胸腺囊肿、囊性胸腺瘤和囊性乏脂型畸胎瘤等鉴别。①多房性胸腺囊肿是一种罕见的、由炎症引起的获得性多房囊性病变,囊壁常较厚,囊液浑浊[14],CT密度较高,可伴有钙化灶。部分病灶同时伴发胸腺瘤和胸腺癌。②囊性胸腺瘤是由胸腺瘤内部血管周围间隙扩张和融合引起,以B2型为主,伴发重症肌无力比例较高。囊腔多为单房,囊液均匀,囊壁多伴有不同程度实性成分,呈结节或肿块状[8]。③囊性乏脂型畸胎瘤是前纵隔较常见的良性生殖源性肿瘤,由3个胚层成熟组织构成[15]。肿瘤囊壁厚薄不匀,可伴有蛋壳样钙化,囊液内部多掺杂肉眼不可见的脂肪微粒,于反相位T1WI上囊液信号明显减低,这些特征均有助于鉴别诊断。
4.本研究的局限性
第一,本研究为单中心回顾性研究,病例数相对较少,可能存在选择性偏倚。第二,Hirokawa等[16]报道胸腺MALT淋巴瘤可伴有多发肺大泡。笔者回顾性分析本研究中患者胸部CT资料,发现5例(26.3%)存在多发肺大泡(图5e~g),而胸部MRI对肺大泡的显示能力有限。第三,胸部DWI易受呼吸运动及心脏搏动影响,其图像分辨率较低;在b=0、1000 s/mm2DWI检查时测量的ADC值无法有效区分肿瘤内部水分子扩散信息和血流灌注信息[17]。
综上所述,胸腺MALT淋巴瘤是一种罕见的、惰性生长的低级别B细胞淋巴瘤,好发于中老年女性,常伴有干燥综合征等自身免疫性疾病,MRI表现具有一定的特征性。肿瘤大小不等,形态多不规则,但边界清楚,很少侵犯邻近纵隔结构,肿瘤内部常含有多发大小不一囊腔是其相对特征性影像学表现,少部分可伴有钙化灶;其ADC值较低,平均1.76×10-3mm2/s。掌握本病的MRI特征,有助于提高临床诊断及鉴别诊断水平,但手术病理检查是最终确诊及治疗的首选方式。

