磁共振BOLD和T2-mapping评价盘源性腰痛大鼠椎旁肌功能改变
杨铠文,罗保发,黄益龙,马寄耀,朱红丽,何波
盘源性腰痛(discogenic low back pain,DLBP)主要是指椎间盘内部结构和代谢功能出现异常,刺激椎间盘内疼痛感受器,但不伴神经根性症状的腰椎间盘退行性疾病[1-3]。DLBP的临床表现缺乏特异性,目前仍无确切的病因和发病机制。MRI是评价DLBP最常用的检查方法,但大多数临床医师和放射科诊断医师将观察重点放在椎间盘上,而忽视了椎旁肌对脊柱稳定性的作用。有研究表明,DLBP患者的椎旁肌肉可能会发生肌肉萎缩和功能障碍等改变[4],而其导致的脊柱失稳可能进一步恶化DLBP。因此,评估椎旁肌功能改变有重要意义。T2-mapping是一种新的MR定量技术,以横向磁化弛豫时间(T2)为测量指标,可定量分析组织成分、水分代谢、乳酸代谢、脂肪浸润和其它生化指标[5-7]。BOLD-MRI是评估神经系统功能的常用技术[8],测得的R2*(1/T2*)值代表了周围组织血液中脱氧血红蛋白和氧合血红蛋白的比值[8-9],可反映组织血氧代谢能力及血流灌注的变化情况[10],因此可用于评估肌肉结构和微循环状况。本研究通过行为学分析来评价大鼠的腰痛程度,影像学方法来评估大鼠椎旁肌功能改变和微循环状况,组织学检查来评价椎旁肌肌纤维情况,以及分子生物学方法评价椎旁肌中炎症因子的表达情况,旨在探究磁共振BOLD和T2-mapping成像技术定量评价椎旁肌功能改变的潜在价值。
材料与方法
1.实验动物的分组和模型制备
选取清洁级健康雌性SD大鼠36只,体重200~250 g,由昆明医科大学动物实验中心提供(许可证号:SYXK(滇)K2020-0006 )。将所有大鼠随机分为2组:正常组(18只)和腰痛组(18只)。
综合相关文献[11-14]以及本课题组前期申请的盘源性腰痛大鼠模型的发明专利(申请(专利)号:CN202011637571.8),向大鼠腹腔注射1%戊巴比妥钠溶液(40 mg/kg)进行麻醉,随后以大鼠左侧髂嵴平齐于第5腰椎(L5)为定位标志,在X线透视的引导下,使用26G针头以侧后入路方式平行于椎体下缘的方向穿刺L4-5及L5-6椎间盘,向椎间盘内注射2.5 μL无菌磷酸缓冲溶液,建立大鼠DLBP模型。造模后1、3和6个月逐批处死大鼠,每批12只(腰痛组6只,正常组6只),用于组织学和分子生物学评价。
2.行为学评价
分别于造模后1天、1周、2周、1个月、3个月和6个月时进行行为学测试。采用步态实验观察大鼠行走步态和后肢使用情况并根据Chatani等[15]的方法进行评分。根据Shi等[16]提出的丙酮实验和热板实验方法,观察大鼠在椎间盘损伤后对冷热刺激的敏感程度。采用Millecamps等[17]建议的方法进行悬尾实验,记录5 min内大鼠的弯腰时间,用于评估大鼠的轴向不适感和身体机能降低程度。
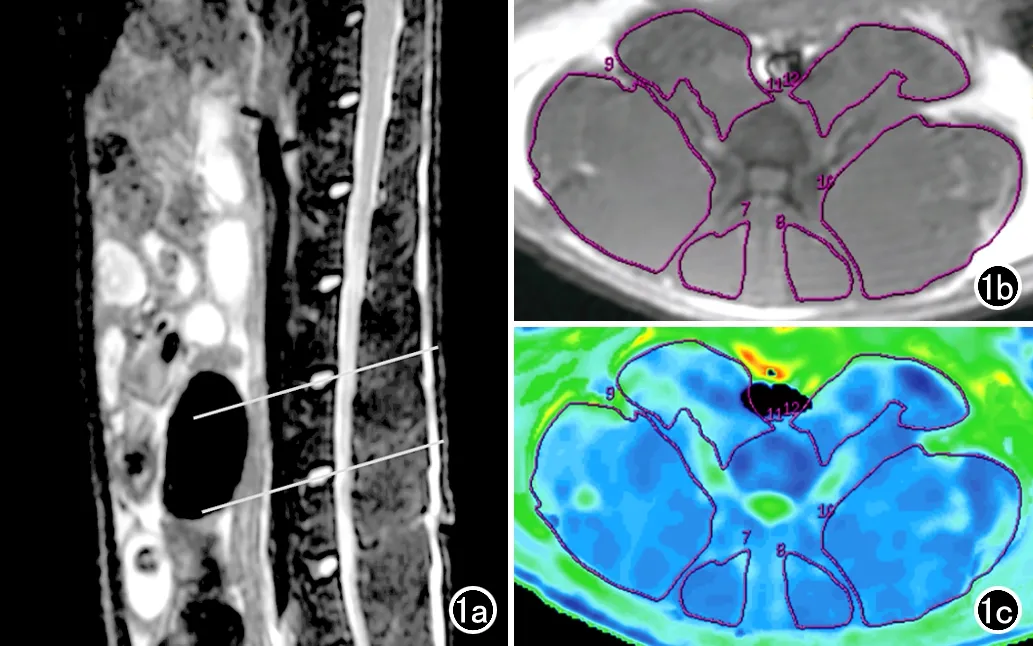
图1 感兴趣区层面选择及各肌肉定量参数值的测量方法。a)在腰椎矢状面T2WI图像上,选取L4-5、L5-6椎间盘中心层面作为感兴趣层面(白线);b)L4-5椎间盘横层面横轴面T2-mapping图像,使用Functool软件沿双侧椎旁肌肉(多裂肌、竖脊肌和腰大肌)边缘勾画ROI,避开肉眼可见的脂肪组织;c)软件自动将勾画的ROI复制到横轴面BOLD定量参数伪彩图上,即可获得各条肌肉的T2和R2*值。
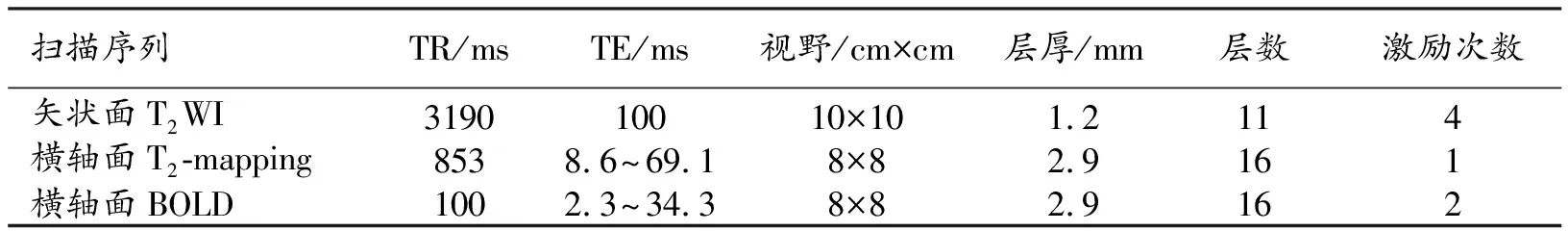
表1 磁共振扫描序列和参数
3.影像学评价
MRI扫描:于造模后1、3和6个月时进行影像学评价。使用GE Discovery MR750w 3.0T磁共振仪和16通道纵向放置老鼠线圈(上海辰光医疗科技股份有限公司)。使用1%戊巴比妥钠溶液(40 mg/kg)腹腔注射的方法麻醉大鼠,大鼠取仰卧位,腰椎置于线圈中央。分别采用常规序列(T2WI)和功能成像序列(T2-mapping、BOLD)进行扫描,扫描参数详见表1。
MRI后处理:使用GE AW4.4工作站和Functool软件进行后处理。选择L4-5和L5-6椎间盘中心层面,用描点法勾勒出穿刺侧(左侧)和健侧(右侧)的椎旁肌(多裂肌、竖脊肌和腰大肌),共12个ROI,软件自动计算出各ROI的T2和R2*值,计算12个ROI的平均值作为椎旁肌肉的T2和R2*值;其中,T2-mapping的色阶范围为19~81,BOLD MR图像上色阶范围为28~202,置信度均为0.05(图1)。
4.组织学和分子生物学评价
造模后1、3和6个月时,在MRI检查后将大鼠行安乐死,每个时间点腰痛组和正常组各6只,于L4-5和L5-6椎间隙水平在穿刺侧(左侧)和健侧(右侧)椎旁肌组织处取材。其中的一部分组织使用10%中性福尔马林溶液固定,石蜡包埋,进行免疫荧光染色,检测椎旁肌内肌球蛋白重链基因MYH1和MYH7的表达情况,在荧光显微镜下观察和采集图像,并用Image-Pro Plus 6.0软件对实验图像进行分析;其它椎旁肌肉组织采用ELISA法测量TNF-α浓度,根据检测试剂盒(上海酶联生物科技有限公司)说明书进行操作,分析腰痛组和正常组1、3和6个月时椎旁肌内TNF-α的实际浓度。
5.数据的统计分析
使用SPSS 19.0统计软件。当数据符合正态分布时以均数±标准差表示,采用独立样本t检验;当数据不符合正态分布时采用中位数和四分位数间距表示,采用曼-惠特尼U检验。显著性水准 α=0.05。
结 果
1.大鼠行为学指标
正常组和腰痛组大鼠步态实验、丙酮实验、热板实验和悬尾实验结果见图2。步态实验结果显示,术后6个月时腰痛组大鼠的步态评分显著增高,与正常组之间的差异具有统计学意义(Z=-2.345,P=0.019)。丙酮和热板实验结果显示,造模后1天至1个月时,腰痛组大鼠在冷、热刺激下的缩爪时间阈值均下降,但与正常组之间的差异无统计学意义(P均>0.05);在造模后第3和6个月时则表现为显著下降,且与正常组之间的差异具有统计学意义(P均<0.05)。悬尾实验结果显示,造模后1天至1个月时,腰痛组大鼠的弯腰时间与正常组相比无显著变化(P>0.05);于造模后3和6个月时弯腰时间显著增加,且均与正常组之间的差异具有统计学意义(t=-2.696,P=0.022;t=-2.698,P=0.022)。
2.T2-mapping分析
两组大鼠不同时间点腰椎旁肌肉T2值测量结果见图3a。腰痛组大鼠椎旁肌肉的T2值随着造模后时间的延长呈进行性下降,在造模后1个月时与正常组之间的差异无统计学意义(P>0.05),在造模后3个月(Z=-3.853,P<0.001)和6个月(Z=-5.296,P<0.001)时显著低于正常组(图3b~c)。各时间点穿刺侧(左侧)与健侧(右侧)椎旁肌T2值的差异均无统计学意义(P>0.05)。
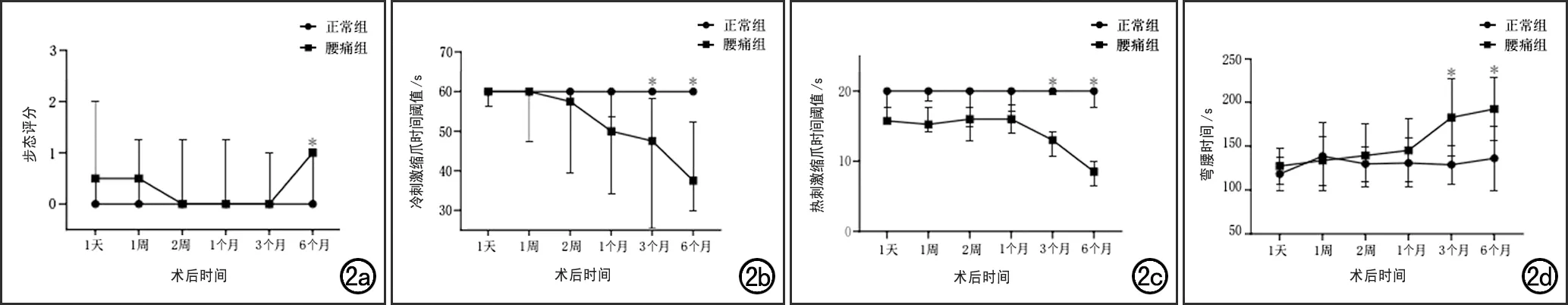
图2 两组大鼠不同时间点行为学指标点线图(星号为正常组与腰痛组比较,P<0.05)。a)步态实验,腰痛组大鼠造模后步态评分呈先降低、后增高的表现;b)丙酮实验,冷刺激缩爪时间阈值腰痛组大鼠于造模后3和6个月时显著低于正常组且差异具有统计学意义;c)热板实验,腰痛组大鼠热刺激缩爪时间阈值低于正常组,于造模后3和6个月时具有显著差异;d)悬尾实验,腰痛组大鼠于造模后3和6个月时弯腰时间显著大于正常组。
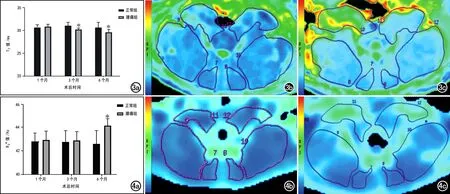
图3 正常组和腰痛组T2-mapping表现。a)不同时间点两组大鼠腰椎旁肌肉T2值柱形图,显示腰痛组在造模后3和6个月时的T2值显著低于正常组(*P<0.05);b)正常组大鼠造模后6个月腰椎旁肌肉的T2-mapping伪彩图,椎旁肌以蓝色为主;c)腰痛组大鼠造模后6个月腰椎旁肌肉的T2-mapping伪彩图,椎旁肌偏向绿、黄色,表明其T2值低于正常组。注:肌肉颜色蓝-绿-黄-红表示T2信号从高到低变化。图4正常组和腰痛组BOLD-MRI表现。a)不同时间点两组大鼠腰椎旁肌肉R2*值柱形图,显示腰痛组于造模后6个月时的R2*值显著高于正常组(*P<0.05);b)正常组大鼠造模后6个月腰椎旁肌肉的BOLD伪彩图,椎旁肌以蓝色为主;c)腰痛组大鼠造模后6个月腰椎旁肌肉的BOLD伪彩图,椎旁肌偏向绿色,表明其R2*值高于正常组。注:肌肉颜色蓝-绿-黄-红表示R2*信号从低到高变化。
3.BOLD-MRI分析
两组大鼠不同时间点腰椎旁肌肉R2*值的测量结果见图4a。腰痛组椎旁肌R2*值随着造模后时间的延长呈进行性上升,在造模后1和3个月时与正常组之间的差异无统计学意义(P>0.05);在造模后6个月时显著高于正常组(图4b~c),且差异具有统计学意义(Z=-4.319,P<0.001)。各时间点穿刺侧(左侧)和健侧(右侧)椎旁肌R2*值的差异均无统计学意义(P>0.05)。
4.组织学结果
两组大鼠各时间点椎旁肌免疫荧光染色结果的柱形图见图5a~b,免疫荧光染色图见图6~7。在造模后1和3个月时腰痛组大鼠椎旁肌肌球蛋白重链基因MYH1和MYH7的表达水平与正常组接近,差异均无统计学意义(P>0.05);造模后6个月时腰痛组的肌球蛋白重链基因MYH1表达明显增高(Z=-2.882,P=0.004), MYH7表达水平明显减低(Z=-2.882,P=0.004)。各时间点穿刺侧(左侧)和健侧(右侧)椎旁肌的MYH1和MYH7表达水平无显著差异(P>0.05)。
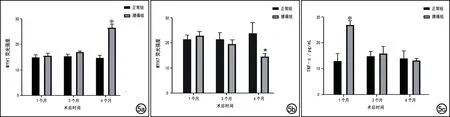
图5 两组大鼠椎旁肌组织学和分子生物学指标测量结果的柱形图(*P<0.05)。a)两组大鼠造模后各时间点椎旁肌肌球蛋白重链基因MYH1表达水平(荧光强度)比较,腰痛组在造模后6个月时显著高于正常组;b)两组大鼠各时间点椎旁肌肌球蛋白重链基因MYH7水平(荧光强度)比较,腰痛组在造模后6个月时显著低于正常组;c)两组大鼠各时间点椎旁肌中TNF-α含量比较,腰痛组在造模后1个月时显著高于正常组。
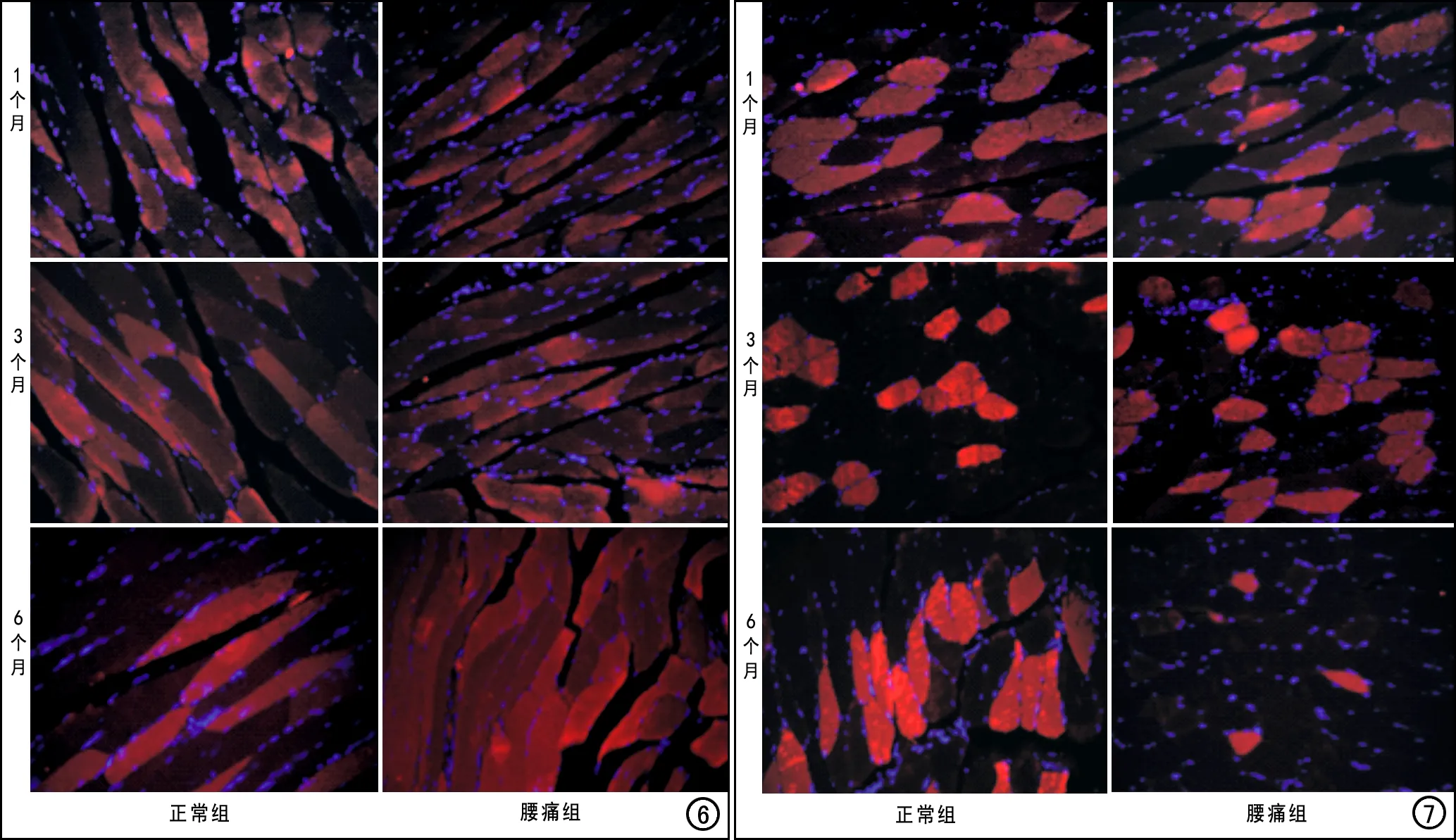
图6 两组大鼠各时间点椎旁肌肌球蛋白重链基因MYH1免疫荧光检查显微镜下图像(×20),显示造模后6个月时腰痛组的肌球蛋白重链基因MYH1表达水平较正常组明显增高,红光表示肌细胞,蓝光表示细胞核,红光的亮度与MYH1的表达水平成正比。 图7两组大鼠各时间点椎旁肌肌球蛋白重链基因MYH7免疫荧光检查显微镜下图像(×20),显示造模后6个月时腰痛组的肌球蛋白重链基因MYH7表达水平较正常组明显减低,红光表示肌细胞,蓝光表示细胞核,红光的亮度与MYH1的表达水平成正比。
5.分子生物学结果
两组大鼠各时间点椎旁肌TNF-α表达水平的ELISA实验结果柱状图见图5c。造模后1个月,与正常组相比,腰痛组大鼠椎旁肌中的TNF-α表达水平显著增高(t=-10.279,P<0.001),且达到高峰;造模后3月和6个月,腰痛组TNF-α表达水平较造模后1个月逐渐降低,且与正常组之间的差异均无统计学意义(P>0.05)。造模后各时间点穿刺侧(左侧)和健侧(右侧)椎旁肌内TNF-α的表达水平均无显著差异(P>0.05)。
讨 论
本研究中采用新的MRI定量技术T2-mapping和BOLD对DLBP大鼠的椎旁肌功能改变进行评估,结果显示椎间盘发生退变后,DLBP大鼠出现步态障碍、对冷热刺激痛觉过敏和弯腰时间延长等行为学改变;同时椎旁肌的R2*值增加、T2值减小。手术结果可能与DLBP大鼠椎旁肌中出现慢肌纤维向快肌纤维转换及TNF-α含量增加有关。而这些肌肉改变能通过T2-mapping和BOLD成像进行无创性定量评估,他们可为诊断盘源性腰痛提供重要的参考依据并指导临床早期干预。
T2-mapping是通过计算横向磁化弛豫时间(T2)来检测组织内微量水分子含量的变化,可从分子水平反映组织生化和代谢信息[5-6,18],目前主要应用于椎间盘基质成分的变化及关节软骨的研究[7,19-20]。BOLD-MRI是一种对微小血管敏感的无创性成像方法[21],当人体血管中去氧血红蛋白含量增加的时候,血管内及其周围水分子的T2或T2*信号减低,即增加了邻近水分子的横向弛豫率R2(1/T2)和R2*(1/T2*)[22]。其测得的R2*(1/T2*)值可反映组织的血氧代谢能力及血流灌注的情况[10],可用于评估肌肉的结构和微循环状况。
本研究结果显示腰痛组大鼠椎旁肌的R2*值随着造模后时间的延长呈进行性增高,T2值则逐渐减小,并于造模后6个月时显著低于正常组(Z=-5.296,P<0.001)。本课题组前期实验中发现腰痛患者椎旁肌R2*值增加、T2值减小,与本实验结果相同[23]。同时行为学检查结果显示,腰痛组大鼠由于腰痛,步态出现明显障碍,弯腰时间延长,并出现对冷、热刺激的痛觉过敏。提示腰痛大鼠的行为变化与椎旁肌退变密切相关,这可能是由于椎间盘退变造成椎旁肌微循环灌注减低,使其R2*值增高,同时椎旁肌内结缔组织增多[24],使细胞水交换受到抑制,使其T2值降低,为保护受损组织,肌肉产生的反射性抑制导致疼痛和脊柱失稳。
在盘源性腰痛发展过程中,TNF-α作为主要的促炎症细胞因子,可加速椎间盘组织细胞外基质的降解,导致椎间盘组织退变[25];使背根神经生长因子浓度增加,神经末梢P物质释放,导致腰痛发生[26]。进而引起椎旁肌肉微循环受损,椎旁肌的血流量和含氧量减少,椎旁肌内有更多的去氧血红蛋白,表现为在BOLD成像上R2*值相应的增加。同时血流灌注的减低导致微血管密度和通透性减低,使水分子由肌间隙向血管内迁移,因此T2-mapping成像时局部T2值减小。本模型中腰痛组大鼠椎旁肌内TNF-α含量于造模后1个月时显著升高(t=-10.279,P<0.001),随后逐渐下降(P>0.05)。此结果与既往的大鼠椎间盘损伤模型的研究结果类似,如Miyagi等[27]发现在穿刺大鼠L5-6椎间盘造模后的1天至1周内椎间盘的TNF-α含量显著升高,自造模后第2周时开始下降,提示炎症可引起椎旁肌血供降低,并且参与了早期疼痛的诱发机制。
本研究中免疫荧光染色结果显示造模后6个月时腰痛组大鼠椎旁肌内肌球蛋白重链基因MYH1表达增高(Z=-2.882,P=0.004)、MYH7表达减低(Z=-2.882,P=0.004),提示椎旁肌中出现慢肌纤维向快肌纤维转换,而肌纤维转换会导致肌肉微循环灌注减低[28];同时脱氧血红蛋白的增加可导致肌肉T2值降低[29];而慢肌纤维可容纳更多的组织水,从而延长T2弛豫时间[30],这些都可以被T2-mapping成像检测到。而且,有研究表明TNF-α也可能参与了椎旁肌肌纤维的转换,促进肌肉纤维的降解和成肌细胞的分化[31-33]。
本研究的不足之处:首先,大鼠虽然是经典的用于模拟人类腰痛患者的实验动物,但是动物与人类之间有不小的种属差异,仍无法完全充分地模拟真实的腰椎间盘退变。其次,TNF-α参与盘源性腰痛模型的作用机制目前尚不清楚,且有其它炎症因子需要验证。另外,本实验样本量尚小,仍需扩大样本量进行验证。
综上所述,炎症因子TNF-α可能参与椎间盘退变,并与椎旁肌内肌纤维的转化有关,从而可影响DLBP大鼠的行为学改变。T2-mapping及BOLD成像技术可无创性反映DLBP大鼠椎旁肌肉内的炎症反应和肌纤维转化,对DLBP患者椎旁肌的功能评价及指导DLBP的预防和治疗具有一定的潜在价值。

