基于multi-atlas QSM定量分析阿尔茨海默病脑基底核团异常铁沉积
简思,张顺,李葭,张妍,覃媛媛,朱文珍
阿尔茨海默病(Alzheimer’s disease,AD)是最常见的神经系统退行性疾病之一,其主要病理学特征是β淀粉样斑块(β-amyloid plaques)沉积形成细胞外老年斑和高度磷酸化的Tau蛋白聚集形成细胞内神经原纤维缠结(neurofibrillary tangles,NFT)。目前诊断AD主要依靠临床评估,虽然可以通过PET检测Aβ斑块,但PET检查费用高、有辐射且图像分辨率较低,目前尚无安全的、可靠的标志物协同诊断AD。最新研究表明,AD患者Aβ斑块与铁的沉积部位具有很好的一致性[1]。铁是大脑中含量最丰富的转运相关金属之一,参与多种大脑生理活动。随着年龄的增长,大脑深部灰质核团如苍白球、壳核、尾状核、红核和黑质等结构的铁含量逐渐增加[2-3]。而且,已有研究者观察到AD患者的大脑深部灰质核团存在过量铁沉积[4-6]。
定量磁化率成像(quantitative susceptibility mapping,QSM)通过评估组织的磁化率来定量分析铁的含量,是目前活体定量分析脑组织铁含量的主要方法[7]。磁化率是物质的一种内在物理属性,大脑中铁主要以铁蛋白的形式储存,它为强顺磁性物质,当回波时间一定,组织中含铁量越多,则相位改变越显著,QSM信号越强。因此QSM可以量化每个体素的磁化率值。与磁敏感加权成像(susceptibility weighted imaging,SWI)一样,QSM同样利用了相位信息来测量组织的磁化特性,但使用了不同于SWI的后处理方法,真正实现了磁化率的定量测量[7]。既往的研究中多应用SWI或者T2*WI来检测大脑内铁含量[8-9],但它们受到场强限制和开花伪影等因素的影响,不能准确地分析脑内铁含量。QSM是目前定量测量铁含量的最佳影像检查技术。
目前大部分研究中采用基于感兴趣区(region of interest,ROI)的方法手动测量基底核团的磁化率,费时、费力且比较主观,而准确性高、全自动分割基底核团的方法目前尚未在临床普遍应用[10]。由于富含铁的基底核团在T1WI上对比度较差,手动勾勒难以准确地界定基底核团的边界,而基于QSM和T1WI的双通道(双对比度)单图谱或多图谱分析(multiatlas-based analysis)可避免上述缺点,通过采用以T1WI结构像为标准模板的全脑配准方法,能够非常准确地自动分割基底核团[11]。由于单个脑图谱的分割精度取决于目标人群与解剖图谱的相似性,而人脑铁的含量会随着脑发育和衰老而变化,因此多图谱分析较单图谱能够更好地反映不同人群基底核团磁化率的细微变化。虽然计算成本相对较高,但通过MRICloud平台将数据打包上传,操作简单,复杂的计算由云平台自动完成,能够满足广大临床医师的需求[12]。此外,由于既往影像检查技术的限制,对于AD患者丘脑底核铁沉积情况的研究比较少。
基于既往研究中存在的上述不足之处,本研究采用目前最为精确的基底核团磁化率全自动化定量测量方法,即基于multi-atlas的QSM和T1W双通道全自动分割基底核团[11],定量分析AD患者脑基底核团的磁化率改变,并探讨铁沉积与AD患者认知损害的关系。
材料与方法
1.一般资料
将2016年3月-2019年5月在本院神经内科门诊就诊的34例AD患者纳入本研究。所有患者符合美国国立神经病、语言交流障碍和卒中研究所及老年性痴呆及相关疾病学会(NINCDS-ADRDA)制定的诊断标准[13]。另从社区招募年龄、性别和受教育程度相匹配的34例健康志愿者(normal control,NC)作为对照组。
对所有受试者进行简易精神状态量表(mini-men-tal state examination,MMSE)评分,并在放射科完成头部磁共振扫描。排除标准:①既往明确伴有其它神经或精神性疾病、系统性疾病、酒精或药物滥用、急性脑血管病和严重外伤等病史;②头部有金属异物;③有幽闭恐惧症。
本研究经本院伦理委员会批准,并获得了所有受试者或其家属的知情同意。
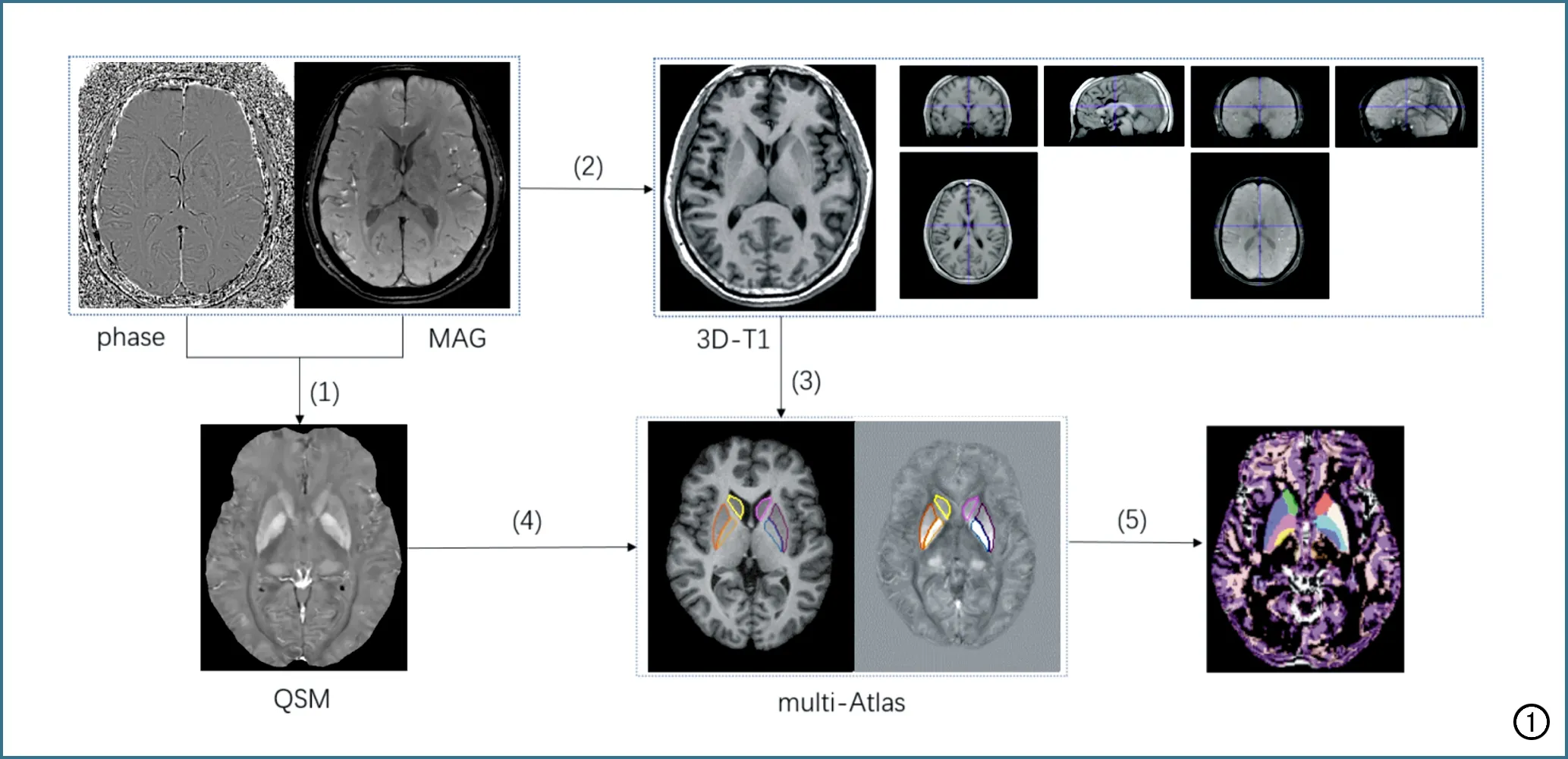
图1 基于multi-atlas的QSM定量分析流程图。步骤1为自动重建多回波GRE图像(幅度图phase和相位图MAG)得到QSM参量图;步骤2为采用SPM软件将受试者的相位图MAG和自身的3D-T1WI图像进行配准,从而获得配准后的QSM参量图;步骤3为将3D-T1WI上传至MRICloud平台获得T1WI分割结果;步骤4为上传配准后的QSM参量图和3D-T1WI分割结果到MRICloud平台,进行基于multi-atlas的多图谱融合分割;步骤5为自动获得QSM分割结果及20个ROI的磁化率值。
2.MR扫描及数据后处理
使用GE discovery MR750 3.0T磁共振扫描仪和32通道头部专用线圈。扫描序列包括三维颅脑容积成像(three-dimension brain volume imaging,3D-BRAVO)T1WI和3D多回波GRE序列。3D-BRAVO T1WI序列扫描参数:TR 3.18 ms,TE 450 ms,翻转角12°,层数188,层厚1.0 mm,矩阵256×256,视野240 mm×240 mm。3D多回波GRE序列扫描参数:8个回波,视野240 mm×240 mm,TR 66 ms,TE 14.8 ms,△TE 10.5 ms,矩阵416×256,读出带宽244 Hz/pixel,层厚3.0 mm,翻转角20°。
采用全自动零参考形态偶极子翻转法重建多回波GRE图像,得到QSM参量图,以脑脊液磁化率为0作为参考值[14]。基于multi-atlas的QSM定量分析在MRICloud云平台上完成(https://mricloud.org/),主要后处理流程见图1。主要后处理步骤:首先,采用SPM软件将受试者的QSM参量图和3D-T1WI图像进行配准;然后,将3D-T1WI数据上传至云平台进行分割及空间标准化,获得标准化后的T1WI数据及其形变信息;最后,将配准后的QSM图像和3D-T1WI分割结果上传至云平台,采用10个解剖图谱集(名称:atlases_T1_QSM_V02)融合分割,获得QSM脑基底核团的精准分割结果[11],同时自动获得20个脑基底核团的平均磁化率值,包括双侧尾状核、壳核、内侧和外侧苍白球、背侧丘脑、丘脑枕、丘脑底核、黑质、红核及齿状核。
3.统计分析
使用SPSS 23.0统计软件进行数据的统计分析。采用单样本K-S检验验证各定量资料的数据是否符合正态分布,对于符合正态分布的变量采用独立样本t检验进行组间比较(采用Gpower软件计算得到本研究的效应量为0.89,满足统计学要求),不符合正态分布的变量采用曼-惠特尼U检验进行组间比较;性别差异的组间比较采用卡方检验。脑基底核团磁化率值与MMSE评分的相关性采用Pearson相关性分析。以P<0.05为差异有统计学意义。
结 果
AD组和对照组一般临床资料的比较见表1。两组受试者的性别、年龄和受教育年限的差异均无统计学意义(P>0.05)。 AD组的MMSE评分较对照组明显降低,差异有统计学意义(P<0.001)。基于multi-atlas的QSM定量分析结果显示见表2和图2。
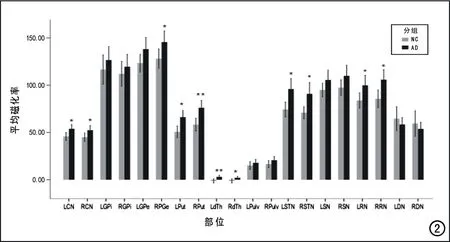
图2 AD组和对照组脑基底节灰质核团磁化率值的直方图。图片上的*代表P<0.05(未校正),**代表P<0.05(Bonferroni校正)。LCN=左侧尾状核,RCN=右侧尾状核,LGPi=左侧内侧苍白球,RGPi=右侧内侧苍白球,LGPe=左侧外侧苍白球,RGPe=右侧外侧苍白球,LPut=左侧壳核,RPut=右侧壳核,LdTh=左侧背侧丘脑,RdTh=右侧背侧丘脑,LPulv=左侧丘脑枕部,RPulv=右侧丘脑枕部,LSTN=左侧丘脑底核,RSTN=右侧丘脑底核,LRN=左侧红核,RRN=右侧红核,LDN=左侧齿状核,RDN=右侧齿状核。
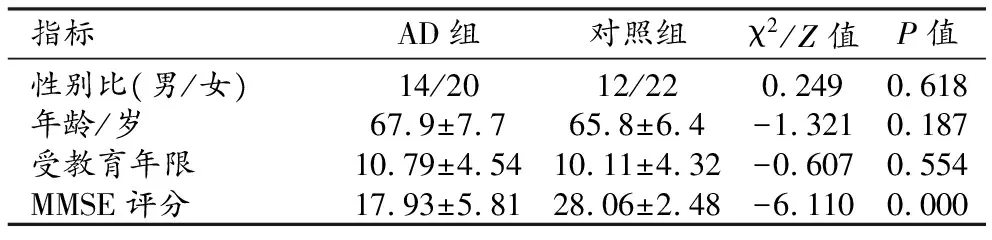
表1 AD组和对照组一般资料的比较
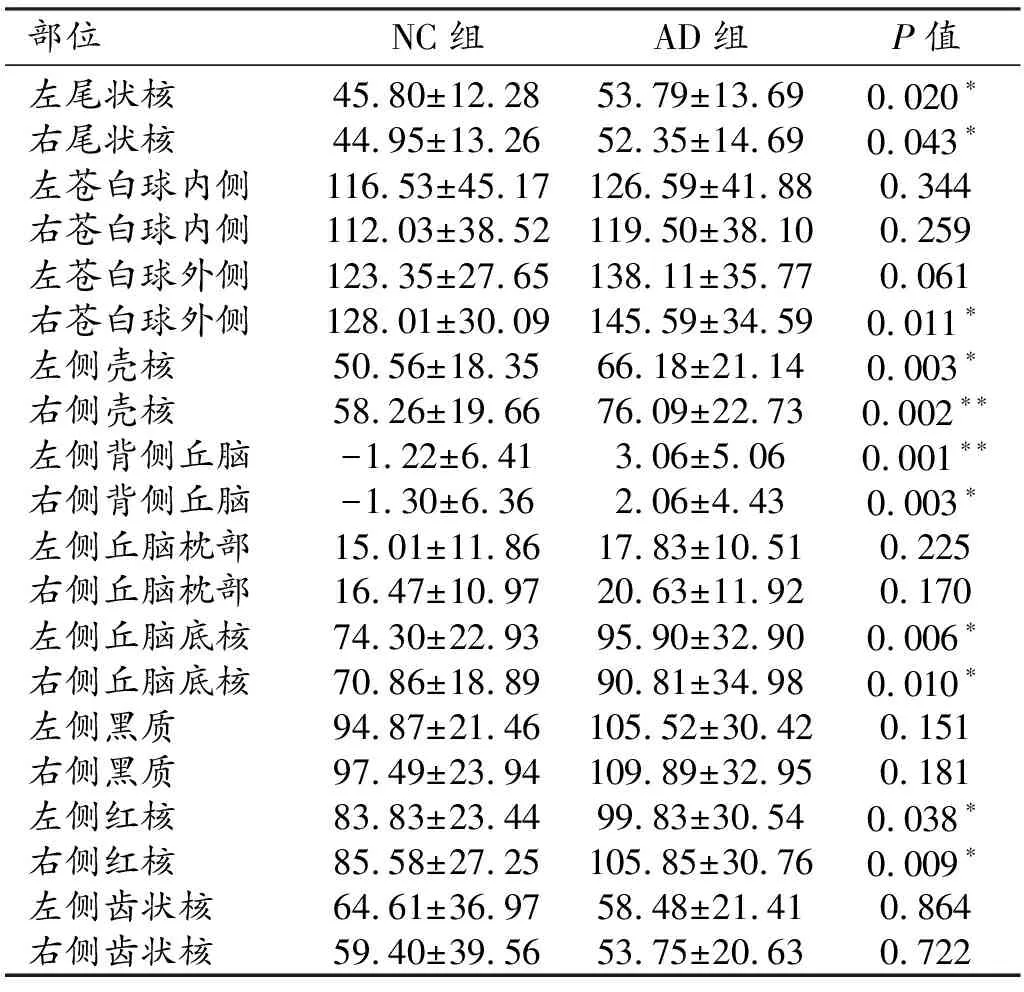
表2 AD组和NC组各部位的磁化率值 /×10-3ppm
在20个脑基底核团中,AD患者11个核团(双侧的尾状核、壳核、背侧丘脑、丘脑底核和红核及右侧外侧苍白球)的磁化率值较对照组升高(P<0.05,未校正);其余9个核团的磁化率值与对照组之间的差异无统计学意义(P>0.05,未校正)。而经过Bonferroni校正后,仅右侧壳核(P=0.002)和左侧背侧丘脑(P=0.001)的磁化率值与对照组之间的差异具有统计学意义。
选取AD组磁化率值显著高于NC组的基底核团,将其磁化率值与MMSE评分进行相关性分析,散点图见图3。结果显示,右侧壳核(r=-0.302,P=0.020)和左侧背侧丘脑(r=-0.319,P=0.014)的磁化率值与MMSE评分呈显著负相关。
讨 论
目前铁在AD发生发展中的作用尚未完全明确,早期研究发现AD患者尸检脑组织β淀粉样斑块中可见铁沉积[15],而近期研究发现在PET检测发现Aβ阳性的患者中局部脑区铁沉积越多,患者的认知功能下降越明显[16]。可见,过量的铁沉积与神经退行性疾病密切相关。目前其原因尚未完全阐明,可能与铁超载导致有毒自由基的产生和氧化损伤有关[17-18];也有学者认为铁能准确地结合神经元中的Tau蛋白,将其转变为P-Tau蛋白(过度磷酸化的Tau蛋白),导致NFT的产生[19];铁过载同时可导致具有神经毒性的游离铁释放,从而引起神经细胞凋亡[20],导致记忆减退。因此,铁沉积过多可能潜在加速AD的患病进程或者是AD潜在致病的原因之一。
基底神经节参与了相当多类型的认知和记忆功能的调节过程[21],尾状核、壳核和苍白球等部位的铁沉积可能导致皮质-纹状体通路的破坏,进而引起患者记忆力下降。本研究中发现AD患者右侧壳核和左侧背侧丘脑的铁含量较NC增多,这与之前的研究结果基本一致[22];且右侧壳核和左侧背侧丘脑磁化率升高与认知功能下降显著相关,可能与铁过载导致神经细胞凋亡从而引起认知功能下降有关。背侧丘脑是一个复杂的神经核团复合体,既往大部分影像学检查中将整个丘脑作为一个ROI[4],但有研究显示丘脑枕与视觉皮质和边缘皮质有着广泛的联系,其扩散特征和组织结构特点与丘脑其它亚区显著不同[22]。因此,本研究中所采用的脑图谱将丘脑枕与丘脑其它部位分开测量,但并未发现丘脑枕存在过度铁沉积。之前多数研究者认为丘脑铁含量增多与患者认知功能之间并无显著相关性[4,23],与本研究结果不一致,笔者认为可能的原因未本研究中采用的分割方法不同。
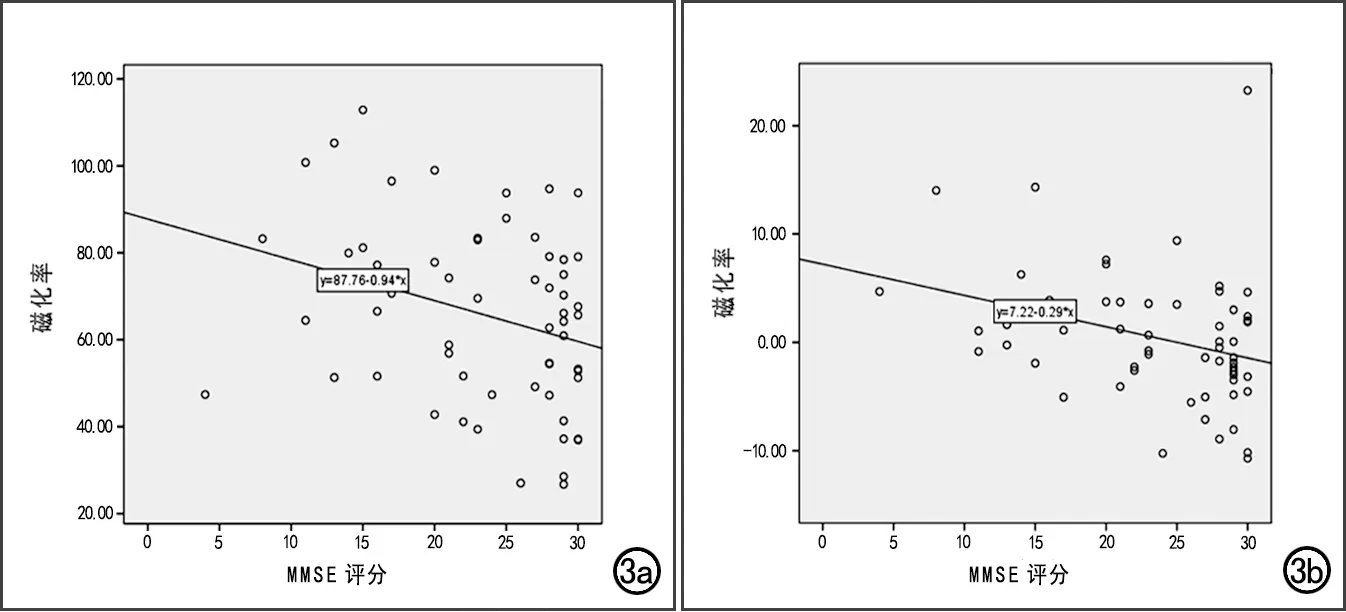
图3 AD患者基底核团磁化率值与MMSE评分相关性分析散点图。 a)右侧壳核的磁化率值与MMSE评分呈显著线性负相关;b)左侧背侧丘脑的磁化率值与MMSE评分呈显著线性负相关。
另外,本研究中首次探索了AD患者中丘脑底核是否存在过度铁沉积。丘脑底核位于红核外侧、内囊膝部的内侧,覆盖于黑质嘴侧的上方,由内前向外后呈斜形走行,呈双凸透镜形或月牙形;丘脑底核可被细分为3个亚单位:背外侧区、腹侧区及中间区,背外侧区主要与运动通路有关,而腹侧区及中间区则与联合通路、边缘系统通路有关[24]。既往有研究者发现[25-26],经深部电刺激(deep brain stimulation,DBS)治疗后的帕金森病患者虽然运动功能得到改善,但是出现了认知功能的下降(如语言流利度下降、反应时间变长等),同时还伴有轻度躁狂和/或抑郁状态等情绪改变。还有一些功能影像学研究中观察到丘脑底核-颞叶环路在大脑认知功能机制中具有至关重要的作用[27]。本研究中也发现AD患者双侧丘脑底核的磁化率值较健康对照升高,但经多重比较校正后,2组之间的差异无统计学意义,这可能与本研究样本量较小有关。我们认为AD患者丘脑底核的磁化率升高,但是相对于壳核和背侧丘脑,其增加程度较小,未来尚需要进一步扩大样本量以明确丘脑底核铁沉积增多在AD患者认知功能下降中的作用。
综上所述,本研究采用基于multi-atlas的QSM定量分析方法,准确地测量了AD患者和健康对照脑基底核团的磁化率,发现AD患者大脑深部基底核团的铁含量较健康对照显著增加,且与认知功能的下降具有相关性。基于multi-atlas的QSM定量分析方法可用于AD患者基底核团异常铁沉积的定量评估,但本研究为回顾性分析,样本量较少,且对患者认知功能的评估中仅采用了MMSE评分,相对单一,尚需在今后进一步增加样本量并进行更为详细全面的认知功能评估来深入研究。

