CT影像组学联合炎症指标构建逻辑回归模型预测食管鳞癌新辅助化疗疗效
宫悦,胡逸凡,夏茜,丁娟娟,顾红梅
目前,食管癌是发病率排名第八位、死亡率排名第六位的恶性肿瘤,晚期患者生存率仅15%~25%[1]。在中国,95.5%的食管癌病理类型为食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)[2]。根据食管癌治疗指南的推荐,对于cT1b~cT2N+或cT3~cT4a+N0~1可切除食管癌患者,术前新辅助治疗联合手术切除是较为推荐的治疗模式[3]。晚期食管癌患者术前进行新辅助治疗可以提高患者的生存率[4]。在新辅助治疗方式的选择上,欧美国家首选新辅助放化疗(neoadjuvant chemoradiation treatment,NCRT),亚洲国家则推荐新辅助化疗(neoadjuvant chemotherapy,NAC)[5]。针对ESCC患者,NAC和NCRT哪种更优目前尚存在争议。接受NCRT的患者在手术后心脏和肺部并发症的发生率及围手术期的死亡率较接受NAC的患者更高[6],因此本研究着重于探讨ESCC患者NAC疗效。
使用实体肿瘤PET反应标准有助于预测肿瘤的治疗反应和预后[7-8],但PET-CT价格昂贵,基层普及率不高。影像组学通过定量分析肿瘤的纹理特征,解码肿瘤在遗传和细胞水平上的生物学特征,有助于对肿瘤疗效的预测和预后的判断[9-10]。有研究者建立了基于CT的食管癌NCRT疗效评估的机器学习模型,并显示出比临床模型更好的预测性能[11-12]。
炎症微环境与肿瘤的发展密切相关,以往的研究多探讨炎症指标与患者长期生存率之间的关系,而本文则评估了其在预测ESCC患者在NAC疗效中的应用价值。血液学炎症指标可影响ESCC患者的疗效和预后生存期,但其在食管癌中的价值以及如何优化其与其它因素的组合以尽早选择针对不同患者的最优个性化治疗,仍需进一步深入研究。
食管癌患者的总生存期(overall survival period,OSP)与肿瘤对治疗的反应显著相关[13],对反应不佳的患者采用NAC方案,不仅使患者遭受不必要的治疗导致的不良反应,增加治疗费用,还会延误最佳治疗时机。故本文通过分析基于CT影像组学和血液学炎症指标构建的列线图对预测ESCC患者NAC反应的效能,寻找能早期筛查出对NAC反应不佳患者的影像学方法,旨在为临床最优的个性化治疗提供依据。
材料与方法
1.研究对象
本研究为回顾性研究,研究对象为2016年1月-2021年9月在南通大学附属医院(医院A)和东台市人民医院(医院B)接受规范化NAC治疗的ESCC患者。入组标准:①经手术病理证实为食管鳞状细胞癌;②根治性手术前接受规范化NAC治疗;③有NAC治疗前、后的完整的胸部CT增强图像;④在完成NAC后接受食管癌根治切除术。排除标准:①同期接受了其它相关治疗(免疫治疗、新辅助放疗等);②合并其它恶性肿瘤;③肿瘤病灶过小(直径<10 mm)或图像质量差,不能满足评价要求;④靠近贲门的病灶与贲门分界不清。最终共将54例符合要求的患者纳入本研究,其中男41例、女13例,年龄49~78岁,中位年龄64岁;28例来自医院A, 26例来自医院B。
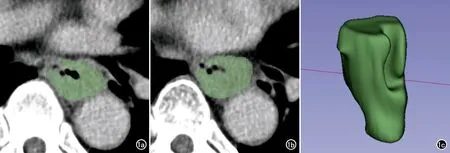
图1 食管癌患者CT图像。a~b)静脉期增强图像,逐层沿肿瘤边缘勾画ROI(绿色区域),避开空气等;c)逐层勾画ROI后软件自动生成VOI。
2.临床资料及分组
所有入组患者的NAC方案:第1天静脉滴注紫杉醇(135 mg/m2),第1~3天静脉滴注顺铂(30 mg/m2);重复上述注射方案,3周为1个疗程,持续进行2个疗程。所有患者在完成NAC后4~6周接受食管癌根治切除术。
搜集所有患者在NAC前一周内的基线实验室检查资料,主要包括血液学炎症相关指标:单核细胞(monocytes,MON)、血小板(platelet,PLT)、中性粒细胞(neutrophilicgranulocyte,NE)、淋巴细胞(lymphocyte,LYM)和白细胞计数(white blood count,WBC),并计算其衍生指标:淋巴细胞-单核细胞比(lymphocyte to monocyte ratio,LMR)、中性粒细胞-淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)、中性粒细胞/血小板比值(platelet to lymphocyte ratio,PLR)和系统免疫炎症指数(systemic immune-inflammation index,SII=血小板×中性粒细胞计数/淋巴细胞)。
本研究按照实体肿瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)1.1进行疗效评估。在纵隔窗矢状面或横轴面图像上测量肿瘤的最长径。NAC结束3周后复查胸部增强CT,测量治疗后病灶的最长径,计算最长径的变化率。对于治疗后CT图像上未能观察到的病灶则在观察期间记录为病灶消失,不测量其大小。
在NAC治疗前、后的增强CT图像上测量治疗前、后病灶的最长径,计算其变化率;根据变化率将治疗效果分为以下4种。完全缓解(complete response,CR):目标病灶完全消失;部分缓解(partial response,PR):病灶最长径较基线缩小程度≥30%;疾病进展(progressive disease,PD):病灶最长径较基线增加至少20%;疾病稳定(stable disease,SD);病灶最长径减小或增加的程度介于PR和PD之间。将CR和PR患者纳入NAC治疗有效组,将PD和SD患者纳入无效组[14]。
3.CT扫描方法
患者取仰卧位,双手举过头顶;扫描范围为胸廓入口至双侧肾上腺下缘水平。两家医院扫描层厚、层间隔均为5.0 mm,120 kV,像素矩阵512×512,0.75 s/r;行动脉期和静脉期双期增强扫描,对比剂注射流率为3.0 mL/s,采用CT值阈值法触发动脉期扫描,动脉期扫描完成后延迟30 s行静脉期扫描。
医院A:使用Philips Brilliance ICT机,对比剂为碘普罗胺,用量约60 mL,扫描前口服对比剂;医院B:使用Siemens Definition AS螺旋CT机,对比剂为碘佛醇,用量约80 mL,扫描前未口服对比剂。
4.影像组学特征提取
将患者NAC治疗前静脉期原始图像以DICOM格式导入3D Slicer 4.11软件(https://download.slicer.org/),采用人工方法沿肿瘤边界逐层勾画ROI,避开空气,来自医院A的图像还需注意避开对比剂,勾画完成后软件自动生成病灶的三维容积感兴趣区(图1)。ROI的勾画由一位具有5年以上相关工作经验的住院医师和一位主治医师分别进行。
本研究设计基于影像生物标记物标准化倡议(Image Biomarkers Standardization Initiative,IBSI)。使用PyRadiomics 3.0.1软件包(https://pyradiomics.readthedocs.io/)对DICOM格式的图像进行标准化及重采样(体素大小2.0×2.0×2.0 mm3)处理,使用小波(Wavelet)滤波器、高斯滤波器的拉普拉斯算子(LoG)滤镜,对原始图像和经滤镜处理后的图像分别进行特征提取,包括一阶特征、形态特征、灰度共生矩阵(gray level co-occurrence matrix,GLCM)、灰度区域大小矩阵(gray-level size-zone matrix,GLSZM)灰度游程矩阵(gray-level run-length matrix,GLRLM)、邻域灰度差矩阵(neighborhood gray-tone difference matrix,NGTDM)和灰度依赖矩阵(gray-level dependence matrix,GLDM)。其中,形态特征只能自原始图像中提取。
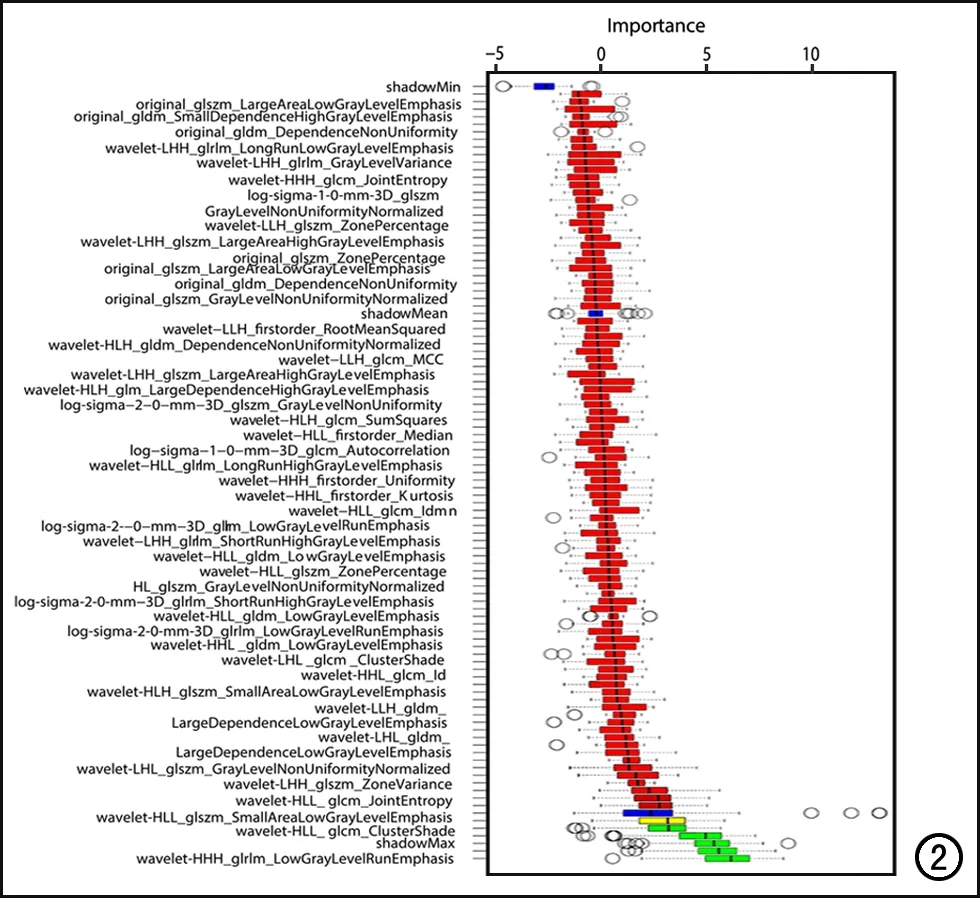
图2 Boruta特征按重要性排序,wavelet-HLL_gldm_DependenceEntropy、wavelet-HHL_gldm_LargeDependenceLowGrayLevelEmphasis、wavelet-HHH_glrlm_HighGrayLevelRunEmphasis、wavelet-HHH_glrlm_LowGrayLevelRunEmphasis、wavelet-HLL_glszm_ZoneEntropy这5个影像组学特征的重要性最高,最终用于构建影像组学标签。
在Python中使用Sklearn 0.23.2(https://scikit-learn.org/)软件包进行特征工程。在R语言4.0.3(https://www.r-project.org/)中使用irr程序包计算组间相关系数(Intraclass Correlation Coefficient,ICC)来评估基于两位医师勾画的VOI所提取的纹理特征的一致性,ICC>0.75表明相关性较好,选择相关性较好的特征进行标准化处理后,使用mRMR及Boruta程序包进行特征降维,构建逻辑回归模型,并根据逻辑回归中截距和特征系数计算影像组学标签(Radscore)。
5.统计分析
使用R语言stats程序包中的Shapiro-Wilk检验对计量资料是否符合正态分布进行验证,如符合正态分布使用均值±标准差表示,不符合则使用中位数(上、下四分位数)表示。对于符合正态分布的变量,组间比较采用独立样本t检验;非正态分布的变量,组间比较则采用Mann-WhitneyU检验。将P<0.05的变量纳入后续分析。
6.模型的建立和验证
基于血液学炎症指标和影像组学特征分别建立逻辑回归模型,通过R语言中rms程序包构建血液学炎症指标联合Radscore的逻辑回归模型,使用六折交叉验证对3个模型分别进行内部验证,并绘制其ROC曲线。使用ROC曲线评估影像组学模型、血液学炎症指标模型及联合模型的效能,计算曲线下面积(AUC),并利用混淆矩阵得到模型预测效能的各项定量指标(平均准确率、平均精确率、平均召回率及F1-score)。使用rmda程序包中的决策曲线分析(decision curve analysis,DCA)评估模型的临床价值。
结 果
1.基本临床资料
54例患者中治疗有效组30例,无效组24例。两组患者NAC前的血液学炎症指标值详见表1。两组之间LYM和LMR的差异有统计学意义(P均<0.05);MON、PLT、NE、WBC、NLR、PLR和SII在两组间的差异无统计学意义(P均>0.05)。
2.影像组学模型及标签
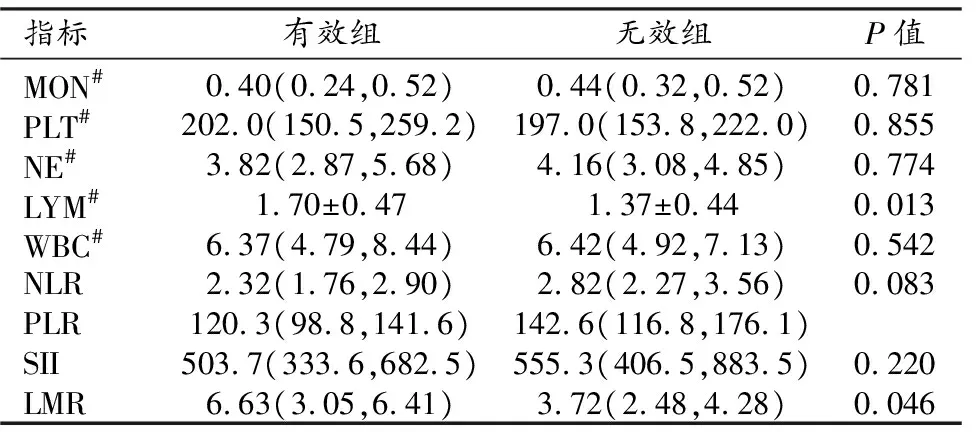
表1 两组患者NAC前血液学炎症指标值的比较
共提取1168个组学特征,经特征降维后最终筛选出5个特征用于构建影像组学模型(图2),相应的影像组学标签(Radscore)的计算公式:
Radscore=0.16-0.48×wavelet-HLL_gldm_DependenceEntropy+0.63×wavelet-HHL_gldm_LargeDependenceLowGrayLevelEmphasis-0.20×wavelet-HHH_glrlm_HighGrayLevelRunEmphasis+0.20×wavelet-HHH_glrlm_LowGrayLevelRunEmphasis+0.52×wavelet-HLL_glszm_ZoneEntropy
(1)
3.血液学炎症指标模型及联合模型
将组间差异有统计学意义的血液学炎症指标纳入逻辑回归分析,LYM和LMR被纳入临床预测模型。基于血液学炎症指标和Radscore构建联合模型并绘制列线图(图3),相应的计算公式[P(y=1)是预测为治疗有效的概率]:
P(y=1)=-2.27+1.28×LYM+0.094×LMR+1.20×Radscore
(2)
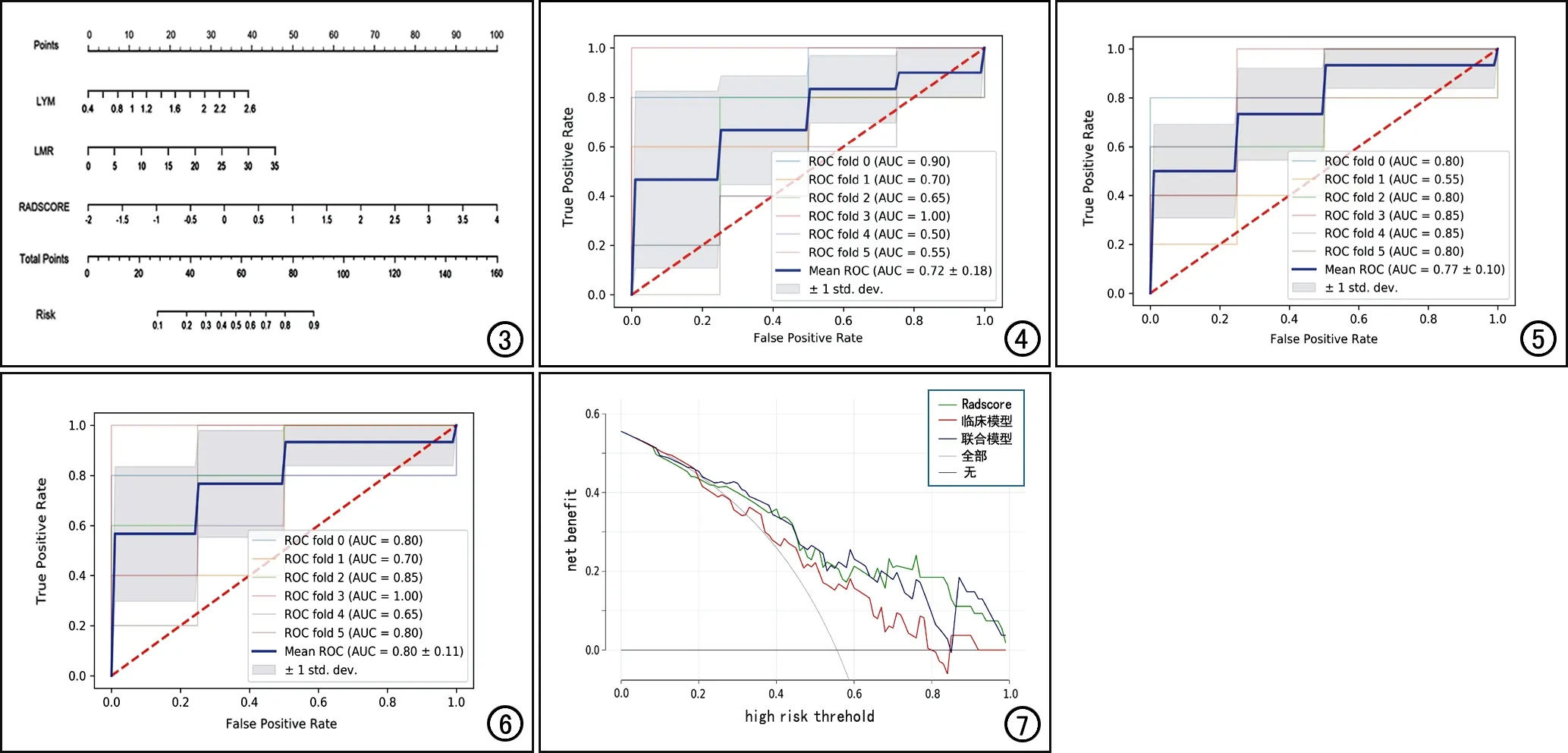
图3联合CT影像组学标签和血液学炎症指标构建的预测ESCC患者NAC疗效的列线图。图4血液炎症学模型的ROC曲线,经过6折交叉验证后平均AUC为0.72。 图5影像组学模型6折交叉验证的ROC曲线图,平均AUC为0.77。 图6联合模型6折交叉验证的ROC曲线图,经过6折交叉验证后平均AUC为0.80。图7各模型的DCA图,显示影像组学模型和联合模型的患者临床受益均较好,风险阈值为0.68~0.84时联合模型的获益较其它模型高。
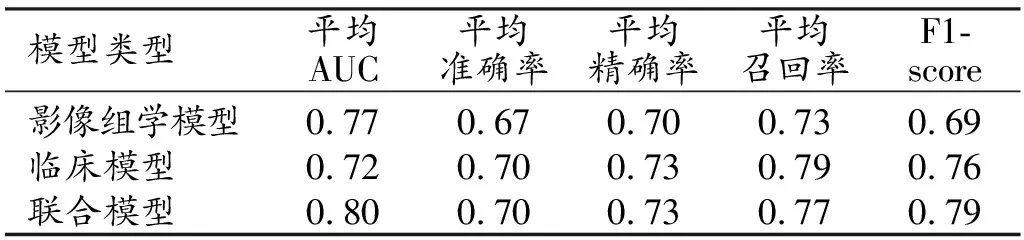
表2 不同模型的预测效能指标
不同模型预测治疗有效的效能指标值见表2,6折交叉验证的ROC曲线见图4~6,DCA曲线见图7。结果显示影像组学模型、临床模型和联合模型均具有较高的预测效能,其中以联合模型的预测效能最佳。DCA曲线显示影像组学模型和联合模型具有较好的患者获益,风险阈值为0.68~0.84时联合模型的获益较其它模型高。
讨 论
NAC在不同ESCC患者中治疗效果差异较大,治疗前判断患者能否从NAC中受益具有较大的临床价值。ESCC患者对NAC反应的差异可能与其肿瘤的异质性有关,本研究利用影像组学方法,通过不同的纹理参数值来揭示病变内部性质变化,从而无创性量化分析肿瘤的微环境。本研究结果显示:GLRLM中的高灰度运行强调(high GrayLevel Run Emphasis,HGLRE)特征测量的是病灶内高灰度值的分布,其与治疗效果呈负相关,而低灰度运行强调(low gray level run emphasis,LGLRE)与治疗效果呈负相关,上述结果与一项基于PET-CT及另一项基于MR T2WI序列的影像组学研究结果类似[15-16],这表明HGLRE不仅具有良好的鲁棒性,在预测肿瘤治疗效果方面也具有良好效能。GLSZM参数中的区域熵(zone entropy,ZE)测量的是区域大小和灰度级别分布的随机性,其值越大说明肿瘤的异质性越高[17],此纹理参数与治疗效果呈正相关,说明内部结构异质性越高的病灶治疗疗效更好,这似乎意味着愈加混乱的肿瘤微环境更有利于化疗药物作用于肿瘤细胞。本研究发现降维后的影像组学特征全部为Wavelet滤波器预处理图像提取的特征,我们推测Wavelet滤波器通过应用高通或低通滤波器可降低影像噪声,增强纹理细节,从而有助于提高表达肿瘤异质性的效率,提升放射组学模型的预测效能。
炎症指标与大多数种类的恶性肿瘤的行为与进展密切相关,如国内刘永倩[18]等在原发性肝癌的研究中显示了NLR与肿瘤病理分级的相关性,由免疫细胞、基质和血管系统组成的肿瘤微环境是影响常规放化疗和免疫治疗疗效的关键因素[19-20]。在日本的一项研究中,NLR是反映ESCC患者NAC病理反应的独立预测指标[21],但本研究中并未显示出NLR是NAC疗效的独立影响因子,这与国内罗何三等[22]关于ESCC放化疗的研究结论类似,故尚不能认为NLR可作为预测ESCC新辅助化疗疗效的生物标志物。本研究结果显示低水平的LYM和LMR是ESCC患者化疗效果不佳的危险因素,而PLR则无显著相关性。这一表现与其它肿瘤(如乳腺癌[23])不完全相同,另外一方面,各类研究结论的不一致还可能来源于研究设计的不同、治疗方案的迥异或肿瘤本身的异质性,我们期待进一步前瞻性研究可以控制这些混杂因素。
本研究按照RECIST 1.1进行疗效评估。RECIST 1.1标准以单径的方法测量病灶来评价化疗疗效,James等[24]的研究结果表明肿瘤最长单径变化比WHO标准中肿瘤双径乘积更能反映肿瘤细胞数量的变化。在两者评估食管癌治疗疗效有着较好一致性的基础上,RECIST标准更易操作,同时也更贴近食管癌的特点[25]。
本研究中存在的不足之处:①样本量不足,虽使用了K折交叉验证从一定程度上说明了模型的可靠性,但独立测试集的缺失还是让模型的泛化能力缺乏一定的说服力,仍需在真实世界中进行大样本、多中心验证;②手工分割的ROI虽然严格沿肿瘤边缘,但这样的分割方法忽略了肿瘤周缘的信息,并不能体现肿瘤完整的特征,在后续的研究中,拟引入深度学习模型用于肿瘤自动分割。
综上所述,本研究使用基于CT的影像组学分析为实验室资料提供有益的信息补充,构建并验证了基于CT影像组学及新辅助化疗前血液炎症学指标建立的列线图预测模型可以在新辅助化疗前较好地预测食管癌患者新辅助化疗的疗效,为ESCC患者制订个性化治疗方案提供参考。

