全球mRNA疫苗产品研发态势分析*
潘黎姿,陈 娟,杨潇逸,欧阳昭连
(中国医学科学院医学信息研究所,北京 100020)
mRNA疫苗是将编码一种或多种目标抗原蛋白的mRNA导入到宿主细胞的细胞质中,并在宿主细胞内表达、翻译成足够数量的抗原蛋白,进而传递给宿主细胞的免疫系统,激活免疫系统产生抗体,达到预防或治疗的目的[1]。相比于传统疫苗及DNA疫苗,mRNA的表达翻译是在宿主细胞的细胞质中,其整合到宿主细胞基因组的风险很低,且可通过生理代谢途径被降解[2],其生物安全性更高[3];mRNA疫苗编码所表达的抗原蛋白可同时诱导机体产生体液免疫和细胞免疫,产生效果较好的免疫反应;其制备流程更灵活、简单,同时可在短时间内大量生产,以迅速应对传染病暴发期的需求[4]。近年来,多个国家在预防传染病及肿瘤领域都加大了mRNA疫苗的研发投入。新型冠状病毒肺炎(COVID-19)疫情的暴发更是推动了mRNA疫苗的快速发展,为未来mRNA疫苗在其他疾病领域的发展奠定了坚实的基础。在此,检索与汇总全球mRNA疫苗产品的研发信息,分析全球mRNA疫苗的研发态势,总结mRNA疫苗研发所面临的挑战。
1 研究方法
计算机检索Cortellis数据库中全球范围内的mRNA疫苗产品研发信息,汇总处于不同研发状态的产品,排除已停止研发产品,形成数据集。数据采集时间为自建库起至2021年11月17日。分别从以下4个方面分析全球mRNA疫苗的研发态势:1)展示全球处于不同研发状态的mRNA疫苗数量及全球研发进展较快的国家;2)描述在研mRNA疫苗产品的适应证及对应的数量;3)汇总全球mRNA疫苗的主要原研机构;4)分析目前全球研发进展已进入Ⅲ期临床试验、预注册、注册和上市的产品数据。
2 结果与分析
2.1 全球产品数量及研发状态分布
共检索到在研mRNA疫苗148个,其中1个暂停研发。目前,临床前阶段所占产品数量最多(78个),处于Ⅰ期和Ⅱ期临床试验的在研产品数量较多(分别有26个和23个)。详见图1。
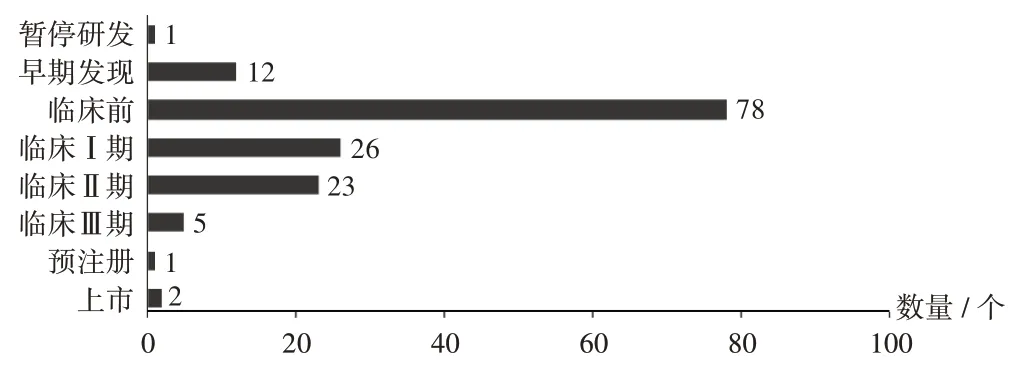
图1 全球148个mRNA疫苗的研发状态及数量分布(检索日期:2021年11月17日)Fig.1 R&D status and quantity distribution of 148 mRNA vaccines in the world(date of search:November 17,2021)
疫苗产品顺利经过早期发现、临床前研究和临床研究环节后可进入注册上市流程。目前,全球进展最快的mRNA疫苗产品中,已有5个启动Ⅲ期临床试验,其中美国有3个,中国和德国各有1个;此外,美国还有1个注册/上市的疫苗,德国处于预注册和注册/上市的疫苗各有1个。
2.2 适应证分布
mRNA疫苗在研或上市产品适应证(表1)主要为感染,共133个。其中,排名前5位感染适应证分别为COVID-19感染(53个)、流感病毒感染(14个)、未指明类型的传染病(13个)、呼吸道合胞病毒感染(6个)和艾滋病毒感染(6个)。第二大适应证为肿瘤(62个),详见表1。其中,在研产品不少于4个的肿瘤适应证为黑色素瘤(7个)、乳腺肿瘤(5个)、胰腺肿瘤(4个)和非小细胞肺癌(4个)。另外,还有3个产品适应证分别为多发性硬化症、移植后淋巴增生性疾病和免疫紊乱。上述适应证开发进展较缓慢,目前还无已进入Ⅲ期临床试验的mRNA疫苗(表2)。
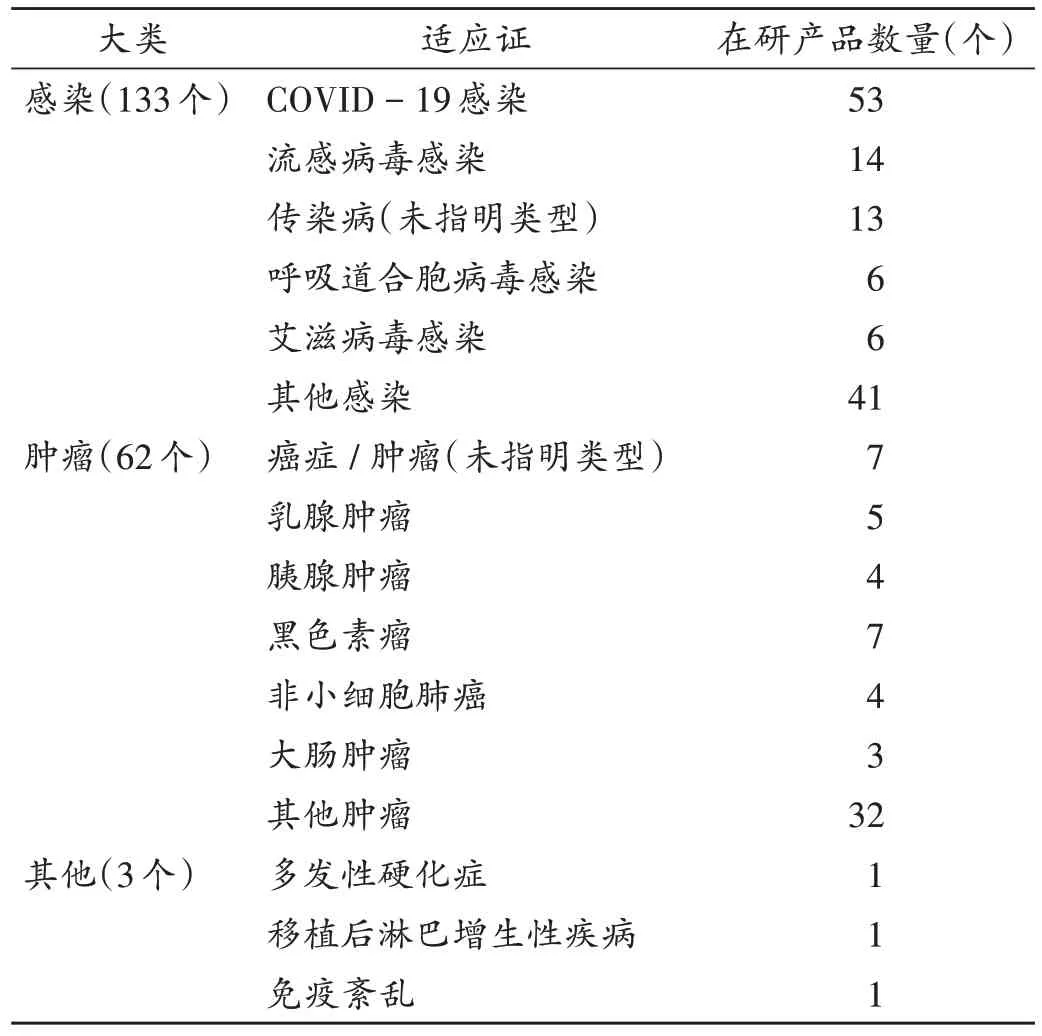
表1 全球在研或上市mRNA疫苗的适应证Tab.1 Indications of mRNA vaccines under research or marketed in the world
2.3 主要原研机构
全球范围内,原研mRNA疫苗数量超过1个的机构共有15个,其中美国5个,德国3个,中国2个,加拿大2个,英国、比利时和澳大利亚各1个。美国Moderna Therapeutics公司原研的mRNA疫苗产品数量最多(28个);美国的AlphaVax公司和比利时的Ziphius Vac⁃cines公司次之,原研疫苗数各10个;中国的斯微生物(StemiRNA)和苏州艾博生物(Anbogen Biosciences)公司分别有9个和2个产品在研。详见图2。

图2 原研mRNA疫苗超过1个的机构(检索日期:2021年11月17日)Fig.2 Institutions with more than one original-patented mRNA vaccines(date of search:November 17,2021)
2.4 各国研发进展
目前,全球范围内仅有3个国家有已启动Ⅲ期临床、预注册、注册或上市的mRNA疫苗产品,分别为德国、美国、中国,且适应证多为感染(表2)。已上市的2个mRNA疫苗均为COVID-19疫苗,分别为2020年上市的德国BioNTech公司研发的BNT162b2和2021年上市的美国ModeRNA研发的mRNA-1273;其余已启动Ⅲ期临床试验的疫苗分别由美国ModeRNA、美国Arcturus Therapeutics公司和中国苏州艾博生物、中国复星医药研发;此外,德国CureVac公司研发的CvnCoV已进入预注册。
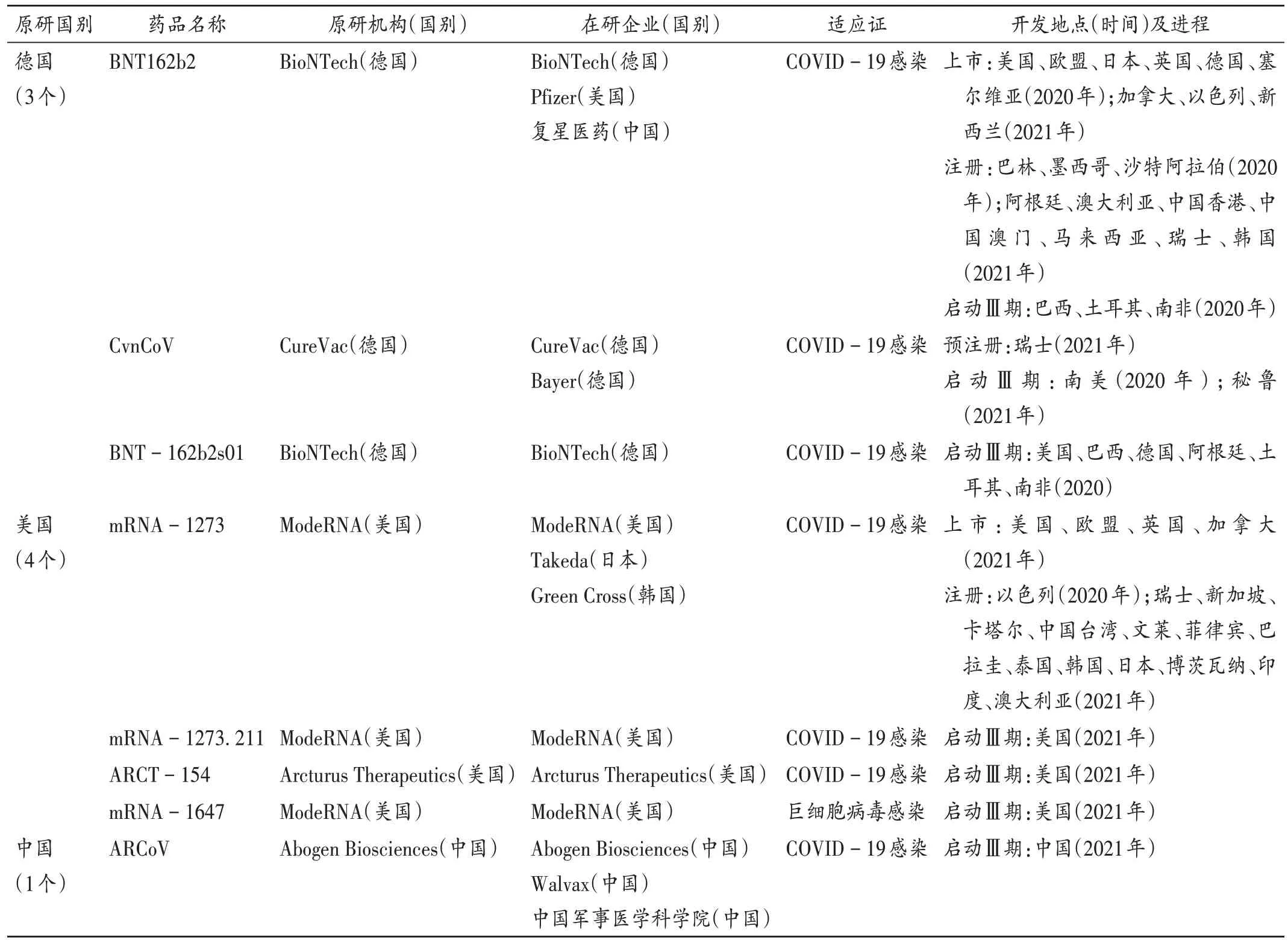
表2 全球启动Ⅲ期临床试验、预注册、注册或上市的mRNA疫苗Tab.2 mRNA vaccines that have been launched the phaseⅢclinical trials,pre-registered,registered or marketed in the world
3 讨论
3.1 上市时间趋势
2020年至2021年,为了应对COVID-19疫情,降低感染率和死亡率,全球疫苗研发进展迅速。根据世界卫生组织统计,截至2022年3月15日,全球范围内共有149个疫苗进入临床试验阶段,195个疫苗处于临床前阶段;其中,27个mRNA疫苗已进入临床阶段,占所有进入临床试验阶段疫苗的18%[5]。目前,已上市的两款mRNA疫苗均为COVID-19疫苗,已进入Ⅲ期临床试验的疫苗中也多为COVID-19疫苗,可见疫情的蔓延大大加速了mRNA疫苗的研发进展。同时,由于疫苗接种规模较大,为已上市的两款RNA COVID-19疫苗提供大量的真实世界数据,利用真实世界数据可向研发人员提供反馈,改进研发技术,预计将会有更多针对其他适应证的mRNA疫苗成功上市。
3.2 传染病mRNA疫苗开发
目前在研的mRNA疫苗以感染为主要适应证,且在疫情的推动下取得了突破性进展,已上市的两款mRNA疫苗均为COVID-19疫苗,分别由德国BioNTech公司研发的BNT162b2和由美国ModeRNA公司研发的mRNA-1273,有效性及安全性均良好。其中,BNT162b2疫苗的有效性为95%,不良反应主要为轻中度的注射部位疼痛、疲劳及头痛[6];而mRNA-1273疫苗的有效性为94.1%,无严重不良反应报告[7]。上市后的真实世界研究发现,在美国退伍军人中,接种了BNT162b2或mRNA-1273疫苗的受试者COVID-19感染率仅为5.75‰和4.52‰,有效地保护了易感人群[8]。
中国在mRNA疫苗研发方面也取得了初步进展,由苏州艾博生物、沃森生物和中国军事医学科学院共同研发的COVID-19疫苗ARCoV已启动Ⅲ期临床试验。动物模型实验结果[9]及临床试验结果[10]显示,ARCoV疫苗可有效刺激病毒中和抗体的产生,包括针对Omicron变异株的抗体水平显著升高,且安全性良好。
尽管国际上mRNA疫苗的研发已取得一定进展,但仍需对疫苗的有效性和保护作用进行深入研究。一项在卡塔尔人群中展开的研究显示,接种2针BNT162b2疫苗后针对Delta变异株和Omicron变异株的有效性分别为93%和70%[11]。另一项研究显示,受试者血清中针对野生型、Beta变异株、Delta变异株和Omicron变异株的平均中和抗体滴度在接种2针BNT162b2疫苗后分别为16.56,1.27,8.00,1.11;在接种3针BNT162b2疫 苗 后 分 别 上 升 为891.4,152.2,430.5,107.6[12]。此外,有关mRNA-1273疫苗的研究显示,接种1针疫苗后14 d疫苗有效性仅为65.5%;接种2针疫苗后3个月疫苗有效性增至峰值的90%,接种2针疫苗后第4个月疫苗有效性开始下降,至第7个月有效性降至50%以下[13]。可见,mRNA疫苗针对不同病毒变异株的保护效力有较大程度的浮动,且有效性随着时间的推移而降低。目前,许多国家针对疫情采取了接种加强针或序贯接种以加强和维持免疫效果,但仍需对mRNA疫苗的保护作用进行研究,为疫苗的大规模接种提供证据支持。
此外,mRNA疫苗需要低温运输,严格的储藏条件给mRNA疫苗的大规模接种带来了巨大挑战,尤其是贫困地区和热带地区[14]。BNT162b2和mRNA-1273疫苗分别需要在-80~-60℃(-112~-76 °F)和-15~25℃(-13~5°F)条件下储存和运输。为应对这一挑战,辉瑞公司目前将未稀释的冷冻疫苗以传统的储存温度保存,该温度下仅可维持2周,同时声称其正在开发特殊的运输集装箱,以便顺利分配疫苗[15]。目前的研究证明了制备耐热疫苗的可能性[16]。在未来的研发中,还需重视对耐热疫苗的开发及对mRNA疫苗配方的优化。
3.3 肿瘤mRNA疫苗开发
已启动Ⅲ期临床试验、预注册、注册或上市的疫苗中无以肿瘤为适应证的疫苗,进展较传染病缓慢。抗原的选择是研发肿瘤疫苗的重点与难点,目前常用的抗原为肿瘤相关抗原(TAA),但TAA表达范围有限、非肿瘤特异性表达及具有广泛的变异性等特点,使得以TAA为抗原所制备的mRNA疫苗出现适用范围受限、易产生免疫逃逸及引发中枢或外周免疫耐受反应等问题[17]。仅源于肿瘤细胞突变而在正常细胞中不表达的肿瘤特异性抗原又称新抗原,能激发机体产生较强的免疫反应,且不易产生免疫逃逸和耐药性,是突破上述问题的重点[18]。通过肿瘤组织活检,配合下一代基因测序(NGS),识别并筛选肿瘤组织中具有最高免疫原性的候选抗原,可制备基于肿瘤特异性抗原的mRNA疫苗,从而实现个体化疫苗治疗[19-20]。
要提高疫苗对肿瘤的作用,除了抗原的正确选择外,还要诱导足够水平的T淋巴细胞免疫反应,目前的解决方案除了上述对抗原的选择外,还包括通过选择治疗时机、联用免疫佐剂及改变肿瘤微环境等策略来增加抗肿瘤效果[17]。
在肿瘤的早期阶段使用mRNA疫苗,有助于提高疫苗治疗效果。因为当肿瘤已经生长到一定大小或已经转移至其他器官时,免疫系统已和肿瘤细胞有过一定时间的相互作用,此时可能会产生一定的免疫逃避,降低疫苗的作用[21]。此外,现有研究还发现在疫苗中添加佐剂也可提高mRNA疫苗的免疫原性,如诺华公司将MF59和阳离子纳米乳剂作为佐剂,将疫苗注射入动物体内后发现疫苗的免疫原性和有效性显著升高[22]。肿瘤组织形成的免疫抑制微环境也是需要克服的一大难题,免疫检查点抑制剂能改变微环境的细胞组成,减少T淋巴细胞耗竭,是提高mRNA疫苗有效性的好帮手[23]。随着疫苗生产平台的技术进步,同时在多方案的配合下,以肿瘤为适应证的mRNA疫苗的成功上市指日可待。
3.4 小结
在COVID-19疫情的冲击下,mRNA疫苗以其安全性高、制备灵活及免疫效果好的特点受到各大科研机构及企业的重视,德国和美国已成功上市两款COVID-19疫苗,取得了较大进展,中国的科研团队也有产品已进入Ⅲ期临床试验。目前在研的mRNA疫苗多以感染和肿瘤为适应证,但因储存条件、抗原选取、免疫佐剂及肿瘤微环境等方面的困难,已进入Ⅲ期临床试验及之后阶段的产品数量较少,而随着COVID-19疫苗经验的积累及疫苗技术的进步,将会有更多mRNA疫苗成功上市。

