同型半胱氨酸在心肌细胞凋亡和增殖中的作用及其机制
刘达越,董小艳,徐灵博,张慧萍,全尚琨,马胜超,白永生,杨勇,李桂忠*
1宁夏医科大学基础医学院,宁夏银川 750004;2国家卫生健康委员会代谢性心血管疾病研究重点实验室/宁夏血管损伤与修复研究重点实验室,宁夏银川 750004;3宁夏医科大学总医院产前诊断中心,宁夏银川 750004;4宁夏回族自治区人民医院神经内科,宁夏银川 750004;5宁夏回族自治区人民医院核医学科,宁夏银川 750004
同型半胱氨酸(homocysteine,Hcy)是心血管疾病的独立危险因素,血浆Hcy水平升高及代谢异常可增加心血管疾病的风险[1]。研究表明,血浆Hcy浓度每降低3 μmol/L,心肌梗死的风险即降低10%左右;而血浆Hcy浓度每增加5 μmol/L,冠心病的发病率增高20%[2]。其中,氧化应激和细胞凋亡的诱导是Hcy产生心脏毒性的主要机制[3]。有研究发现,虾青素可通过抑制线粒体功能障碍和氧化应激,从而抑制Hcy诱导的心脏毒性[4]。也有研究发现,miR-7可通过靶向基质金属蛋白酶14(MMP-14)调节Toll样受体4/核转录因子κB(TLR4/NF-κB)信号而影响Hcy诱导的大鼠脑动脉血管平滑肌细胞增殖、迁移和炎性因子的表达[5]。本课题组前期研究发现,Hcy可通过转录因子c-Myc、DNA甲基转移酶DNMT1和组蛋白甲基转移酶EZH2调节miR-1929-5p的表达,从而诱导足细胞凋亡[6]。以上研究均提示Hcy可通过氧化应激引起细胞损伤,而氧化应激又可引起Toll样受体4(TLR4)信号通路激活。但是,目前对Hcy诱导的心肌细胞损伤机制尚不清楚。本研究探讨了TLR4/NF-κB信号通路在Hcy所致心肌细胞凋亡和抑制心肌细胞增殖中的作用,旨在为高Hcy血症所致心血管相关疾病研究提供理论依据。
1 材料与方法
1.1主要仪器与试剂 恒温CO2培养箱(德国Heraeus公司),微量台式离心机(德国Eppendorf公司),共聚焦显微镜(德国蔡司公司),流式细胞仪(美国安捷伦生物公司)。DMEM培养基(澳大利亚Gibco公司),胎牛血清(澳大利亚Gibco公司),全蛋白提取试剂盒(货号P0013F,上海贝博公司),BCA试剂盒(货号KGPBCA,南京凯基生物科技发展有限公司),超敏ECL化学发光试剂盒(货号P10010,苏州新赛美生物科技有限公司),EdU染色试剂盒(货号C10310-3,广州锐博生物科技有限公司),藻红蛋白标记的膜联素Ⅴ/7-氨基放线菌素D(Annexin V-Phycoerythrin/7-Aminoactinomycin D,Annexin V-PE/7-ADD)细胞凋亡流式细胞术检测试剂盒(货号559763,美国Becton Dickinson公司),Hcy(货号STBJ0903,德国Sigma公司),Bax(货号ab32503,兔源)、Bcl-2(货号ab196495,兔源,美国Abcam公司),cleaved-caspase 3(货号WL02117,兔源,中国万类生物公司),TLR4(货号SC-293072,小鼠源,美国Santa Cruz公司),髓样分化因子(MyD88,货号AF5195,兔源)、磷酸化的NF-κB(p-NF-κB,货号AF3219,兔源)、NF-κB(货号AF5006,兔源)、兔源二抗(HRP标记的山羊抗兔IgG,货号S0001)、小鼠源二抗(HRP标记的山羊抗小鼠IgG,货号S0002)(中国Affinity公司),山羊抗兔HRP标记的β-actin(货号AC028,兔源,中国Abclonal公司),荧光封片剂(货号ZLI-9556,北京中杉金桥生物技术有限公司),TLR4干扰片段(上海吉玛制药技术有限公司)。
1.2 方法
1.2.1 细胞分组及培养 H9C2细胞系(大鼠)购自美国模式培养集存库(American Type Culture Collection,ATCC)。细胞分为对照组(37 ℃、5%CO2的环境下,正常含有10%胎牛血清和1%青链霉素的DMEM培养基中培养)与Hcy组(正常培养同时加入3 mmol/L Hcy干预24 h)。
1.2.2 Western blotting检测TLR4/NF-κB信号通路相关蛋白和凋亡相关蛋白的表达 将细胞铺于25 cm2培养瓶中并分为对照组与Hcy组。向各组处理后的心肌细胞中加入裂解液、蛋白酶抑制剂、磷酸酶抑制剂、PMSF提取细胞总蛋白,采用BCA法测浓度,以10 μl/30 μg蛋白向SDS-PAGE凝胶中加样,80 V、1.5 h电泳后用300 mA 2 h转膜,配制5%脱脂牛奶封闭PVDF膜2 h,4 ℃孵育兔抗鼠MyD88(1:1000)、兔抗鼠NF-κB抗体(1:1000)、兔抗鼠p-NF-κB抗体(1:1000)、小鼠抗大鼠TLR4抗体(1:1000)、兔抗鼠Bax抗体(1:1000)、兔抗鼠Bcl-2抗体(1:1000)、兔抗鼠cleaved-caspase-3抗体(1:1000)过夜,第2天洗膜,用HRP标记的山羊抗兔IgG(1:5000)或HRP标记的山羊抗小鼠IgG(1:5000)室温孵育2 h,洗膜3次,加入发光液后曝光,以β-actin(1:5000)作为内参照。
1.2.3 流式细胞术检测心肌细胞凋亡率 6孔板培养各组细胞后用冷PBS清洗细胞2次,加入不含EDTA和酚红的胰酶消化细胞30 s,轻轻吹下细胞后1000 r/min离心5 min,取细胞沉淀加入100 μl 1×结合缓冲液重悬细胞至5 ml离心管中,向各组中加入5 μl Annexin V-PE,再加入5 μl 7-ADD,室温避光孵育15 min后,再向每管加入400 μl 1×结合缓冲液,1 h内上机检测。
1.2.4 EdU检测心肌细胞增殖情况 共聚焦皿培养各组心肌细胞24 h后加入EdU工作液,使其终浓度为10 μmol/L,将细胞放置于37 ℃恒温孵育箱中孵育2 h,弃上清后多聚甲醛固定15 min。弃固定液,PBS洗1次,添加0.3% TritonX-100后静止15 min。弃通透液,PBS洗1次,添加Click-iTTM细胞反应缓冲液室温避光孵育30 min,添加DAPI室温孵育10 min。PBS清洗后在共聚焦显微镜下观察拍照。
1.2.5 TLR4干扰片段转染及筛选 将心肌细胞铺于6孔板中,分为5组:对照组(正常无血清培养基处理)、si-NC组(转染si-TLR4空载体)、si-1组(转染si-TLR4-1426)、si-2组(转染si-TLR4-466)、si-3组(转染si-TLR4-2062)。具体操作步骤为:(1)配置A液(250 μl纯DMED培养基+5 μl Lipofectamine 2000,室温静置5 min)和B液(250 μl DMED培养基+6 μl siRNA);(2)将A液与B液混合后室温静置20 min,加入6孔板,补充纯培养基至终体积为2 ml,6 h后换10%含血清培养基继续培养;(3)24 h后换液,其中正常对照组更换为7%含血清培养基,Hcy组更换为含有3 mmol/L Hcy培养基,干预24 h后收细胞提取总蛋白,采用Western blotting检测TLR4表达情况进行干扰片段的筛选。后续实验选取干扰效果最明显的片段作为si-TLR4+Hcy组(转染TLR4干扰片段si-1并用3 mmol/L Hcy进行干预),同时以si-NC+Hcy组(转染干扰片段空载体并用3 mmol/L Hcy进行干预)作为对照。
1.2.6 干扰后TLR4/NF-κB信号通路相关蛋白和凋亡相关蛋白的表达 采用Western blotting检测干扰后各组相关蛋白的表达情况,具体方法见1.2.2。
1.2.7 干扰后心肌细胞凋亡及增殖情况 采用流式细胞术检测干扰后各组心肌细胞凋亡率,具体方法同1.2.3。采用EdU检测干扰后各组心肌细胞增殖情况,具体方法见1.2.4。
1.3 统计学处理 采用GraphPad Prism 8.0.1进行统计分析。所有数据均为计量资料,以±s表示,两组间比较采用t检验;多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠心肌细胞TLR4/NF-κB通路相关蛋白和凋亡相关蛋白表达情况 Western blotting检测结果显示,与对照组比较,Hcy组通路相关蛋白TLR4、MyD88和p-NF-κB表达水平明显升高,心肌细胞凋亡相关蛋白Bax、cleaved-caspase 3表达水平明显升高,抗凋亡相关蛋白Bcl-2表达水平明显降低,差异均有统计学意义(P<0.01,图1)。

图1 两组大鼠心肌细胞干扰前TLR4/NF-κB通路相关蛋白和凋亡相关蛋白的表达(Western blotting, n=3)Fig.1 Comparison of protein expressions of TLR4/NF-κB related signaling pathway protein and apoptosis related protein in cardiomyocytes before interfere between the two groups of rats (Western blotting, n=3)
2.2 大鼠心肌细胞凋亡率的比较 流式细胞术检测结果显示,与对照组(5.68%±3.17%)比较,Hcy组大鼠心肌细胞凋亡率(25.01%±1.43%)明显增高,差异有统计学意义(P<0.05,图2)。
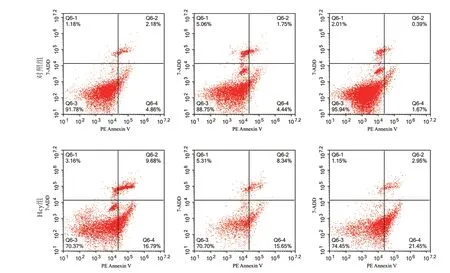
图2 两组大鼠心肌细胞凋亡率比较(流式细胞术,n=3)Fig.2 Comparison of apoptosis rate of cardiomyocytes between the two groups of rats (Flow cytometry, n=3)
2.3 大鼠心肌细胞增殖情况比较 EdU染色检测结果显示,与对照组(10.52%±2.51%)比较,Hcy组EdU阳性细胞率(1.96%±1.14%)明显降低,差异有统计学意义(P<0.01,图3)。

图3 两组心肌细胞增殖情况比较(EdU染色, n=3)Fig.3 Comparison of proliferation of cardiomyocytes between the two groups of rats (EdU stainning, n=3)
2.4 TLR4干扰片段的筛选 Western blotting检测结果显示,TLR4干扰片段转染各组心肌细胞后,与对照组比较,si-NC组TLR4表达水平无明显变化,si-1组TLR4表达水平明显降低(P<0.05),si-2、si-3组TLR4表达水平无明显变化(P>0.05);与si-NC组比较,si-1组TLR4表达水平明显降低(P<0.05),si-2、si-3组TLR4表达水平无明显变化(P>0.05)(图4),因此选择干扰片段si-1用于后续实验。
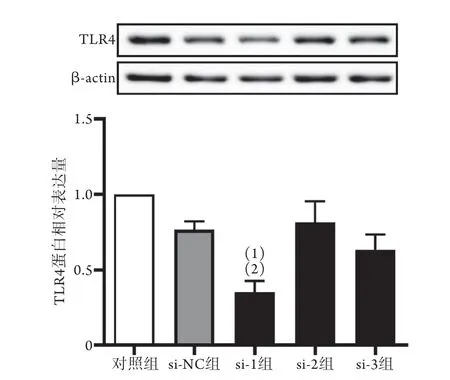
图4 Western blotting检测大鼠心肌细胞TLR4蛋白表达变化(n=3)Fig.4 Protein expression of cardiomyocyte TLR4 of rats detected by Western blotting (n=3)
2.5 TLR4干扰后大鼠心肌细胞TLR4/NF-κB通路相关蛋白及凋亡相关蛋白的表达 Western blotting检测结果显示,与si-NC+Hcy组比较,si-TLR4+Hcy组TLR4/NF-κB通路相关蛋白TLR4、MyD88、p-NFκB表达水平明显降低(P<0.01),凋亡相关蛋白Bax、cleaved-caspase-3表达水平明显降低(P<0.01),抗凋亡相关蛋白Bcl-2表达水平明显升高(P<0.01)(图5)。

图5 Western blotting检测大鼠心肌细胞干扰后TLR4/NF-κB通路相关蛋白和凋亡相关蛋白表达(n=3)Fig.5 Expressions of TLR4/NF-κB signaling pathway related protein and apoptosis related protein in cardiomyocytes of rats after interfere (Western blotting, n=3)
2.6 T L R 4 干扰后大鼠心肌细胞凋亡率比较
流式细胞术检测结果显示,与si-NC+Hc y组(25.11%±1.06%)比较,si-TLR4+Hcy组心肌细胞凋亡率(18.22%±2.32%)明显降低(P<0.01,图6)。
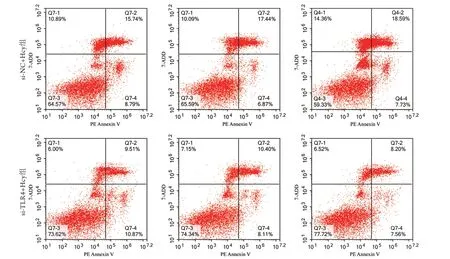
图6 TLR4干扰后大鼠心肌细胞凋亡率比较(流式细胞术,n=3)Fig.6 Comparison of apoptosis rate of cardiomyocytes after interference with TLR4 between the two groups of rats (Flow cytometry, n=3)
2.7 TLR4干扰后大鼠心肌细胞增殖水平的比较 EdU染色检测结果显示,与si-NC+Hc y组(11.90%±7.93%)比较,si-TLR4+Hcy组EdU阳性细胞率(37.53%±2.80%)明显增高,差异有统计学意义(P<0.01,图7)。
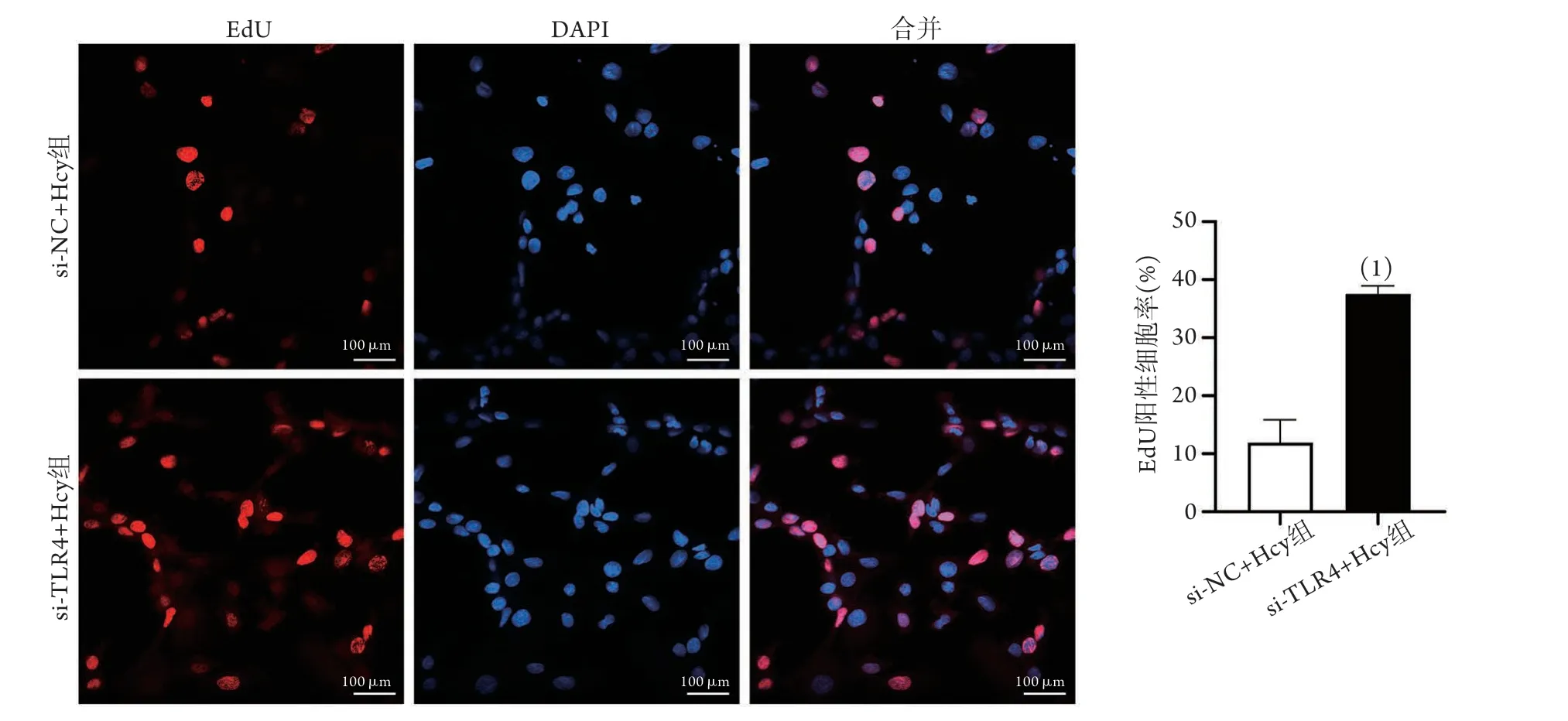
图7 TLR4干扰后两组大鼠心肌细胞增殖情况比较(EdU染色,n=3)Fig.7 Comparison of cardiomyocytes proliferation after interference with TLR4 between the two groups of rats (EdU, n=3)
3 讨 论
心血管疾病严重危害人类健康,影响人类生活质量,其发病率和致残率远远高于其他疾病[7]。Hcy是体内氨基酸代谢的产物,被认为是一种氧化应激的血管损伤因子,流行病学研究表明,血清Hcy浓度升高与心血管疾病的风险增加有关[8]。目前的研究发现,Hcy可导致内皮细胞损伤,促进管壁重构和动脉粥样硬化等,并可影响心肌梗死后心肌细胞的修复,抑制血管再生,促进心肌细胞肥大和间质纤维化,发挥促心肌重构的作用[9]。还有研究发现,在高Hcy血症的缺血再灌注小鼠模型中,心脏的舒张和收缩功能受损更严重[10]。在离体培养的成年大鼠心室肌细胞中,用Hcy刺激24 h后,心肌细胞收缩力明显受损,且损伤程度呈Hcy浓度依
赖性[11]。此外,Hcy还可通过多种途径介导细胞损伤。有研究发现,雷公藤红素可通过调节沉默调节蛋白1/腺苷酸激活蛋白激酶(Sirt1/AMPK)通路而减轻Hcy诱导的血管内皮损伤[12];本课题组前期研究也发现,Hcy可通过叉头框蛋白O1(FoxO1)调节转录激活因子6(ATF6)而引起肝细胞凋亡[13];虽有报道Hcy异常可诱导心肌细胞凋亡[14],但该病理过程的分子和细胞机制尚不明确。因此,本研究进一步探讨了Hcy通过影响Toll样受体及下游的信号通路而调控心肌细胞凋亡的机制。
细胞凋亡是程序性细胞死亡严格控制的模式,其特征为细胞发生明显的形态变化,可通过外源性或内源性途径触发细胞凋亡。其中外源性途径是在胞外因素的刺激下通过相关信号途径激活半胱氨酸-天冬氨酸蛋白酶(caspase家族蛋白)使细胞蛋白水解并导致细胞凋亡[15];内源性途径则是通过线粒体释放细胞色素C等作为凋亡诱导因子,进一步形成凋亡小体招募并激活caspase-3,而caspase-3是caspase级联反应下游凋亡的执行者,其活化后可导致抗凋亡蛋白Bcl-2的下调和促凋亡蛋白Bax的上调,引起级联反应,导致细胞凋亡[16]。研究表明,细胞凋亡广泛参与了动脉粥样硬化、心力衰竭、心律失常等多种心血管疾病的病理过程[17]。此外,还有研究发现,成年哺乳动物的心肌细胞具有增殖能力,心肌增殖可作为心肌损伤后修复再生的基础[18]。总之,心肌细胞的凋亡和增殖过程是心脏发挥正常功能的前提[19]。本研究也发现,Hcy可通过增加心肌细胞中活化的caspase-3(cleaved-caspase-3)及凋亡相关蛋白Bax的表达,减少抗凋亡蛋白Bcl-2的表达,从而促进心肌细胞凋亡;此外,Hcy还可降低心肌细胞的增殖能力。Hcy可通过促进心肌细胞凋亡,抑制心肌细胞增殖,最终导致心肌损伤。
Hcy在体内发生氧化时可使ROS增加,而ROS则可激活TLRs家族[19]。TLR4是TLRs家族成员之一,不仅可识别病原体的相关受体,还可识别衰老死亡或受损细胞中的相关受体。有研究发现,TLR4/NF-κB信号通路是具有多向性的核转录调节因子信号通路,可调节炎症、免疫及生长相关蛋白的表达,也是细胞凋亡的重要途径之一[20]。TLR4与接头蛋白MyD88结合后,可使配体发生构象改变,进而使NF-κB发生磷酸化,并加速向细胞核移位,随后与目标启动子区域结合并激活转录,最终影响凋亡相关蛋白的翻译后修饰,改变凋亡相关蛋白的表达水平[21]。还有研究发现,Hcy可通过凝集素样氧化低密度脂蛋白受体1(LOX-1)造成内皮细胞损伤[22]。本研究也发现,Hcy可促进TLR4/NF-κB信号通路蛋白的表达,进一步影响凋亡相关蛋白Bax、cleaved-caspase-3和抗凋亡蛋白Bcl-2的表达;此外,在Hcy存在的情况下,干扰TLR4可减轻心肌细胞的凋亡,促进心肌细胞的增殖,提示Hcy在激活TLR4/NF-κB信号通路的同时,还可调控心肌细胞的凋亡和增殖。
综上所述,本研究初步证实Hcy可通过TLR4/NF-κB信号通路诱导心肌细胞凋亡,并可降低心肌细胞的增殖能力;而干扰TLR4后,可逆转Hcy诱导的心肌细胞凋亡,且心肌细胞增殖能力也明显增强。因此,调节TLR4/NF-κB信号通路可改善Hcy对心肌细胞的损伤作用。但由于Hcy的代谢过程比较复杂,本研究未针对其代谢物是否直接影响TLR4/NF-κB信号通路进行探讨,推测Hcy激活TLR4信号通路与Hcy代谢过程中释放的ROS有关,但其更深层次的机制仍有待进一步探究。

