静息态功能磁共振成像在局灶性肌张力障碍中的应用研究进展
吴兰香,吴伟
南昌大学第二附属医院神经内科,江西南昌 330000
肌张力障碍是一类运动障碍疾病,流行病学调查显示其发病率为(3~30)/10万[1-2],其中局灶性肌张力障碍临床较常见,严重影响患者的社交及生活质量,给家庭和社会带来了沉重的负担。因此,探索肌张力障碍的发病机制、寻找其治疗靶点一直是亟待解决的问题。有研究认为肌张力障碍是一种基底神经节功能障碍[2],然而临床发现越来越多的患者出现感觉症状,表明该疾病存在初级躯体感觉皮质功能和微结构改变[3-5]。目前神经影像学研究改变了研究人员对该疾病发生机制的认识,并为其客观诊断和治疗开辟了新的视角。早期研究使用正电子发射断层扫描(positron emission computed tomography,PET)发现,局灶性肌张力障碍患者的基底神经节、丘脑、小脑和感觉运动皮质的葡萄糖代谢和脑血流发生异常变化[6]。使用扩散加权成像(diffusion-weighted imaging,DWI)和高分辨率磁共振成像(magnetic resonance imaging,MRI)序列进行分析发现,局灶性肌张力障碍患者存在大脑结构和功能的改变[7]。此后,大规模大脑网络数学建模应用揭示了全脑神经网络异常[8]。局灶性肌张力障碍的诊断主要依赖症状学观察,缺乏客观指标,目前开展的神经影像学检查如超声、CT、MRI等对鉴别诊断有一定帮助,但无法精准定位功能区及评估预后。
静息态功能磁共振成像(resting state functional magnetic resonance imaging,rs-fMRI)是在MRI基础上发展起来的一项重要研究技术,能定位病灶及分析不同脑功能区的联系。由于其具有无创、简便易行、分析方法多样等优势,已广泛应用于研究运动障碍的病理生理学改变,包括肌张力障碍、帕金森病和震颤等[9]。rs-fMRI技术的应用打破了局灶性肌张力障碍是单纯基底神经节功能障碍的观点,强化了其是一种神经网络障碍性疾病的概念,即由于共同的网络改变,不同形式的肌张力障碍存在统一的病理生理机制[10]。本文就rs-f MRI的工作原理、临床应用及其在各种局灶性肌张力障碍中的研究进展进行综述,以期寻找高敏感度和特异度的客观脑成像标志物。
1 rs-fMRI概述
1.1 工作原理 f MRI通过无创探测大脑内部血氧水平依赖信号(blood oxygen level-dependent,BOLD),利用BOLD效应间接反映脑区神经元的活性[11]。根据BOLD效应原理,神经元活动增强的脑区表现为信号升高(激活增强)[11]。静息状态下,正常大脑依然存在有规律的功能活动网络,且该网络在病理状态与健康状态下存在差异及重塑,受试者处于静息状态下应用血氧水平依赖脑功能成像获得脑活动功能图的成像技术称为静息态f MRI。静息态(resting state)是相对于任务态(task state)的一种状态,即受试者保持清醒、闭眼、平静呼吸、不接收任何外部刺激或执行高级认知功能的安静状态。rs-f MRI是在没有输入及输出因素影响的情况下,对大脑区域内和区域间的自发活动进行研究,或通过对脑区之间自发活动进行相关分析来呈现功能和解剖密切联系的神经环路,是了解大脑潜在机制的有力工具。
1.2 数据分析方法 rs-fMRI的数据分析方法大致分为两种类型:功能分离和功能整合。功能分离是根据认知功能的差异将大脑分成不同的脑区,主要关注不同脑区的自身功能,常用指标为低频振荡振幅(amplitude of low frequency fluctuation,ALFF)和局部一致性(regional homogeneity,ReHo)。ALFF计算每一个体素(voxel)在0.01~0.08 Hz之间的信号振荡平均强度,通过功率谱方法获得BOLD的振幅,分析BOLD信号基线的变化来研究大脑在静息状态下BOLD信号的改变,从能量角度反映各个体素在静息状态下的神经元自发活动水平,其意义类似于PET,能记录一段时间内的脑代谢活动[12-13]。ReHo值是通过测量给定体素与其周边体素时间序列信号的相关性(肯德尔系数)来反映局部大脑神经活动的同步性。ReHo值越高表明局部体素与邻近体素的一致性越好,但并不一定说明局部神经活动越显著[14]。
功能整合认为大脑的各个脑区是互相配合、各有权重的网络。静息状态下不同空间散在分布的脑区中BOLD低频振荡信号存在明显的同步相关性,研究认为,这是不同大脑皮质维持脑功能活动时内部存在功能连接的证据[15]。此外,将静息状态下可探测到的空间上散在分离而内部有较高同步活性的脑区群落定义为固有脑功能网络(简称脑网络)[16]。功能整合关注不同脑区的交互效应,分析方法包括功能连接(functional connectivity,FC)分析、基于种子点(region of interest,ROI)的功能连接分析、独立成分分析(independent component analysis,ICA)和基于图论的脑网络分析(graph analysis)。其中FC分析通过计算某个体素与其他体素BOLD时间序列的相关系数,反映两体素之间功能连接的强度,而非具体的连接路径;基于ROI的功能连接分析通过计算某ROI与大脑其他所有体素或感兴趣区的BOLD时间序列的相关系数,得到各脑区之间的功能连接;ICA依据“盲源分离”的方法,分离出空间上相互独立、时间序列相关的功能网络,通常分离出的几种静息态脑功能网络(resting-state brain network,RSN)包括默认网络、听觉网络、突显网络、执行控制网络、视觉网络、感觉运动网络、背侧视觉网络(额顶注意网络)等;图论分析描述大脑在局部和整体进行高效且有序的信息传递,提供脑网络拓扑结构的理论框架,可进行全脑网络分析,亦可对特定脑网络展开针对性分析[17-18]。
2 rs-fMRI在局灶性肌张力障碍中的应用
目前,rs-f MRI广泛应用于局灶性肌张力障碍的研究,如眼睑痉挛(blepharospasm,BPS)、偏侧面肌痉挛(hemifacial spasm,HFS)、颈肌张力障碍(cervical dystonia,CD)、喉肌张力障碍(spasmodic dystonia,SD)及书写痉挛(writing cramps,WC)等。现有研究主要采用功能分离和功能整合的方法,详见表1。
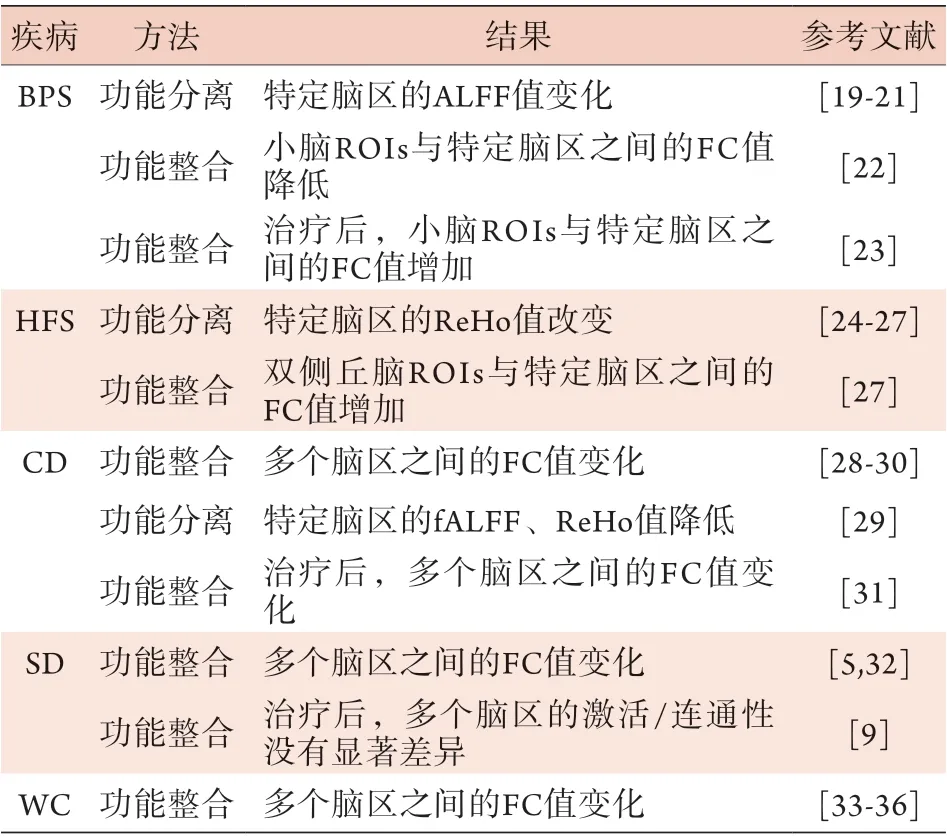
表1 rs-fMRI在局灶性肌张力障碍中的应用Tab.1 Application of rs-fMRI in focal dystonia
2.1 rs-fMRI与BPS BPS主要表现为不自主、持续的眼睑闭锁,感觉运动功能障碍是其特征性表现[21]。以运动症状和感觉症状为特征的BPS病理生理机制仍不清楚。一项基于体素的形态计量学(VBM)分析显示,BPS患者的壳核、初级感觉运动皮质和小脑灰质体积发生了变化[37],且该变化可能与过度不自主运动后神经元突触重构有关。Ni等[38]采用rs-f MRI进行研究发现,BPS患者右尾状核的分数低频振荡振幅(fractional amplitude of low-frequency fluctuations,fALFF)和ReHo值升高,且与疾病严重程度呈正相关。双侧纹状体间的FC值升高,尾状核与运动皮质之间、壳核与前扣带皮质之间的FC值降低,表明基底神经节区在该病的发病机制中起着重要作用[19]。既往认为,BPS是单纯运动障碍性疾病,但目前越来越多的研究发现,该疾病存在感觉-运动整合障碍,异常的感觉-运动环路可能参与了其病理生理过程。
一项体素镜像同伦连通性(VMHC)研究发现,与健康受试者相比,BPS患者的颞下回、扣带回后部、中央后回等脑区的VMHC值明显升高,提示其可能存在视觉-空间感觉整合异常[39]。因此,额叶下回、扣带回后部、颞下回和中央后回的VMHC值升高可作为鉴别BPS患者与健康人的潜在影像指标[39]。有研究发现,与健康受试者相比,BPS患者左侧丘脑的ALFF值降低[21]。丘脑与包括顶叶、颞叶和躯体感觉皮质在内的广泛皮质区域相连,丘脑-皮质环路功能障碍可能导致BPS患者的各种症状[21]。BPS的静息状态网络改变与默认模式网络有关,包括丘脑和皮质-纹状体-苍白球区域。另有研究发现,BPS患者纹状体、丘脑、小脑、躯体感觉区、额叶/前额叶皮质、扣带皮质和岛叶皮质的ALFF值发生变化,且丘脑的ALFF值与扬科维奇评分(Jankovic rating scale,JRS)中的发作频率分值、JRS总分呈正相关,提示该区域的ALFF值可用于衡量患者的疾病严重程度[19-20]。此外,Shakkottai等[22]以小脑作为ROI与全脑进行功能连接分析发现,小脑与联合视觉皮质、躯体感觉关联皮质和顶叶关联皮质之间的FC值降低。同时有研究发现,肉毒毒素(BONT-A)治疗后,BPS患者小脑与相关视觉皮质之间的FC值升高,提示BONT-A可通过改变视觉和感觉输入来调节BPS患者的大脑网络[23]。因此,BPS是一种神经网络障碍性疾病,丘脑、基底节、尾状核、小脑参与了其发病过程,且神经活动异常在其中发挥了重要作用。
2.2 rs-f MRI与HFS HFS指单侧、不自主、阵发性的面部肌肉收缩,会导致严重的视觉和语言障碍、社交尴尬[1]。面神经根出口处的神经血管受压是HFS最常见的病因,也有研究认为HFS的发生与面神经核异常兴奋有关[40],目前其确切的发病机制尚不清楚。Bao等[41]通过VBM研究发现,HFS患者的丘脑、壳核、额前回背外侧皮质、杏仁核及海马旁回灰质体积减小,且杏仁核灰质体积与抑郁、焦虑量表评分明显相关。Tu等[24]和卫永旭等[25]研究发现,HFS患者的多个脑区存在异常自发活动;与健康受试者相比,HFS患者左侧额中回、左侧扣带回内侧、左侧舌回、右侧颞上回、右侧楔前叶的ReHo值降低,左侧体感皮质、扣带前回、右侧脑干和小脑的ReHo值升高,且脑干的ReHo值与疾病严重程度呈正相关,表明HFS发病与控制眨眼运动的大脑区域的异常活动有关。与上述研究结果不同,陆海锋等[26]发现,HFS患者小脑的ReHo值明显降低,而大脑皮质的ReHo值未见明显变化,分析原因可能与样本量少及纳入标准不一致有关。另有研究发现,HFS患者脑干的ReHo值升高,楔前叶的ReHo值降低,进一步以丘脑为ROI进行分析发现,双侧丘脑与双侧颏上回(SMG)和躯体感觉关联皮质(SAC)之间的FC值明显升高,右丘脑与右SMG之间的FC值与患者焦虑和抑郁程度呈负相关[27],提示右丘脑与右SMG之间的FC值可作为评估情绪变化的影像指标。以上研究结果表明,HFS患者参与激活面肌运动的皮质和灰质核团兴奋性增强,而参与抑制面肌运动的皮质存在功能弱化,推测这些改变可能参与了HFS的病理生理进展,同时支持中枢致病学说。
2.3 rs-fMRI与CD CD又称痉挛性斜颈(spasmodic torticollis),是最常见的成人局灶性肌张力障碍类型之一[42]。CD的特点是神经递质系统受损、基底节连接性改变、高级躯体感觉整合和感觉运动通路功能障碍或失衡[31]。VBM研究发现,与健康受试者相比,CD患者的左侧尾状核头、壳核、运动前和初级感觉运动皮质的灰质体积明显减小[43]。随访5年发现,患者左侧初级感觉运动皮质的灰质体积较基线明显减小[43]。有研究发现,CD患者的豆状核、基底节、苍白球内侧、丘脑、小脑、运动皮质、辅助运动区(SMA)、壳核、右侧视皮质和右侧背外侧前额叶皮质的结构均发生改变,右侧中央前回与SMA之间(属于M1-SMA运动网络)的FC值降低,且FC值改变与疾病严重程度呈明显负相关[44]。因此,右侧中央前回与SMA之间的FC值可作为评估CD严重程度的影像指标。
最近有研究发现,在颈部肌张力障碍中,不仅存在感觉运动网络改变,还存在视觉和执行控制网络的变化,如感觉运动区、颞区、顶叶和枕叶区的皮质区域,以及丘脑、脑干和小脑的皮质下区域。多项研究采用ICA分析发现,CD患者的高级躯体感觉功能整合受损,基底节内以及基底节、丘脑与感觉运动皮质之间的FC值升高,壳核与丘脑之间尤为明显,感觉运动与初级视觉网络之间的FC值降低[28-30]。此外,Li等[29]研究发现,双侧中央后回的fALFF、ReHo值降低,提示控制头部运动的激动肌和拮抗肌受损,且可能与突触抑制增强及局部脑血流量增加有关。一项VMHC和图论分析研究发现,与健康受试者相比,CD患者的SMA、楔前回、中央后回(PCU)和内侧前额叶上回(MPFC)的VMHC值明显降低,右侧PCU的中心度明显增加,右侧豆状核和左侧MPFC的中心度明显降低,且SMA的VMHC值与疾病严重程度呈负相关[45],提示感觉运动网络(SMA、中央后回和PCU)、默认模式网络(MPFC和PCU)和基底节的局部异常、半球间的相互作用缺陷与CD发病密切相关。另有研究发现,BONT-A治疗后初级和次级躯体感觉皮质之间的FC值升高,丘脑底核(STN)与壳核、感觉运动皮质、丘脑之间的FC值降低,丘脑和壳核对躯体感觉皮质的影响明显减轻,提示CD主要与基底神经节和感觉运动网络的连接性增强,以及关键区域(如壳核、丘脑和躯体感觉皮质)连接的反应性丧失有关[31]。因此,CD往往是一种神经网络障碍,尤其与皮质-纹状体-苍白球-丘脑-皮质环路有关,该环路由基底神经节以外的SMA和中央后回组成[46]。总之,皮质和皮质下感觉运动异常都可导致肌张力障碍症状,初级躯体感觉皮质和小脑均是减轻CD症状的干预靶点。
2.4 rs-fMRI与SD SD的特征是在发声时喉部肌肉不由自主地痉挛,但在情感声音表达(如欢笑和哭泣)时不会出现该症状[47]。有研究发现,与健康受试者相比,静息状态下SD患者左侧运动前/初级感觉运动与下顶叶皮质之间的FC值异常,且与SD的多基因风险相关,下顶叶皮质连通性下降与SD的发病年龄关系密切[5],这些脑区之间的FC值可能是SD诊断和风险预测的潜在指标。SD患者的感觉运动网络与初级听觉皮质(听觉网络)之间的FC值升高,且与颞顶交界处脑区之间的FC值降低,发音障碍与左侧大脑半球颞叶活动呈正相关[9]。除喉运动皮质、辅助运动区和小脑外,初级/联合颞区以上是发声网络的主要区域之一,引导体感/听觉反馈环路调制的语音处理[9]。此外,BONT-A治疗前后,SD患者的激活/连通性没有显著变化,颞叶皮质与触觉处理之间的连通性可能暗示了跨模态感觉传导之间的异常作用[9]。有研究发现,运动皮质(右侧中央前回)与听觉相关皮质(左侧颞中回和颞下回)、躯体感觉皮质(左侧中央后回)和右侧额叶之间,以及左侧下盖与右侧中央前回、中央后回之间的FC值升高[32]。基于上述研究结果,有研究采用机器学习算法试图表征SD的神经标志物。其中分类算法是识别单个特征或特征组合的有力工具,这些特征表征分离了两类或多类对象或主体。一项基于初级感觉运动区、运动前区和顶叶下区异常静息状态连接的多元分类算法线性分析发现,分类算法在鉴别SD和健康人时准确率高达71%,在区分不同(内收肌和外展肌)表型时准确率保持在71%[48]。因此,可使用神经影像的异质性来区分SD患者和健康人,这为开发特异性诊断疾病的生物标志物开辟了新的途径。
2.5rs-fMRI与WC WC是一种孤立的任务特异性局灶性手部肌张力障碍。目前研究发现,多巴胺功能异常与连接到运动前皮质的内侧纹状体区域有关,推测可能是WC的发病机制。既往研究显示,WC患者左侧初级感觉运动皮质、双侧丘脑和小脑的手部区域灰质体积减小[49],同时感觉运动皮质的γ-氨基丁酸(GABA)水平较健康受试者明显降低[2]。这些大脑区域主要负责写作和说话过程中感觉运动的控制,如初级躯体感觉皮质、额中回、颞上/下回、扣带回中/后回和枕叶皮质等[48]。与主要影响非自愿运动(如眨眼)表现出的感觉运动和认知/执行网络的变化相比,影响高度学习和熟练动作(如写作和说话)的变化更为明显[50]。Moore等[33]研究发现,与健康对照组相比,WC患者的左侧壳核后部与左侧小脑、左侧运动感觉皮质之间的FC增强,同时,左侧壳核前部与双侧辅助运动区、左侧运动皮质前区之间的FC亦增强。由此推测,运动感觉区和相关皮质纹状体环路的联系增加,提示纹状体可能参与了补偿过程。在一项f MRI研究中,与健康受试者相比,WC患者苍白球对运动皮质的抑制作用显著减弱,同时右侧小脑和左侧感觉运动皮质的GABA-A受体密度异常降低,导致皮质失去抑制性控制[34]。其中,左侧初级躯体感觉区与左壳核之间的FC增强,左侧背侧运动前皮质和左顶上叶的功能脱钩[35]。另一项研究显示,WC患者右侧小脑灰质体积减小,而且小脑网络和基底节的网络间正向FC减弱,小脑网络到运动前顶网络、背侧和腹侧感觉运动网络之间的FC值保持不变,并表现出不同的网络方向性依赖[36]。Neumann等[51]观察到WC患者苍白球-小脑偶合与疾病严重程度呈负相关,丘脑腹核群可直接与运动皮质相连,并通过红核直接调节脑干和脊髓的下行投射过程,提示小脑与丘脑腹核群的异常连接可影响姿势和运动。因此,WC可能与小脑-基底神经节功能失调有关,进一步深入研究可能对明确该病的发病机制具有重要意义。
3 总结与展望
rs-f MRI为研究局灶性肌张力障碍的病理生理机制提供了新的方法。越来越多的证据表明,由于共同的网络改变,不同的局灶性肌张力障碍疾病存在统一的病理生理机制,小脑是最常受到影响的区域之一。既往研究认为,大脑改变局限于基底神经节,而目前的研究结果表明这些损伤延伸到了小脑、感觉运动皮质及其他皮质下区域,形成一个功能失调的网络,其中受损的主要是纹状体-丘脑-皮质和小脑-丘脑-皮质通路。目前rs-fMRI已广泛应用于局灶性肌张力障碍的研究,但仍存在一定局限。首先,多为单中心小样本研究,且存在选择偏倚、发表偏倚的可能;其次,多为病例对照研究,未进行长期随访观察;最后,不同研究采用不同的分析方法,得出的结果难以进行相互比较。影像学研究可结合多模态脑影像及基因影像学技术,对不同类型的患者进行研究,这有助于明确疾病的发病机制及寻找干预靶点,从而在早期对易感人群进行识别和干预,且对局灶性肌张力障碍的预后具有重要指导意义。

