下肢动脉计算机断层成像血管造影的超低剂量成像分析
威晋,陈依林,王华,陈光亮,段青
近年来,随着我国人口老龄化及生活方式的改变,下肢动脉栓塞性疾病的发病率越来越高[1]。下肢动脉栓塞性疾病通常表现为间歇性跛行、下肢疼痛、皮温降低,同时常合并糖尿病、高血压病、高脂血症等。为了制定最佳治疗方案,必须进行完整的影像学评估。数字减影血管造影(digital subtraction angiography, DSA)具有高空间和时间分辨率的特点。尽管存在成本高、侵入性检查、仅有二维图像等局限性,DSA仍被认为是诊断下肢动脉栓塞病变的“金标准”[2]。计算机断层成像血管造影(computed tomography angiography, CTA)具有诊断准确率高及成本较低的优势,目前已发展成为间歇性跛行或严重肢体缺血患者影像学诊断及评估中替代DSA的方案,但大量的CTA造影剂使用有致肾损伤的风险,而且过多的电离辐射也可能致癌,限制了CTA的应用[3]。
目前,减少辐射暴露的方法包括降低管电压和调节管电流[4]。虽然电离辐射减少不可避免增加图像噪声,但可通过迭代重建方法来降低图像噪声[5]。已有许多下肢动脉扫描方案运用了多种方式的低剂量扫描[6-8]。本研究旨在评估采用低管电压、低管电流的扫描方法结合自适应迭代重建(adaptive statistical iterative reconstruction-V, ASiR-V)的超低剂量下肢动脉CTA扫描策略的应用价值。
1 对象与方法
1.1 对象 收集2022年1月—2022年6月在笔者医院住院治疗的下肢动脉狭窄患者80例,均行下肢动脉CTA扫描,其中男性61例,女性19例,年龄(66.8±13.1)岁(30~94岁)。纳入标准:年龄>18岁;体质量指数(body mass index, BMI)≤25 kg/m2;估计肾小球滤过率>60 mL/min;促甲状腺激素(thyroid stimulating hormone, TSH)正常。排除标准:碘对比剂过敏史;严重肝肾功能不全者;扫描区域有金属植入物。将患者分为2组:标准化低剂量扫描组(标准化组,n=40)和超低剂量扫描组(超低剂量组,n=40)。2 组患者的性别、年龄、身高等一般资料情况比较见表1。本研究经笔者医院伦理委员会批准(伦理号2022KJT029),患者均签署书面知情同意书。
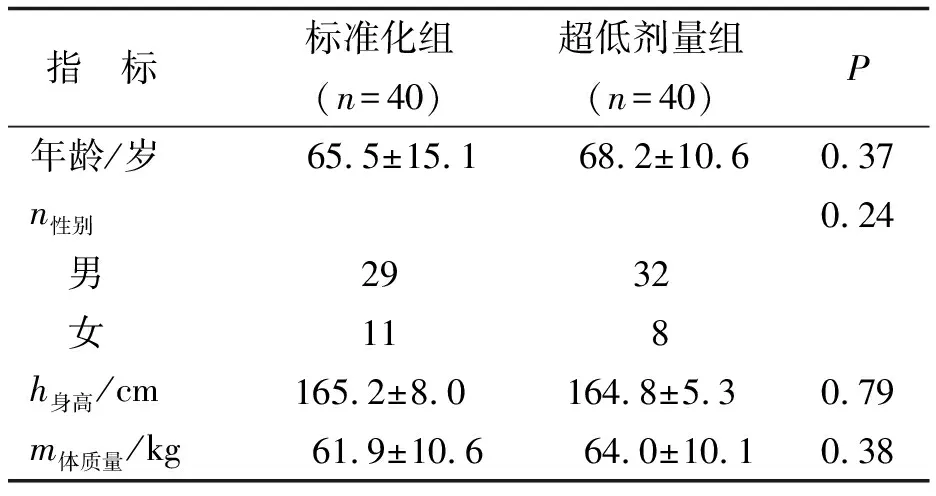
表1 标准化组和超低剂量组的一般情况比较
1.2 方法
1.2.1 CTA扫描参数 所有CTA 扫描均在GE 革命CT上(GE Revolution CT, GE Healthcare, Milwaukee, Wisconsin, USA)上进行,仰卧位、头先进。所有患者扫描前均右肘正中静脉埋置18 G留置针。标准化组采用100 kV的管电压,管电流为自动管电流调节模式(automatic tube current modulation, ATCM),使用滤波反投影(filtered back projection, FBP)模式进行重建;而超低剂量组管电压均为80 kV,使用固定管电流50 mA,采用50%权重的ASiR-V(ASiR-V 50%)进行图像重建。其余参数均相同,其中准直器宽度=0.6 mm,层厚=1.25 mm,重建间隔=1.0 mm,螺距=0.984,球管旋转时间=1 rot/s。对比剂注射方案:非离子碘化造影剂(碘迈伦,400 mg/I,中国博莱科公司),流速3.0 mL/s,总量70 mL,30 mL生理盐水以同样流速冲刷。采用care bolus扫描方案,即造影剂注射开始后10 s,在主动脉的肾动脉起源水平进行第1次参考扫描,并每秒重复1次,直至主动脉出现150 HU的增强,延时8 s后启动扫描,扫描范围从双肾动脉水平至足底。
1.2.2 客观图像质量及辐射剂量 在GE AW 4.7后处理工作站上,分别在腹主动脉与髂总动脉分叉、股总动脉与股深动脉分叉、胫腓干及踝关节水平胫前动脉或胫后动脉的血管中心区测量其CT值与标准差(standard deviation, SD)值,所绘制感兴趣区域(region of interest, ROI)为圆形。应选取血管中心处且接近管腔大小,同时应尽量避开管壁、软板块或钙化斑块等。当有血管完全闭塞时,则测量其邻近血管替代;同时测量同层面血管旁肌肉组织的CT值和SD值。ROI大小与同层面血管测量的ROI相似,但应不小于40 mm2。绘制ROI时应选取密度均匀区域,同时避开硬化伪影、血管等(图1)。所有ROI各测量3次,取其平均值。当有血管完全闭塞时,测其邻近血管代替。按下列公式计算图像的信号噪声比(signal-to-noise ratio, SNR)、对比噪声比(contrast-to-noise ratio, CNR)[9]:
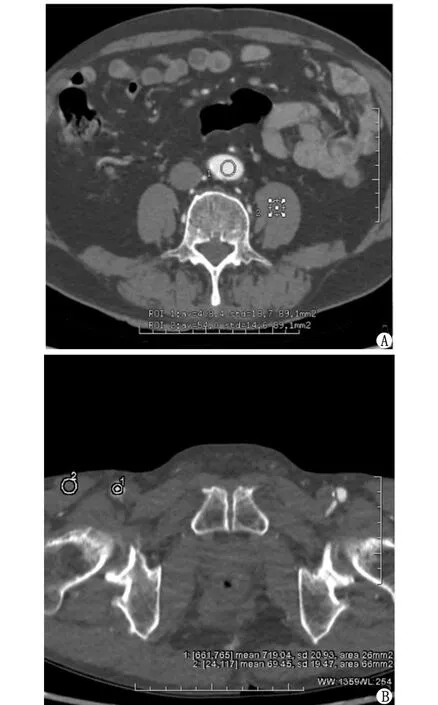
ROI:感兴趣区域。A:73岁男性患者,采用标准化低剂量扫描,血管ROI置于腹主动脉与髂总动脉分叉处,另一ROI置于同层面腰大肌。B:75岁男性患者,采用超低剂量扫描,血管ROI放置于股总动脉及股深动脉分叉水平,另一ROI置于血管旁肌肉。
SNR=血管平均CT值/血管SD值;
CNR=(血管平均CT值-肌肉平均CT值)/肌肉SD值
记录所有患者的容积CT剂量指数(computed tomography dose index volume, CTDIvol)和剂量长度乘积(dose length product, DLP)。
1.2.3 主观评分 为评估诊断性能,每位患者的下肢血管分为4个血管区域(腹主动脉-髂动脉、股-腘动脉、腘下动脉和足动脉)。由两位副主任医师级别血管影像专家根据横断位和曲面重建(curved planar reconstruction, CPR)图像独立评估CTA质量。基于图像空间分辨率、血管是否显示清晰、是否有伪影等方面采用5分法进行评估,意见不一致时取两位副主任医师级别血管影像专家进行评估的平均分(1分为图像质量差,无法观察血管;5分为图像质量良好,血管显示清晰。1、2分图像无法用于诊断,3~5分图像可用于诊断)。

2 结 果
2.1 客观图像质量 超低剂量组中各个血管测量区的CT值均高于标准化组(P<0.05),且拥有更高的CNR(P<0.05)和SNR(P<0.05,表2)。
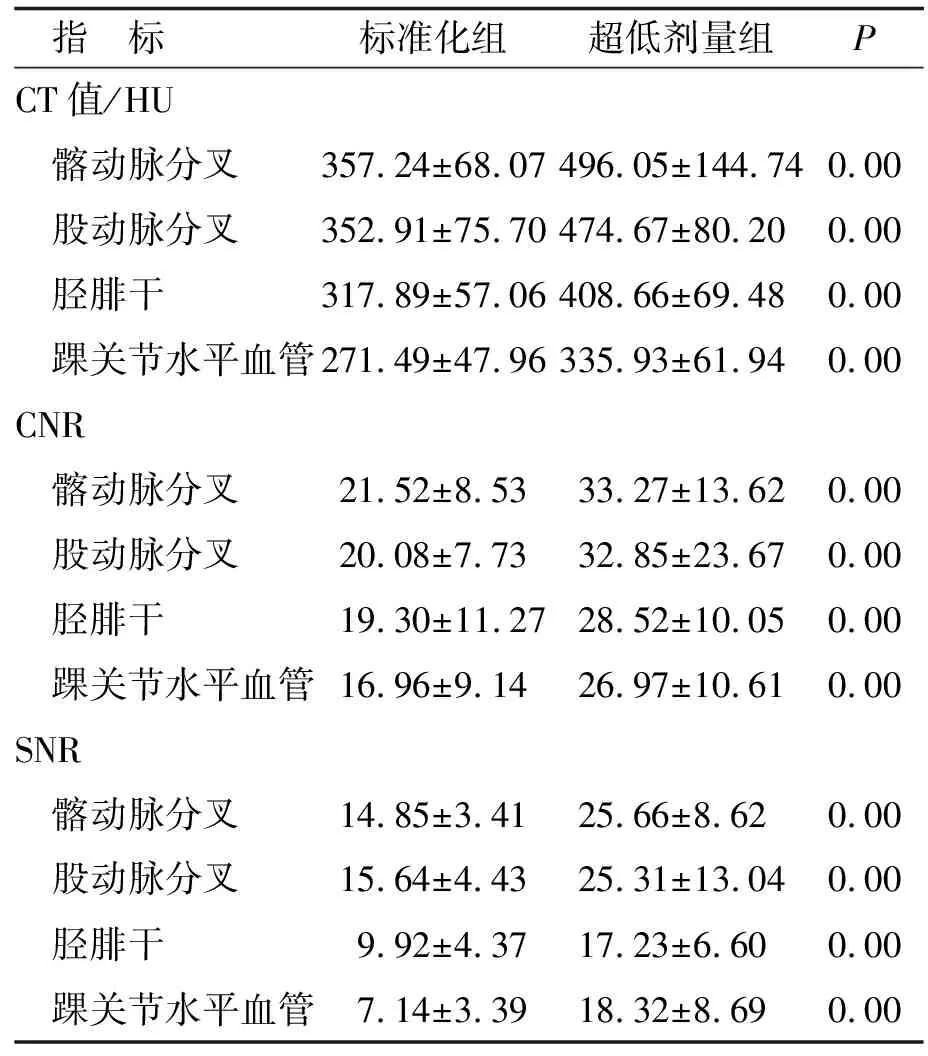
表2 标准化组和超低剂量组的CT值、CNR和SNR比较
2.2 辐射剂量 与标准化组比较,超低剂量组的CTDI明显下降,每次扫描从(5.63±1.28)mGy[(3.6~8.66)mGy]降至(1.09±0.00)mGy[(1.09~1.09)mGy](P<0.05),降低约81%;超低剂量组的DLP显著下降,从(714.94±189.23)mGy·cm[(385.27~1 249.26)mGy·cm]降至(131.05±5.50)mGy·cm[(116.22~141.84)mGy·cm](P<0.05)(图2)。
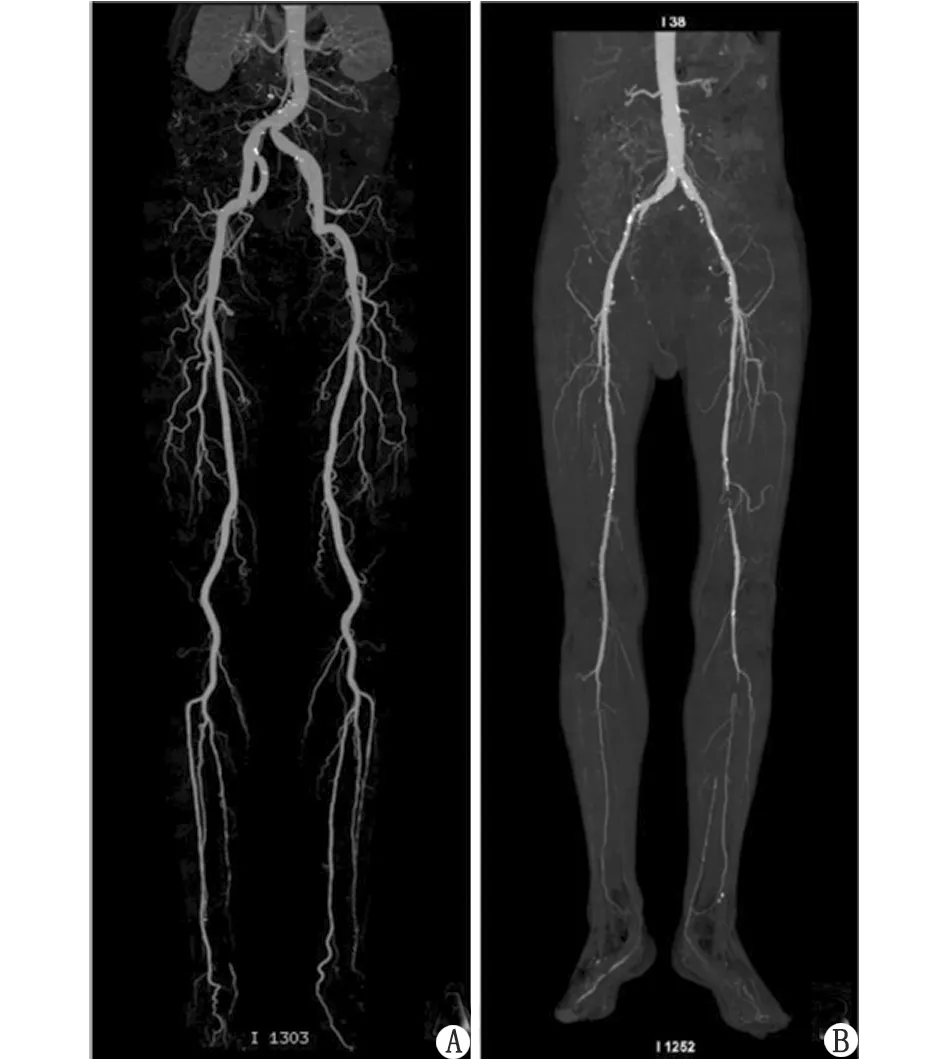
CTA:计算机断层成像血管造影;MIP:最大密度投影;FBP:滤波反投影;CTDIvol:容积计算机体层成像剂量指数;DLP:剂量长度乘积;ASiR-V 50%:50%权重的自适应迭代重建。A:73岁男性患者,采用标准化的低剂量扫描(100 kV,自动管电流)+FBP图像重建模式,CTDIvol及DLP分别为5.87 mGy和773.65 mGy·cm;B:75岁男性患者,采用超低剂量扫描方案(管电压80 kV,管电流50 mA)+ASiR-V 50%图像重建模式,CTDIvol及DLP分别为1.09 mGy和132.86 mGy·cm。
2.3 图像主观评分 超低剂量组的图像评分与标准化组比较,差别无统计学意义(P>0.05,表3)。
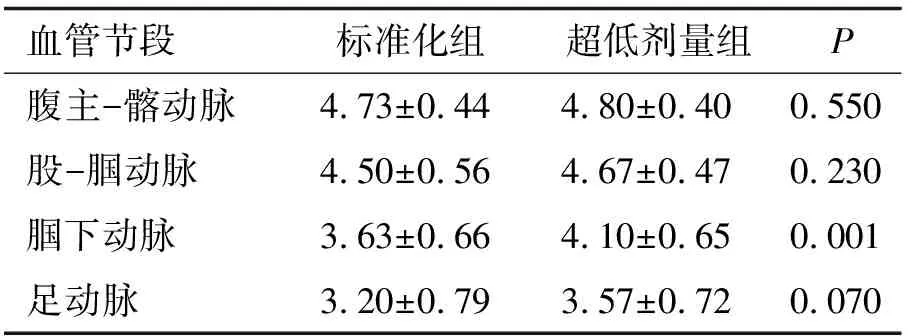
表3 标准化组与超低剂量组主观图像质量评分比较
3 讨 论
本研究发现,采用低管电压和低管电流并结合ASiR-V技术的下肢CTA扫描协议有助于显著减少辐射暴露,且能保持较高的图像质量。
已有研究[10-12]评估了在下肢动脉CTA扫描中,采用较低管电压对辐射剂量和图像质量的影响。其中一项前瞻性的随机性研究[10]比较了在64排螺旋CT中采用不同的管电压预设值时,患者接受的电离辐射和图像质量的差异,证实了将管电压从120 kV降至80 kV,可以显著降低CTDIvol(约61%),同时对于图像质量的影响较小。DUAN等[11]和PARK等[12]的研究均证实,使用70 kV的管电压可得到更低的平均CTDIvol,图像质量虽有下降但仍可用于诊断。由于 70 kV的超低管电压在患者中容易产生较大的射线硬化伪影,其临床应用一直存在较大争议。PARK等[13]证实,当使用70 kV的管电压进行扫描,尽管采用高级建模迭代重建(advanced modelled iterative reconstruction, ADMIRE)的算法进行图像重建,但下肢动脉CTA的主观图像评分仍较低,影响诊断信度。因此,本研究选择80 kV为超低剂量组的管电压,以确保图像质量满足诊断。
除了降低管电压外,降低管电流同样可以减少电离辐射。本研究中,笔者医院的标准低剂量扫描采用ATCM模式,此模式可以依据患者的软组织厚度等对每一扫描层面的管电流进行调节,降低实时管电流,以达到降低总辐射剂量的目的,在胸部和腹部扫描中已被广泛应用于低剂量扫描[14-15]。但实际应用中发现,使用ATCM模式时,由于骨盆皮下软组织较厚、骨组织较多,在骨盆水平测得的实际管电流较大。虽然ATCM模式降低了总扫描剂量,但盆腔重要器官如子宫、附件或前列腺等所接受的辐射剂量较大,无法达到真正的降低辐射的目的[16]。本研究超低剂量扫描组中,将管电流固定于50 mA的超低水平,使得盆腔范围的管电流相对较低且总辐射剂量不高。
由于在其他条件不变的情况下,管电压和管电流均降低时,图像的SNR和CNR会出现较大幅度下降而影响诊断信度。因此,为了保持图像质量,通常应用迭代重建模式替代传统的FBP重建模式[17]。ASiR-V技术是通过自适应技术对扫描的原始数据进行迭代计算,从而达到降低图像噪声的目的,适用于减少管电压和管电流后由于光子数的不足所致图像噪声显著升高的情况。研究[18]证实,在 80 kV管电压模式下,采用更低的管电流(140 mAs)和迭代重建模式后,图像质量与使用 120 kV、180 mAs及FBP重建的扫描策略相当,而辐射剂量显著降低。ASiR-V的重建权重可以从 0%~100% 间隔 10% 进行调节,权重值越高降噪能力越强(100%权重可以得到最强的降低噪声能力)。但在实际临床应用中,ASiR-V权重值过高则会使得图像均匀性增高,图像表现出“塑料样”伪影而无法满足诊断要求。研究[19-20]表明,采用 60%~70% 的ASiR-V权重时,反而会降低主观图像质量。另一项针对布-加综合征患者门静脉、肝静脉及下腔静脉的评估中[21],分析了迭代重建权重从0%~100%的图像质量,认为 50% 的重建权重可以得到最佳的图像质量用于诊断。此外,迭代重建的权重越高,重建所需时间也越长[22]。因此,本研究的超低剂量组运用了ASiR-V 50%的重建模式以提高低管电压和管电流条件下的图像质量,结果表明,与笔者医院下肢动脉CTA的标准低剂量扫描策略比较,这种低管电压、低管电流辅以ASiR-V 50% 的组合可以显著降低辐射剂量,其中CTDIvol约降低81%,DLP则从(714.94±189.23)mGy·cm降至(131.05±5.50)mGy·cm。而在图像质量方面,超低剂量组下肢血管的CT值均高于标准化低剂量组,且具有更高的SNR和CNR,即超低剂量组客观图像质量更佳;两者图像质量的主观评分除超低剂量组腘下动脉节段高于标准化组外,差别无统计学意义,可见此超低剂量扫描方案不仅可使患者接受的辐射剂量显著降低,还能够提供优质的图像。国内有研究[23]采用80 kV管电压结合ATCM技术行下肢动脉CTA成像,得到的CTDIvol高于本次超低剂量组80 kV结合50 mA固定管电流组合的CTDIvol[(2.25±0.45)mGyvs(1.09±0.00)mGy]。可见相同kV下,采用较低的固定管电流可能较ATCM技术得到更低的辐射剂量。本研究的管电流选择50 mA 而没有选择更低值,主要是考虑若过于降低管电流,在更低辐射剂量下,对于小腿和足部相对细小血管的显示可能欠佳,使得图像质量无法达到诊断需求,此种情况下患者需要重新接受扫描,于伦理不符。此外,低管电压的应用同时可以减少造影的碘负荷。本研究中的标准低剂量扫描和超低剂量扫描均采用3.0 mL/s的造影剂注射速率和70 mL 的注射总量,较国内外一些研究低[2,10]。
本研究的局限在于:(1)受试者数量较少。(2)未将诊断结果与DSA结果进行比较,也未对诊断准确率进行研究。(3)本研究未将高BMI患者(BMI>25 kg/m2)纳入研究。下一步研究希望募集更多受试者,扩大纳入标准,计划将25 kg/m2

