不同栖息环境的两种啮齿动物Vkorc1基因多态性
杨新根王艳龙邹波常文英侯玉赵悠悠王庭林*张健旭
(1山西农业大学植物保护学院,农业有害生物综合治理山西省重点实验室,太原 030031)(2山西大学生命科学学院,应用生物学研究所,太原 030006)(3定襄县林草事务中心,定襄 035400)(4太原海关技术中心,临汾 043000)(5中国科学院动物研究所,农业虫害鼠害综合治理研究国家重点实验室,北京 100101)(6中国科学院大学生物互作卓越创新中心,北京 100049)
作为世界上种类和数量最多的哺乳动物,啮齿类动物广泛分布于家居(家栖类)和自然环境(野栖类)中(郑智民等,2008)。一直以来,人类受到啮齿动物的危害涉及农、林、牧业和卫生保健等多个方面(Himsworthet al.,2013;Gryseelset al.,2015;Joneset al.,2017;王金枝等,2020),为此,人类不得不应用多种手段防控啮齿动物种群。1950年以来,抗凝血灭鼠剂(杀鼠灵、氯鼠灵、杀鼠醚等第一代抗凝血剂)因其方便、安全和对环境的影响较小等优点而被广泛使用(Bentley,1972;Sadler,2004;Ishizukaet al.,2008)。然而,第一代抗凝血灭鼠剂使用后不久啮齿类动物开始产生抗药性(Boyle,1960;Greaves,1967;Greaves and Rennison,1973)。“超级老鼠”的出现促进了第二代抗凝血灭鼠剂(溴敌隆、大隆、鼠敌克和氟鼠灵)的大量使用(Redfern and Gill,1980;Petterino and Paolo,2001;Gouloiset al.,2017),但很快在一些国家发现了对其产生抗药性的啮齿动物(Roweet al.,1981;Kohnet al.,2003;Huanget al.,2011)。我国于1980年后开始在家居和自然环境中广泛使用抗凝血灭鼠剂(董天义,2001),并在小家鼠(Mus musculus)、褐家鼠(Rattus norvegicus)和黄胸鼠(Rattus tanezumi)等家栖鼠种群中产生了抗药性(张世炎等,2002;易建荣等,2005),但很少有研究关注野栖类啮齿动物的抗药性(Wanget al.,2008;高志祥等,2008)。
抗凝血灭鼠剂的作用机理是特异性抑制维生素K环氧化物还原酶复合物(vitamin K epoxide reductase,VKOR),进而阻止维生素K循环(Helgeland,1977;Thijssenet al.,2004)。2004年,维生素K环氧化物还原酶复合物亚基1(vitamin K epoxide reductase complex,subunit 1,VKORC1)被鉴定和报道(Rostet al.,2004;Liet al.,2004),啮齿动物对抗凝血杀鼠剂抗药性的遗传机制也逐步被阐明:Vkorc1基因中核苷酸的突变可能会改变VKORC1蛋白的结构,从而降低抗凝血剂与VKOR的结合效率(Buckle,2013)。根据前人的报道,多种VKORC1氨基酸突变可导致啮齿动物产生抗药性,如 小 家 鼠 的Ala26Thr、Trp59Gly、Leu124Met、Leu128Ser和Tyr139Cys(Gouloiset al.,2017),褐家鼠 的Val29Leu、Val45Ala、Arg58Gly、Leu128Arg和Tyr139Cys(Rostet al.,2004),黄 胸 鼠 的Tyr139Cys(Huanget al.,2011)。这些研究无疑为我们开展啮齿动物抗性监测奠定了理论依据。
长尾仓鼠(Cricetulus longicaudatus)主要分布在中国东部和中部,蒙古国西部和中部,俄罗斯图瓦、贝加尔湖地区和布里亚特南部的草原和半沙漠地区(Poplavskayaet al.,2018)。长尾仓鼠是我国重要的优势野栖鼠种,在局部区域其占比达70%以上,可使农作物减产10%~15%(杨新根等,2019a)。黄胸鼠主要分布在东亚和东南亚地区,是一种常见的家栖鼠,也会在秋季迁移至田间危害农作物(Guoet al.,2019)。近年来,黄胸鼠随着物流网络的日益发达已侵入南非和美国等地,严重威胁着当地的生物安全和物种多样性(Aplinet al.,2011;Bastoset al.,2011;Conroyet al.,2013)。一直以来,黄胸鼠被认为是只分布在我国南方省份的重要害鼠,直到20世纪90年代后,该物种入侵山西、陕西、河北等地并逐渐成为家栖鼠类的优势种(张美文等,2000;吴海霞等,2017;杨新根等,2019b)。
鉴于抗凝血灭鼠剂在我国部分地区的大量使用,为了掌握鼠类抗药性的本底资料,为开发啮齿动物抗药性监测的分子标记提供基础依据,本研究以山西省为研究区域(北纬34°34′~40°44′,东经110°14′~114°33′),在不同县(市、区)捕获黄胸鼠和长尾仓鼠样本,对其Vkorc1基因的编码区进行扩增和测序,分析其多态性并鉴定可能与抗药性有关的变异位点,以期为掌握啮齿动物Vkorc1基因在家居和自然环境中的适应性进化提供理论依据,并进一步指导啮齿动物群落的抗性监测和防控工作。
1 研究方法
1.1 样本采集与处理
本研究于2016—2018年5—11月,从山西省农田和养殖场采集样本,所有程序均遵循《中华人民共和国科学技术部实验动物管理条例》(2017年修订)。
从山西省13个县(市、区)的农田捕获啮齿动物,分别为晋城市陵川县(LIC),临汾市隰县(XIX)和永和县(YOH),长治市沁县(QNX),晋中市左权县(ZOQ),吕梁市中阳县(ZHY)和离石区(LIS),太原市娄烦县(LOF)和阳曲县(YAQ),阳泉市盂县(YUX),忻州市静乐县(JNL)和五台县(WUT),大同市浑源县(HNY)(表1,图1A)。以花生、核桃和苹果为诱饵,傍晚同时放置大号捕鼠夹和捕鼠笼,次日收回。夹(笼)距为5 m,行距大于20 m,捕鼠夹(笼)数量每日不少于300个,共计5 805个。
从山西省14个县(市、区)的养殖场(养猪场和养鸡场)捕获啮齿动物,分别为运城市永济市(YOJ)、LIC、临汾市洪洞县(HOT)、XIX、QNX、ZOQ、晋中市祁县(QIX)、LIS、太原市小店区(XID)、LOF、YUX、WUT、朔 州 市 朔 城 区(SOC)、HNY(表1,图1B)。以花生、核桃和苹果为诱饵,同时放置大号捕鼠夹和捕鼠笼,次日收回。捕鼠夹(笼)至少放置2 d,每天检查并重新更换饵料。夹(笼)距为5 m,行距和捕鼠夹(笼)数量根据采样点具体情况确定,共计布夹(笼)3 860个。

图1 长尾仓鼠和黄胸鼠采集地及样本占比(山西省).A:长尾仓鼠;B:黄胸鼠.图中采集地使用缩写,全称见表1.“×”表示未捕获到黄胸鼠的采集地;饼状图表示样本在啮齿动物群落中的占比,红色表示长尾仓鼠,蓝色表示黄胸鼠,白色表示其他啮齿动物Fig.1 The sampling sites and proportions of samples(Shanxi Province).A:Cricetulus longicaudatus;B:Ruttus tanezumi.Abbreviations are used for collection sites,see table 1 for collection sites.‘×’represent the sites that R.tanezumi was not captured;pie charts represent the proportions of samples,red for C.longicaudatus,blue for R.tanezumi,and white for other species

表1 样本采集地概况Table 1 The collecting details of sample sites
计算每个县(市、区)不同采样生境(农田或养殖场)的捕获率:农田或养殖场捕获率(%)=捕获农田或养殖场啮齿动物总个体数/农田或养殖场布夹(笼)数×100;计算长尾仓鼠或黄胸鼠在啮齿动物群落中的占比:长尾仓鼠或黄胸鼠占比(%)=捕获长尾仓鼠或黄胸鼠数/捕获农田或养殖场啮齿动物总个体数。
剪取每只长尾仓鼠和黄胸鼠个体的尾尖并放置于无水乙醇中,-80℃冰箱储存,以备提取基因组DNA。
1.2 DNA提取
每个样本基因组DNA的提取根据血液/细胞/组织基因组DNA提取试剂盒(天根,DP304)的使用说明书进行。DNA提取物在TE缓冲液中洗脱并储存在-20℃环境中。
1.3 物种鉴别
首先应用形态学方法进行物种的鉴别(郑智民等,2008)。在此基础上,采用基于细胞色素c氧化酶亚基I基因(cytochrome c oxidase subunit I,COI)的DNA条形码技术以避免错误鉴别(Hebertet al.,2003):应用通用引物BatL5310(5′-CCTACTCRGCCATTTTACCTATG-3′)和R6036R(5′-ACTTCTGGGTGTCCAAAGAATCA-3′)从每个样本的基因组DNA中扩增COI基因片段,PCR(BioR Technology,G1000)反应体系包括1.5 μL基因组DNA模板(30~50 ng),12.5 μL 2×Taq PCR MasterMix(天根,KT201),9 μL双蒸水和上下游引物各1 μL。扩增条件如下:95℃预变性5 min;95℃变性45 s,54℃退 火1 min,72℃延 伸1 min,循 环35次;72℃延伸10 min。扩增产物经1%琼脂糖凝胶电泳鉴定后送至上海派森诺生物技术有限公司测序。
应用MEGA X软件包中的Muscle软件,对测序所得COI序列与已发表长尾仓鼠COI序列(GenBank编号KC709682.1)和黄胸鼠COI序列(GenBank编号NC_011638.1)进行比对(Edgar,2004),COI序列差异度小于2%为同一物种(Hebertet al.,2003)。
1.4 Vkorc1基因扩增与测序
鉴于Vkorc1基因共含有3个外显子,本研究根据GenBank中已发表的灰仓鼠(Cricetulus griseus)(长尾仓鼠的近缘种)和黄胸鼠Vkorc1基因序列(GenBank编号分别为NC_048596.1和FJ868832.1),分别设计了两组引物(表2)。所有Vkorc1基因的扩增均在PCR仪(BioR Technology,G1000)中进行,反应体系含有1.5 μL基因组DNA模板(30~50 ng),12.5 μL 2×Taq PCR MasterMix(天根,KT201),9 μL双蒸水和上下游引物各1 μL。PCR产物通过1%琼脂糖凝胶电泳鉴定后送至生工生物工程(上海)股份有限公司测序。
长尾仓鼠第一组引物C.l.-Vk1/F/e1-2和C.l.-Vk1/R/e1-2用于将Vkorc1基因从核苷酸(-)113[Vkorc1基因外显子1中的第一个核苷酸编号为(+)1,黄胸鼠同]扩增至核苷酸(+)1231(包含外显子1和2),第二组引物C.l.-Vk1/F/e3和C.l.-Vk1/R/e3用于将Vkorc1基因从核苷酸(+)1810扩增至核苷酸(+)2316(包含外显子3)(表2)。PCR反应条件如下:94℃预变性5 min;94℃变性30 s,58℃(第一组引物)或60℃(第二组引物)退火30 s,72℃延伸100 s,35次循环;72℃延伸5 min。
对于黄胸鼠,第一组引物R.t.-Vk1/F/e1-2和R.t.-Vk1/R/e1-2用于将Vkorc1基因从核苷酸(-)167扩增至核苷酸(+)1278(包含外显子1和2),第二组引物R.t.-Vk1/F/e3和R.t.-Vk1/R/e3用于将Vkorc1基因从核苷酸(+)1789扩增至核苷酸(+)2175(包含外显子3)(表2)。PCR反应条件如下:94℃预变性5 min;94℃变性30 s,58℃(第一组引物)或60℃(第二组引物)退火30 s,72℃延伸100 s,35次循环;72℃延伸5 min。

表2 长尾仓鼠和黄胸鼠Vkorc1基因编码区的特异性引物序列Table 2 Specific primer sequences for the coding regions of Vkorc1 of Cricetulus longicaudatus and Ruttus tanezumi
1.5 Vkorc1基因变异位点检测
应用MEGA X软件包中的Muscle软件(Edgar,2004),分 别 以 灰 仓 鼠(GenBank编 号NC_048596.1)和黄胸鼠(GenBank编号FJ868832.1)Vkorc1基因序列为参考,比对扩增成功的长尾仓鼠和黄胸鼠Vkorc1基因外显子序列,手动检测并记录Vkorc1基因编码区的变异位点,计算携带不同变异位点的个体在种群中的占比。
1.6 统计学分析
应用SPSS 20.0对不同错义突变位点的分布频数进行χ2检验,比较错义突变位点在不同县(市、区)的差异,P<0.05为差异有统计学意义。
2 结果
2.1 捕获率及样本占比
本研究共在山西省的18个县(市、区)捕获啮齿动物613只(表3)。在农田和果园中,共捕获511只啮齿动物(未捕获到黄胸鼠),LIS捕获率最低(6.85%),XIX最高(14.77%);在养殖场共捕获102只家栖类啮齿动物,HNY捕获率最低(0.37%),LIC最高(7.22%)(表3)。
经形态学标准和DNA条形码技术进行物种鉴别后,长尾仓鼠在采样的13个县(市、区)的农田中均有捕获,共捕获119只个体,占野栖类啮齿动物的23.29%,表明该物种在农田中的优势鼠种地位(表3,图1A)。在采样的山西省14个县(市、区)的养殖场中,黄胸鼠呈条带状分布,共在8个县(市、区)有所捕获,分别为YOJ、LIC、HOT、QNX、QIX、LIS、XID和WUT,而 在XIX、ZOQ、LOF、YUX、SOC和HNY未捕获到黄胸鼠;共捕获黄胸鼠个体70只,占家栖类啮齿动物的68.63%,表明该物种在分布区域的优势种地位(表3,图1B)。

表3 啮齿动物捕获率及样本占比Table 3 The sampling sites and the trapping details of rodents
2.2 Vkorc1基因变异位点
本研究共获得105只长尾仓鼠个体Vkorc1基因3个外显子的全序列,在外显子中共检测到11个核苷酸变异位点(表4)。其中,沉默突变位点有6个,分别是外显子1中的G78A(C)(Ala26Ala)、G135A(Val45Val)和C159A(Arg53Arg),外显子2中的C222T(Ser74Ser),外显子3中的C342T(Phe114 Phe)和C438T(His146His);有5个错义突变位点,分别为外显子1中的C8T(Thr3Ile)和G106A(Asp36Asn),外 显 子2中 的A203G(His68Arg)和A203T(His68Leu),外显子3中的G346A(Gly116 Ser)(表4)。在沉默突变位点中,外显子3中C438T(His146His)的变异率最高,为67.62%,其次为C342T(Phe114Phe)的28.57%,外显 子1中 的G135A(Val45Val)变异率最低,为8.57%(表4)。在错义突变位点中,检测到10只长尾仓鼠个体有错义突变A203G(His68Arg),突变率为9.52%;9只个体(8.57%)检测到C8T(Thr3Ile);3只个体(2.86%)有G106A(Asp36Asn);2只个体(1.90%)有A203T(His68Leu);1只个体有G346A(Gly116Ser)(表4)。
获得70只黄胸鼠个体Vkorc1基因3个外显子的全系列,在外显子中共检测到7个核苷酸变异位点(表4)。其中6个为沉默突变位点,分别为外显子1中 的A36G(Arg12Arg)和G123A(Ala41Ala),外 显 子2中 的T204C(His68His)和A246T(Ile82Ile),外 显 子3中 的A321C(Ile107Ile)和T411C(Thr137Thr)(表4);错义突变位点有1个,为外显子3中的A416G导致氨基酸变异Tyr139Cys(表4)。在所有沉默突变位点中,变异率最高的为外 显 子3中 的A321C(Ile107Ile)和T411C(Thr137Thr),变异率为18.57%;变异率最低的为外显子2中的A246T(Ile82Ile),仅检测到3只个体(4.29%)(表4)。共在8只个体中检测到错义突变位点A416G(Tyr139Cys),变异率为11.43%(表4)。

表4 长尾仓鼠和黄胸鼠Vkorc1编码区变异位点Table 4 The mutation positions in coding regions of Vkorc1 gene of Cricetulus longicaudatus and Ruttus tanezumi
分析不同错义突变位点在各县(市、区)分布频数的差异性。在长尾仓鼠种群中,错义突变位点C8T(Thr3Ile)在不同县(市、区)的分布频数有显著差异(P=0.003),其中,该突变在LIC和HNY的分布频数显著高于其他县(市、区);位点G106A(Asp36Asn)的分布频数无显著差异(P=0.349);位点A203G(His68Arg)的分布频数具统计学意义(P<0.001),其在LIC的分布频数显著高于其他县(市、区);位点A203T(His68Leu)在不同县(市、区)的分布频数有显著差异(P=0.015),其在XIX的分布频数显著高于其他县(市、区);位点G346A(Gly116Ser)的分布频数在不同县(市、区)无显著差异(P=0.530)。在黄胸鼠种群中,错义突变位点A416G(Tyr139Cys)的分布频数在不同县(市、区)有显著差异(P=0.019),其中,该位点在XID和QIX的分布频数无显著差异(P=0.528),在XID的分布频数显著高于除QIX外的其他县(市、区)。
2.3 携带变异位点样本的分布
分析携带Vkorc1基因变异位点的长尾仓鼠个体在各采样地的分布,所有13个采样地的个体均含有Vkorc1基因变异位点,其中,LIC、XIX、ZOQ、ZHY、LOF、YAQ、YUX和HNY的样本含有错义突变个体,YOH、QNX、LIS、JNL和WUT的样本只含有沉默突变位点,仅检测到来自YOH、QNX、YUX、LOF和JNL的10个非变异样本(图2)。在含有错义突变个体的采样地中,LIC的样本错义突变率最高,为71.43%,其次为XIX样本的37.50%(图2)。
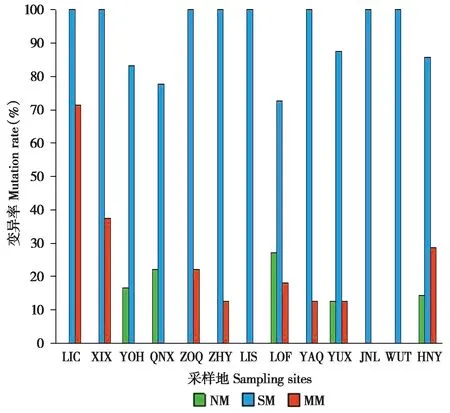
图2 长尾仓鼠不同类型Vkorc1基因变异个体在各采样地的变异率.NM:无变异位点;SM:含沉默突变位点;MM:含错义突变位点Fig.2 The mutation rate of Vkorc1 mutatants about Cricetulus longicaudatus in each sampling sites.NM:Non-mutatants;SM:Silent mutatants;MM:Missense mutatants
变异率最高的沉默突变C438T(His146His)共出现在71个样本中,且在所有13个采样地均有分布。共在17个样本中检测到错义突变,其中,LIC的1个 样 本 同 时 含 有Thr3Ile、Asp36Asn和His68Arg 3种杂合错义突变位点,LIC的2个样本、HNY的2个 样 本、ZOQ的1个样本和ZHY的1个样本同时含有Thr3Ile和His68Arg 2种错义突变位点。Thr3Ile的变异体来自6个采样地(LIC、XIX、ZOQ、ZHY、YAQ和HNY),Asp36Asn的3个突变体分别来自LIC、ZOQ和LOF,His68Arg的变异体来自5个采样地(LIC、XIX、ZOQ、ZHY和HNY),His68Leu仅 在XIX检 测 到,Gly116Ser仅出现在YUX。
黄胸鼠样本中,除YOJ、LIC和QNX外,在HOT、QIX、LIS、XID和WUT中共检测到22个样本存在Vkorc1基因变异位点,占31.43%。在XID的样本中,检测到所有的7个变异位点,在QIX共检测到5个,在HOT、LIS和WUT中检测到4个。对于错义突变Tyr139Cys,8个变异体中有7个来自XID,1个来自QIX,其变异率分别为35.00%和16.67%(图3)。

图3 黄胸鼠不同类型Vkorc1基因变异个体在各采样地的变异率.NM:无变异位点;SM:含沉默突变位点;MM:含错义突变位点Fig.3 The mutation rate of Vkorc1 mutatants about Ruttus tanezumi in each sampling sites.NM:Non-mutatants;SM:Silent mutatants;MM:Missense mutatants
3 讨论
在山西省,因长尾仓鼠在农田的优势种地位(本研究13个采样点均有捕获,相对占比23.29%),成为了抗凝血灭鼠剂在农田化学防治工作中的重要靶标物种(杨新根等,2019a)。20世纪90年代之前,黄胸鼠仅分布于长江以南诸省,与农业和公共卫生均密切相关(张美文等,2004)。近年来,黄胸鼠的持续北扩可能与气候变暖和物流网络的高速发展有密切关系,使我们不得不担心其对公共卫生和生物安全的影响(Plyusninaet al.,2009;Blasdellet al.,2011;Huanget al.,2013)。从采样结果看,黄胸鼠现阶段呈条带状分布于五台县以南的家居环境中,这可能与黄胸鼠借助交通工具的扩散方式有关,加之需逐步适应北方的低温环境,因此在山西省其很少对农作物造成危害。另外,在山西省黄胸鼠已占家栖类啮齿动物的68.63%,在其分布区域处于明显优势种地位,已对当地原家栖类啮齿动物(褐家鼠和小家鼠)造成了较大的威胁。在我国,抗凝血灭鼠剂用于室内和田间鼠害防治已有近40年的历史(董天义,2001),然而,抗药性啮齿动物的出现严重阻碍了该类灭鼠剂的有效性。抗凝血灭鼠剂的大量使用对生态系统也有很大影响。有研究表明,抗凝血灭鼠剂对非靶标动物具有较高的暴露风险,甚至会导致抗药性(Christensenet al.,2012;Geduhnet al.,2016;Stöcket al.,2019)。
Vkorc1基因的核苷酸变异改变了啮齿动物对抗凝血灭鼠剂的反应,因此,其变异位点常被用作检测和监测抗药性啮齿动物的分子标记(Díazet al.,2010)。研究表明,在农田中较低的选择压力、较低的空间药剂浓度及其栖息环境的易变性,使啮齿类动物的抗药性通常很难在田间检测到(Buckle and Smith,1994),但毋庸置疑,抗凝血灭鼠剂的长期使用使野外啮齿类动物对其产生抗性(Veinet al.,2011)。本研究在长尾仓鼠Vkorc1基因编码区共检测到11种不同的变异位点,包括5个错义突变位点和6个沉默突变位点。研究证实错义突变位点His68Asn会导致黑家鼠(Rattus rattus)的Ki催化活性降低(Marquezet al.,2019),本文在长尾仓鼠Vkorc1基因检测到的5种错义突变位点Thr3Ile、Asp36Asn、His68Arg、His68Leu和Gly116Ser是否与抗药性有关,还需从酶动力学、蛋白结构与功能等生化领域深入研究和阐明,以评估其编码的VKORC1酶对抗凝血灭鼠剂的敏感性。但不可否认,高频率用药的县(市、区)常具有Vkorc1基因的高突变率:在LIC和XIX(两县曾持续多年应用抗凝血灭鼠剂对农田害鼠进行高频率防控),错义突变位点Thr3Ile(LIC)、His68Arg(LIC)和His68Leu(XIX)的分布频率显著高于其他县(市、区)。
错义突变A416G(Tyr139Cys)是检测抗药性的重要分子标记之一,在对杀鼠灵和溴敌隆产生抗性的小家鼠、黄胸鼠、黑家鼠和褐家鼠中已有报道(Pelzet al.,2005;Huanget al.,2011;Gouloiset al.,2017)。139位点上的氨基酸突变被认为是疏水性Thr-Tyr-Ala(138-139-140)序列中结合抗凝血灭鼠剂的关键位置(Rostet al.,2005)。本研究在黄胸鼠种群中检测到的7个核苷酸变异位点,包括6个沉默突变位点和1个Tyr139Cys错义突变位点。根据检测结果,8只出现了A416G(Tyr139Cys)变异位点的黄胸鼠已对抗凝血灭鼠剂产生了抗药性,其中,QIX的6只黄胸鼠样本中的1只存在A416G(Tyr139Cys)变异位点,因样本量较小,尚无法确定QIX是否存在黄胸鼠的抗性种群;XID种群中7只个体存在A416G(Tyr139Cys)变异位点,占比达35.00%,说明在XID已经产生了黄胸鼠抗性种群,需加强对此种群的监测(董天义,2001)。
尽管沉默突变不会影响VKORC1蛋白酶的结构及其性质,也不影响啮齿动物的抗药性,但目前尚无法确定这些沉默突变是否会影响其翻译效率,以及是否与药物选择下的基因进化有关(Andruet al.,2013)。在本研究检测到的沉默突变中,长尾仓鼠变异率最高的为C438T(His146His)(外显子3),占67.62%,黄胸鼠最常见变异位点为A321C(Ile107Ile)和T411C(Thr137Thr)(外显子3),变异率为18.57%(表4)。这些沉默突变位点是否与大量使用抗凝血灭鼠剂有关,尚待在未来的研究中进行验证。
自然界中一些啮齿动物具有天然抗性,但更多的啮齿动物是后天在抗凝血类灭鼠剂的选择胁迫下产生的适应性抗性。人类虽然在啮齿动物Vkorc1基因多态性研究方面取得了一些成果,但相对于庞大的啮齿动物群落而言,仍需要广大科研工作者的持续关注和研究。
综上,本研究通过分析长尾仓鼠和黄胸鼠种群Vkorc1基因的多态性,明确了山西省长尾仓鼠种群中存在5种错义突变,这些错义突变是否与长尾仓鼠的抗药性有关,需进一步地深入研究和阐明;黄胸鼠中存在与其抗药性密切相关的A416G(Tyr139Cys)错义突变,且已在太原市小店区形成抗性种群,需加强对此种群的监测;鉴于沉默突变在两物种中的高变异率,其是否与药物选择下的基因进化有关,尚待在未来的研究中进行验证。本研究可以为开发啮齿动物抗药性监测的分子标记提供基础资料,进一步为啮齿动物的监测预警和科学制定区域性综合防控措施提供理论依据。

