基于网络药理学和分子对接研究丹参治疗浆细胞性乳腺炎的作用机制
潘伍亮,张姜宇,许春燕,曾熠,潘宗宇,游元元
(成都医学院 药学院,四川成都 610500)
浆细胞性乳腺炎(plasma cell mastitis,PCM)亦称乳腺导管扩张症,是以导管扩张、导管周围炎症及浆细胞浸润为基础的一种乳腺慢性非细菌性炎症,临床表现为乳头溢液,乳晕下肿块、乳房局部疼痛不适,化脓溃破后易反复发作形成瘘管, 经久难愈[1-2]。目前西医治疗以药物和手术为主,但药物治疗效果不尽如人意,而手术切除则不仅会影响乳房外观,还有较高的复发率[3-4]。中医将PCM归于乳痈的范畴之内,认为该病为肝气郁结、血瘀凝聚所致[5],治疗手段有以中药复方为主的内治法,也有包括引流法、垫棉法、箍围法等的外治法[6]。
在PCM的内治法中丹参使用频率较高[7]。国家级名中医周玉朱教授的经验方——丹参化瘀汤对此病有良好的治疗效果[8],消乳散结汤、蒲公英柴胡汤、柴芩消痈汤等临床治疗PCM的方剂中亦含有丹参。五代时期典籍《日华子本草》记载丹参具排脓止痛、生肌长肉之功效,后世本草对该功效多有记载;宋代刘明之在《图经本草药性总论》中记载了丹参具有排脓止痛、治恶疮疥藓的功效;明代李中梓在《医案必读》《颐生微论》《本草通玄》等多部著作中均强调了丹参散结的作用;《本草纲目》丹参项下则记载了以丹参为君药治疗妇人乳癖的方剂。
丹参所含化合物甚多[9],但治疗PCM的物质基础并不明确。目前对于丹参的研究多集中在心脑血管疾病的治疗或预防方面,对PCM 的治疗机制研究甚少。基于此,本研究采用网络药理学和分子对接分析丹参中有效成分对PCM的作用机制,以期为丹参治疗PCM的临床应用提供依据。
1 材料和方法
1.1 获取丹参的药物活性成分及其潜在作用靶点
以“丹参”为关键词,在中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform ,TCMSP)(https://tcmsp-e.com/)中搜寻丹参的有效化学成分[10-11],根据TCMSP数据库得到的筛选结果,设置筛选条件药物口服生物利用度(oral relative bioavailability,OB)≥30%,设置类药性(drug-likeness,DL)≥0.18[12-15]。在TCMSP数据库中找到并下载药物活性成分潜在靶点。利用UniProt数据库( https://www.uniprot.org/)对查询到的药物活性成分靶点进行靶点蛋白和基因信息校正,得到丹参有效成分的预测靶点。
1.2 构建中药-成分-靶点网络
将1.1筛选得到的丹参的所有有效活性化合物及其对应的靶点导入Cytoscape3.7.2软件中,构建得到中药-成分-靶点网络,确定合适的分析条件,分析得到丹参的主要活性化合物及主要作用靶点。
1.3 筛选PCM的疾病靶点并构建药物-成分-靶点-疾病网络
利用GeneCard数据库(https://www.genecards.org/)以及DisGeNET数据库( https://www.disgenet.org/),搜集PCM的相关靶点基因,对GeneCard数据库取 Score值大于中位数的靶点作为PCM的潜在靶点[16],对DisGeNET数据库设置筛选条件为相关系数(Relevance score)≥1,限定研究物种为人类,对两数据库筛选出的疾病靶点进行整合去重,并剔除潜在致病靶点中在人体乳腺细胞内不表达的基因靶点,得到PCM的高关联性靶点。利用UniProt数据库将查询到的疾病靶点转换为UniProt ID,通过BioinfoGP数据库(https://bioinfogp.cnb.csic.es/tools.html)的在线工具Venny 2.1软件对丹参有效成分靶点与PCM的相关靶点基因取交集,得到丹参治疗PCM关键靶点[17]。并使用1.2得到的中药-成分-靶点网络与PCM的高关联性靶点相映射,利用Cytoscape3.7.2软件将结果可视化,构建药物-成分-靶点-疾病网络。
1.4 交集治疗靶点的蛋白质-蛋白质相互作用网络
蛋白质-蛋白质相互作用网络(protein-protein interaction,PPI)是指从生物体内各种作用角度研究蛋白质之间的相互作用关系。将潜在治疗靶点导入STRING数据库(https://string-db.org/),选择中置信度(minimum required interaction score=0.150)选项,构建交集治疗靶点的PPI网络,导出数据于Cytoscapoe3.7.2软件中分析。了解潜在治疗靶点的互作信息,以degree值确定其中相对重要的靶点。
1.5 靶点的基因本体功能富集分析
将筛选得到的潜在作用靶点导入DAVID数据库v6.8(https://david.ncifcrf.gov/home.jsp),以p≤0.05为筛选条件,选定研究条件限定为人类,进行基因本体( gene ontology, GO)生物过程、细胞组成、分子功能富集,并分析数据得到GO功能富集图。
1.6 靶点的KEGG通路富集分析
利用DAVID数据库v6.8、Metascape数据库(https://metascape.org/gp/index.htm)和KEGG API数据库(https://www.kegg.jp/kegg/rest/)进行京都基因与基因组百科全书 ( Kyoto encyclopedia of genes and genomes,KEGG)信号通路富集,探究丹参作用于PCM可能的生物功能和信号通路。对于每个给定的基因列表,通路和过程富集分析使用以下本体来源进行:KEGG Pathway、Canonical Pathways、Reactome Gene Sets、CORUM、DisGeNET、PaGenBase、Transcription factor target、TRRUST、PANTHER Access和WikiPathways分析。基因组中的所有基因都被用作富集背景,利用KEGG API数据库对所有潜在基因组的表达通路进行筛选。根据P(P< 0.01)[18]、最小计数为3 且富集因子> 1.5(富集因子是观察到的计数与偶然预期的计数之间的比率)收集靶点基因,并根据其成员相似性将其分组到集群中。使用Cytoscape3.7.2对数据进行可视化网络分析[19],将其中每个节点代表一个作用靶点基因,以P大小着色,将Cytoscape3.7.2得到的视图网络与Metascape数据库得到的基因列表分析报告结果进行对比,得到PCM可能的生物功能和信号通路。
1.7 分子对接
为进一步确认潜在疾病治疗靶点与丹参有效成分的作用关系,选择潜在作用靶点互作程度排名前三的编码蛋白,在Protein Data Banks(PDB数据库)(https://www.rcsb.org/)上查找其作用三维结构,保留为PDB格式,使用autodock4.0软件(基于Python语言-使用Python3.7软件)与丹参主要活性化合物进行分子对接。以对接成功的蛋白和分子的结合自由能作为判断方式,若结合自由能最强,则两者亲和力越大,越有可能实现分子与蛋白相互作用。
2 结果
2.1 丹参主要活性成分和相关靶点
通过TCMSP数据库检索共得到丹参活性化合物丹参65种,其中可结合靶点的有效成分共计59种,部分丹参有效活性成分见表1(全表见OSID科学数据与内容附表1)。同时通过TCMSP数据库检索得到丹参潜在作用靶点132个。

表1 部分丹参活性成分
2.2 中药-成分-靶点网络的构建
基于Cytoscape3.7.2软件分析结果,得到丹参的中药-成分-靶点网络(图见OSID科学数据与内容附图2-A), 网络共计191个节点,其中活性成分59个,药物靶点132个,含有961条边。以度值(degree)(可体现网络中交互能力大小)作为判断依据。可得木樨草素的度值最大为54,其次依次为丹参酮ⅡA、鼠尾草酚酮、二氢丹参内脂、丹参酮,其度值分别为40、38、36、34。说明这5种药物成分为丹参中作用靶点较多的重要活性成分。
2.3 筛选PCM潜在致病靶点构建药物-成分-靶点-疾病网络
由GeneCard数据库以及DisGeNET数据库搜集整合的PCM的相关靶点基因,经过筛选,共有125个靶点与PCM相关联。将所有筛选得到的疾病靶点与丹参有效活性成分作用靶点相映射,得到药物-成分-靶点-疾病网络(图见OSID科学数据与内容附图2-B)。Venny 2.1软件对丹参有效成分靶点与PCM的相关靶点基因取交集,得到丹参治疗PCM关键靶点分析网络并绘制Venn 图(图1),分析结果得到潜在治疗靶点共有10个,分别为BCL2L1、EDNRA、ERBB2、ICAM1、IFNG、IL-4、IL-6、NR3C1、PGR、STAT3。其中PGR、NR3C1、BCL2L1等3个基因度值最高,分别为8、7、3,且其发生作用分子多为丹参的有效成分。

图1 丹参成分靶点与PCM疾病靶点维恩图Fig.1 Venn Diagram of Salviae Miltiorrhizae Radix Et Rhizoma component ingredient targets and PCM disease targets
2.4 构建潜在治疗靶点PPI
根据STRING数据库分析结果(图2),利用Cytoscape7.2.0分析其数据,可知此网络图共10个节点,42条边,平均节点度值为8.4。依据度值排名,前4名分别为BCL2L1、IL-6、ICAM1和PGR,说明这4个靶点具有更强的交互作用,对疾病的影响更大。经过进一步文献[20-23]筛选确定,丹参对PCM治疗的作用靶点主要为IL-6、ICAM1和PGR。
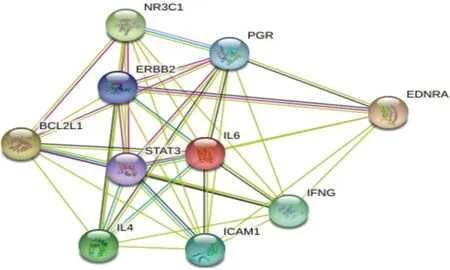
图2 潜在作用靶点PPIFig.2 PPI network of potential target
2.5 GO功能富集分析
利用DAVID数据库对10个潜在治疗基因进行富集分析,得到14个生物过程(biological process,BP)、9个细胞组成(cell composition,CC)、6个分子功能(molecular function,MF),具体结果见分析图(图见OSID科学数据与内容附图2-C)。其中生物过程主要涉及细胞对药物反应的调控、一氧化氮生物合成过程的正调控、趋化因子的正向调控、MAP激酶活性阳性调控等;细胞成分主要为细胞质、外侧质膜,细胞核等;分子功能主要分为细胞因子活性、蛋白质结合、 RNA聚合酶Ⅱ核心启动子近端区序列特异性 DNA 结合等。
2.6 KEGG通路富集分析
KEGG通路富集分析结果筛选得到16条信号转导通路,包括乳腺癌通路、癌症信号通路、库欣综合征通路、NF-κB信号通路、卵巢类固醇合成通路等,有关于PCM以及乳腺癌的通路共计两条;第一条,通过直接影响Her-2或其他间接因素,放大PI3K激活PI3K信号通路,影响细胞增殖、存活、翻译等生物过程,进而影响细胞分裂周期和细胞生物学过程,诱发炎症或癌变;第二条,Jagged或Delta通过影响Notch,使Notch信号通路的Her-2过度表达,Her-2/neu在某些乳腺癌和卵巢癌细胞表面过度表达[24],是乳腺癌变的标志。总体结果见图3。对关联炎症反应、凋亡、氧化应激反应进行分析[25],通过对富集因子、P值及参与调控通路上的基因数进行综合富集通路分析,得到各潜在靶点对生物生理功能的调节过程,结果按照P值大小着色(-logP>10着深橙色,6<-logP<10着橙色,-logP<6着淡橙色)绘制疾病靶点基因KEGG通路富集分析图,见图4。
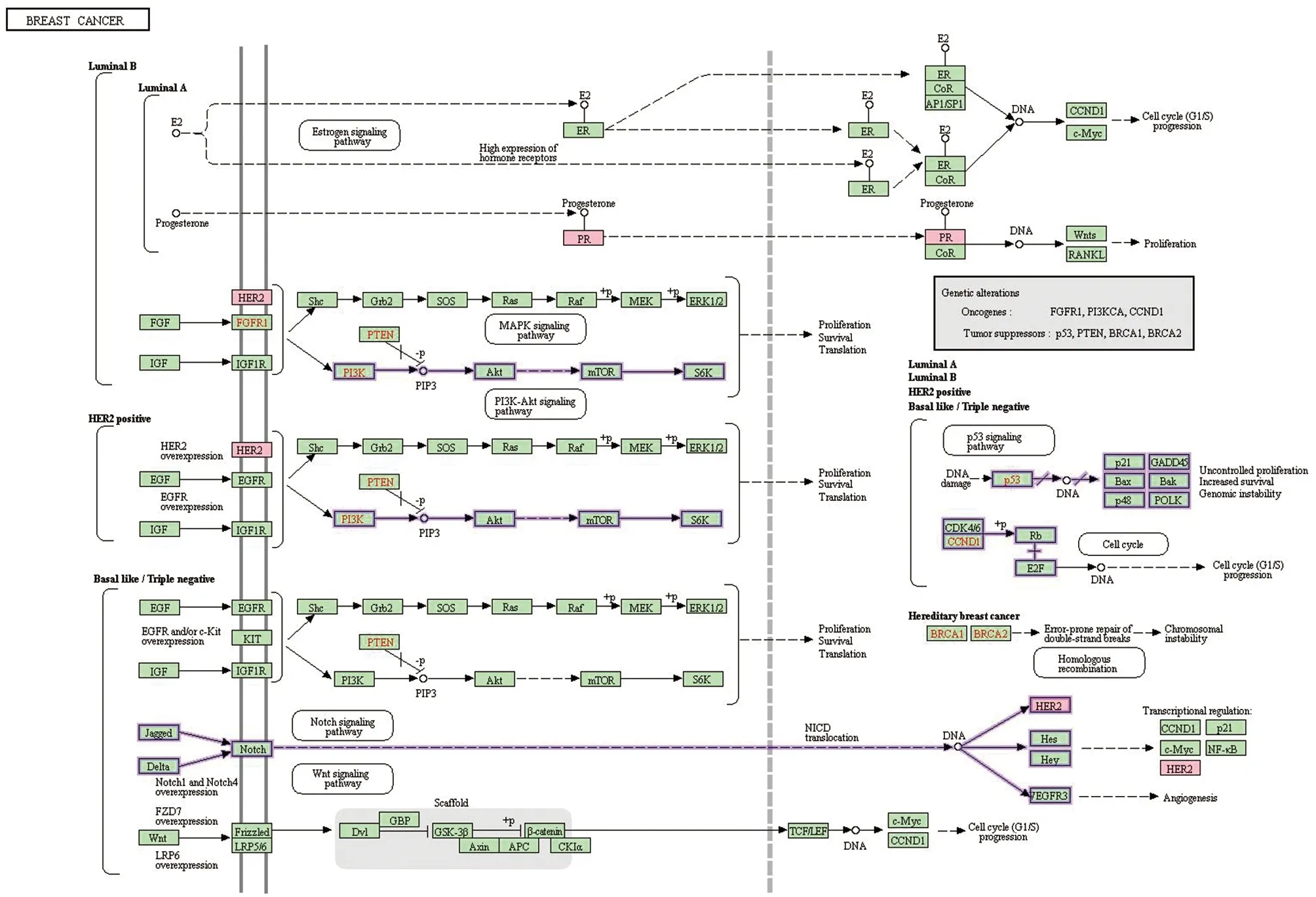
注:相关信号通路采用紫色标记。图3 丹参有效成分与乳腺癌及炎症信号通路的相关靶点示意图Fig.3 Schematic diagram of the relevant targets of the active ingredients of Salviae Miltiorrhizae Radix Et Rhizoma and the breast cancer and inflammation signaling pathways

注:按照P值大小着色,-log P>10着深橙色,6<-log P<10着橙色,-log P<6着淡橙色。图4 疾病靶点基因KEGG通路富集分析条形图Fig.4 Bar chart of the enrichment analysis of disease target genes KEGG pathway
2.7 分子对接结果
为了进一步验证上述筛选的关键成分与重要靶点的准确性,取药物-成分-靶点-疾病网络中度值前五的有效活性成分木樨草素、丹参酮ⅡA、鼠尾草酚酮、二氢丹参内脂、隐丹参醌与筛选出的潜在作用靶点互作程度排名最高的IL-6、PGR、ICAM1的靶点蛋白进行相互结合实验,以结合自由能作为筛选条件,结果15次对接尝试均获得成功,其结果均小于0,且结合自由能都在-8.368~-20.627 12 kJ/mol范围内,其中木樨草素与3种蛋白分子对接后结合自由能最小(图5),分别为-16.275 76 kJ/mol(图5(a))、-18.325 92 kJ/mol(图5(b))及-20.627 12 kJ/mol(图5(c)),由分子对接结果可知木樨草素与疾病靶点结合最为容易且稳定。说明木樨草素可能是治疗PCM疾病过程中一个重要的活性成分,这就为进一步的研究提供了理论依据。
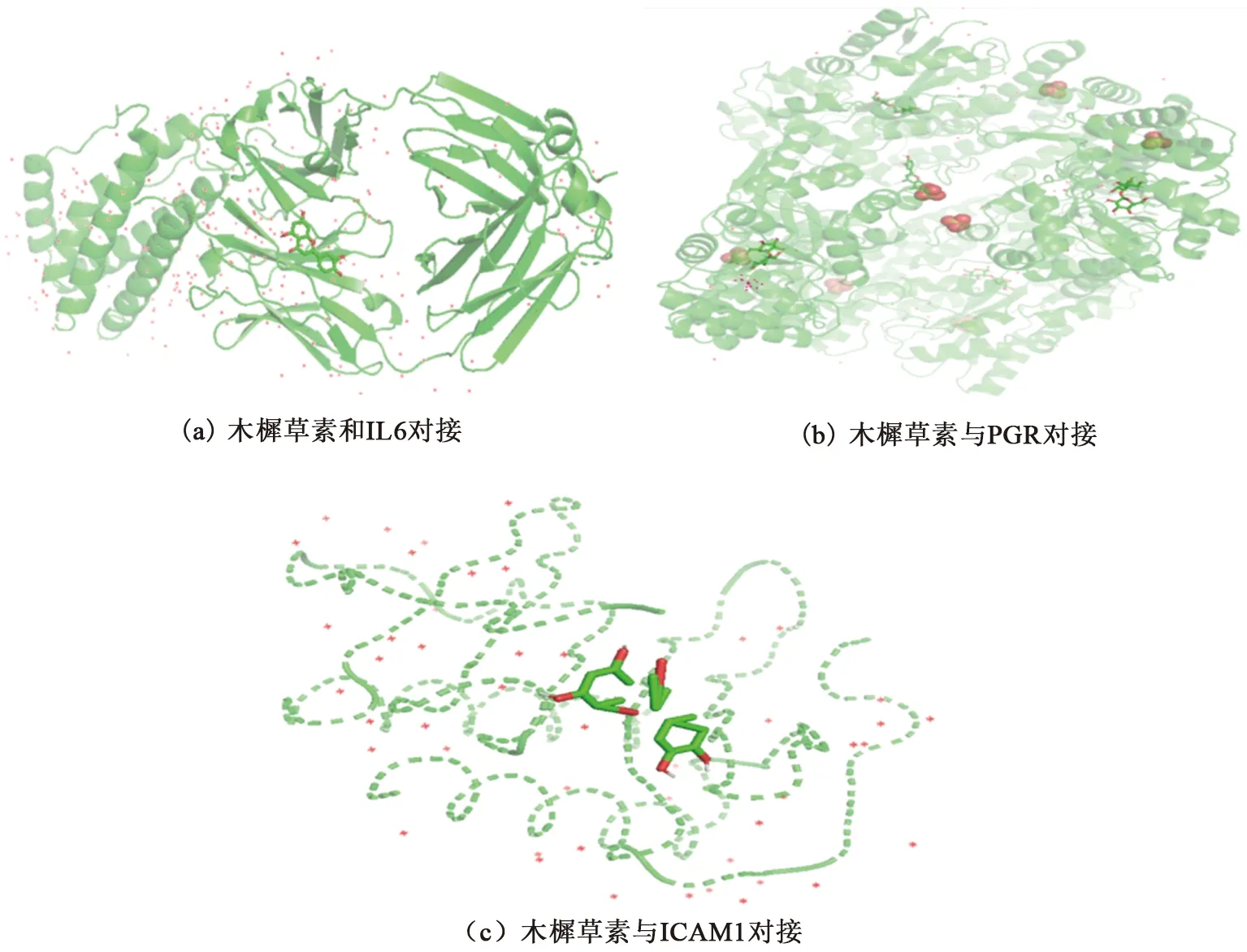
图5 木樨草素与基因的分子对接图Fig.5 Molecular docking map of luteolin and the gene
3 讨论与结论
本研究利用网络药理学和分子对接方法研究了丹参治疗PCM的活性成分,并识别出其中关键的靶点及其调控的 KEGG 通路和GO生物学过程。
通过构建药物-成分-靶点-疾病网络以及分子对接验证,显示丹参的活性成分木樨草素、丹参酮ⅡA、鼠尾草酚酮、二氢丹参内脂、隐丹参醌与潜在作用靶点互作程度排名最高的IL-6、P6GR、ICAM1靶点基因对应的蛋白确有分子结合的可能。其中,木樨草素可与6个潜在治疗靶点(BCL2L1、ERBB2、ICAM1、IFNG、IL-4、IL-6)产生相互作用,提示木樨草素可能在PCM治疗过程中发挥重要作用。此外,丹参酮ⅡA、隐丹参酮、鼠尾草酚酮、二氢丹参内脂、隐丹参醌、丹参酮因能与较多的疾病靶点交互,初步推测其可能在治疗PCM中发挥一定作用。
通过将丹参活性成分靶点与PCM靶点映射后,得到10个潜在治疗靶点,分别为BCL2L1、EDNRA、ERBB2、ICAM1、IFNG、IL-4、IL-6、NR3C1、PGR、STAT3,值得后续深入研究。其中NR3C1、PGR在10个潜在基因靶点中互作的丹参活性成分最多,同时也是degree值最高的两个基因,提示二者的靶点与丹参有效成分交互作用最强。对潜在治疗靶点构成的PPI进行分析,可得到互作程度居于前两位的靶点基因PGR(NR3C3)、IL-6。其中IL-6可介导IL-6产生,IL-6是由活化的单核巨噬细胞、B细胞等细胞分泌产生,是人体内促炎细胞因子和抗炎性肌细胞因子[26],IL-6作为抗炎细胞因子的作用是通过其对TNF-α和IL-1的抑制作用以及IL-1ra和IL-10的活化来介导的[27],并通过一系列生物效应从而刺激人体免疫应答[28],临床将其作为一个PCM的重要指标[29],也有研究表明外界因素是通过IL-6/JAK2/STAT3途径诱发PCM[30],故丹参可能通过抑制此途径发挥治疗作用。PGR基因是编码类固醇受体超家族的一个成员,负责编码蛋白质介导孕酮的生理效应。孕酮在妊娠有关的生殖事件中起着核心作用,是否与PCM相关需要进一步研究[31-34]。
GO富集分析表明丹参可能的作用机制为调节体内细胞对药物反应、增加一氧化氮在体内的含量、介导产生趋化因子、激活并加强MAP激酶活性、增强IL-6受体的拮抗等,KEGG富集分析表明丹参也可能是通过乳腺癌通路、癌症信号通路、库欣综合征通路、NF-κB信号通路、卵巢类固醇合成通路等对PCM进行治疗。而在NF-κB通路中,若药物能抑制NF-κB活性,便可抑制细胞因子TNF-α,作为PCM另一关键指标TNF-α,药物若能降低其在病灶的表达水平,则此药物对PCM就具有良好治疗效果[35-36],说明此通路是丹参作用于PCM的一条作用通路。通过对NF-κB通路的分析,侧面反映了丹参也可能通过上述其余通路作用于PCM。
综上所述,中药丹参治疗PCM是通过多成分、多靶点、多途径共同调控的结果。本研究初步揭示了其治疗PCM的物质基础和可能的作用机制。在的后续研究中,将对本研究筛选的关键靶点和信号通路进行体内外的实验验证。

