基于网络药理学和分子对接探讨蛇床子治疗乳腺癌的作用机制
柯昌虎,潘长江,严慧,刘佳玲,陈苗,李志浩*
(1.湖北医药学院附属国药东风总医院,湖北 十堰 442008;2.湖北医药学院 药学院,湖北 十堰 442000)
乳腺癌(breast cancer)多发生于女性人群中,是由乳腺上皮组织中细胞增殖失控而引起的恶性肿瘤,其发生发展与遗传、炎症、激素、环境等诸多作用因素密切相关。2020年全球乳腺癌新发病例226万,占新增癌症患者的11.7%,跃居全球第一大癌症[1]。乳腺癌在病变过程中易向全身重要脏器转移,严重威胁着女性的生存质量和生命安全。现阶段乳腺癌的治疗多以手术切除、放化疗、内分泌治疗等手段为主,免疫治疗正在不断地探索与优化[2],但均存在一定的副作用,产生的抗药性成为有效治疗的主要障碍[3],加之乳腺癌发病机制较为复杂,治疗疗效方面尚无根本性的突破,情况不容乐观。
中药蛇床子为伞形科蛇床属植物蛇床Cnidiummonnieri(L.)Cuss.的干燥成熟果实,性温,味辛、苦[4],含有香豆素、黄酮、挥发油等多种成分[5-7]。蛇床子在治疗乳腺癌方面具有较好的临床应用前景,多年来,由蛇床子、补骨脂和制附子组成的温肾壮骨方对转移性乳腺癌具有良好的治疗作用[8];顾氏外科临证习用乳宁II号方配伍蛇床子等中药治疗乳腺癌骨转移患者[9];刘胜教授认为乳腺癌骨转移当扶正祛邪,温肾壮骨,多用蛇床子等中药组方补肾生髓、壮骨通阳[10]。研究发现,香豆素类成分蛇床子素是蛇床子抗乳腺癌的作用成分之一[11-13]。由于蛇床子成分多样,加之实验研究的局限性,目前其抗乳腺癌的分子机制尚无系统报道。网络药理学可以揭示中药治疗相关疾病的生物活性成分及分子机制,反映出中药多成分、多靶点的作用关系,从整体水平解释中药的有效性和科学性[14-15],与分子对接相结合有助于药效物质的明确以及药物功效的阐释[16]。本研究运用网络药理学探讨蛇床子防治乳腺癌的相关靶点及可能的作用机制。
1 资料与方法
1.1 蛇床子活性成分及作用靶点的筛选
采用中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)(http://tcmspw.com/index.php)和文献查阅,收集蛇床子的活性成分及靶点,以口服生物利用度(oral bioavailability,OB)≥30%和类药性(drug-likeness,DL)≥0.18作为筛选条件[17-18],并结合文献记载补充活性成分[11-13]。将活性成分的靶点导入Uniprot数据库(http://www.uniprot.org/),去掉非来自“Homo sapiens”物种的靶点并进行基因名称转换。
1.2 乳腺癌疾病相关靶点的筛选
以乳腺癌“breast cancer”为关键词,分别在GeneCards数据库(https://www.genecards.org/)和OMIM数据库(https://omim.org/)中筛选乳腺癌相关靶点,将GeneCards中相关性评分大于15的基因与OMIM中的基因合并去重,得到乳腺癌的靶点。
1.3 活性成分-疾病共有靶点的筛选
在Venn在线平台(http://bioinformatics.psb.ugent.be/webtools/Venn/)upload lists项下分别录入蛇床子与乳腺癌的靶点,在Provide name for list项下分别命名“蛇床子靶点”和“乳腺癌靶点”,点击“Submit”,导出维恩图,并获取药物与疾病的共有靶点。
1.4 药物-有效成分-疾病-靶点网络构建
使用Cytoscape 3.7.2软件,上传蛇床子-成分-乳腺癌-靶点相关数据信息,构建药物-成分-疾病-靶点网络图,使用Network Analyzer工具以节点度值(degree)为拓扑指标对网络进行分析。在网络中,节点(不同的形状)代表药物、有效成分、乳腺癌、靶点等,边代表药物-有效成分、有效成分-靶点、乳腺癌-靶点等两两之间的相互作用。
1.5 蛋白质-蛋白质相互作网络构建
在STRING在线平台数据库(https://www.string-db.org/)中上传共有靶点,限定物种为“Homo sapiens”进行分析,选择交互作用大于0.4的靶点,保存TSV格式,导入Cytoscape 3.7.2软件中构建蛋白质-蛋白质相互作用(protein-protein interaction, PPI)网络模型。
1.6 GO功能和KEGG通路富集分析及可视化
在DAVID 6.8数据库(https://david.ncifcrf.gov/)中上传靶点,选择物种为“Homo sapiens”,进行基因本体(gene ontology,GO)功能和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes, KEGG)通路富集分析。以P<0.05进行筛选,探讨蛇床子抗乳腺癌的生物学过程和信号途径。
1.7 分子对接
从PubChem(https://pubchem.ncbi.nlm.nih.gov/)数据库下载化合物分子(配体)的2D结构sdf格式,PDB数据库(http://www.rcsb.org/)获取核心靶点(受体)对应的蛋白三维结构pdb格式。使用AutoDock软件对配体进行调整电荷、判断root等,对受体进行加氢、计算电荷、设定原子类型等,分别将配体及受体格式转换为pdbqt格式,再进行对接并获取结合能计算结果,使用PyMOL软件对成分-蛋白对接结果进行可视化分析。
2 结果
2.1 蛇床子主要活性成分及作用靶点
检索TCMSP数据库得到蛇床子化学成分114个,经筛选获取活性成分19个。尽管蛇床子素(DL=0.13)低于筛选标准,但多篇文献指出蛇床子素对乳腺癌具有显著的防治效果[19-20],因此将其纳入活性成分列表中,20个成分数据信息见表1。再通过TCMSP数据库获取成分的作用靶点,经UniProt数据库筛选处理,共得到80个对应靶点。

表1 经口服生物利用度和类药性筛选的蛇床子活性成分信息
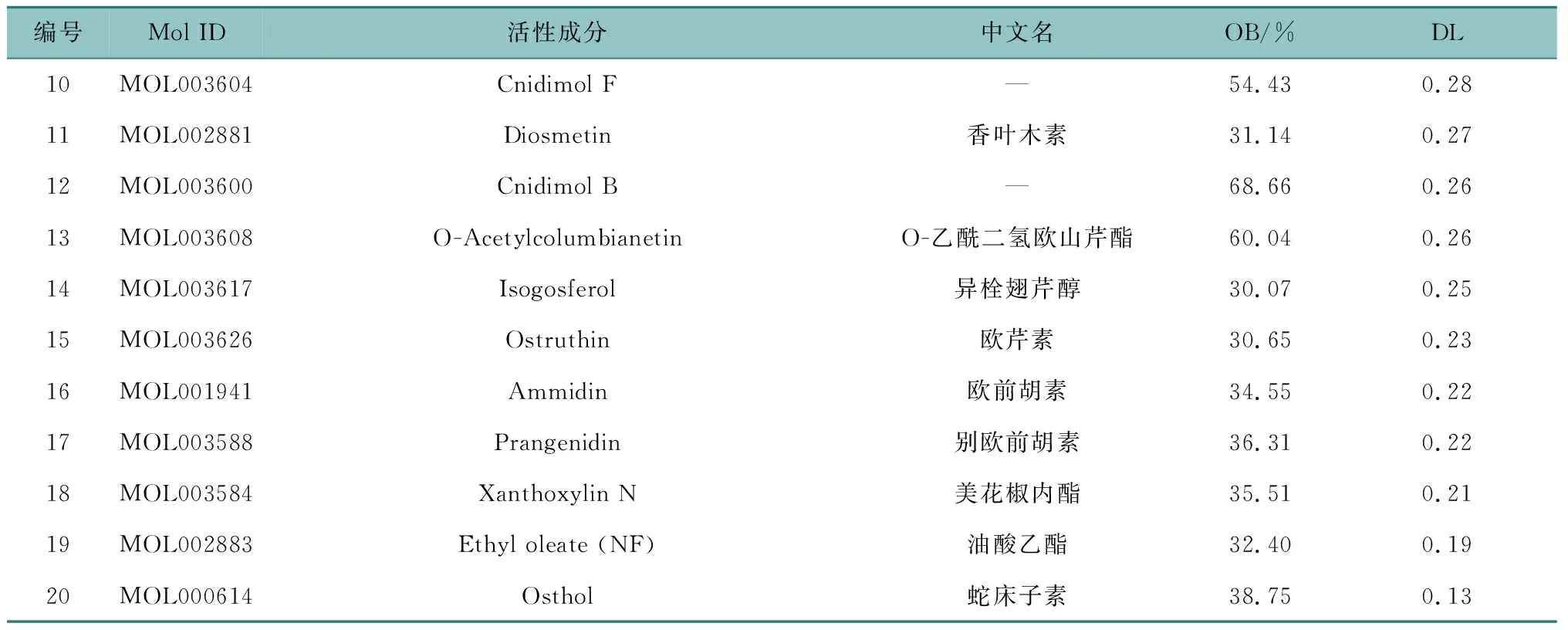
表1(续)
2.2 疾病靶点及共有靶点的筛选
在GeneCards数据库中筛选与乳腺癌相关的靶点,取相关性评分大于15的靶点,与OMIM数据库中筛选的乳腺癌靶点合并去重,共获取1 530个靶点。将80个成分靶点和1 530个疾病靶点进行匹配分析,共得到19个共有靶点,维恩图见图1。
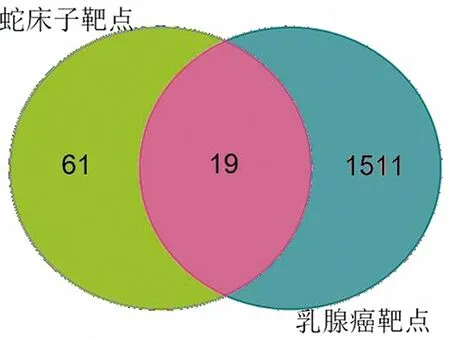
图1 蛇床子与乳腺癌的维恩图Fig.1 Venn diagram of the target of Cnidii Fructus and breast cancer
2.3 药物-活性成分-靶点-疾病网络构建
将共有靶点输入Cytoscape 3.7.2软件中,绘制药物-成分-靶点-疾病相互作用的网络图,见OSID科学数据与内容附图1。网络中共有38个节点,82条边,平均度值为2.705,大于平均度值的成分有9个,其中排名前4位的是β-谷甾醇(degree=10)、(E)-2,3-bis(2-keto-7-methoxy-chromen-8-yl)acrolein(degree=6)、豆甾醇(degree=6)、蛇床子素(degree=6),可能为蛇床子治疗乳腺癌的关键活性成分。连接线越多的图形,越能直观反映关键节点信息。
2.4 PPI网络构建
在STRING数据库中录入共有靶点,选取置信度>0.4的网络数据,去掉2个游离靶点,在Cytoscape 3.7.2软件中制作蛇床子治疗乳腺癌的PPI网络图,见OSID科学数据与内容附图2。其中排名前4位的靶点依次是HSP90AA1(degree=10)、JUN(degree=10)、PRKACA(degree=9)、KDR(degree=8),可能在治疗乳腺癌中发挥重要调控作用。
2.5 GO功能分析结果
运用DAVID数据库进行GO分析,以P<0.05为筛选条件,结果有103条生物学过程,其中生物过程(biological process,BP)68条、细胞组分(celluar component,CC)16条和分子功能(molecular function,MF)19条,选择前20个条目进行气泡图展示,见OSID科学数据与内容附图3。BP主要涉及ERK1和ERK2级联的正调控、药物反应、线粒体细胞色素C的释放等,CC主要涉及细胞质膜、轴突、细胞表面等,MF主要涉及激酶活性、蛋白质结合等。结果表明蛇床子可以通过参与调控多种生物学过程而发挥抗癌作用。
2.6 KEGG通路分析结果
进行KEGG分析,取P<0.05,蛇床子抗乳腺癌的靶点涉及的通路共56条,选择排位靠前的20条信号通路进行气泡图展示,见OSID科学数据与内容附图4。主要有癌症通路、结肠直肠癌、癌症的蛋白聚糖、粘着斑、神经营养因子信号通路、安非他明成瘾、乙型肝炎、雌激素信号通路等信号通路。由DAVID 6.8平台富集得到程度较高的PI3K-Akt信号通路,涉及GSK3B、HSP90AA1、BCL2、KDR、PRKCA、MET、PIK3CG等7个靶点,见OSID科学数据与内容附图5。
2.7 分子对接结果
根据PPI的分析结果,从PDB数据库中提取前四位靶点(HSP90AA1、JUN、PRKACA、KDR)的蛋白三维结构,将其分别与配体β-谷甾醇(A)、(E)-2,3-bis(2-keto-7-methoxy-chromen-8-yl)acrolein(B)、豆甾醇(C)、蛇床子素(D)进行分子对接,结合能见表2,结合能小于0,表明配体与受体可以自发结合,结合能小于-20.92 kJ/mol表示可以形成稳定的对接结构[21]。其中HSP90AA1与β-谷甾醇、豆甾醇,PRKACA与β-谷甾醇、(E)-2,3-bis(2-keto-7-methoxy-chromen-8-yl)acrolein、豆甾醇,KDR与β-谷甾醇、豆甾醇均可以产生较强的结合。
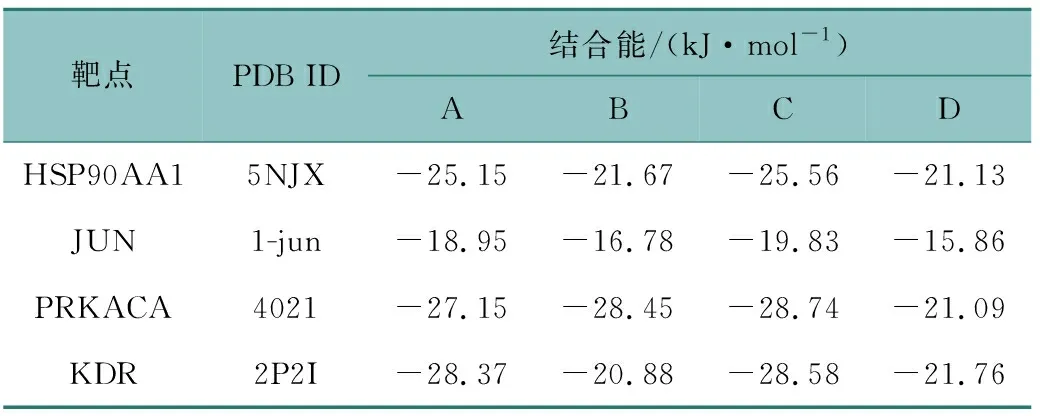
表2 活性成分与靶点受体蛋白间的结合能
以4个活性成分与PRKACA的分子对接结果进行展示,见图2。靶点PRKACA与成分A可以通过氨基酸残基LYS-105、GLU-121、TYR-122、GLN-176产生氢键相互作用(图2a),与成分B可以通过氨基酸残基HIS158、TRP-211、GLY-193、ASN-216、ILE-163产生氢键相互作用(图2b),与成分C可以通过氨基酸残基PHE-100、VAL-123、TYR-122、ALA-124产生氢键相互作用(图2c),与成分D可以通过氨基酸残基TYR-122、HIS-68、GLY-66产生氢键相互作用(图2d)。
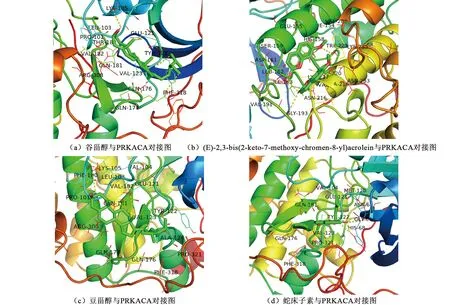
图2 分子对接图Fig.2 Diagrams representing the interaction of molecular docking
3 讨论
乳腺癌在中医学上归属于“乳岩”“乳石痈”“乳疳”等范畴,“癌毒”贯穿于乳腺癌发生、发展和转移整个过程,“癌毒”残存是导致其复发转移的主要因素[22]。乳腺癌病症整体属虚、局部属实,肾阳亏虚、阴寒凝聚,易于转移复发,治疗当扶正祛邪,温肾壮骨[8]。蛇床子始载于《神农本草经》,性温,归肾经,是中医常用补肾壮阳药。现代药理研究表明,蛇床子具有抗乳腺癌及其并发症的作用[23-27]。由于蛇床子化学成分复杂,对乳腺癌作用的分子机制仍有待明晰。本研究就蛇床子抗乳腺癌的复杂网络机制进行网络药理学分析。
以生物利用度和类药性为考察指标,最终从蛇床子中筛选出β-谷甾醇、(E)-2,3-bis(2-keto-7-methoxy-chromen-8-yl)acrolein、豆甾醇、蛇床子素等共17个抗乳腺癌活性成分。其中β-谷甾醇、豆甾醇属于植物甾体固醇类成分,均具有抗乳腺癌的活性,β-谷甾醇对雌激素受体α(ERα)有抑制或诱导作用,可以通过ER介导调节Cyclin D1蛋白与mRNA水平的表达,从而影响ER阳性人乳腺癌T47D细胞增殖活性和细胞周期,发挥植物雌激素样作用[28]。豆甾醇具有细胞毒性作用,可以抑制肿瘤生长、诱导细胞凋亡和抑制肿瘤转移。透明质酸-阿霉素-豆甾醇制成植物脂质体(HA-DOX-STS),对表达不同水平CD44受体的乳腺癌MDA-MB-231、MCF-7细胞及其异种移植瘤模型具有抗肿瘤活性[29]。蛇床子素能有效抑制乳腺癌MCF-7和MDA-MB-231细胞中基质金属蛋白酶-2(MMP-2)启动子和酶活性,对乳腺癌细胞迁移和侵袭产生抑制作用[30];还可以激活促凋亡蛋白Bax诱导凋亡,调节人乳腺癌细胞信号蛋白Akt和ERK1/2的磷酸化,诱导激活JNK蛋白介导的细胞凋亡[31]。
经蛇床子活性成分和乳腺癌靶点交集筛选出HSP90AA1、JUN、PRKACA、KDR等共19个靶点基因。其中热休克蛋白(HSP)在细胞中作为分子伴侣参与蛋白质的合成、折叠、转运等过程,成为乳腺癌治疗中有价值的潜在分子靶点。HSP90分为HSP90α(HSP90AA1)和HSP90β(HSP90AB1),两者同源性高达84%,乳腺肿瘤患者的血浆中HSP90AA1水平较高,血浆HSP90AA1结合其他标志物可预测乳腺癌的发生和转移风险,可以作为乳腺癌疾病和转移风险评价指标[32]。c-Jun是转录因子激活蛋白1(AP-1)的一个组成部分,c-Jun多数情况下在乳腺癌浸润侵袭过程活化,并与增殖和血管生成有关[33],有望成为乳腺癌治疗的潜在靶点[34]。蛋白质激酶环磷酸腺苷激活催化亚基α(PRKACA)是蛋白激酶A(PKA)的催化亚基之一,研究发现雌激素和抗雌激素药物可以通过GPER1/PRKACA/CMA通路,使MORC2不被溶酶体分解,从而参与雌激素诱发乳腺癌细胞繁殖和内分泌耐药,通过靶向药物阻断该通路,有可能同时防止乳腺癌生长和内分泌耐药[35]。血管内皮生长因子受体(VEGFR2,KDR)是蛋白酪氨酸激酶(PTK)家族成员。研究表明VEGFR2蛋白在三阴性乳腺癌中高表达,其阳性表达与患者的组织学分级、临床分期、远处转移有相关性,可以作为三阴性乳腺癌新的评价指标[36]。
经GO功能分析获取ERK1和ERK2级联的正调控、细胞质膜、细胞质、蛋白质结合等103条生物学过程。经KEGG通路分析获取癌症途径、癌症的蛋白聚糖、粘着斑、PI3K-Akt等56条通路,表明蛇床子可以激活上述通路,并通过多条通路对乳腺癌产生作用。其中PI3K-Akt信号通路在细胞增殖、转移、血管生成、凋亡等方面起着重要的调节功能,在乳腺癌中被发现异常激活,主要表现为PTEN活性缺失、PIK3CA基因激活突变以及AKT失调,其过度激活还与HER2阳性乳腺癌BT474细胞抗HER2治疗耐药相关[37]。最后,基于分子对接对活性成分和靶点作用关系进行验证,结果显示配体与受体可以通过氢键作用力进行结合。
综上所述,蛇床子的有效成分可以经多个途径对乳腺癌产生作用。本研究对蛇床子抗乳腺癌药效物质基础、关键靶点和信号通路进行预测分析,建立蛇床子-成分-靶点-乳腺癌网络图,多角度探索蛇床子治疗乳腺癌的潜在作用机制,通过调控相关生物学过程和信号通路而发挥其抗癌功效,并基于分子对接模拟分子与靶点之间可能的作用。本研究为蛇床子抗乳腺癌机制研究提供了理论依据,其预测结果有待于进一步的实验验证。

