D-阿洛酮糖的功能特性及其生物合成研究进展
(廊坊梅花生物技术开发有限公司,河北 廊坊 065001)
D-阿洛酮糖(D-psicose/D-allulose)是一种稀有糖,自Itoh等[1]首次报道以来已有近30年历史。D-阿洛酮糖具有蔗糖70%的甜度,可与食物中的氨基酸或蛋白质发生美拉德反应,改善食物色泽,且其提供热量较少,仅相当于同等质量蔗糖的0.3%[2],不会给人体带来额外的消化负担,对人体不构成健康威胁。2011年8月,美国食品与药物管理局(FDA)确定D-阿洛酮糖为普遍公认安全食品(Generally regarded as safe,GRAS),可作为食品或食品添加剂的组成成分[3]。
D-阿洛酮糖已陆续在日本、韩国、美国和澳大利亚等国家批准上市,其市场规模在不断增加。目前,我国与欧盟正在受理D-阿洛酮糖作为新食品原料的申请,预计可在2024年前获批。随着获批国家的增多,D-阿洛酮糖的市场规模也将保持快速增长,在未来有望替代食品工业中常规糖分所占据的广阔市场,在提高人们营养健康水平方面发挥积极作用。
1 D-阿洛酮糖特性
1.1 D-阿洛酮糖简介
D-阿洛酮糖是一种稀有糖,分子式为C6H12O6,分子量为180.16,它是D-果糖的C-3位差向异构体,D-果糖的分子结构式为

D-阿洛酮糖纯品为白色粉末状晶体,极易溶于水,可溶于甲醇和乙醇,不溶于丙酮,自然界中D-阿洛酮糖分布极少,可见于少部分植物和少数细菌中。此外,D-阿洛酮糖也出现在各种人工制作食品中,如水果干、果酱和糖制品等,这些食品一般都有高糖的特点,D-阿洛酮糖在各类食品中的质量分数与生产过程中的温度和加热时间密切相关[4]。D-阿洛酮糖的分子结构式为

1.2 阿洛酮糖功能特性
1) 高甜度与低能量
虽然D-阿洛酮糖可同等程度地满足消费者对甜味的味觉需求,但是其仅提供相当于同等质量蔗糖0.3%的热量,可作为食品中蔗糖最理想的替代品。对大鼠连续喂食D-果糖、蔗糖与D-阿洛酮糖20 d后,喂食阿洛酮糖的大鼠体重增加量最小,能量计算结果显示D-阿洛酮糖提供的有效能量几乎为0,意味着D-阿洛酮糖产生的能量最低[2]。
2) 抑制血糖升高
多项研究证明D-阿洛酮糖具有降血糖的功效。分别以蔗糖、麦芽糖和可溶性淀粉喂食大鼠,同时喂食少量D-阿洛酮糖或果糖,结果发现D-阿洛酮糖能够显著抑制由蔗糖和麦芽糖引起的血糖升高,对于可溶性淀粉引起的血糖升高作用并不明显。进一步的研究发现D-阿洛酮糖能抑制肠道蔗糖酶和麦芽糖酶活性,降低肠道对这两种糖类的吸收,达到抑制血糖升高的效果[5]。单独服用D-阿洛酮糖(7.5 g)也不会引起血液中血糖与胰岛素水平的变化[6]。D-阿洛酮糖还可抑制餐后血糖水平的升高,可作为临界型糖尿病患者的辅助治疗剂,在连续摄入D-阿洛酮糖12周后没有观察到任何副作用或不良反应[7]。
3) 降低脂肪积累
肥胖与高热量和高糖分食物的摄入息息相关,D-阿洛酮糖甜味剂不仅几乎不提供任何热量,而且能降低小肠对蔗糖、麦芽糖等糖类的吸收速率以及生物体内脂肪合成酶的活性,提高脂肪氧化酶表达水平,通过抑制脂肪合成速率和提高脂肪分解速率而有效控制体重,治疗肥胖[7-8]。
4) 安 全 性
作为一种主要应用于食品领域的甜味剂,D-阿洛酮糖的安全性至关重要。为了验证D-阿洛酮糖的安全性,有研究者对大鼠进行了长达18个月的D-阿洛酮糖口服毒性研究,长期给予大鼠D-阿洛酮糖饮食后,除大鼠肝脏和肾脏的相对重量有所增加外,未观察到其他异常情况,随后肝脏和肾脏组织的病理学观察结果显示这两种器官未出现因摄入D-阿洛酮糖而产生的异常[9]。
2 D-阿洛酮糖的制备
自然界中天然存在的D-阿洛酮糖极少,部分植物与细菌中含有少量的D-阿洛酮糖。目前,D-阿洛酮糖的大规模获取主要来自于人工合成,主要有化学合成与生物合成两种方式,化学合成法存在产量低、副产物多和产物分离困难等问题,生物合成法则更为环保,副产物少,更利于后续产物的分离纯化。根据生物合成D-阿洛酮糖所需要原材料的不同,其生物合成途径有:1)D-果糖通过异构化反应生成D-阿洛酮糖;2) 以葡萄糖为原料,先由葡萄糖异构酶或木糖异构酶获得D-果糖,再由DTE或DPE催化D-果糖获得D-阿洛酮糖;3) 由阿洛醇通过氧化还原反应得到D-阿洛酮糖。
2.1 D-果糖异构化生产D-阿洛酮糖
2.1.1 异构化酶的筛选及来源
通过生物酶催化将D-果糖异构化为D-阿洛酮糖是目前大部分生物法生产D-阿洛酮糖的基础,D-果糖异构化生产D-阿洛酮糖的途径如图1所示。这些生物酶主要有D-塔格糖3-差向异构酶(D-tagatose 3-epimerase,DTE)和D-阿洛酮糖3-差向异构酶(D-psicose 3-epimerase,DPE)。D-塔格糖3-差向异构酶由Izumori等[10]首次发现,因其最适底物为塔格糖,故命名为D-塔格糖3-差向异构酶。2006年韩国Kim等[11]成功克隆表达了根瘤农杆菌的DTE,该DTE可催化所有己酮糖在C-3位置的差向异构反应,且对D-阿洛酮糖的底物特异性最高,其次是D-果糖和D-塔格糖。因此,该酶是一种新的差向异构酶,被更名为D-阿洛酮糖3-差向异构酶。

图1 果糖异构化生产D-阿洛酮糖
虽然DTE与DPE可催化相似的反应,即单糖C-3位置的差向异构反应,但是由于它们的来源不同,因此彼此之间的氨基酸序列同源性差异很大,氨基酸相似度一般在23.9%~94.2%[12]。目前已有3种DTE酶家族成员的晶体结构被成功解析,分别是AgrobacteriumtumefaciensDPE[13],PseudomonascichoriiDTE[14]和ClostridiumcellulolyticumDPE[15],这3种DTE酶家族成员的晶体结构表明DTE具有同源二聚体的酶分子结构,而其他两种DPE是同源四聚体的酶分子结构。天然状态下,DTE与DPE更适宜中性或弱碱性环境,它们的最适催化温度分布范围广泛,一般为40~75 ℃;此外,与DTE相比,DPE多具有金属离子依赖性,最适金属离子为Mn2+和Co2+,这些金属离子在提高酶的活性与热稳定性方面具有重要作用[16]。随着已发现的DTE与DPE越来越多,它们组成了一个新家族—DTE酶家族[17]。迄今为止,研究者们已先后在瘤胃球菌(Ruminococcussp.)[18]、梭状芽孢杆菌(Clostridiumcellulolyticum)[19]和类球红细菌(RhodobactersphaeroidesSK011)[20]等菌株中发现新的DTE酶家族成员。国内关于D-阿洛酮糖的研究起步较晚,江南大学率先发现一种可产DTE的类球红细菌,转化率最高达6.54%[21],这也是国内首次报道发现具有生物转化D-果糖生成D-阿洛酮糖功能的菌株。随后,天津工业生物技术研究所Zhu等[18]在瘤胃球菌中也发现了D-塔格糖3-差向异构酶,目前已发现的DTE酶家族成员如表1所示,表1中转化率均为最适条件下数据。

表1 不同微生物来源的DTE和DPE及其性质
虽然天然菌种产生的DTE可用于D-阿洛酮糖的生产,但是已报道的天然DTE多为胞内酶,不仅需要分离纯化后才能使用,而且产量较低,催化效率以及酶稳定性都有待提高。相较于化学法,该方法产生的DTE用于D-阿洛酮糖的生产虽然可以提高D-阿洛酮糖的生产效率,但是也会带来非常高的生产成本,并且在D-阿洛酮糖生产初期添加的是游离酶,这使得DTE难以重复利用且在与产物的分离过程中增加额外的成本。
2.1.2 固定化酶催化技术生产D-阿洛酮糖
随着基因工程技术的发展,研究者对天然DTE进行了分子改造,如将DTE改为胞外分泌、更换DTE的生产宿主等[34-36]。对根瘤农杆菌的DPE基因进行随机和定点突变,获得高热稳定性的DPE,延长DPE在高温下(≥50 ℃)的半衰期,有利于果糖异构化反应正向进行,提高D-阿洛酮糖转化率[35]。与游离酶相比,固定化酶可重复使用并利于产品分离,可以有效降低生产成本,延长酶的使用周期。Itoh等[1]首次对DTE进行固定化操作,以壳聚糖为固定化载体,在pH 7.5,45 ℃条件下反应10 d后阿洛酮糖转化率为18%。Lim等[37]以离子交换树脂为载体固定DPE,在pH 8.5,50 ℃条件下,最终D-阿洛酮糖转化率为29%。此外,为提高酶分子固定化的牢固程度,在酶分子多肽链的一端引入带电荷的氨基酸侧链,增加电荷数量并用离子交换树脂进行吸附固定,该方法对酶进行固定化且不涉及酶的分离纯化,直接使用粗酶液即可,降低了生产成本[38]。
2.1.3 全细胞催化生产D-阿洛酮糖
全细胞催化技术的兴起再一次改变D-阿洛酮糖的生产方式,利用工程菌表达DTE并分泌到胞外,可以将D-果糖原料与菌液混合以进行D-阿洛酮糖的生产。相比酶催化方法,利用全细胞生物转化方法生产稀有糖颇受欢迎,因为它可以避免酶的提取与分离纯化,既可以省去繁琐的操作步骤,又可以降低生产成本。Park等[39]将根癌农杆菌(A.tumefaciens)的DPE基因异源表达于大肠杆菌中,重组大肠杆菌细胞24 h的DPE表达量为8.6%,表明该酶具有较高表达量,在pH 8.5,60 ℃条件下重组细胞可在40 min内转化700 g/L的D-果糖产生230 g/L的D-阿洛酮糖,转化率为33%(以质量计,下同)。此外,来源于F.plautii的DAEase基因在大肠杆菌中异源表达,以果糖为底物在pH 7.5,65 ℃反应条件下,添加2.4 g的重组大肠杆菌,60 min后转化率也可达到33%,即使延长催化时间或增加底物质量浓度反应率也没有明显提高,意味全细胞催化可以在较高的果糖质量浓度下进行,提高菌体的利用效率[40]。
在以果糖为底物转化D-阿洛酮糖的过程中,果糖的质量浓度不能无限制地提高,过高的果糖质量浓度(<800 g/L)会导致菌体细胞裂解,从而降低转化率[41]。随着反应的不断进行,果糖质量浓度也会随之降低,D-阿洛酮糖质量浓度的增加会抑制反应的正向进行,此时若能对底物果糖进行补充,则能提高果糖质量浓度,此举不仅能促进反应正向进行,也能起到提高菌体利用率的作用。王洋[41]采用大肠杆菌工程菌进行全细胞催化,以质量浓度为300 g/L的果糖为初始底物,每隔6 h添加一定量的果糖以及终质量浓度为20 g/L的新鲜全细胞,经6次补料后D-阿洛酮糖产量和产率分别达到110 g/L和36%,而不进行补料的实验组D-阿洛酮糖的转化率仅为18.45%,实验结果表明全细胞补料转化可进一步提升D-阿洛酮糖转化率。
全细胞催化生产D-阿洛酮糖常用大肠杆菌作为DTE表达宿主,目前大部分相关文献报道也都是以大肠杆菌为主,虽然其操作系统成熟,培养简单且细胞生长迅速,并且以大肠杆菌作为DTE酶家族成员的异源表达系统往往都可以取得比较高的转化效率,但是大肠杆菌会产生内毒素,使其在食品工业中的应用受到限制。枯草芽孢杆菌(Bacillussubtilis)和各类酵母菌也是常用表达系统,这些菌株均不含内毒素,操作系统较为成熟,菌体生长迅速,常被作为食品级酶表达的优良宿主[42]。
Wang等[43]构建了枯草芽孢杆菌WB600中异源表达A.tumefaciensDPE的工程菌株,优化发酵条件后,重组枯草芽孢杆菌细胞以果糖为底物生产D-阿洛酮糖,转化率为29.01%。大多数DPE的最佳反应温度>50 ℃(表1),对细胞造成了严重的损伤,导致细胞裂解。因此,Wang等[43]又以海藻酸钙固定化重组枯草芽孢杆菌细胞,在pH 8,50 ℃条件下,将固定化细胞转化率降至20.74%,并且此时固定化细胞的pH和温度稳定性相较于游离细胞都有所提升,有利于提高重组菌重复利用性,节省生产成本。
李灿[38]构建了来自于菌Ruminococcussp.的DTE,以短芽孢杆菌作为表达宿主,该工程菌株具有较高的DTE表达量,所产的胞外DTE经固定化后,以100 g/L的果糖为底物,反应6 h,可得到30%的D-阿洛酮糖。同样条件下,利用该菌株的固定化细胞反应6 h后可得到29.3%的D-阿洛酮糖。各类酵母菌也是常用的食品级酶表达宿主,Yang等[44]报道了一株马克斯克鲁维酵母(Kluyveromycesmarxianus)工程菌株,该菌株能够异源表达Agrobacteriumtumefaciens的DTE,利用该工程菌株作为生物催化剂,以750 g/L的D-果糖为底物,55 ℃反应12 h得到190 g/L的D-阿洛酮糖,转化率达25.3%。虽然由枯草芽孢杆菌或酵母菌作为表达宿主产生D-阿洛酮糖,其生产转化率一般低于大肠杆菌(大肠杆菌转化效率可达33%),但是枯草芽孢杆菌和酵母菌不产生内毒素,这对可作为食品原料的D-阿洛酮糖来说尤为重要,因此未来以全细胞催化方式生产D-阿洛酮糖枯草芽孢杆菌和各类酵母菌将是宿主菌的最佳选择,关于这两大类菌的研究也将会成为热点。
2.1.4 提高异构化反应效率
DTE催化D-果糖到D-阿洛酮糖的反应为可逆反应,在反应达到平衡以后,不会有额外的D-阿洛酮糖生成,因此D-阿洛酮糖的转化率普遍较低,约30%,这也是D-阿洛酮糖产量低的主要原因之一。针对该问题,目前有两种解决方案:1) 提高异构化反应温度,对于吸热反应,升高温度可使反应物活化分子数增多,增强分子间有效碰撞,提高反应速率,加快产物生成,以促进反应的正向进行;2) 反应过程中及时移走生成物,这也是最有效的提高转化效率的方法。2008年Kim等[45]发现:D-阿洛酮糖与硼酸在碱性条件下形成复合物的能力高于D-果糖,且该复合物不参与D-果糖与D-阿洛酮糖之间的异构化反应,可在反应混合物中加入部分硼酸,打破反应平衡,使得异构化反应逐渐向D-阿洛酮糖方向进行,进而提高D-阿洛酮糖的产量;在D-果糖与D-阿洛酮糖的反应体系中加入摩尔比例为60%的硼酸可使D-阿洛酮糖的产量达到最高,约为未加硼酸体系的2倍。
向反应混合物中加入硼酸,在一定程度上可以促进反应向阿洛酮糖生成的方向进行,由于硼酸具有毒性,故通过该方法获得的阿洛酮糖在食品中的应用可能会受到一定的阻力。近些年来有研究者发现L-鼠李树胶糖激酶(L-rhamnulose kinase,RhaB)可催化D-阿洛酮糖转化为D-阿洛酮糖-1-磷酸[46],且该反应为不可逆反应,因此将RhaB与DTE一起使用,可以打破异构化反应的平衡点,进而提高D-阿洛酮糖的转化率。温俊婷等[47]将DPE与RhaB偶联,利用RhaB消耗一分子ATP将DPE反应产生的D-阿洛酮糖磷酸化,后者再通过酸性磷酸酶(Acid phosphatase,AP)将D-阿洛酮糖-1-磷酸脱磷酸为D-阿洛酮糖,以5 g/L果糖为底物,pH 8.5,35 ℃条件下偶联体系反应转化率可达70%。
D-阿洛酮糖磷酸化过程需要消耗一分子ATP,如没有额外的ATP补充,则反应难以进行。多聚磷酸盐激酶(Polyphosphate kinase,PPK)可用于ATP的重生,该酶可分为PPK1和PPK2。PPK1能以ATP为底物合成多聚磷酸盐(PolyPn),也可以在ATP/ADP值偏低时,催化ADP转化为ATP,PPK2更倾向于PolyPn的分解生成ATP。温俊婷等[47]尝试将DTE,RhaB和PPK1组成偶联体系,相同条件下该偶联体系反应转化率降至50%,但ATP消耗降低至原来的1/5。冯林雪[48]则在大肠杆菌中异源表达DPE,RhaB和PPK2,此偶联体系需要在D-阿洛酮糖生产过程中补加PolyPn保证ATP的充足供应,全细胞催化条件下以40 g/L的D-果糖为底物,反应8 h后阿洛酮糖转化率可达65%。相较于添加硼酸,使用生物酶手段提高异构化效率的方法不仅更为安全可靠,而且有利于D-阿洛酮糖在食品领域的应用。
2.2 氧化阿洛醇产D-阿洛酮糖
除了通过异构化反应生产阿洛酮糖外,氧化还原也可用于阿洛酮糖的生产,且氧化还原方法生产阿洛酮糖具有较高的转化率。Wen等[49]在大肠杆菌中异源表达来GluconobacterfrateuriiNBRC 3264的NAD(P)-依赖型醇脱氢酶[NAD(P)-dependent alcohol dehydrogenase,ADH],该酶在浓度为0.05 mol/L的阿洛醇底物下,pH 7,50 ℃条件下反应4 h,最终所得D-阿洛酮糖的转化率为97%,利用ADH氧化阿洛醇产D-阿洛酮糖的途径如图2所示。另外,Wen等[49]以该工程菌为生物催化剂,分别以10 g/L和100 g/L的阿洛醇为底物,在pH 10,50 ℃条件下以全细胞催化的方式进行D-阿洛酮糖的生产,D-阿洛酮糖的最终转化率分别为80.9%,48%。由此可以看出:通过ADH催化阿洛醇生产D-阿洛酮糖不仅可以获得较高的转化率,而且也有利于D-阿洛酮糖后续的分离纯化[49]。该方法中的底物阿洛醇也是一种稀有糖醇,目前尚未见其大规模工业化生产的相关报道,由于阿洛醇价格高昂,目前来看以其为原料生产D-阿洛酮糖得不偿失。
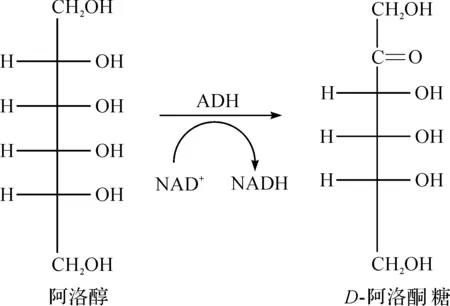
图2 氧化阿洛醇产D-阿洛酮糖
2.3 葡萄糖直接转化生产D-阿洛酮糖
D-果糖作为D-阿洛酮糖的主要生产原料,可由葡萄糖经葡萄糖异构酶(Glucose isomerase,GI)或木糖异构酶(Xylose isomerase,XI)催化得到。与葡萄糖相比,D-果糖的市场价格远高于葡萄糖,若以葡萄糖为原料进行D-阿洛酮糖的生产可极大程度地降低D-阿洛酮糖的生产成本。日本香川大学的研究人员率先以固定化DTE与XI偶联的方式进行D-葡萄糖为底物转化D-阿洛酮糖的实验,仅有10%的葡萄糖转化为D-阿洛酮糖[1]。随后Zhang等[50]在E.coliBL21(DE3)菌株中同时表达了Acidothermuscellulolyticus11B的GI酶和Doreasp. CAG317的DPE,该工程菌以葡萄糖为原料,先催化葡萄糖转化为D-果糖,随后在其分泌的DPE作用下,将D-果糖转化为D-阿洛酮糖,葡萄糖直接转化获得D-阿洛酮糖的途径如图3所示。该共表达体系在pH 6.5,75 ℃时表现出最大的催化活性,当添加500 g/L的D-葡萄糖为底物时,可产生204.3 g/L的D-果糖和89.1 g/L的D-阿洛酮糖,约有17.8%的葡萄糖转化为D-阿洛酮糖。Li等[51]通过两步法由葡萄糖生产D-阿洛酮糖,首先在大肠杆菌中表达XI,以此工程菌株催化葡萄糖转化为果糖,然后将反应混合物的上清液倒入含DPE的酵母孢子中,60 ℃反应,实现将D-果糖转化为D-阿洛酮糖,该方法的D-阿洛酮糖最高转化率可达12%。

图3 葡萄糖直接生产D-阿洛酮糖
虽然以上方法均达到了由葡萄糖直接生产D-阿洛酮糖的目的,并在一定程度上降低了D-阿洛酮糖的生产成本,但是当以D-葡萄糖为基础原料时,无论是一步法还是两步法生产阿洛酮糖,D-阿洛酮糖的转化率均低于20%,产量偏低。造成D-阿洛酮糖低转化率的原因:1) 反应受热力平衡的限制;2) 胞外多酶催化反应中所有酶均处于同一环境中,而不同酶的最适反应条件难以统一,很难充分发挥每一种酶的最高催化活性。此外,在由葡萄糖生产D-阿洛酮糖的过程中,GI(XI)催化葡萄糖异构化为D-果糖的效率一般≥50%,而由DTE催化的D-果糖异构化为D-阿洛酮糖效率一般约为30%,由此可见由葡萄糖直接转化获得D-阿洛酮糖这一过程的限速酶为DTE,因此若要提升以葡萄糖为原料生产D-阿洛酮糖的转化效率,仍然需要在提升DTE性能方面进一步研究。
3 阿洛酮糖的分离纯化
D-果糖到D-阿洛酮糖的转化是可逆反应,在最终达到反应平衡后,D-果糖依旧大量存在。由于生产D-阿洛酮糖的底物D-果糖与D-阿洛酮糖的性质极为接近,使得D-阿洛酮糖的分离纯化极为困难,从而制约D-阿洛酮糖的规模化生产。因此,开发简单有效的分离方法在D-阿洛酮糖的实现工业化方面变得极为重要。目前分离阿洛酮糖的方法主要有:1) 利用模拟移动床技术分离;2) 利用生物转化法分离。
3.1 模拟移动床色谱技术(SMB)纯化分离D-阿洛酮糖
模拟移动床色谱技术(Simulated chromatographic moving bed technology,SMB)是利用各组分在固定相和流动相中吸附和分配系数的微小差异,实现各组分彼此分离的连续色谱技术。模拟移动床来源于移动床色谱分离技术,在移动床色谱分离中,固定相在重力作用下自上而下运动,流动相在泵机的作用下由下向上运动,两者形成逆流并进行各自的循环,将固定相的移动速率设置在两种目的样品迁移速率之间,可以在不同出口连续得到两种目的样品[52-53]。固定相和流动相的连续流动会导致固定相材料的磨损,磨损的残渣会造成管道和阀门的堵塞,影响系统的稳定性,这些问题使得移动床色谱技术在实际运行中难以达到理想状态。
SMB技术使用装填于色谱柱中的静止分离介质,其色谱柱首尾连接成环,不断改变洗脱液入口和出口位置,使色谱柱发生相对运动[53]。周锦怡等[54]通过单柱实验筛选用于SMB分离D-果糖与D-阿洛酮糖的固定相,经过考察D-阿洛酮糖在不同类型树脂上的保留行为及分离效果,确定了Ca2+型树脂为适宜的固定相。Nguyen等[55]以Dowex50WX4-Ca2+离子交换树脂为固定相以模拟SMB过程,结果显示D-阿洛酮糖的纯度和收率分别为99.04%和97.46%,残液(D-果糖)的纯度和收率分别为99.06%和99.53%,D-阿洛酮糖和D-果糖都取得了较好的分离效果。Li等[31]使用Ca2+型固定相,以去离子水为洗脱剂,分离果糖与D-阿洛酮糖,经SMB分离后D-阿洛酮糖纯度可达98.5%。使用SMB进行D-阿洛酮糖产物的分离是一种高效的分离方法,不仅可以获得高纯度的D-阿洛酮糖,而且还可以分离出未反应的果糖或其他糖类,这些糖类还可继续用于D-阿洛酮糖的生产,残余糖利用率高,节省了大量生产成本,随着产量的增加,这种成本优势会愈发明显,非常适宜大规模工业化生产。
3.2 生物法分离纯化阿洛酮糖
虽然使用SMB分离方法可以将D-果糖与D-阿洛酮糖从反应液中分离出来,但是其设备投资较高、技术复杂,更适合大规模生产企业的应用。由于异构化反应中主要目的产物是D-阿洛酮糖,故可以考虑先将残余果糖转化为其他易于与D-阿洛酮糖分离的物质,再进行D-阿洛酮糖的分离纯化,目前常使用生物催化剂将剩余果糖进行转化。姜彦君等[56]在果糖转化为D-阿洛酮糖后,将混合糖液中的D-果糖作为底物进行酿酒酵母的好氧发酵,24 h后D-果糖被大量消耗,果糖去除率达94.22%,该过程虽然去除了大量果糖,但是未能产生其他有价值的产品,经济损失较大。袁堂国等[40]利用马克斯克鲁维酵母将未转化的果糖经无氧发酵后生成乙醇,将乙醇回收用作燃料,既减少了混合糖液中果糖的质量分数,降低了D-阿洛酮糖的分离难度,又能尽可能利用残余果糖。李灿[38]使用固定化GI先将反应残液中的D-果糖转化成葡萄糖,然后利用固定化葡萄糖氧化酶(Glucose oxidase,GOD)将生成的葡萄糖转化为葡萄糖醛酸,最后利用阴离子交换树脂吸附葡萄醛酸,并将葡萄醛酸回收利用,得到高质量浓度的D-阿洛酮糖溶液,最终D-阿洛酮糖的纯度达到91.2%,该方法不仅得到较高质量浓度的D-阿洛酮糖溶液,还能尽可能地对残余果糖进行回收,具有一定的工业化生产意义。
虽然以上方法降低了D-阿洛酮糖的分离难度,操作方法也较为简单,但是也降低了底物(如D-果糖)的利用率。生物法分离纯化D-阿洛酮糖存在以下劣势:1) 由于将其他菌株引入了发酵反应液,故难免会产生其他代谢废物,对以全细胞催化生产D-阿洛酮糖的工艺来说存在杂菌污染的风险;2) 反应液发酵产生的乙醇质量浓度低,将乙醇进行浓缩精馏也会带来额外的成本投入。因此,生物法分离纯化D-阿洛酮糖能否应用于工业化生产还有待商榷。生物法分离纯化D-阿洛酮糖的优势在于不仅不需要额外的设备投入,成本较低,而且操作方法简单有效,非常适合实验室研究。总之,两种D-阿洛酮糖分离纯化方法都可以取得良好的分离效果,有各自的适用环境,具体采用哪一种,可根据实际情况进行选择。
3.3 D-阿洛酮糖结晶
结晶是D-阿洛酮糖生产的最后一步,关系着最终产品的质量优劣和经济效益。在工业生产中最常用的结晶方法有蒸发法、降温法、真空冷却法和有机溶剂析出法等。由于D-阿洛酮糖在高温下会变色,并且其溶解度会随着温度变化而发生较大变化,因此D-阿洛酮糖常采用降温法进行结晶。此外,D-阿洛酮糖在有机溶剂中溶解度较低,也可采用有机溶剂析出法进行阿洛酮糖的结晶。
李灿[38]将模拟移动床分离得到的D-阿洛酮糖溶液浓缩,得到糖度为60,70,75,80的糖溶液,分别加入0.1%的400目的D-阿洛酮糖晶种,由65 ℃降温至4 ℃结晶,发现当糖度>75后加入晶种才能结晶,此方法的结晶率可达80%。赵哲卫等[57]先在D-阿洛酮糖浓缩液(质量分数≥85%)中加入晶种,在50~30 ℃温度区间内交替进行梯度降温和恒温结晶,当糖液温度为30 ℃停止结晶,结晶收率≥70%。采用降温结晶法对D-阿洛酮糖进行结晶,对设备要求低、工艺简单,便于实际生产,尤其适合大规模工业化生产加工。
有机溶剂析出法常用的析出剂是乙醇,乙醇与水分子的亲和力大于D-阿洛酮糖和水分子的亲和力,乙醇的加入可以将D-阿洛酮糖和水分子有效分离,从而促进D-阿洛酮糖析出晶体。佟毅等[58]开发了一种利用乙醇析出D-阿洛酮糖结晶的方法,在浓缩后的D-阿洛酮糖溶液中加入少量乙醇,再次浓缩,乙醇带走D-阿洛酮糖溶液中的水分,得到D-阿洛酮糖乙醇浓缩液,重复此步骤2~3次即可得到D-阿洛酮糖晶体。该方法一次结晶率高于50%,易于固液分离。郭元亨等[59]通过调节结晶过程中糖溶液密度、乙醇与糖液质量比、结晶时间和结晶温度来改进结晶工艺,认为:1) 糖液质量浓度应控制在1.35 g/L以下,过高的糖液密度会降低液体传热性能,易发生美拉德反应,影响产品品质;2) 乙醇与糖液质量比为3.8∶1,当乙醇加入量过高时部分D-阿洛酮糖会溶于乙醇,降低结晶率;3) 结晶时间宜低于5 h,结晶温度宜控制在25 ℃以下,此方法可尽量降低生产成本,结晶率可达71.58%。由于乙醇是易燃品,因此对结晶过程提出了更高的要求,在使用过程中乙醇需要回收,增加了成本。相较于降温结晶法,有机溶剂析出法中需要的D-阿洛酮糖浓缩液质量浓度低,不需要额外的浓缩步骤,因此在实际应用也具有一定的优势,生产者可根据浓缩液浓度或自身实际情况选择结晶方式。
4 结 论
作为一种高甜度、低热量的新型甜味剂,D-阿洛酮糖在食品领域具有广阔的应用前景。虽然在生物合成和分离纯化领域都已建立了比较系统的D-阿洛酮糖生产工艺,但是其在生物合成法方面还有较大的改进空间。笔者认为当前对D-阿洛酮糖的生物合成研究需要聚焦于2个方面:1) 继续提升DTE家族催化能力,提高D-阿洛酮糖转化率,增强酶的稳定性,提高酶的重复利用率,改善各种酶的催化环境,如降低DTE最适pH,减少褐变反应的发生等;2) 以全细胞催化的方式生产D-阿洛酮糖或将成为主流,构建重组食品安全菌株成为必需。随着越来越多国家通过对D-阿洛酮糖食品级应用的批准,D-阿洛酮糖的市场将保持快速增长,其在食品领域中的应用也将得到不断拓展。

