Cathepsin D在宫颈鳞状细胞癌中的表达及其临床意义*
欧阳晨捷 周东华 刘小燕 陈 莹
广东省佛山市妇幼保健院病理科 528000
在各国女性所罹患的恶性肿瘤中,目前宫颈癌是严重威胁女性生命健康的第二大“杀手”,据报道,在发达国家中宫颈癌5年存活率约为66%,而在发展中国家,甚至低于50%。而在我国女性所患宫颈癌中,每年新增人数约为9.89万,占世界宫颈癌总人数的17.4%,每年死亡的人数达到3.05万,有发病率不断上升及发病年龄日趋年轻化的迹象[1]。宫颈鳞状细胞癌是宫颈癌中最常见的组织学类型。目前宫颈癌的病因尚未完全明确,与宫颈癌发病相关的因素错综复杂,因此,提高宫颈癌的诊治水平是当下十分紧迫的任务。
近年来,研究发现组织蛋白酶(Cathepsins)作为人体中重要的信号分子,占体内酶的2%左右,有序地调节着人体的生命过程,并且受到严格的调控,一旦任何的失调,都会导致肿瘤的发生。根据氨基酸活化部位的不同,Cathepsins家族有11个成员,分布于各种哺乳动物组织的细胞溶酶体内,是一组具有强效的溶酶体水解酶,是一类肿瘤侵袭、转移相关的酶[2]。Cathepsin D是Cathepsins家族中的一员,其基因定位于染色体11p15.5,是一种天冬氨酸溶酶体蛋白水解酶,在不同恶性肿瘤组织中呈差异性的表达,在胃癌、结直肠癌等多种肿瘤的发生与发展中起到了促进的作用[3-4];但是,Cathepsin D在宫颈鳞癌中的表达情况鲜有相关报道。故本研究同时检测宫颈鳞状细胞癌和正常子宫颈组织中Cathepsin D蛋白的表达情况,分析Cathepsin D的表达水平与宫颈鳞状细胞癌中患者各病理特征的关系,对Cathepsin D在宫颈鳞癌发生发展过程中的作用做一初步探讨,为提高宫颈癌的诊治水平提供新的思路。
1 资料与方法
1.1 资料来源 本课题组收集了佛山市妇幼保健院病理科2018年1月—2020年8月由病理确诊的40例子宫颈鳞状细胞癌手术切除的患者组织标本及临床资料,同时选取同期正常的宫颈上皮组织标本28例作为对照组。纳入标准:(1)有完整的临床资料;(2)子宫颈鳞状细胞癌病例均为原发,取材前都未做过放、化疗等任何特殊治疗,也无特殊疾病史;(3)正常的宫颈上皮组织标本来源于因子宫肌瘤和(或)子宫腺肌症行子宫全切术的住院患者,术前常规行宫颈液基细胞学检查,未见异常,并通过病理证实为慢性宫颈炎的组织。排除标准:(1)合并有其他部位的恶性肿瘤;(2)正在参与其他课题组研究的病例。本实验中子宫颈鳞状细胞癌患者共40例,患者年龄28~65岁,中位年龄45岁,其中<45岁13例,≥45岁27例;肿瘤直径≤4cm 33例,>4cm 7例;组织学分级根据2014版世界卫生组织(WHO)标准,其中高分化13例,中~低分化27例;临床分期按照国际妇产科联盟(FIGO)2009年修订的标准,其中Ⅰ+Ⅱ期30例,Ⅲ+Ⅳ期10例;浸润深度<1/2肌层34例,≥1/2肌层6例;术中均进行淋巴结清扫,并经术后证实有淋巴结转移22例,无淋巴结转移18例。两位病理医师对所有实验对象的病理诊断一致。本研究通过了我院伦理委员会的审批。
1.2 主要试剂 鼠抗人单克隆抗体Cathepsin D(D-7):sc-377299购自美国Santa Cruz Biotechnology,Inc,免疫组织化学Power Vision二步法试剂盒(PV-9000)购自北京中杉金桥生物技术有限公司,DAB显色试剂盒购自北京中杉金桥生物技术有限公司。
1.3 免疫组织化学染色方法 所有组织标本切开固定于10%的福尔马林里,用石蜡包埋好的蜡块连续切片2张,分别用于HE染色和免疫组织化学染色,每张切片的厚度为4μm,使用环保透明剂脱蜡,梯度乙醇脱水。将处理好的组织切片用0.01mol/L的枸橼酸缓冲液高压修复10min,冷却到室温后,PBS冲洗3次,每次3min;3%H2O2室温孵育10min,PBS冲洗3次,每次5min;滴加稀释浓度为1∶50的Cathepsin D一抗后,按Power Vision二步法免疫组织化学试剂盒(PV-9000)的说明书操作进行。DAB显色剂显色,苏木素复染,返蓝,脱水,透明,中性树脂封片,显微镜下观察。以Cathepsin D抗体试剂盒说明的涎腺组织作为阳性对照标本,同时采用PBS液取代一抗作为阴性对照标本。
1.4 结果判定 Cathepsin D蛋白阳性表达主要为细胞质内出现棕黄色或棕褐色颗粒,但要考虑到着色的强度及阳性细胞所占比例。本实验建立了一个分值累加的系统:(1)按着色强度打分:无着色0分,淡黄色颗粒1分,棕黄色颗粒2分,棕褐色颗粒3分;(2)在目镜视场数为22的200倍显微镜下,随机看5个视野,取平均值,按阳性细胞所占比例打分:<1%计为0分,1%~10%计为1分,>10%且≤50%计为2分,>50%且≤80%计为3分,>80%计为4分。将(1)(2)两项分值相加为免疫组化最终评分,阴性:0~1分,阳性:2~7分。全部实验对象的免疫组织化学染色切片由两位病理医师一致性双盲观察诊断完成。
1.5 统计学方法 所得数据输入SPSS25.0软件并进行统计学的分析。各组间率的差异采用χ2检验。两组变量间的相关分析采用Spearman等级相关分析。检验采用双侧检验,P<0.05时为差异有统计学意义。
2 结果
2.1 Cathepsin D的免疫组织化学结果 应用Power Vision二步法检测结果显示,Cathepsin D蛋白主要表达于细胞质,阳性颗粒为棕黄色或棕褐色。本组40例宫颈鳞状细胞癌组织中38例为阳性,2例为阴性,阳性表达率为95.0%;28例正常子宫颈组织中4例为阳性,24例为阴性,阳性表达率为14.3%。两组间Cathepsin D蛋白的表达不完全相同,且Cathepsin D蛋白的表达在宫颈鳞癌组织中的阳性率显著高于正常子宫颈组织(χ2=45.437,P<0.01)。
2.2 Cathepsin D在宫颈鳞癌组织中的表达及与临床病理特征的关系 如表1所示,经过统计学分析,Cathepsin D蛋白的表达与宫颈鳞癌组织的分化程度、临床分期、浸润深度及淋巴结转移密切相关,差异有显著的统计学意义(P<0.05),而与患者的年龄、肿瘤直径的大小无关,差异无统计学意义(P>0.05)。
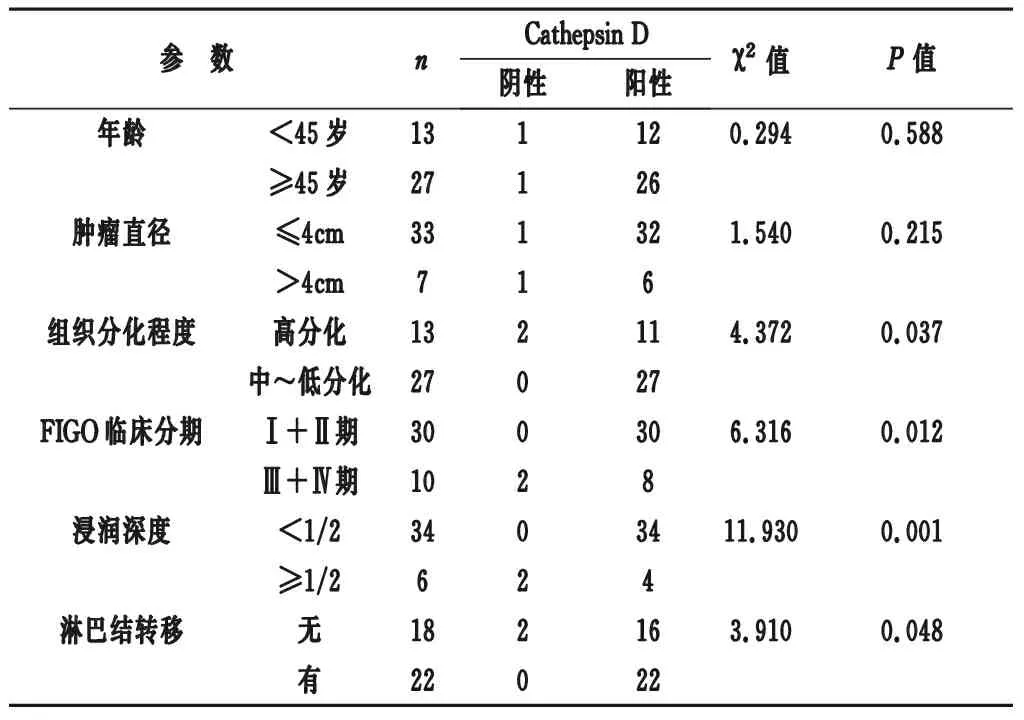
表1 Cathepsin D与宫颈癌组织中各临床病理参数之间的关系
3 讨论
宫颈鳞癌的发生发展是一个循序渐进的过程,从组织非典型增生到原位癌再到浸润癌,病因尚不完全清楚。目前对宫颈鳞癌的早期诊断及预测转移也无统一的肿瘤标志物。但是,宫颈癌的治疗效果与是否转移密切相关。随着近年来肿瘤研究的不断深入和发展,有关Cathepsin D的分子生物学研究也得到了极大的发展。新近研究表明,Cathepsin D不仅在生理情况下起着至关重要的作用,而且与肿瘤的发生发展也关系密切。
Cathepsin D主要分布在细胞内溶酶体、囊泡、吞噬体及次级内涵体内,最开始是以天冬氨酸蛋白酶原(相对分子量为52000)的形式合成于粗面内质网,接着被快速转移到核内体,具有活性,形成单链中间产物(相对分子量为48000),并且在酸性环境中完全活化,形成有催化活性的重链(相对分子量为34000)和轻链(相对分子量为14000)蛋白,在生理情况下,Cathepsin D促进正常细胞分裂、增殖和移动[5]。
Cathepsin D的异常表达可导致细胞分裂、增殖和移动的异常,最终促使肿瘤的发生与发展[6]。在肿瘤的酸性微环境中,Cathepsin D的高表达可作为一种丝裂原会引起有丝分裂时,有丝分裂原底物的调控失常引起细胞分化的缺乏,并且刺激细胞不断迅速分裂、生长,继续分裂、生长来达到细胞生长的失常引起克隆性无限增殖[7]。本研究检测了Cathepsin D在宫颈鳞状细胞癌组织和正常宫颈组织的表达,免疫组织化学法显示Cathepsin D蛋白在癌组织和正常宫颈组织中均有表达,但是Cathepsin D在癌组织中的阳性率显著高于正常宫颈组织,符合宫颈鳞癌的进展过程,可提示Cathepsin D的表达上调促进了宫颈鳞癌的发生与发展。
Cathepsin D作为Cathepsins家族中的一员,是一种强效的溶酶体水解酶,在多种肿瘤的侵袭转移中发挥着至关重要的作用。研究表明,Cathepsin D的表达上调通过水解作用会促进基底膜和细胞外基质的降解[8],导致细胞骨架的崩塌,引起细胞黏附性的下降,且对血管和淋巴管的基底膜有溶解作用,并在周围形成溶解区域,成为肿瘤细胞的移动通道,促使肿瘤细胞的侵袭性生长。除此之外,Cathepsin D的过度表达还可激活溶酶体靶通道,让Cathepsin D蛋白酶原及其他溶酶体酶不断分泌和释放[9],进一步促进了周围局部溶解区域的形成,为肿瘤细胞的侵袭转移提供了非常便利的“绿色”通道,进而激发了肿瘤细胞侵袭转移的潜能。本研究通过分析发现,Cathepsin D蛋白的表达与宫颈鳞癌组织的分化程度、临床分期、浸润深度及淋巴结转移密切相关,差异有显著的统计学意义(P<0.05),支持宫颈鳞癌的进展过程,可提示Cathepsin D的表达上调促进了宫颈鳞癌的侵袭转移。相关报道指出[10],血清中Cathepsin D水平在宫颈鳞癌组是显著高于不典型增生组和慢性宫颈炎组,与宫颈鳞癌临床分期、分化程度、间质浸润深度、盆腔淋巴结转移有不同程度相关,对宫颈鳞癌的诊断与转移预测具有非常重要的价值,与本课题组在组织学上对Cathepsin D蛋白表达水平的检测相一致,并且在肿瘤的分化程度、临床分期、浸润深度及淋巴结转移上都是密切相关的。
综上所述,Cathepsin D在子宫颈鳞状细胞癌发生发展过程中表达逐渐升高,说明Cathepsin D在宫颈癌的发生发展中起到了一定的促进作用,可能参与了宫颈鳞癌的侵袭转移过程,检测其表达情况有可能为评估宫颈鳞状细胞癌的转移潜能和预后提供参考依据。Cathepsin D促癌作用的机制可能与促进有丝分裂、基底膜和细胞外基质降解和激活溶酶体靶通道等途径有关,但这一推测需要后续的实验研究进一步验证,其具体机制还有待进一步深入探讨。

