妊娠期糖尿病患者血清microRNA-122、血管内皮生长因子的表达及与围生儿结局的关系*
杨雅嵋,张程举,胡灏懿,刘胜凤,冉伟
(1.川北医学院附属医院 妇产科,四川 南充 637002;2.南充市中医医院 妇产科,四川 南充 637000)
妊娠期糖尿病(gestational diabetes mellitus,GDM)会使胎盘基底膜、胎盘的细胞功能及其细胞外基质发生改变,影响胎盘生长,导致胎儿营养物质运输与吸收障碍,进一步造成胎儿生长发育异常[1]。目前GDM 的发病机制尚未完全明确,现公认的发病机制有拮抗胰岛素激素水平升高、胰岛素对抗等[2]。近年来,有学者提出GDM 与2 型糖尿病的发病机制相似[3]。
血管内皮生长因子(vascular endothelial growth factor,VEGF)主要通过增加血管通透性参与糖尿病发病机制,改变血管内皮细胞基因表达及促进该基因的有丝分裂,诱导新血管生成[4]。VEGF 在糖尿病肾病和糖尿病视网膜病变的血管改变中均起重要作用[5]。调控基因表达主要分为mRNA 翻译为蛋白质和调控DNA 的转录过程,前者为非编码RNA 的调控,以microRNA(miRNA)最受关注[6]。越来越多研究证实,miRNA 能够调控血糖的代谢过程,不过有关miR-122 在糖尿病的表达研究较少。本研究目的在于探讨miR-122、VEGF 是否参与GDM 病理的改变,并分析两者对GDM 患者围生儿结局的影响。
1 资料与方法
1.1 一般资料
选取2018 年5 月—2020 年1 月川北医学院附属医院妇产科收治的GDM 患者80例作为研究组。其中,初产妇52例,经产妇28例;年龄20~38岁,平 均(29.36±4.12)岁;孕 周31~39周,平 均(35.20±1.36)周。另选取同期在本院产检的健康妊娠女性70例作为对照组。其中,初产妇45例,经产妇25例;年龄20~37岁,平均(29.03±4.07)岁;孕周30~39周,平均(35.07±1.18)周。研究组中胎膜早破3例,胎儿窘迫4例,早产4例,将患者分为不良组与良好组,分别有11例和69例。两组分娩经历、年龄、孕周等一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究属于前瞻性研究,且符合《赫尔辛基宣言》[8]。
1.2 纳入与排除标准
1.2.1 纳入标准①符合《妊娠合并糖尿病诊治指南(2014)》[7]诊断标准;②为妊娠期首次诊断;③无其他妊娠合并症;④入组近1 周内未使用过糖代谢药物;⑤已签署研究知情同意书。
1.2.2 排除标准①胎儿唐氏综合征;②胎儿心脏发育异常;③胎儿宫内发育受限或畸形。
1.3 方法
1.3.1 血糖及VEGF 水平检测抽取受试者2 mL静脉血,采用GLM-77 型血糖分析仪(上海益联医学仪器发展有限公司)测定患者空腹血糖(fasting blood glucose,FGB)、餐后2小时血糖(2 hour postprandial blood glucose,2 hPG)、糖化血红蛋白(glycosylated hemoglobin,HbA1c);另抽取受试者静脉血3~4 mL,3 000 r/min 离心10 min,分离血清,采用IAMMGE 特定蛋白分析仪(美国贝克曼公司)行酶联免疫吸附试验测定VEGF。
1.3.2 实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)检测miR-122 表达采集受试者外周静脉血3~4 mL,3 000 r/min 离心5 min,取血清,置于混凝管中,加入miRNA Extractor 混匀分装至EP管,置入-70℃冰箱冷冻保存。提取miRNA,取出样本室温下放置5~10 min,完全分离核酸与核蛋白,加入氯仿0.2 mL,震荡30 s,12 000 r/min 离心15 min,吸取上层水相置于新的EP 管中,加入1/3 倍无水乙醇混匀,加入吸附柱中,12 000 r/min 离心10 min,收集穿流液到新的EP 管中,加入2/3 倍无水乙醇混匀,将全部溶液用转液器加入吸附柱中,7 500 r/min 离心5 min,倒掉收集管中的废液。再将吸附柱放回收集管,12 000 r/min 离心2 min,倒掉收集管中的废液,再重复1 次。最后将吸附柱放回收集管,12 000 r/min离心2 min,置入新的EP管中,加入30 μL RNase-free水,12 000 r/min 离心2 min,弃吸附柱,保留流出液。逆转录合成cDNA,离心管中加入各种反应成分,混匀12 000r/min 离心3~5 s,反应混合物应用TPfofessional Standard PCR 仪(德国Biometra公司)37℃温浴60 min,85℃加热5 min,使酶失活。qRT-PCR 反应中miR-122 的引物序列,正向引 物:5'-GCGGTCGACATGGTGGAATGTGGAGGTGA AG-3',反向引物:5'-GGAATTCAAAAAAGATTGAG AAGACTGATATC-3',均130bp。获得cDNA样本后,4℃保存。加入相应的样本、试剂,加样,应用实时荧光定量PCR 仪进行反应体系操作。数据采集应用2-ΔΔCt法。
1.3.3 随访自研究组在本院确诊妊娠期糖尿病开始,以电话、微信、短信的形式进行随访,直至其结束妊娠。若参与者中途转至其他医院产检,则随访终止。统计研究组胎膜早破、胎儿窘迫、早产等不良围生儿结局的发生情况。
1.4 统计学方法
数据分析采用SPSS 23.0 统计软件。计量资料以均数±标准差()表示,比较用t检验;相关性分析用Pearson 法;绘制ROC 曲线。P<0.05 为差异有统计学意义。
2 结果
2.1 两组血糖水平比较
两组血糖水平比较,经t检验,差异有统计学意义(P<0.05),研究组高于对照组。见表1。
表1 两组血糖水平比较()
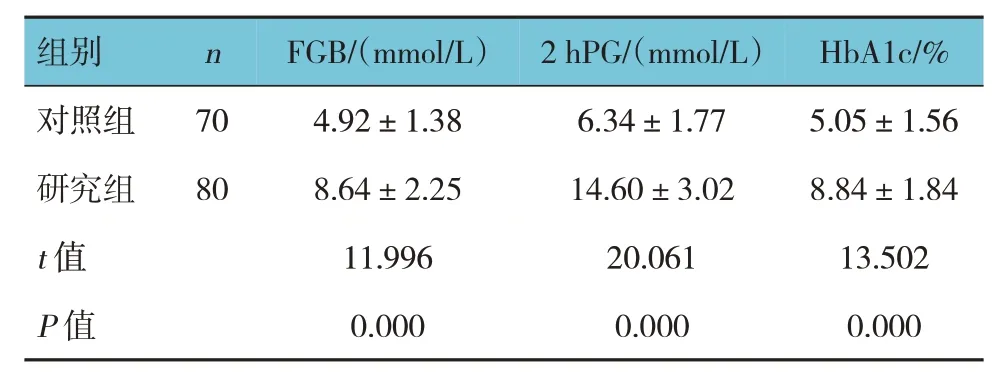
表1 两组血糖水平比较()
2.2 两组miR-122、VEGF比较
两组miR-122、VEGF 比较,t检验,差异有统计学意义(P<0.05),研究组高于对照组。见表2。
表2 两组miR-122、VEGF比较()
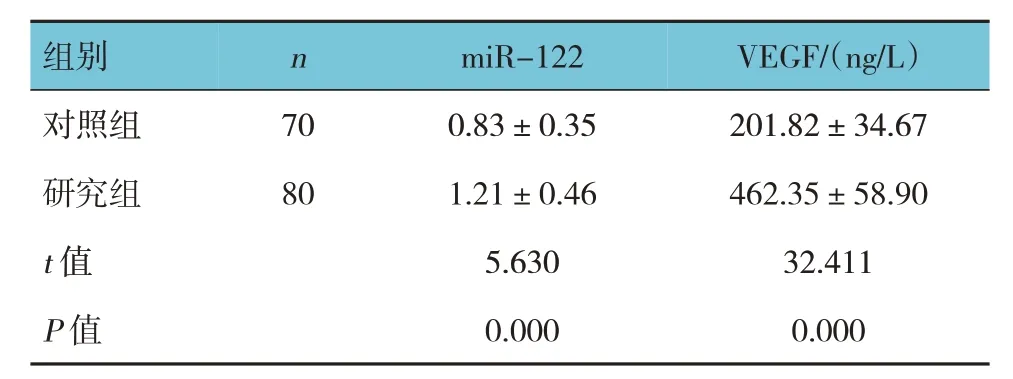
表2 两组miR-122、VEGF比较()
2.3 GDM患者miR-122、VEGF与血糖的相关性
Pearson 相关性分析结果显示,GDM 患者miR-122 与FGB、2hPG和HbA1c呈正相关(r=0.605、0.752 和0.542,均P=0.000),VEGF与FGB、2hPG和HbA1c呈正相关(r=0.532、0.623 和0.596,均P=0.000)。
2.4 不良组与良好组miR-122、VEGF比较
两组miR-122、VEGF 比较,差异有统计学意义(P<0.05),不良组高于良好组。见表3。
表3 不良组与良好组miR-122、VEGF比较()
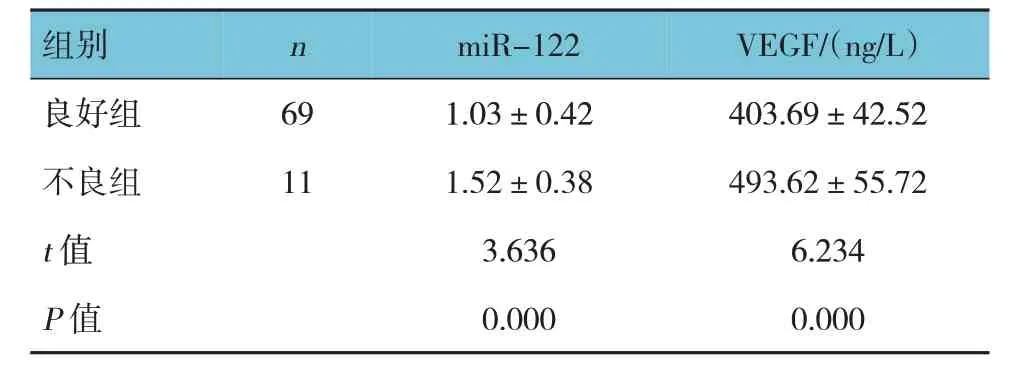
表3 不良组与良好组miR-122、VEGF比较()
2.5 ROC曲线分析
ROC 曲线结果显示,miR-122、VEGF 及两者联合检测GDM 患者不良围产儿结局的AUC 分别为0.787(95% CI:0.687,0.887)、0.755(95% CI:0.658,0.851)、0.842(95% CI:0.760,0.923)。miR-122 诊断GDM 患者不良围生儿结局的敏感性、特异性为0.822(95% CI:0.792,0.911)和0.615(95% CI:0.560,0.741),VEGF 诊断GDM 患者不良围生儿结局的敏感性、特异性为0.778(95% CI:0.645,0.874)和0.446(95% CI:0.382,0.576),两者联合检测诊断GDM 患者不良围生儿结局的敏感性、特异性为0.867(95% CI:0.802,0.937)和0.569(95% CI:0.464,0.664)。见表4 和图1。
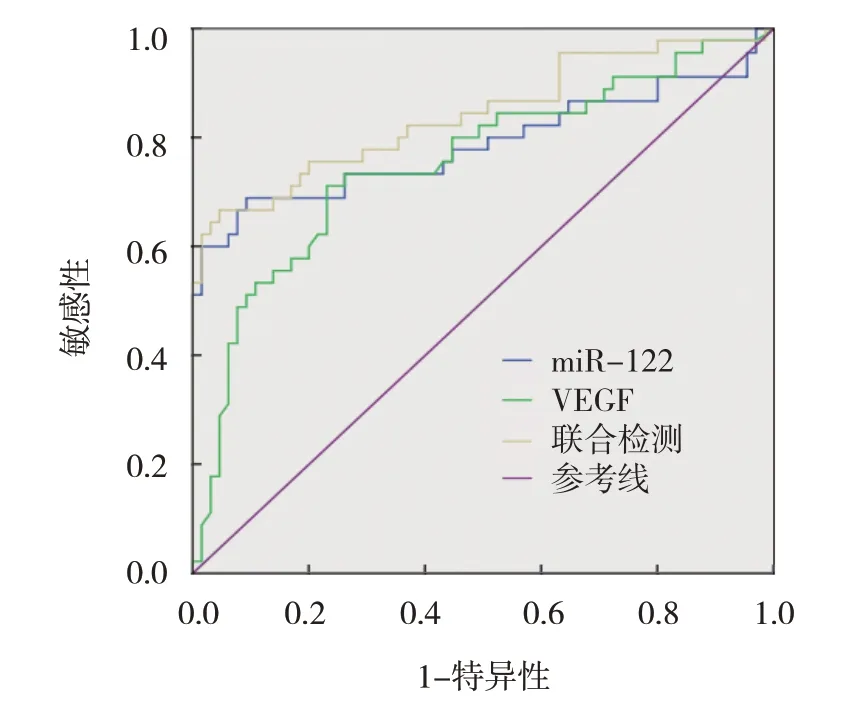
图1 miR-122、VEGF及两者联合检测预测GDM患者不良卫生儿结局的ROC曲线
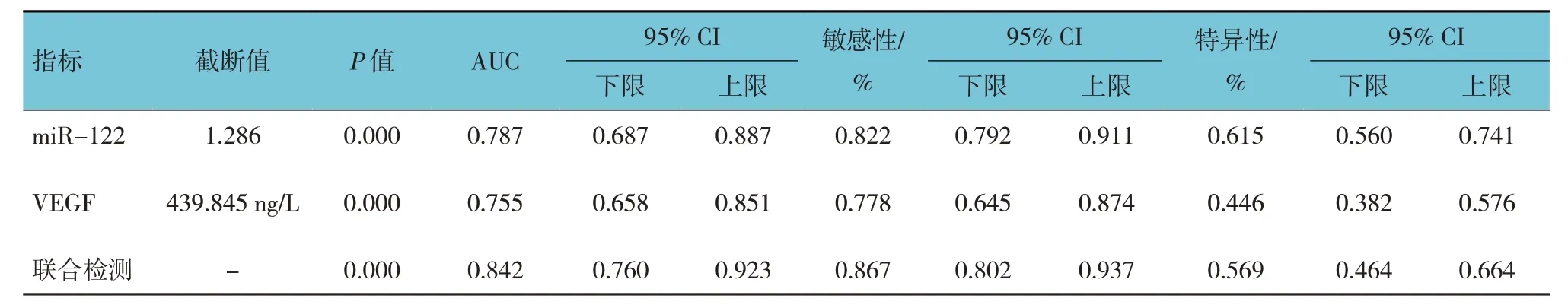
表4 miR-122、VEGF及两者联合检测预测GDM患者不良卫生儿结局的ROC曲线参数
3 讨论
女性妊娠期间随孕周的增加,体内胎盘泌乳素、孕激素、催乳素等拮抗胰岛素激素水平会显著升高,使得胰岛素敏感性降低。正常情况下,机体为维持正常的血糖代谢,会不断分泌胰岛素,而GDM 患者胰岛素分泌受限无法完成代偿,便会造成体内血糖水平升高[9]。血糖的病理改变虽然不会给胎盘带来特异性结构的改变,但会影响许多形态上的变化,如胎盘细胞滋养层增生、绒毛小动脉增生、小血管管腔狭窄、滋养层基底膜变厚等,同时绒毛毛细血管过度充盈、毛细血管扩张,这一系列的变化是造成胎盘慢性缺氧及新生儿窒息、胎膜早破、胎儿窘迫等新生儿不良结局的主要原因[10]。此外,血糖的升高会使胆酸含量增多,引发肝内胆汁淤积症,提高子宫前列腺素水平,刺激子宫平滑肌催产素受体,引发严重宫缩,造成早产[11]。MUCHE等[12]研究指出,GDM 会增加新生儿不良结局的风险。因此,早期及时诊断GDM,采取救治措施对改善母婴结局十分重要。
GDM 的胎盘滋养细胞的生存内环境遭到破坏,细胞功能发生适应性改变,可诱导胎盘组织凋亡[13-14]。这一过程与胎盘组织的血供有密不可分的关系,而VEGF 因子是目前已知最强的血管生成因子之一。本研究结果显示,研究组VEGF 水平高于对照组,初步推测血清VEGF 异常表达可能与GDM有关。分析原因可能在于:①胎盘血管密布及胎盘床血管内皮损伤,可造成其血液灌注不足,血管活性物质分泌失衡,最终会引起胎盘血氧供应缺失[15];高血糖状态下细胞无氧酵解增强,为适应高糖环境,糖酵解相关酶基因转录水平会发生改变,导致胎盘微血管的慢性缺氧[16];③胎盘血管壁变厚,管腔狭窄,绒毛或部分绒毛发育不成熟,且绒毛毛细血管过分充盈,毛细血管扩张,从而导致胎盘微血管的慢性缺氧[17]。以上过程均会导致VEGF 表达异常升高,造成胎盘形成障碍,是引发早产及流产的重要原因。
miRNA 可以与靶基因mRNA3'端非编码区互补结合,在翻译水平或转录后参与基因的表达调控。如今miRNA 在高血脂、糖尿病等多种代谢疾病中的作用逐渐受到关注。ZHU等[18]在妊娠期糖尿病患者基因中获得了184 个低miRNA 靶向上调基因和234 个高miRNA 靶向下调基因,另有67 个上调基因和48 个下调基因受到miRNA 异常交替的调控。DENG等[19]研 究指出,GDM 患者血清miR-29a/b 表达下调。ANJA等[20]研究指出,血清miR-16、miR-29a 和miR-134 在GDM 患者中呈高表达。禤文婷等[21]体外细胞实验证实,软脂酸诱导胰岛素抵抗状态下,miR-122 表达显著上调,原因为miR-122 可通过下调AMPK基因表达,进一步加重胰岛素抵抗程度。本研究结果显示,研究组血清miR-122 表达高于对照组,提示GDM 患者miR-122 表达异常可能与胰岛素抵抗有关。主要机制是通过上调二脂酰甘油酰基转移酶2 基因和固醇调节元件结合蛋白1基因调节脂肪酸、低密度脂蛋白受体和胆固醇合成途径,并催化甘油三酯类合成,从而参与胰岛素抵抗调节。但也有研究得出不一样的结论,FORNES等[22]研究显示,miR-122 的表达在妊娠期糖尿病大鼠及其雄性胎儿的血浆中下调,且miR-122 水平可通过体外过氧化物酶体增殖物激活受体γ 活化和体内富含过氧化物酶体增殖物激活受体配体的母体饮食进行调节。鉴于miR-122 在GDM 患者中表达的相关研究较少,此结果还需日后扩大实验范围进一步获取实验数据。
综上所述,GDM 患者血清miR-122、VEGF 均存在表达失调,两者与血糖呈正相关,且两者联合检测可有效预测不良围生儿结局的发生。

