第29届国际生物学奥林匹克竞赛试题理论2-2
周 洁 杨 扬 张 立 张雁云 范六民
(1华中师范大学第一附属中学 湖北武汉 430223 2清华大学生命科学学院 北京 100084 3北京师范大学生命科学学院 北京 100875 4北京大学生命科学学院 北京 100871)
总时间为3 h。你将在屏幕顶部找到一个倒计时的个人时钟。
你可使用右上角的下拉菜单选择语言。
举起你的旗帜以引起工作人员的注意。
题目
1~16题:生物化学与细胞生物学;17~31题:动物生理学与解剖学;32~40题:植物生理学;41~51题:生态学与进化。
将采用以下计分方案:
1)有4个陈述的问题:

正确的陈述数量0 1 2 3 4分数0.0 0.0 0.0 0.5 1.0
2)有5个陈述的问题:

正确的陈述数量0 1 2 3 4 5分数0.00 0.00 0.00 0.25 0.75 1.25
注意:没有负分。尝试回答尽可能多的问题。
8.酪氨酸激酶受体:将编码细胞表面酪氨酸激酶受体(RTK)基因的2种不同突变形式分别插入载体中。一个突变体编码具有非功能性激酶结构域的蛋白质,另一个突变体缺乏功能性配体结合结构域。将每种载体分别引入可从其内源基因表达出野生型RTK的正常细胞中。
已知所用细胞在其表面具有较高的RTK受体结合能力。该配体与受体蛋白的单体形式结合,且异源二聚体受体在信号转导中无活性。下图描绘了4种已鉴定的细胞类型。每个图显示了在各细胞类型上观察到的仅有的受体形式,以及观察到的比例。
实验在添加非饱和浓度的配体条件下进行。
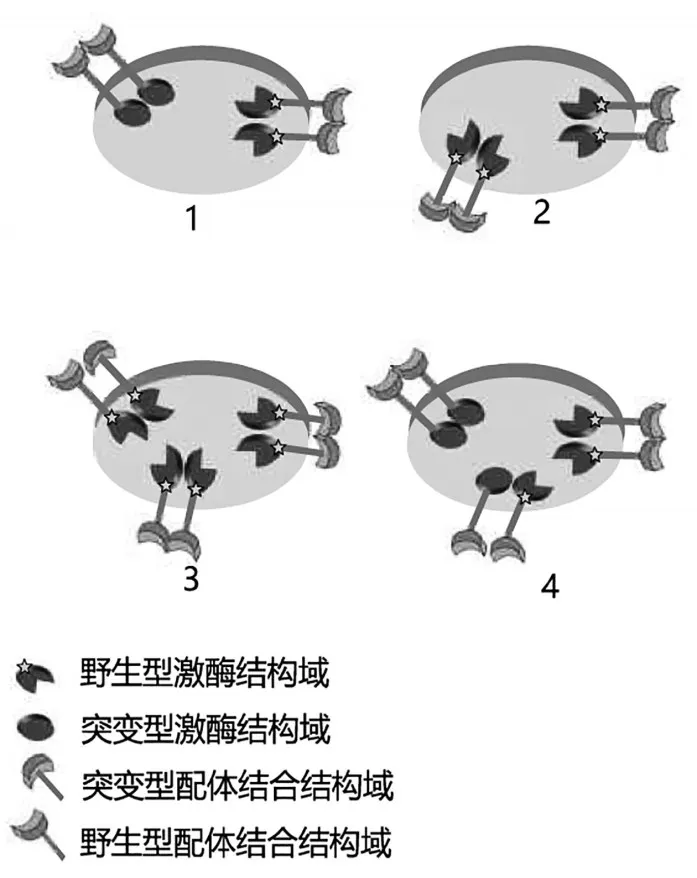
判断以下陈述是否正确。
A.在1型细胞中,具有非功能性激酶结构域的突变体受体将通过细胞的正常RTK干扰信号转导
B.在2型细胞中,缺乏功能性配体结合结构域的突变体RTK对信号转导无活性,但不会干扰细胞自身酪氨酸激酶受体介导的正常信号转导
C.3型和4型细胞将体现相同的信号转导水平
D.2型细胞和3型细胞的突变体RTK对细胞自身正常RTK的信号转导水平的影响将是相同的
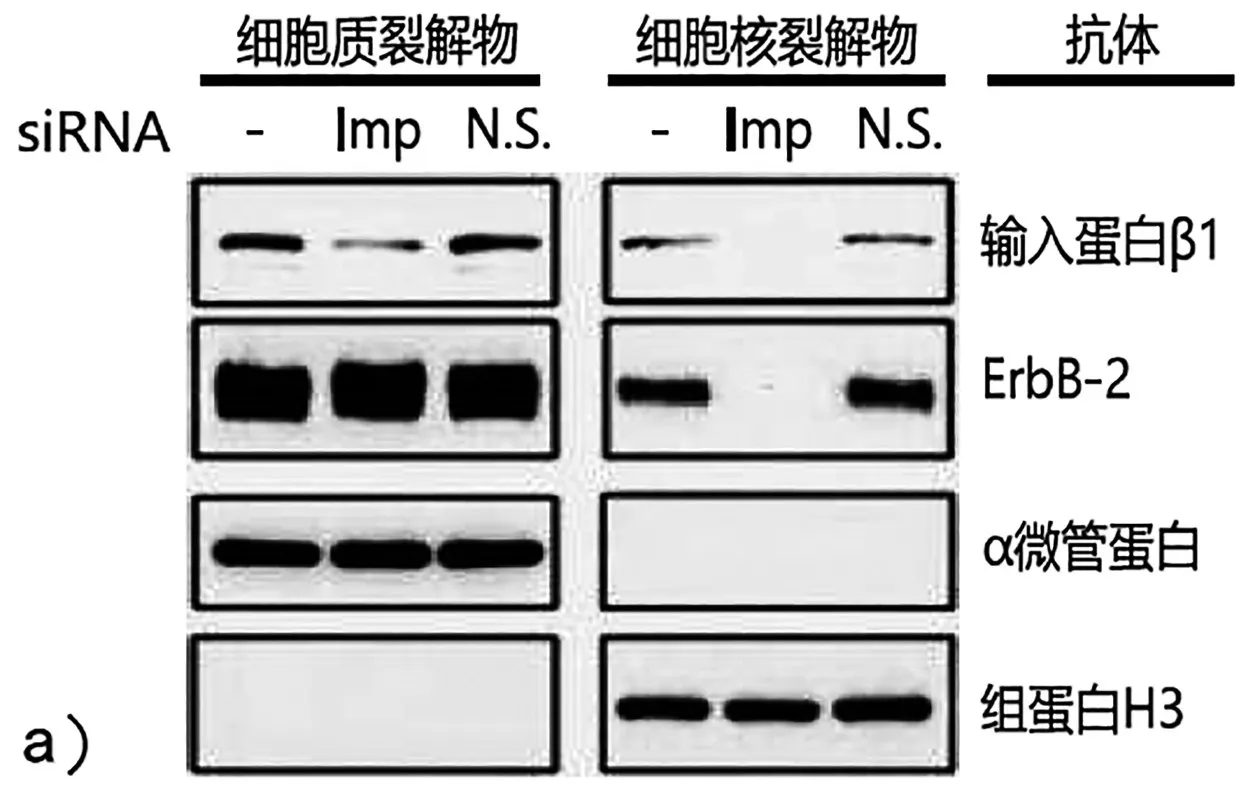
9.ErbB-2蛋白的运输:ErbB-2是在哺乳动物细胞膜上发现的受体,可从细胞膜移动至细胞核。由于在细胞质与细胞核之间穿梭的大多数蛋白质是可溶的而不是整合的膜结合蛋白,因此,ErbB-2运输至细胞核的机制是特别令人感兴趣的。进行了下面描述的3个实验以阐明潜在的机制。
实验1:siRNA敲低靶细胞输入蛋白β1的表达。用输入蛋白β1的siRNA(Imp)、非功能性siRNA对照(N.S.)或仅缓冲液(-)转染细胞。Western blot用于检测细胞裂解物中的细胞核和细胞质部分的蛋白。蛋白的检测,使用输入蛋白β1、ErbB-2、α微管蛋白和组蛋白H3的抗体。
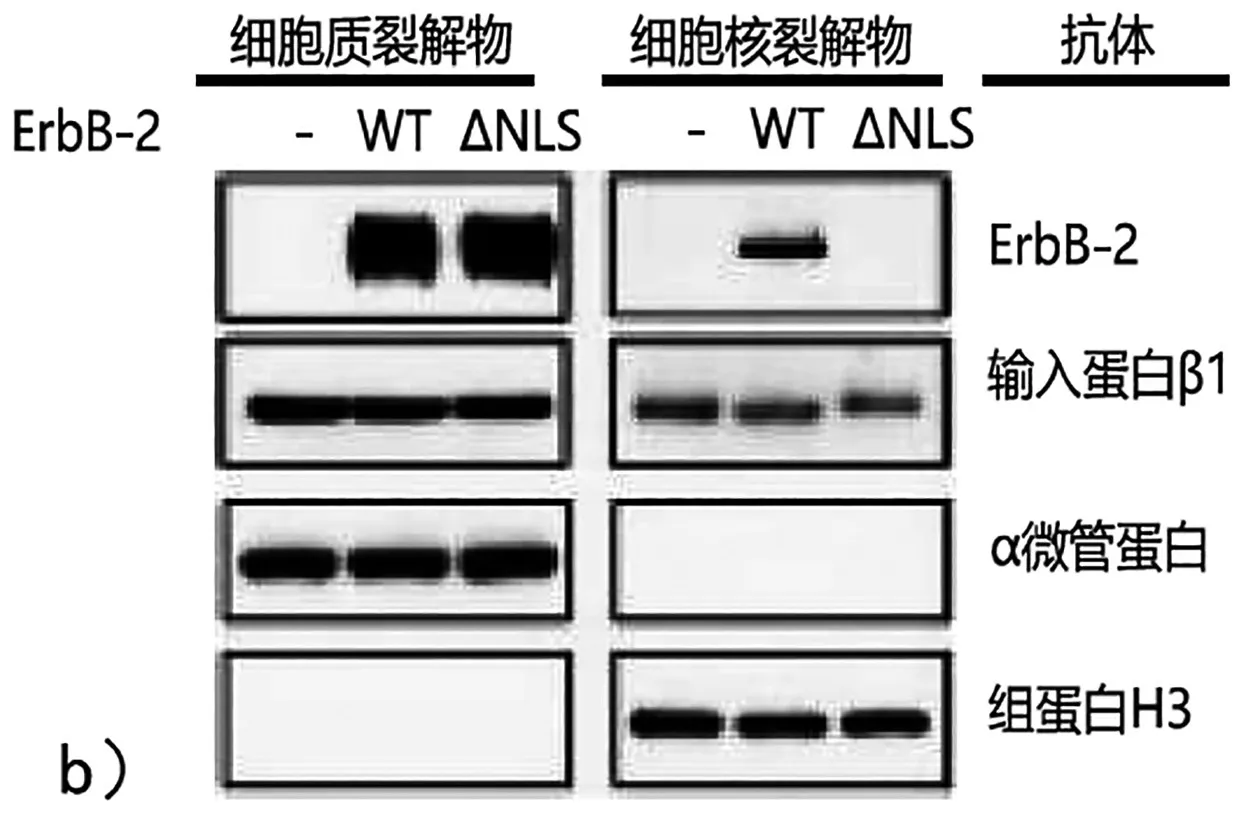
实验 2:用野生型 ErbB-2(WT)、缺少核定位信号ErbB-2突变体(ΔNLS)或载体对照(-),转染缺乏ErbB-2编码基因的突变细胞。然后通过Western blot分析来自细胞质组分和细胞核组分的蛋白质,使用ErbB-2、输入蛋白β1、α微管蛋白和组蛋白H3的抗体。
实验3:用抗ErbB-2抗体或小鼠IgG(mIgG)免疫沉淀细胞裂解物。然后通过Western blot分析沉淀的免疫复合物和细胞裂解物,使用网格蛋白、输入蛋白β1和ErbB-2的抗体。

判断以下陈述是否正确。
A.图a中的数据表明,ErbB-2需要输入蛋白β1才能进入细胞核
B.预计输入蛋白β1的抗体不会沉淀ErbB-2(ΔNLS)
C.所呈现的数据表明,组蛋白到细胞核的定位是由一种不同于运输ErbB-2的不同的机制介导的
D.与其他膜结合受体一样,ErbB-2通过胞吞作用进入细胞质
10.酵母分泌物捕获:植物病原体利用其分泌的蛋白质“分泌蛋白组”攻击植物宿主。酵母分泌物捕获(yeast secretion trap,YST)功能筛选是用于分离和鉴定这些分泌蛋白质的方法。该方法涉及构建载体文库,包括利用突变的酿酒酵母(Saccharomyces cerevisiae)suc2报告基因融合的植物病原体RNA的cDNA(含有5′非编码序列)。
Suc2编码的蛋白质是酵母菌用于催化蔗糖降解的唯一转化酶。降解发生在细胞外。该基因的突变形式(suc2-sp)编码的转化酶氨基末端缺乏分泌信号肽。融合文库用于转染转化酶缺陷型酵母菌株,随后将细胞接种在蔗糖选择培养基上。预期每个恢复的细胞含有重组载体,其cDNA编码嵌合蛋白的信号肽。分离载体并对其cDNA进行测序以鉴定分泌的蛋白质。
图1是载体的示意图,图2总结了上述实验流程。
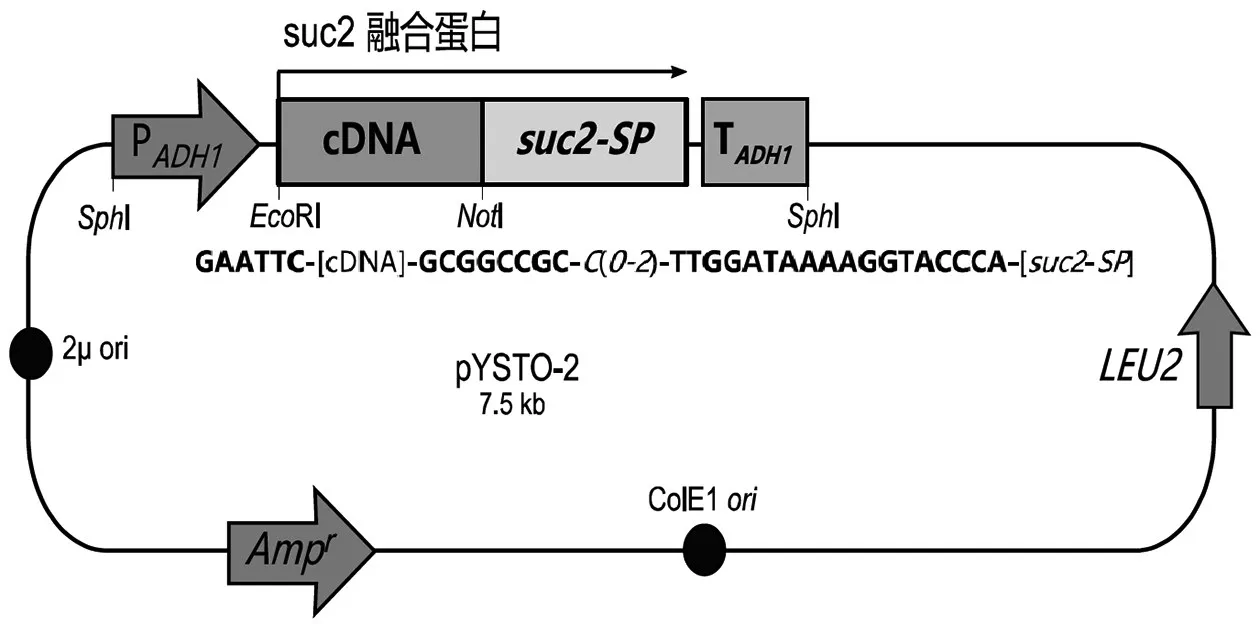
图1 GAATTC:EcoRI识别位点;GCGGCCGC:NotI识别位点

图2
判断以下陈述是否正确。
A.为实现该筛选,oligo-dT引物可用于合成cDNA
B.载体中NotI位点后可变数目的胞苷核苷酸可确保获得正确的阅读框
C.融合蛋白中信号肽的存在不一定能确保酵母在选择培养基上的生长
D.为了将EcoRI和NotI位点引入cDNA分子的末端,连接子(linker,其为短双链寡核苷酸;实例如下所示)优于适配子(adpter,其具有单链末端;实例如下所示)。
EcoRI连接子的实例:
-GAATTC-
-CTTAAG
NotI适配子的实例:
-G- 和-AATTC-
-CTTAA- -G-
11.酶-辅酶相互作用:许多引起酶编码基因突变的疾病会影响酶与其辅酶相互作用的相关参数,从而降低反应速率。称为TPP-或硫胺素依赖性酶(例如,转酮酶)的一组酶的辅酶是硫胺素焦磷酸(thiamine pyrophosphate,TPP)。
分别从患者及正常个体组织分离出TPP依赖性酶,并在底物饱和的条件下,比较二者的动力学性质。制备无TPP形式的酶并用于酶动力学测量。Lineweaver-Burk样图如下图所示。
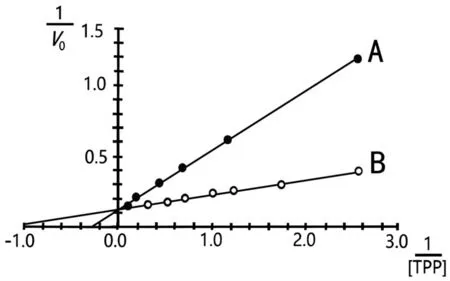
判断以下陈述是否正确。
A.A与病人的酶有关
B.B的最大速率高于A的最大速率
C.可得出结论,A中的酶对其底物具有较低的亲和力
D.向患者施用硫胺素预期可恢复酶活性
12.Förster共振能量转移:Förster共振能量转移(Förster resonance energy transfer,FRET)是一种依赖于距离的过程,来自被激发的荧光分子(供体)的能量被转移至其附近的第2个非激发分子(受体)。FRET效率取决于供体发射光谱和受体吸收光谱的光谱重叠。各种形式的FRET中的受体在从供体接收能量后可能会或可能不会发出荧光。
量子点(quantum dots,QD)是荧光纳米粒子,可作为FRET供体,用于生物传感器系统。一些分子与QD的结合增强了QD的发射性质。在该研究中,使用560 nm发射的QD(QD-560)。麦芽糖结合蛋白(maltose binding protein,MBP)-结合的QD-560比未结合的QD-560具有更高的发射强度。
在一系列蛋白质∶QD比率下,测试了天然MBP或 5-组 氨 酸 标 记 的 MBP(MBP-5His)与QD-560结合对荧光强度的影响(图1)。组氨酸残基可结合QD颗粒表面的锌离子。
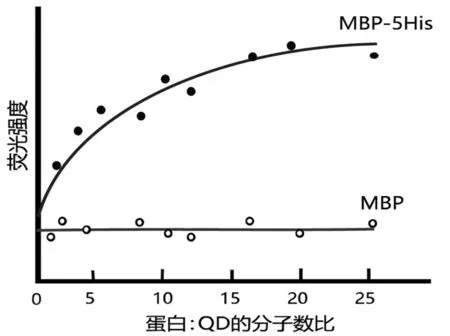
图1 与MBP或MBP-5His结合的QD在560 nm下的荧光测量
为了构建麦芽糖检测生物传感器,每个与QD配合的MBP-5His的糖结合口袋预加载一个麦芽糖类似物,即β-环糊精。β-环糊精(β-CD)与QSY9结合,形成β-CD-QSY9。QSY9成分吸收光线。图2显示了这个生物传感器。
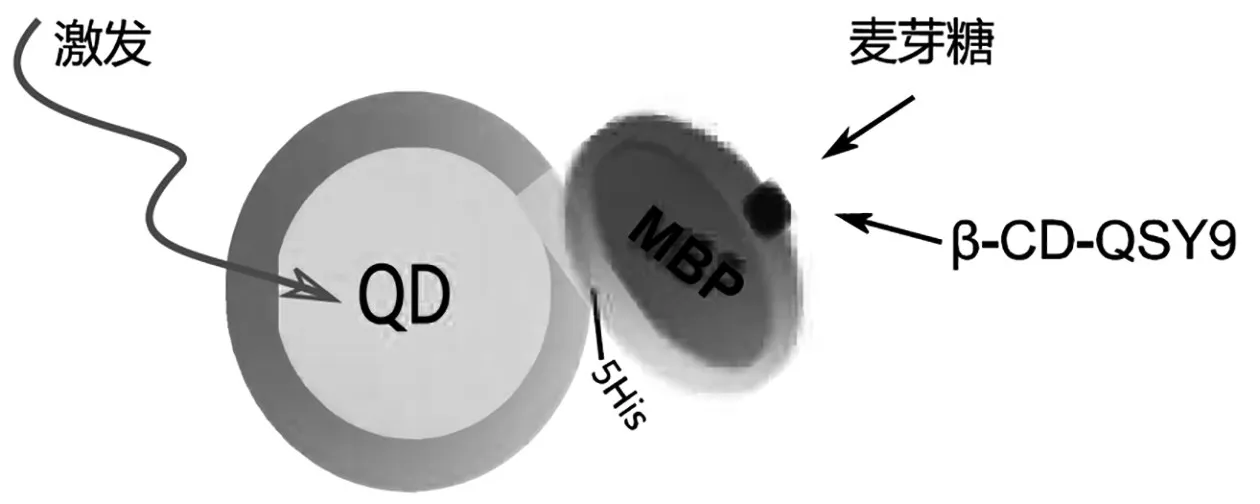
图2 麦芽糖检测生物传感器的示意图
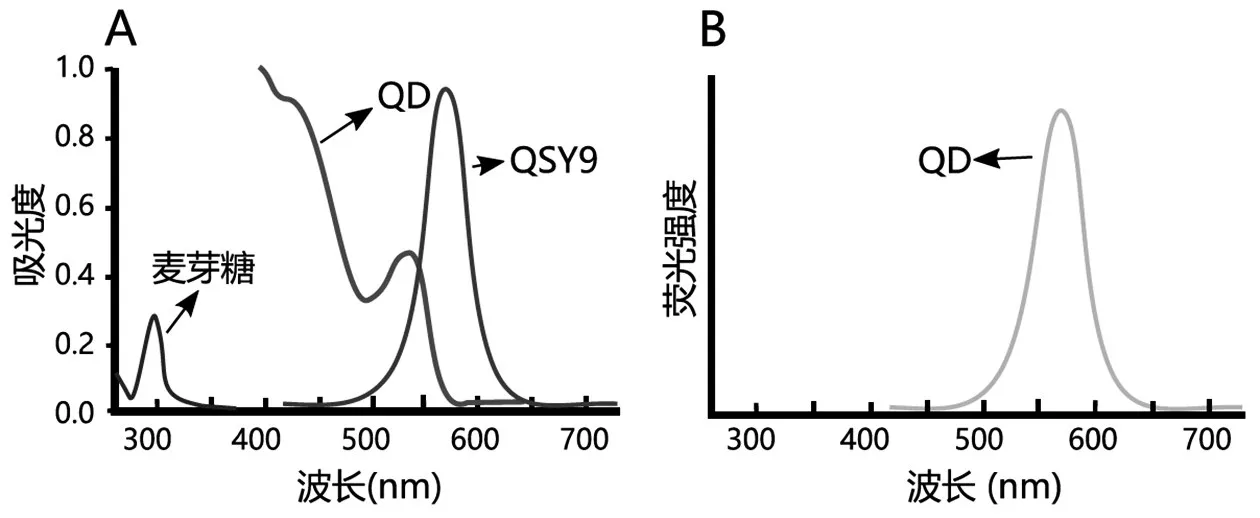
图3 各种分子的吸收光谱(A)和发射光谱(B)
判断以下陈述是否正确。
A.麦芽糖在生物传感器上置换β-CD-QSY9将导致荧光强度降低
B.在没有麦芽糖的情况下,生物传感器中不会发生FRET
C.预计在以下条件下的相对荧光强度水平是C>B>A
A:QD与MBP-5His和β-CD-QSY9染料一起
B:QD与MBP-5His和游离QSY9染料一起
C:QD与MBP-5His一起
D.预装有β-CD-QSY9的MBP孵育的QD不显示FRET
13.产热基因的表达:通过β-肾上腺素信号转导途径实现的棕色脂肪组织(brown adipose tissue,BAT)的激活,与产热基因的表达和产热过程有关。糖原合成酶激酶-3(glycogen synthase kinase-3,GSK3)作为棕色脂肪细胞中β-肾上腺素信号转导的调节剂。ISO也是BAT激活的化学刺激剂,下面的Western blot结果显示其对GSK3的作用(p-GSK3是GSK3的磷酸化形式)。SB216763是GSK3的抑制剂。这2种试剂对产热基因(Fgf21、Ucp1、Dio2和Ppargc1a)表达的影响如下图所示。
基于这些结果,判断以下陈述是否正确。
A.GSK3充当棕色脂肪细胞中β-肾上腺素信号转导的负调节因子
B.GSK3的磷酸化导致Fgf21的表达降低
C.SB216763可防止饮食导致的肥胖

*显示与对照(H2O)相比有显著性差异
D.SB216763和ISO一起施加导致Ppargc1a mRNA转录本数量比Fgf21mRNA转录本数量更高
14.疟原虫(Plasmodium)中的抗氧化防御:疟原虫是一种寄生原生动物,在热带国家很普遍。一旦寄生虫侵入宿主红细胞,它们会在24 h内繁殖。红细胞中的Fe2+可与游离的O2及H2O2反应,形成可破坏寄生虫细胞的自由基。
与宿主细胞不同,寄生虫缺乏抗氧化防御系统的酶。科学家使用二维凝胶电泳分析寄生虫细胞质中的蛋白质(见下图)。
然后,用质谱和肽质量指纹识别鉴定了对应于人类过氧化物还原酶的6种蛋白质(蛋白点1~6),以及一种蛋白质(点7)对应于疟原虫的过氧化物还原酶。

判断以下陈述是否正确。
A.基于所提供的数据,疟原虫过氧化物还原酶是多聚体蛋白质
B.所有人类的过氧化物还原酶蛋白在生理pH条件下具有正的净电荷
C.凝胶过滤色谱适用于分离和纯化6种人类过氧化物还原酶蛋白
D.免疫亲和层析可用于从其他疟原虫胞质蛋白中分离疟原虫过氧化物还原酶
(待续)

