微藻光合作用的优化升级助力“双碳”目标
王松,吴莎,2,江亚男,胡章立,3
(1深圳大学生命与海洋科学学院,广东省海洋藻类工程技术研究中心,广东 深圳 518055;2深圳大学物理与光电工程学院,广东 深圳 518060;3南方海洋科学与工程广东省实验室(广州),广东 广州 511458)
国家主席习近平在2021年出席领导人气候峰会时发表了题为《共同构建人与自然生命共同体》的重要讲话,正式宣布:中国将力争2030年前实现碳达峰、2060年前实现碳中和。这是中国基于推动构建人类命运共同体的责任担当和实现可持续发展的内在需求做出的重大战略决策。中国承诺实现从碳达峰到碳中和的时间,远远短于发达国家所用时间,需要中方付出艰苦努力。与其他固碳方式相比,自养生物利用太阳能进行光合作用固定CO2的方式,具有低成本、环保且可持续等优势,受到极大的关注[1]。地球上全部绿色植物和藻类的生长都依赖光合作用进行,而光合作用固定CO2合成有机物是地球上最重要的无机碳转化为有机碳反应,是全球碳循环的关键环节。其中浮游生物对全球碳循环具有重要影响[2],仅硅藻就贡献了海洋中40%的初级生产力,是海洋食物网的基础[3]。
目前,全球每年CO2总排放量约1/2被藻类通过光合作用固定为有机物[4]。同陆地高等植物相比,微藻光合固碳具有诸多独特优势:首先,与植物相比,微藻光合作用效率更高且生长速率更快[5];其次,微藻培养不占用耕地和淡水资源,甚至可以利用废水和工业烟气培养[6]。微藻中碳元素含量接近50%,主要来源于固定的CO2,生产1 kg微藻生物质(干重)可以固定约1.8 kg CO2[7]。更重要的是,产生的微藻生物质被视为生物能源和生物化工产品的可持续来源,通过生物精炼的概念最大化微藻生物质资源的价值逐渐成为世界范围内的研究热点[8]。微藻生物质含有多种具有药用和营养价值的生物活性物质,例如多不饱和脂肪酸、类胡萝卜素、维生素等;微藻生物质还可以用来生产多种生物能源作为化石能源的替代,例如生物氢气、生物乙醇以及生物柴油等[9-10]。此外,微藻不但是水产养殖动物的天然饵料,同时可作为人类食品的高质量蛋白来源,缓解粮食安全问题[11-12]。然而,微藻的规模化培养和商业化应用仍面临实际产量低、培养成本高等挑战[13-14]。微藻通过光合作用合成生物质过程中的太阳能利用效率理论最大值为8%~10%[15-16],在叶片温度为30°C、CO2浓度为387 mL/m3条件下,C3和C4植物太阳能转化率的理论最大值分别为4.6%和6%[17]。但多数情况下,实验室中微藻连续培养的实际光能利用率仅为3%左右,而规模化培养的转换率甚至更低[15]。这说明微藻培养远未发挥其光合潜力,微藻无论是光合固碳能力还是培养技术的潜力仍具有巨大的优化空间。
本文首先综述了近几年国内外科研人员在改造微藻光合作用不同阶段(光反应和暗反应阶段)取得的研究进展,并深入讨论和分析了目前实施策略的限制和瓶颈问题;然后,结合高等植物光合作用优化与改造的研究报道,探讨优良光合元件挖掘、调控光合作用的转录因子(transcription factor,TF)和microRNA筛选以及新途径构建等方案进一步提升微藻光合能力的可行性;最后,本文提出利用合成生物学方法和概念,以微藻作为光合固碳底盘生物,通过外源代谢途径导入和背景代谢网络改造,设计构建微藻高效固碳工程株的技术流程。
1 微藻光合作用光反应阶段优化
图1是微藻光反应阶段示意图[18-19]。同高等植物相似,微藻通过不同类型的捕光天线(捕光复合体)捕获光能,传导至光系统Ⅱ的反应中心,氧化水释放氧气,产生氢离子和电子,并最终产生ATP和NADPH。光系统Ⅱ和Ⅰ之间存在电子传递链,其中包含质体醌(plastoquinone)和细胞色素体b6f(Cyt b6f)等电子受体[20]。截短捕光天线和提高光能利用效率是目前针对微藻光反应阶段改造最常用的手段。在相关实验中,通过以上方法可以筛选得到光合作用速率和生物量积累水平升高的转化株。
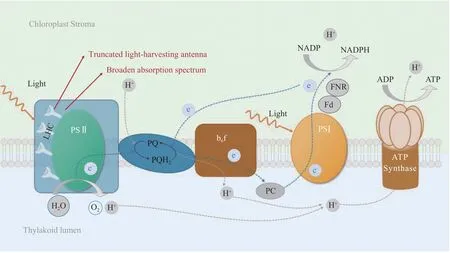
图1 微藻光合作用光反应阶段及优化策略[18-19]Fig.1 Strategies for modifications of light-dependent reactions in microalgal photosynthesis[18-19]
1.1 截短捕光天线
光反应阶段面临的主要挑战是在光饱和条件下,捕光速率远高于能量转化速率造成的速率不匹配。据估计,在最大太阳光强度条件下,天线捕光的速率是电子传递过程中限速步骤(细胞色素b6f复合体氧化质体醌醇)的10倍以上[21-23]。这导致很大一部分(80%以上)捕获的光能没有进入光化学反应,而是以热能和荧光的形式浪费,其中以热能形式消散过多光能的过程被称为非光化学 猝 灭(nonphotochemical quenching,NPQ)[24]。NPQ是植物和微藻进化的一种光保护机制,以保护细胞光合器官免受过多光能造成的损伤。在水域环境中光照不足通常是微藻生长的限制条件,为了应对光照不足,微藻进化了强大的光捕获系统[25]。在改造高等植物和微藻光合作用的工作中,广泛使用的方法之一是截短光系统Ⅱ和Ⅰ周围的捕光天线,其原理在于减少光能捕获,从而缓解光能和电子转移效率的不匹配。微藻的捕光天线由不同类型的捕光复合体构成,因此调控捕光复合体的手段多样,效果不一。例如,绿藻中捕光复合体主要由叶绿素a/b、类胡萝卜素和捕光复合体 蛋 白(LHC)构 成[26],而 硅 藻 捕 光 复 合 体(fucoxanthin-chlorophyll-protein,FCP)主要由叶绿素a/c、岩藻黄素和蛋白构成[27];藻胆体是原核蓝藻中的捕光复合体,捕光复合体位于类囊体的膜上[28-29]。
Polle等[30]通过DNA插入诱变的方式,结合叶绿素荧光和叶绿素a/b比例两个表征,筛选得到莱茵衣藻(Chlamydomonas reinhardtii)捕光天线显著缩小的突变体Tla1。进一步表型分析结果显示,Tla1与野生株相比,叶绿素和天线蛋白含量显著降低,但单位叶绿素的光合放氧率、光饱和放氧速率以及光饱和点显著高于野生株[30]。这些表型特点在模拟室外环境条件的培养过程中同样得到保持[30]。Mussgnug等[28]利用细胞中不同类型的捕光复合体蛋白同源性较高这一特点,通过RNA干扰(RNAi)技术靶向捕光复合体蛋白基因的保守区域。筛选得到的莱茵衣藻突变体Stm3LR3细胞内所有捕光复合体蛋白的转录和表达水平下调,同时伴随着叶绿体类囊体结构变化[28]。在815 μmol/(m2·s)的光照强度下,Stm3LR3和对照组相比,光合量子效率提高了80%以上;即使在可以诱导光抑制的高光照强度下[1400 μmol/(m2·s)],Stm3LR3与对照组相比仍保持了较高的光合放氧水平,显示了其对光抑制的低敏感性[28]。莱茵衣藻中脱植基叶绿素a加氧酶(chlorophyllide a oxygenase,CAO)负责催化叶绿素a氧化生成叶绿素b[31-32]。Perrine等[33]通过RNAi技术使莱茵衣藻CAO的表达水平下调,从而降低叶绿素b含量的方式调控天线大小;对比分析结果显示,叶绿素b含量降低的转基因藻株光合放氧速率显著高于野生株,并且光照强度越强,差异越显著。
除了DNA插入诱变和遗传改造的方法外,最近的综述详细总结了获得捕光天线截短突变体的不同方法[34]。利用UV、化学诱变、CRISPR/CAS9基因编辑等方法获得的突变体在特定环境条件下展现出更高的光合效率和生物量产率,但同时也有部分突变体并没有展现出显著的优势[34]。虽然截短捕光天线的方案可以在一定程度上缓解捕获光能和电子传递速率的不匹配以及藻细胞之间的遮挡效应[30],但缺点也同样显著。捕光天线具有保护光合系统免受光抑制的功能,截短的天线可能使微藻更容易受到高光强造成的光损伤。还可以进一步推测,截短的天线导致用于清除自由基的类胡萝卜素含量降低,继而导致藻细胞应对胁迫条件(高温、高盐甚至是敌害生物)能力的下降。因此在规模化培养捕光天线截短藻株的过程中要严格控制光生物反应器(photobioreactor,PBR)的入射光照条件,这极大限制了藻株的应用范围。然而,利用太阳光能进行户外培养的过程中,光照条件一直变化。在近期的研究中,Negi等[21]利用一种光调控的基因表达翻译抑制因子NAB1,实现了根据外界光照条件动态调控捕光天线的过程,具有较大的应用价值。研究人员重新设计了莱茵衣藻CAO基因,插入可以与NAB1结合的光响应域;高光条件下,NAB1与CAO的mRNA结合抑制其翻译,干扰CAO表达,从而影响叶绿素b的合成;而在低光条件下,NAB1对叶绿素b正常合成途径的干扰降低[21]。通过这种方法得到的转化株与对照组相比,光合放氧率、不同光照条件下的叶绿素a/b比例以及生物量积累水平均显著提高[21]。以上研究结果证明,根据变化的光照条件动态调节天线的策略,可以更灵活地适应光照变化的户外环境。另外,在光照条件不佳的情况下,捕光能力的降低有可能成为生长的负影响因子,而实际上光照不足的情况在户外规模化培养过程中非常常见。
1.2 增加捕光能力和光能利用率
如上文所述,光照不足通常是依赖太阳光作为唯一光源培养方式的限制因子,例如跑道池培养。同样,在生物反应器中进行高密度微藻养殖的过程中,当微藻密度较高时,遮挡效应下的细胞得到的光能不足,抑制生物质的进一步积累[35]。因此,增加微藻的捕光能力和吸收光能的利用效率,更有利于促进生物量积累。
微拟球藻(Nannochloropsis)作为一种极具应用价值的经济藻种,属于不等鞭毛藻门,其质体起源于二次内共生[36]。微拟球藻捕光天线中的光合色素主要由叶绿素a和类胡萝卜素构成,不含叶绿素b/c,区别于绿藻门微藻和同属于不等鞭毛藻 门 的 硅 藻[37-38]。Koh等[38]通 过 在 微 拟 球 藻(Nannochloropsis salina)中异源表达莱茵衣藻CAO基因,首次实现了叶绿素b在微拟球藻中的合成;在90 μmol/(m2·s)光照条件下,转化株和野生株相比光合作用效率和生物量显著提高;分析结果还显示,转化株中与光合作用相关的蛋白含量、电子传递效率和量子产率均显著提升。Fu等[39]提出了一种胞内光谱重排的方法,通过在三角褐指藻(Phaeodactylum tricornutum)中表达增强绿色荧光蛋白(enhanced green fluorescence protein,eGFP),将利用率较低的高能蓝光在胞内转化为绿光,借助硅藻捕光复合体中岩藻黄素高效利用蓝绿光的特点提高光能利用率;虽然在实验室低光条件下[50 μmol/(m2·s)]转化株与野生株生长表现差别不大,但在高光条件下[200 μmol/(m2·s)],表达了eGFP的三角褐指藻转化株光合作用效率和光系统Ⅱ有效量子产量与野生株相比分别提升了30%和18%;模拟室外开放环境条件下培养的实验结果显示,转化株光合作用效率和生长提升50%以上,显示了良好的促进生长效果。岩藻黄素主要负责吸收蓝绿光,可以与叶绿素a/b的吸收光谱互补,但岩藻黄素的胞内合成途径以及与天线蛋白组装构成FCP复合体的机制尚不完全清晰,这阻碍了岩藻黄素在其他藻种中的异源表达[40]。
可以看出,目前针对微藻光反应阶段的调控主要通过优化光反应阶段的捕光能力,而针对光反应阶段核心元件(光系统Ⅱ、光系统Ⅰ以及ATP合成酶等)和电子传递链的改造升级研究较少。Gimpel等[41]敲除了6个莱茵衣藻叶绿体基因组中光系统Ⅱ的核心基因,然后利用来源于其他藻种的光系统Ⅱ合成模块完成了敲除藻株的光合作用功能互补;虽然只有部分光合作用活性得到恢复,但这证明通过合成生物学手段改造微藻光反应阶段核心元件的可行性。
2 微藻光合作用暗反应阶段优化
微藻光合作用暗反应阶段(light-independent reactions),主要利用还原性戊糖磷酸途径[(reductive pentose phosphate pathway),也 称 为Calvin-Benson-Bassham循 环(CBB cycle)]实 现CO2固定。CBB循环主要包括CO2羧化、羧化产物还原和受体再生3个阶段,共由11个酶催化完成(图2)[42-43]。

图2 微藻光合作用暗反应阶段及优化策略[42-43]Fig.2 Strategies for modifications of light-independent reactions in microalgal photosynthesis[42-43]
2.1 改造核酮糖-1,5-二磷酸羧化酶/加氧酶
在CBB循环中,核酮糖-1,5-二磷酸羧化酶/加氧酶(ribulose-1,5-bisphosphate carboxylase/oxygenase,Rubisco)负责催化1分子CO2与1分子Ribulose-1,5-bisphosphate(RuBP)反应,生成2分子的3-磷酸甘油酸酯(3-phosphoglycerate)[44],这被认为是整个循环的限速步骤。Rubisco是生物圈最丰富的蛋白质,构成了无机碳和生命有机物的桥梁[44-46],但同时Rubisco也被认为是一个非常低效的催化剂,主要有以下两个原因:(1)Rubisco对CO2和O2的底物区分性不高,导致催化羧化反应的活性会受到其加氧酶活性的干扰(以O2作为底物),氧化反应的代谢产物需要通过耗能的光呼吸过程进行回收利用。光呼吸过程同时还会造成已经固定的CO2和NH3的丢失和浪费,据估计,光呼吸过程可以使固碳作用降低50%[44]。(2)Rubisco催化羧化反应的效率极低,据估计每秒每个Rubisco分子只可以催化2~4个CO2分子固定[47]。因此,在高等植物中Rubisco同样被作为光合作用改造的首要目标,得到了极大的关注和研究。蓝藻、硅藻和绿藻中的Rubisco结构非常类似,由8个大亚基和8个小亚基构成[48]。绿藻Rubisco的大亚基和小亚基基因分别存在于叶绿体和核基因组中[49],而硅藻大、小亚基编码基因都位于叶绿体基因组中[50]。
微藻一直被视为优良的Rubisco“供体”,利用微藻源Rubisco替代高等植物中的Rubisco被视为提高高等植物光合作用效率和生物量的潜在手段[45]。然而,由于Rubisco复杂的组装机制,微藻源Rubisco在植物中异源表达并没有取得令人满意的结果[45,51]。Lin等[45]优化了植物Rubisco改造的方法,将细长聚球藻(Synechococcus elongatusPCC7942)大、小亚基因分别与伴侣分子和羧化体蛋白结合后,转入敲除了本体Rubisco大亚基基因的烟草中进行异源表达;筛选得到的两株转化株可以正常进行光合作用,这说明微藻Rubisco可以在烟草中正常组装;虽然转化株Rubisco含量和生长显著低于野生株,但在不同CO2浓度下转化株表现出更高的单位Rubisco CO2固定效率,并且CO2浓度越高差异越明显。Orr等[52]实现了细长聚球藻大亚基在烟草叶绿体中的异源表达,结果表明,聚球藻大亚基可以和烟草小亚基形成杂合酶进行光合作用,但在高浓度CO2条件下,转化株的生长受到抑制。另外,研究发现磷酸糖类有可能和Rubisco的活性区域结合,抑制Rubisco活性,需要Rubisco活化酶(Rubisco activase)重新激活[53]。Wei等[54]在微拟球藻(Nannochloropsis oceanica)中推测了一个可能的Rubisco激活酶基因,该基因的转录水平在低浓度CO2条件下上调,在高浓度CO2(5%)条件下下调;在空气CO2浓度条件下,Rubisco激活酶过表达的转基因藻株和野生株相比,生长率和光系统Ⅱ最大量子效率提高了约30%,生物量和Rubisco大亚基含量分别提高了46%和45%;然而,在高浓度CO2条件下,差异并不显著。以上实验结果表明,Rubisco激活酶也是潜在的优化目标。
虽然Rubisco作为CBB循环中最主要的限速酶,但微藻中针对Rubisco的改造尝试目前十分有限,即使在高等植物中针对Rubisco的改造效果也不理想。这主要有以下几个原因:①Rubisco的生物发生过程复杂,蛋白折叠和组装过程受到多个因子调控,例如分子伴侣[55]、辅助蛋白和装配因子;②Rubisco的催化活性受到Rubisco活化酶和抑制因子的调控[56];③Rubisco存在羧化速率与CO2底物亲和性的权衡,例如蓝藻Rubisco的特点是催化速率较快,但CO2的底物特异性较低[57]。因此,挖掘不同来源的Rubisco,再通过合成生物学手段合成、组装成一个羧化效率高且对CO2底物特异性高的新Rubisco,可以进一步提高微藻的固碳效率。但需要注意的是,Rubisco的活性受到一些辅助因子的调控,因此匹配的辅助因子同样必不可少。
2.2 改造CBB循环其他关键酶
景天庚酮糖-1,7-二磷酸酯酶(sedoheptulose-1,7-bisphosphatase,SBPase)和果糖-1,6-二磷酸酯酶(fructose-1,6-bisphosphatase,FBPase)参与CBB过程中RuBP的再生,同样被视为潜在的优化目标。通过提高SBPase表达水平增加光合作用效率和生物量产率的方法已在多种作物中被验证。Fang等[58]在盐藻(Dunaliella bardawil)中异源表达来自衣藻的SBPase,导致转化株光合放氧速率的增加,并伴随着甘油含量的升高。在最近的研究中,Hammel等[59]利用合成生物学模块克隆的方法(Gibson组装)构建了衣藻SBP1的表达体系,大大提高了实验效率,莱茵衣藻转化株与野生株相比光合放氧速率显著升高。裸藻(Euglena gracilis)可以大量积累β-1,3-葡聚糖,具有重要的经济价值,Ogawa等[60]在裸藻叶绿体中成功表达了蓝藻果糖-1,6-/景天庚酮糖-1,7-二磷酸酯酶(fructose-1,6-/sedoheptulose-1,7-bisphosphatase,FBP/SBPase);结果显示,在高光[350 μmol/(m2·s)]和高浓度CO2条件下,转基因藻株的光合放氧速率和叶绿素含量均显著增加,最大生物量浓度高达野生株的2倍,同时伴随着细胞体积的明显增大。研究发现,表达了集胞藻FBPase的小球藻(Chlorella vulgaris)转化株与对照组相比表现出显著升高的生物量浓度、CO2固定效率以及光系统Ⅱ有效量子产率;此外,FBPase过表达虽然可以提高其他CBB相关酶的转录水平,但是酶活性并没有显著变化,这说明CBB还存在其他的调控机制[61]。在聚球藻(Synechococcus7002)中过表达BiBPase,同样可以提高转化株的生长率和光合放氧率,同时进一步分析显示,光合作用和碳代谢相关的基因表达水平也相应提高,并且碳流的分配发生了调整[62]。
然而,过表达FBPase的效果并不一致。Dejtisakdi和Miller[63]利用叶绿体表达体系在莱茵衣藻叶绿体中过表达核编码的FBPase基因,转化株中FBPase表达量和活性分别达到野生株的4倍和1.4倍,然而在不同环境条件下的培养实验结果显示,转化株同野生株相比生物量积累被显著抑制;作者推测这可能是由于FBPase的过量表达导致用于碳水化合物合成的代谢产物甘油醛-3-磷酸(glyceraldehyde-3-phosphate,G3P)含量减少,影响了生物量积累。与Rubisco复杂的合成和组装机制相比,针对CBB循环中其他关键酶单一基因的遗传改造和优化更容易取得理想的结果,更具操作性。总体上,CBB循环除了利用了一个非常低效的CO2固定酶,同时CBB循环还不耐受高温,因此构建一个额外的固碳途径作为CBB循环的补充,可能会发挥更大的固碳作用[64]。
2.3 构建光呼吸支路
Rubisco的氧合作用会产生有毒代谢产物2-磷酸乙醇酸(2-phosphoglycolate,2-PG),需要通过光呼吸途径回收利用,但光呼吸过程需要消耗ATP和NADPH,并且释放已固定的CO2和NH3(图3)[65];通过光呼吸途径将2分子2-PG转化为1分子3-磷酸甘油酸(3-phosphoglycerate,3-PGA),整个过程由分布在叶绿体、过氧物酶体、线粒体和细胞质的9个酶促步骤完成;据估计,光呼吸可以释放高达1/4已固定的CO2,造成C和N元素的巨大浪费[66-69]。但光呼吸过程从2分子2-PG中为细胞代谢回收了75%的C,对细胞代谢具有很重要的作用,因此,理论上,构建一个新的光呼吸支路(photorespiration bypass)避免CO2和NH3的浪费或者增加释放CO2的回收能力,可以提高CO2的利用效率,进而增加生物量产率[70]。这一方案的可行性在模式生物拟南芥(Arabidopsis thaliana)和油料作物亚麻荠(Camelina sativa)中得到了成功验证,新构建的光呼吸支路可以帮助转化株显著提高生物量产率[65,68]。Shih等[70]利用细长聚球藻光呼吸过程与嗜热自养生物橙色绿屈挠菌(Chloroflexus aurantiacus)的3-羟基丙酸(3-hydroxypropionate)固碳途径具有相同的中间代谢产物——乙醛酸(glyoxylate)这一特点,通过导入含有6个基因的表达载体,首次在光自养蓝藻中构建了一条合成的光呼吸支路。与传统的光呼吸途径相比,新构建的支路不仅不释放NH3,而且实现了CO2的净收益。虽然转化株与野生株相比并没有显著的差异,但作者推测了潜在的优化步骤,这为微藻光呼吸途径的优化提供了新选择。

图3 光呼吸过程及代表性光呼吸支路构建方案[65]Fig.3 Photorespiratory and the construction of representative photorespiratory bypass[65]
2.4 碳浓缩机制改造
与C3植物不同,大多数微藻和C4植物具有碳浓缩机制(carbon-concentrating mechanism,CCM)以应对水体环境中较低的CO2浓度[71]。蓝藻中Rubisco被密封在羧酶体中,而真核微藻Rubisco主要存在于叶绿体蛋白核中[72],通过CCM可以使Rubisco活性部位周围CO2浓度达到周围环境的1000倍以上[73]。碳酸酐酶(carbonate anhydrase,CA)是参与CCM的关键酶,负责催化和CO2之间的可逆转化[74]。微藻的CCM通常是诱导机制,通过对周围CO2浓度的感知,调控CCM的表达水平[74]。微藻的规模化养殖通常会使用远高于空气中的CO2浓度,可能导致CCM的关闭[75]。在15% CO2条 件 下,小 球 藻PY-ZU1(ChlorellaPY-ZU1)中CA几乎不表达,因为当CO2浓度足够高的条件下,CO2可以通过直接扩散的方式满足Rubisco对CO2的需求;进一步分析发现,利用1% CO2可以为小球藻提供足够的CO2,从而不需要启动CCM[76]。Wei等[77]通过RNA干扰技术使微拟球藻中细胞质CA(CA2)活性降低28%~35%,在高浓度CO2(5%)条件下,转化株生物质浓度提高了40%;进一步在不同规模、不同类型的反应器中的培养实验证明,在高浓度CO2(5%)条件下转化株的优良性状得到保留。过表达CCM中另一关键酶——碳酸氢根转运蛋白(bicarbonate transporter)的转化株,在不同CO2条件下也显示出生物量积累的差异。例如在通入空气条件下,过表达了碳酸氢根转运蛋白的集胞藻(Synechocystissp.PCC6803)转化株与野生株相比,生长率和生物量产率几乎增加1倍,但在高浓度CO2条件下转化株的生长受到抑制[78]。研究结果显示,在高浓度CO2条件下,下调CCM活性可能提高微藻的固碳效率和生物量积累水平。Lin等[79]在两种小球藻(C.vulgaris和C.sorokiniana)中异源过表达百脉根中生根瘤菌(Mesorhizobium loti)的CA。分析结果显示,在1% CO2浓度条件下,两株转化株的生长较野生株均有显著增加,而在不通入CO2的培养过程中,转化株生长受到了明显抑制[79]。以上结果的差异说明不同来源的CCM元件对CO2浓度的感知存在显著差异。
3 研究展望
合成生物学是以工程化设计理念,对生物体进行有目标地设计、改造乃至重新合成。真核微藻基因工程及合成生物学已经成为国际研究的热点领域。合成生物学的快速发展,使微藻光合作用的改造、理性设计甚至是新光合途径的构建成为可能。本文认为下一步研究可以从优秀光合元件挖掘、调控元件筛选、新途径和高效固碳工程株构建四方面寻求突破。
3.1 挖掘新的光合作用元件
一般认为以叶绿素a为主要捕光色素的光合作用只能利用400~700 nm的可见光,而在蓝藻中发现的叶绿素d和叶绿素f则又向远红外光方向进一步拓展了光合作用可用光谱的范围[80-81]。叶绿素d和叶绿素f的异源合成有可能进一步拓宽微藻捕光天线的吸收光谱[82]。叶绿素f合成酶基因的鉴定及其在聚球藻(Synechococcussp.PCC 7002)中的异源表达证明了这种方案的可行性[83-84]。实验结果证明异源合成的叶绿素f可以与聚球藻PSⅠ结合并增强PSⅠ对远红光(>700 nm)的吸收能力[84]。在下一步实验中需要进一步评估转化株的光合作用效率和生长水平变化。在拟南芥中过表达烟草细胞色素b6f复合体硫铁蛋白(Rieske FeS protein,PetC),可以提高转化株光系统Ⅱ和Ⅰ复合体蛋白的表达水平,并且显著提高光系统Ⅱ和Ⅰ的量子效率、电子传递速率和生物量;研究显示,细胞色素b6f复合体在电子传递链中发挥重要功能,同时表明硫铁蛋白也是优化光合作用效率的潜在目标[85]。质体蓝素是电子传递链上重要的一环,同时是一种含铜的蛋白,对维持细胞内铜离子稳态具有重要作用,参与细胞内活性氧的清除[86-87]。在拟南芥中异源合成来源于盐生植物Suaeda salsa的质体蓝素,可以使转化株快速恢复强光导致的最大光合量子产率下降,同时增加抗氧化能力[87]。与此形成鲜明对比的是,微藻中关于电子传递链的研究较少,针对提高微藻电子传递速率的基因工程改造研究尚未见相关报道。此外,需要更加重视从适应极端环境条件的微藻中挖掘优秀光合元件。Chlorella ohadii进化了出色的光保护功能使其可以在沙漠极端高光的条件下进行光合作用;除了缩小天线,增加类胡萝卜素含量外,C.ohadii还通过过量积累依赖ATP的锌金属蛋白酶(ATPdependent zinc metalloprotease,FtsH),快速修复被光损伤的光系统蛋白[88]。为了适应南极极端的环境条件,南极绿藻(Koliella antarctica)利用两个叶黄素循环来应对快速变化的光照条件[89]。
在室外光照条件不停变化的环境下,NPQ是植物抵御光损伤的一种保护机制,但NPQ的诱导和松弛存在速率上的不对称,稍慢的松弛速率(从猝灭态到非猝灭态)可能抑制固碳过程,这一假设得到了实验结果验证[90]。因此,提高NPQ松弛速率被认为是一种可以有效提高光合作用效率和生物量的方法[91]。Kromdijk等[90]通过在烟草中过表达拟南芥PsbS、紫黄素和玉米黄素加快NPQ的松弛;温室中的实验结果显示,转化株的生物量产率提高15%,证明上述方法是改造光合作用、提高生物量产率的可行方案[90]。虽然微藻中NPQ的调控机制和参与的成分有差异,例如LHCSR和LHCX分别在绿藻和硅藻NPQ过程的调控中起重要作用,但这仍是可以借鉴的方案[92-94]。构建快速筛选元件的平台对提高优良元件筛选效率具有重要意义。与之前需要产生稳定的转化株来研究NPQ的相关基因不同,Leonelli等[95]开发了农杆菌介导的烟草瞬时转染系统,可以高效预测NPQ的相关基因,并对4个微拟球藻和海链藻中类胡萝卜素合成相关的基因进行了功能验证。
研究发现,嗜热红藻Galdieria partita和Cyanidium caldariumRubisco的CO2/O2相对特异性分别是菠菜Rubisco的2.4倍和2.5倍,具有显著的羧化酶特异性[96]。Haslam等[97]总结了在相同温度条件下(25℃)不同物种Rubisco特异性系数的变化,同样证明海洋红藻Rubisco CO2/O2特异性显著高于绿藻和高等植物;硅藻Rubisco特异性与温度呈现显著负相关,当温度降低时,Rubisco特异性越高。Rubisco的特异性和羧化反应速率通常呈负相关,海洋红藻门和杂色藻门微藻中的Rubisco比高等植物、绿藻和细菌的Rubisco具有更高的特异性[98]。在利用红藻Rubisco过程中需要注意的是,Rubisco的活性位点可能与磷酸糖类代谢产物结合抑制其活性,在这种情况下需要Rubisco激活酶重新激活Rubisco释放抑制因子[99]。Loganathan等[100]证明红藻Cyanidioschyzon merolae中两个cbbX基因编码的产物负责形成Rubisco激活酶。为了在固碳方面发挥更大的作用,需要筛选在高浓度CO2甚至是烟气(CO2含量通常在10%以上)条件下,可以保持较高羧化反应速率的Rubisco。除了植物和微藻中研究较多的Ⅰ型Rubisco,在其他非产氧光合微生物中还发现了不同类型的Rubisco[101-102]。Zhang等[101]比较了7种不同来源的Rubisco活性,发现巨型管虫营养体内共生细菌的Rubisco羧化效率比聚球藻(Synechococcussp.PCC7002)Rubisco高50%以上。
3.2 挖掘调控光合作用的转录因子和microRNA
TF具有与目标基因启动子顺式作用元件结合的功能域,通过影响(激活或抑制)RNA聚合酶活性调控基因的表达,植物中发现了很多可以调控光合作用效率的TF[103]。与针对单基因改造的方法相比,利用TF的优势在于可以调控一系列基因的表达。研究发现转录因子BpMYB106负责调控多个光合和氧化磷酸化相关基因的表达水平,在桦树中过表达BpMYB106可以增强光合作用和生长率[104]。生物信息学手段的快速发展为筛选与光合作用相关的TF提供了机会,例如Yu等[105]通过使用TRAP和ARACNE算法,预测了拟南芥中参与调控光合作用的TF,这为下一步实验验证TF功能打下了基础。TF(mEmBP-1)可以与光合作用相关基因的启动子结合,提高光合作用相关基因的表达水平,在水稻中过表达玉米的转录因子mEmBP-1可以显著提高光合作用速率(30%)和谷物产率(29%);转录组结果显示,mEmBP-1过表达转化株中光合作用各个阶段的相关基因同时上调[106]。在水稻中异源表达玉米GOLDEN2-LIKE(GLK)TF,不但可以增加水稻的生物量产率和粮食产量,同时可以增加转化株中叶黄素含量,并且帮助缓解在光照变化和高光条件下的光抑制,增强光保护能力[107]。除了正向调控光合作用的TF,最近的研究同样发现了和光合作用呈负相关的TF。敲除水稻中的NRP1可以提高户外培养水稻的光合作用和生物量水平[108]。Tokutsu等[109]发现衣藻中的CONSTANS转录因子和核转录因子Ys(NF-Ys)调控衣藻的光保护机制。MicroRNA是真核生物中一类内源的单链RNA,一般包含20~24个核苷酸,通过影响靶基因的mRNA调控靶基因的表达[110]。研究发现,在水稻中过表达一个保守的microRNA(miR408)可以显著提高水稻的光合作用和粮食产量;深入的分析显示,miR408通过下调质体蓝素家族基因的表达水平,影响质体蓝素水平和光合作用[111]。随后的研究在多种植物中证明过表达miR408可以有效提高植物的生长和光合作用;分析显示过表达miR408转化株的质体蓝素和铜离子浓度、光合作用指标及光合作用相关基因的表达水平均有显著提高[112]。因此,在微藻中寻找光合作用相关的TF和microRNA是进一步提高光合作用效率和生物量产率的潜在有效途径。
3.3 构建新的光合作用途径
考虑到目前对Rubisco改造取得的成果有限,通过合成生物学手段,在微藻中构建新的固碳途径提升固碳效率值得尝试。虽然CBB是自然界中最主要的固碳途径,但并不是唯一的固碳途径,在原核自养生物中还有其他5个固碳途径:还原乙酰辅酶A途径(reductive acetyl-coenzyme A pathway)、还原柠檬酸循环(reductive citric acid cycle)、二羧酸/4-羟基丁酸循环(dicarboxylate/4-hydroxybutyrate cycle)、3-羟基丙酸/4-羟基丁酸循环(3-hydroxypropionate/4-hydroxybutyrate cycle)和羟基丙酸双循环(3-hydroxypropionate bi-cycle)[113-114]。Bar-Even等[115]以5000个已知的代谢酶为基础,通过基于约束的建模方法提出了一条比CBB快2~3倍的合成固碳途径。不同羧化酶的动力学特性对比发现,磷酸烯醇丙酮酸羧化酶(phosphoenolpyruvate carboxylase)具有很高的特异活性和对无机碳源的亲和性,因此合成途径选取磷酸烯醇丙酮酸羧化酶作为其中唯一的羧化酶[115]。虽然在底盘细胞中合成这条途径并发挥固碳功能还面临很多挑战,但为新固碳途径的构建提供了可选方案。在集胞藻SynechocystisPCC 6803过表达磷酸烯醇丙酮酸羧化酶可以在低光条件下提高转化株生长[116]。研究认为羟基丙酸双循环对氧气敏感性低,所含酶背景信息清晰,与其他固碳途径相比更适合光合自养生物[70,117]。Shih等[70]以羟基丙酸双循环为基础,在蓝藻中构建了光呼吸支路,不但增加了CO2的回收能力,同时增强了CO2的吸收能力。如果构建新的固碳途径是“开源”,构建光呼吸支路则是“节流”过程,对于固碳效率提升同样至关重要。植物中构建的多种光呼吸支路对于微藻光呼吸支路的构建具有很高的借鉴价值。Kebeish等[68]通过分步转化的方法,将E.coli乙醇酸分解途径的5个基因转入拟南芥中,实现了所有酶在叶绿体中的表达,构建了一个质体光呼吸支路;这条完全位于质体中的光呼吸途径支路具有诸多优点,如新的代谢途径不耗能和NADPH,也不产生NH3,并且在质体中释放CO2,更有利于CO2的回收利用;得益于此,转化株的光呼吸显著降低,光合作用和生物量积累显著提高。在产油作物中导入葡糖酸脱氢酶(glycolate dehydrogenase,GDH)、乙醛酸醛连接酶(glyoxylate carboligase,GCL)和酒石半醛还原酶(tartronic semialdehyde reductase,TSR)等基因,构建与天然途径竞争的光呼吸支路,使种质产量增加了50%以上[65]。Shen等[118]构建了一个同时表达3个水稻本体酶的表达载体,通过Rubisco小亚基转运肽导入叶绿体中,成功构建了一个新的叶绿体光呼吸支路;野外试验结果表明,转化株的地上干重和粮食产量均有显著提升。可见通过引入外源和内源酶构建能耗低、不产生NH3且更有利于回收CO2的光呼吸支路,同样是提升微藻生物量产率的可行方案。
早在19世纪60年代,Boussingault提出假说,认为光合作用是一个双向过程,除了受光驱动外,同时受光合终产物利用效率的反馈调节[119]。而光合作用终产物的利用效率又在很大程度上取决于包括温度和营养盐在内的环境因子[120]。光驱动过程保证了光能的高效率利用,而光合同化产物的反馈调节保证了不同途径碳流分配的平衡,对生物的生长和存活同样具有重要意义[120]。越来越多的研究观察到在高等植物和微藻中,低效的光合产物利用率会导致固碳效率和整体光合作用效率的降低,这种现象被称为“汇限制”[121]。在微藻中构建异源产物消耗途径,可以有效缓解“汇限制”对光合作用的抑制作用[121]。例如Abramson等[121]首 先 诱 导 细 长 聚 球 藻(Synechococcus elongatusPCC 7942)在细胞质中积累大量蔗糖,再通过异源表达蔗糖转运蛋白将蔗糖排出细胞,显著提高了转化株光合作用效率。因此,利用光合作用双向调控的特点,构建新的光合作用产物(例如甘油醛-3-磷酸)利用途径,提高产物的消耗速率,有望进一步提高微藻的光合作用效率。
3.4 高效固碳工程株的构建
毫无疑问,微藻因其较高的光合作用效率,是构建“高效固碳工程株”的理想底盘生物。但从进化的角度,微藻的光合作用系统适应水域生态中较低的CO2浓度,而为了在固碳方面发挥更大的作用,需要进一步通过基因工程和合成生物学的方法对现有的光合作用系统进行改造或新途径合成,使其适应生物反应器中的高浓度CO2或烟气环境。高效固碳工程株的构建可以概括为三部分内容:(1)固碳底盘微藻的筛选。除了利用现有藻种库保藏和野外分离的藻种外,可以通过诱变(理化诱变或随机插入突变)的方式筛选CO2低敏感或不同CO2浓度环境下具有高固碳效率的藻种或突变株。(2)研究固碳特性的调控机制。对野生株与突变株进行CO2胁迫的钙信号成像、转录组和microRNA组学等分析,挖掘筛选控制微藻高效固碳的相关功能基因,调控microRNA、TF及微藻感受与响应CO2的信号通路。(3)微藻固碳关键代谢通路的设计改造。通过扩展光合有效辐射范围、减少激发能的非光化学耗散、操纵NPQ并增加对氧化应激的抵抗力(表达调控基因)等途径,对微藻光照能量收集复合体的结构与功能进行改造优化。对微藻CBB循环和CCM相关酶进行改造或利用人工microRNA或TF对两个关键途径的代谢通路进行表观调控,针对两个关键代谢途径的特定节点设计构建调控开关等,重构额外的CO2固定代谢途径、光呼吸支路和终产物消耗途径,提高微藻固碳效率。
4 总结
综上所述,通过截短捕光天线、增加捕光能力和光能利用率、改造CBB循环和CCM以及构建光呼吸支路等手段对微藻光合系统的改造和优化,已经取得了诸多重要的开创性进展。但整体进度落后于高等植物特别是经济作物光合作用路径的改造和优化,导致微藻固碳的潜能未充分发挥。通过优良光合元件、调控因子的挖掘以及新途径的构建,可以有效解除瓶颈步骤的限制,实现光、暗反应之间的能量平衡。光合作用除了受光调控外,还受终产物消耗效率的调控,这说明需要同时开展在细胞水平上针对光合作用相关代谢途径的改造。随着合成生物学的快速发展,为以微藻作为光合固碳底盘生物,设计构建高效固碳微藻工程株奠定了基础。利用合成生物方法和概念可以摆脱物种的限制,设计或合成光能利用率和固碳效率更高、抵抗光损伤以及产生更少活性氧的光合作用系统[114]。本文提出通过固碳底盘微藻的筛选、固碳特性的调控机制研究以及微藻固碳关键代谢通路的设计改造的方案,构建适应不同CO2浓度的工程株。微藻固定空气中的CO2一方面能够有效降低碳排放,加速我国节能减排目标的早日实现;另一方面能够大幅度降低微藻生产成本,获得的微藻生物质可以作为多种高附加值生物活性物质的可持续来源。因此,微藻高效固碳工程株的设计构建不但可以帮助应对温室气体含量的升高,同时对缓解日渐紧张的能源和粮食危机具有重要意义。

