面向碳达峰与碳中和的植物合成生物学
杨健钊,朱新广
(1中国科学院分子植物科学卓越创新中心,上海植物生理生态研究所,植物分子遗传国家重点实验室,上海 200032;2 中国科学院大学,北京 100049)

合成生物学是基于工程学思想和原理,对自然生物系统进行设计和改造的一门新兴学科。它与数学、物理学、化学、信息科学等多学科交叉融合,以实现预期的生物功能乃至创造非自然的“人工生命”[1-2]。20世纪60年代开始,基因工程技术发展使得人为操纵、改造生命遗传信息具有了可行基础[1]。21世纪早期,从在大肠杆菌(E.coli)中人工设计合成基因线路实现振荡网络[3]和双稳态开关[4]开始,合成生物学的概念被确立,而后进入了定量化表征的高速发展时代。迄今为止,合成生物学已经在细菌、酵母和哺乳动物细胞中建立了一系列成熟的底盘和工具[5],形成了一套完备的“设计-构建-测试-改进”(Design-Build-Test-Learning,DBTL)研究体系[6]。
与细菌、酵母和哺乳动物细胞相比,植物的合成生物学依然处于起步阶段[7],成熟的模式植物底盘少、基因组普遍较大且结构复杂、繁殖迭代周期较长等都是制约其发展的重要因素[8]。植物与人类生活息息相关:光合作用是人类粮食、能源的来源基础[9];植物能生产环境友好的生物制品、提供清洁能源[10]、修复环境改善气候[11];植物丰富的次生代谢天然产物还可以作为药物和化工原料等[12],可以预见植物合成生物学具有非常广泛的发展前景[13-15]。目前人类面临的粮食短缺、能源危机、环境污染等挑战也迫切需要植物合成生物学的发展以提供解决方案[16]。
在当前碳达峰与碳中和背景下,利用植物的固碳能力是实现碳中和的重要途径[17]。特别因为植物能够光合自养,相比微生物发酵需要消耗糖类等额外有机物,植物合成代谢工程具有更强的可持续发展能力[14,18-19]。可见植物合成生物学不仅将助力“双碳”目标实现,同时也将迎来其自身迅速发展的契机。
1 “双碳”目标与植物碳汇
大气CO2浓度持续上升导致全球变暖,已成为世界关注的问题。地质记录表明地球气温与大气CO2浓度呈正相关,当今大气CO2浓度是过去30万年以来的最高值,且在过去半个世纪里每年增加约1~2 mL/m3,这使得地球平均气温上升约0.8℃[20]。全球变暖的负面影响涉及从个体健康到生态平衡的方方面面[21]。例如,全球变暖对植物光合作用影响巨大[17],平均气温每上升1℃将造成作物减产至少10%[22];温度升高也影响植物开花和授粉[23]、干扰媒介昆虫和植食动物的生态[24-25],从而引发粮食危机[26]。
为应对温室效应导致的全球气候变化,世界各国都采取了一系列减排措施。2020年9月22日联合国大会上,中国庄严承诺将在2030年前实现碳达峰、2060年前实现碳中和。2021年10月24日,中共中央、国务院印发《关于完整准确全面贯彻新发展理念做好碳达峰碳中和工作的意见》正式对实现“双碳”目标做出系统规划和部署[27]。“双碳”目标规划包括到2025年初步形成绿色低碳循环发展的经济体系,到2030年二氧化碳排放量达到峰值,到2060年全面建立清洁低碳安全高效的能源体系,最终非化石能源消费比重超过80%[27]。
“双碳”目标规划中的重要一环是持续巩固提升生态系统碳汇能力,具体目标为到2030年森林覆盖率达到25%、森林蓄积量达到190亿立方米[27]等。碳汇(carbon sink)是生态系统吸收大气中的CO2等温室气体从而减轻温室效应的机制,分为陆地碳汇和海洋碳汇。陆地碳汇主要以森林等植被通过光合作用固碳为主[28],而海洋碳汇中藻类光合作用也扮演着重要作用[29]。植物是陆地碳汇的关键角色[30]。以中国为例,陆地碳汇中森林、农田和灌木林3个最大贡献源在2001—2010年间的固碳量相当于期间化石燃料碳排放量的14.1%[31],但实现碳中和的目标依然需要大幅提升当前植物的碳汇能力。
2 植物合成生物学在“双碳”目标中的应用领域
植物合成生物学可应用于提升植物的碳汇能力,如提高光合作用效率增加固碳量、利用植物天然产物和清洁能源以减少碳排放、发展分子农业和植物工厂以建立低碳经济模式等。“双碳”目标进程分为近期使碳排放总量达到上限的碳达峰、中远期将人类活动排放的二氧化碳全部抵消的碳中和,即在第1个阶段以减少新增的二氧化碳排放为主,而第2个阶段以吸收二氧化碳并建立最佳碳循环体系为核心。当下植物合成生物学业已取得较多进展的天然产物合成和分子农业领域侧重于碳达峰这一目标,利用植物光能自养的特征挖掘天然产物的生产潜力,以取代当前基于高碳排放的工业生产模式,将是植物合成生物学助力碳达峰的重要方式。光合作用的合成生物学改造和创制碳汇植物则面向碳中和目标里提升植物固碳能力的需求。建立碳中和模式的植物工厂,整合多领域工程系统,发展具有最优碳效益的植物生产体系,则是未来植物合成生物学同时兼顾碳达峰和碳中和的重要模式。以下从植物天然产物合成与次生代谢工程、分子农业、光合作用合成生物学、碳汇植物创制和植物工厂5个领域分别探讨植物合成生物学在碳达峰与碳中和的作用。
2.1 植物天然产物合成与次生代谢工程
植物丰富的次生代谢(secondary metabolism)提供了大量天然产物(plant natural product,PNP),包括生物碱、萜类、醌类、苷类、甾体、色素、有机酸和酯化物等。从原始社会开始,人类就有漫长的植物天然产物利用历史,如作为药物治病、提取染料和纤维用于纺织、获得橡胶树脂等[32]。植物中最早的合成生物学研究起始于次生代谢工程,包括解析植物次生代谢途径、提升天然产物产量、改良天然产物性状等,并在植物本底、微生物或无细胞体系中大规模生产植物天然产物[33]。近年来,植物天然产物研究领域也提出以植物的特异性代谢(specialized metabolism)取代次生代谢的概念,强调与植物的基础性代谢(general metabolism)相对应[34]。
植物天然产物是环境友好的,但目前大多数天然产物的提炼加工会造成大量碳排放和环境污染。利用合成生物学方法不仅可以挖掘新的天然产物,还可以通过提高天然产物含量,或改变提炼的副产物,来改良生产工艺减少碳排放,从而实现以天然产物取代化石燃料为原料的化学品。
2.1.1 植物次生代谢产物合成途径挖掘
20世纪60年代人们发现,与微生物基因组类似,植物次生代谢相关基因有一部分也串联排列成生物合成基因簇(biosynthetic gene cluster,BGC)[35]。但大多数植物特异性代谢基因没有成簇排列,而且BGC上的基因也并非全部都发挥功能,定位到植物次生代谢每个环节也很困难[35]。随着高通量测序、高效液相联用质谱和代谢流分析等技术的发展,植物次生代谢产物相关基因及其合成途径挖掘已经形成了较为成熟的DBTL体系,应用机器学习和计算化学可精准预测潜在天然产物的分子结构和代谢途径[35],这些都极大推动了植物次生代谢产物的合成生物学研究。
最新的DBTL挖掘植物天然产物案例是基于定量结构活性互作算法(quantitative structureactivity relationship,QSAR)和AlphaFold训练模型,根据人类Ⅱ型糖尿病相关靶点葡萄糖转运蛋白(glucose transporter)GLUT1和GLUT3的结构,预测筛选出潜在的具有竞争性结合能力的抑制剂,如山柰酚、棉黄素、蒽醌等一系列植物天然产物[36]。罗汉果甜苷合成途径解析也是典型挖掘案例,根据上游两大前体合成途径,MVA(甲羟戊酸)途径和MEP(甲基赤藓糖醇磷酸)途径,在不同亚细胞空间位置中的代谢流配比确认了下游各个分支反应,并成功在酿酒酵母中成功重构其合成途径并获得产物[37]。很多植物次生代谢成分可以特异杀伤寄生虫,已有研究结合正向利用高通量小分子化合物筛选和反向预测药物作用靶点,挖掘出一系列可作为口服抗寄生虫药物的植物天然产物[38]。
近年来,我国科学家在植物天然产物合成途径解析、优化生产工艺和实现规模化生产方面做出了一系列卓越的贡献。例如挖掘甜叶菊合成途径关键酶[39-40]、在酵母中构建人参皂苷有效成分的合成途径并提高产量[41]、以葡萄糖为原料在大肠杆菌中发酵合成天麻素从而显著降低生产成本[42]和理性改造创建全新的丹参素人工替代合成途径[43]等。越来越丰富的植物天然产物可以逐渐替代一些化工合成物,为人们的日常生活和工业生产提供更加低碳、环境友好的产品选择。
2.1.2 合成生物学应用于大规模生产植物天然产物
植物天然产物往往存在产量少、提取难、生产受产地限制和毒害副作用等问题[44],因此利用合成生物学方法人工改良生产工艺、在植物或异源体系大规模生产天然产物是研究热点[45]。植物具有MVA和MEP两种产生异戊二烯的途径,基于已建立的植物细胞表达体系可以大规模生产异戊二烯用于合成萜类、甾体和天然橡胶等天然产物[33,46]。
青蒿素的半生物合成是一个经典案例。天然青蒿素只在黄花蒿等几种植物中存在且产量极低,纯化学合成青蒿素极为复杂,产率低且生产成本高昂。Keasling等[47]先将青蒿素合成关键酶引入大肠杆菌中表达,其酶的活力很低,于是将其转入酿酒酵母中获得成功。虽然最后一步反应由青蒿酸转变为青蒿素的反应在酵母中无法实现,但利用酵母发酵生产青蒿酸,再经化学催化成青蒿素达到了25 g/L的高产量。这个案例对异源生产植物天然产物的底盘选择、线路设计、途径优化和生物化学催化相结合都具有高度参考意义。此外,青蒿素的纯植物底盘合成也已经有成功案例,如Farhi等[48]在烟草中转基因获得了0.48~6.8 μg/g干重的青蒿素,而Ikram等[49]在小立碗藓中转基因获得了0.21 mg/g干重的青蒿素,但产量有待提高且生产成本需要进一步降低。
2.2 分子农业
分子农业(plant molecular farming,PMF)的概念起始于20世纪80年代。在建立植物转基因体系之后,很多研究者设想通过分子生物学方法,于植物中表达外源基因以获取附加生物制品或助力作物更好地生长[50],发展至今形成了分子农业这一植物合成生物学领域。这方面的案例包括在植物中表达抗虫[51]、抗除草剂[52]的抗性基因以抵御病害;“黄金大米”等提升食品营养成分或延长保质期[53-54];表达抗原作为口服疫苗或生产小分子药物用于口服给药[55]等。但分子农业也面临诸多社会伦理争议[10]和与环境问题相关的担忧[51-52,56]。在当前的碳排放控制要求下,分子农业结合光伏发电和自动化控制体系,有望建成碳中和模式的植物工厂,生产高质量农作物、制造方便口服的药物、供给清洁能源、净化空气与水体,为建成未来太空探索所必需的生态维持系统奠定基础[57-58]。
2.2.1 植物遗传转化体系
20世纪70年代建立起成熟的微生物转基因体系后,在80年代陆续开发了一系列植物转化表达体系。最经典的是基于农杆菌转化Ti质粒,将T-DNA插入植物基因组的稳定转化和瞬时表达体系[59];对于农杆菌不易侵染的植物还有基因枪和电击法转化[60],以及花粉管显微注射、聚乙二醇介导的原生质体转化和叶绿体、线粒体等质体转化[61]。相较于微生物和一些动物细胞,植物转基因有操作复杂、实验周期长、稳定转化物种少等问题,但植物光合自养的特征使植物转化具备天然生物制品生产工厂的优势[62]。
新近的纳米技术在遗传转化方面有广阔的应用前景[63],已有多种不同的纳米材料应用于向植物组织内递送DNA[64],包括碳量子点(CQD)[65]、碳纳米管(CNT)[66]、纳米钻石颗粒[67]等碳基纳米材料,聚乙烯亚胺(PEI)包被Fe3O4的铁磁性材料纳米颗粒(MNP)[68],介孔SiO2硅基纳米颗粒(MSN)[69],层状双氢氧化物(LDH)[70],以及共轭聚合物纳米颗粒(CPN)[71]、壳聚糖颗粒[72]、聚酰胺-胺(PAMAM)树形聚合物[73]等高分子有机物纳米材料。这些纳米材料已经在拟南芥、烟草、水稻、小麦、玉米、番茄、洋葱等模式植物和作物中有成功递送DNA转化或递送RNA诱导基因沉默的案例[74]。
另外,近年出现了一系列植物多基因大片段遗传转化体系,让大规模转入外源代谢通路成为可能[75]。以Liu等开发的TSⅡ(transgene stackingⅡ)植物多基因转化载体为代表,可以高效便捷组装长度达15 kb基因片段[76],该体系一次性将虾青素合成通路的4个基因转入水稻实现胚乳中虾青素的从头合成[77]。
2.2.2 植物口服给药平台
很多植物可供食用,因此分子农业的一个重点领域就是改造更具营养价值或抗病能力的植物,以及将植物改造成口服药物或疫苗递送平台[78](表1)。最早的尝试是在烟草叶绿体中瞬时表达霍乱弧菌毒素B亚基(CTB)抗原,将叶片磨成粉后喂食小鼠,检测到激活肠道黏膜免疫系统产生IgA抗体[79]。现在该体系已经在生菜、玉米和水稻等多种可食用植物中表达,并制成冻干粉胶囊供人口服用于预防或治疗霍乱[80]。目前已经报道的植物表达口服疫苗还有乙肝[81]、脊髓灰质炎[82]、疟疾[83]等。另外也有在番茄、灵芝中表达人源小胰岛素原,经糖尿病模型小鼠口服使血糖得到一定控制的案例[84]。Daniell等[85]在生菜叶绿体中表达脂肪酶、葡聚糖酶和抗菌肽,制成可长期保存的植物冻干口香糖,可咀嚼来消除口腔生物薄膜以治疗龋齿或口服缓释给药,这种口香糖成本比胶囊更低,是一种平价的居家口服给药模式。Lomonossoff等[86]在烟草中利用瞬时表达组装包含有新冠病毒(SARS-CoV-2)的病毒样颗粒(VLPs),利用中和抗体能检测到原始毒株和Delta突变株的刺突蛋白(Spike),提供了一种利用植物安全地生产传染病疫苗的策略。

表1 部分植物疫苗和口服药物应用案例Tab.1 Some examples of plant molecular farming
2.3 光合作用合成生物学
光合作用是人类所需的主要能源和全部食物的来源。除了少数微生物外,地球上全部生命活动所需能量都来自于将太阳能转换为生物质能的光合作用[87]。根据植物光能利用效率公式[88]:

式中,Y为植物同化产量;St为生长季阳光辐射到地球表面的总能量;εi为截获系数(可达0.9);εc为转换系数;εp为分配系数(约0.6)。
实际测算出来εc仅为0.03~0.06。由此可见,植物光能利用效率还有很大提升空间,大多数光能在转换过程中以各种形式耗散掉,没有被利用。
光合作用分为光反应和碳反应两部分,光反应的光能转换过程和碳反应的碳固定代谢通路都存在许多能提高光能利用效率的改良靶点[89]。提高光能利用效率有望让作物产量再提升至少30%,以解决人口增长的粮食缺口[11],高光效作物也可以减少化肥使用从而减少土地和河流的富营养化[87],是创造可持续碳中和生态环境的重要途径。基于光合作用的生物能源与核能、风能、太阳能等一样,也是未来碳中和清洁能源选项,农作物秸秆和光合藻类发酵可以大规模生产生物乙醇和生物柴油[87]。人工光合作用是和可控核聚变并列的有望彻底解决能源问题的技术,充分利用太阳能,以CO2为原料合成各种有机物[90]。
光合系统是长期适应环境变化的结果。在自然选择中,植物演化出的诸多性状首要目的是为了增强生存繁殖向后代传递遗传信息的能力,而并非是为了获得高光效[91],因此需要利用合成生物学技术人工优化光合系统。基于DBTL体系的概念,首先在现有高等植物和藻类的光合系统基础上设计改良的光反应和碳反应体系,然后整合各个光合元件改造靶点以提升植物整体的光能利用效率,再经从实验室到大田各个尺度的验证不断迭代获得更优良的改造结果,乃至创造全新的人工光合系统。
2.3.1 光反应:优化光能传递损耗和能量转换效率
光合作用光反应是发生在高等植物叶绿体类囊体膜或光合细菌的光合色素膜上的光化学反应[92]。光反应主要包括光能吸收传递、光合电子传递和光合磷酸化3个主要部分[93]。一轮完整的光反应吸收8个光量子,产生3分子ATP和2分子NADPH[92],理论上能量利用效率可达约30%~40%,实际光反应有很多损耗导致效率低于理论值。
光合色素天线共振传递能量效率非常高,仅有少量磷光散射和热耗散,在高等植物中光合天线能量传递效率可接近100%[94]。但高光下,光合天线收集的光能会超过光合同化能力上限,导致光抑制,乃至损伤光合机构[95]。光系统具有非光化学猝灭(non-photochemical quenching,NPQ)等热耗散机制,将多余的光能转换成热能释放出去,以保护光合元件不受损,但响应光环境变化较为缓慢的热耗散机制也会影响光能利用效率[96]。Kromdijk等[97]将拟南芥调节NPQ的VDE、ZEP、PsbS蛋白在烟草中过表达,能增强烟草NPQ应对闪动光的效率,可使生物量积累提升15%。在高等植物NPQ缺失突变体中引入藻类或苔藓的叶黄素循环元件,也能部分恢复NPQ的光保护能力[98-99]。
Song等[100]通过冠层光合模型发现减小或重分配光合天线尺寸,优化光合天线吸收最适的光能,例如叶绿素减少的浅绿表型作物的光能利用效率反而会提高。过表达补充损耗严重的光合元件组分也可以维持原初反应中心运转。叶绿体基因组编码的光系统Ⅱ(photosystemⅡ,PSⅡ)的原初反应中心D1蛋白是损耗最多的,Guo等[101]通过拟南芥、烟草和水稻核转基因过表达D1蛋白转运进叶绿体内,发现均可以显著增加生物量。除此以外,藻类具有藻胆素等与叶绿素吸收光谱不同的光合色素,有望引入高等植物中拓宽可吸收利用的光谱波段[102-103]
光合电子传递链中环式电子传递途径也是潜在光能利用效率改良靶点,可设计更优化的电子传递路径,调节还原力的分配以实现更高效的光反应[104]。优化光合电子传递链还可以减少超氧负离子等自由基产生,消耗过剩的还原力,保护光合机构元件。PSⅠ结合的NDH复合体对调节环式电子传递链非常重要,NDH复合体结构非常复杂,还有待进一步解析其中潜在的改良靶点[104]。
植物冠层形态性状包括叶片形状、叶面指数、叶间夹角等都是影响光能利用效率的外在表型。通过表型组平台收集记录不同光合效率的表型经机器学习和建模分析得到最优光合表型,利用GWAS分析等方法将表型性状与基因联系到一起,将为建立高光效元件库提供基础,以支持高光效植物创制[105]。目前我们已经收集到分别在高光、低光和闪动光下能够增强光合效率的元件,并且在大田试验中都观察到生物量积累显著增加[106-108]。除此之外,Wei等[109]在水稻中过表达调控光合和氮素利用效率的转录因子DREB1C,单个基因使水稻产量增加可达30%以上。
2.3.2 碳反应:C3~C4植物改造和重构光合代谢通路
C4植物相较于C3植物有更高的光、水分及氮素能利用效率,CO2补偿点较低,更适应高温干旱的环境。然而绝大多数植物特别是主要作物多为C3植物。自20世纪60年代开始就有C4植物改造的尝试,但至今尚未成功[110-111]。大多数C4植物具有独特的花环结构,叶肉细胞浓缩CO2与维管束鞘细胞中卡尔文-本森循环的功能分化是其高效光合的关键结构基础,当前改造重点在C3植物中试图重构花环结构[112-113]。
光呼吸旁路改造也是当前研究的一个热点,设计新的代谢通路减少光呼吸损耗,或者再利用光呼吸产物2-磷酸乙醇酸合成其他有机物,提升碳同化效率[114-116]。Kebeish等[117]将大肠杆菌中乙醛酸代谢途径引入拟南芥,直接在叶绿体中将2-磷酸乙醇酸转化为甘油酸,减少了线粒体和过氧化物酶体途径的能量消耗,增加了拟南芥积累的生物量。Peng等[118]在水稻中构建了多种光呼吸支路,包括利用水稻本底的乙醇酸-草酸氧化途径,以及在水稻叶绿体内让乙醇酸代谢释放CO2的GCGT捷径(转入水稻乙醇酸氧化酶OsGLO1以及大肠杆菌过氧化氢酶EcCAT、乙醛酸聚醛酶EcGCL和羟基丙二酸半醛还原酶EcTSR)等[115],均显著提高了水稻的光合效率和产量。Ort等[119]在烟草中尝试构建多种光呼吸通路,在叶绿体中引入苹果酸合酶和绿藻来源的乙醇酸脱氢酶,同时利用RNAi降低叶绿体乙醇酸/甘油酸转运蛋白PLGG1表达,以使乙醇酸在叶绿体内转变为苹果酸,最高可使烟草干重增加40%。
1,5-核酮糖-二磷酸羧化酶/加氧酶(RuBisCO)是CO2同化的关键酶,其加氧酶活性也是产生光呼吸的原因。长久以来,改造RuBisCO提升CO2催化效率并降低加氧酶活性一直是热点[120-121]。一些藻类具有CO2浓缩机制(CO2concentration mechanism,CCM)或者富集CO2的羧体[122],将衣藻等藻类的CCM引入作物中有望提升光合作用效率、增加产量[123-124]。某些光合细菌和藻类具有更高效的RuBisCO[125-126]。Whitney等[127]将类球红细菌(Rhodobacter sphaeroides)的RuBisCO和响应活化酶转入烟草叶绿体中,可使光合速率提升2倍。某些单细胞C4植物在单个细胞中具有不同类型叶绿体可在RuBisCO周围实现局部高CO2浓度,提升RuBisCO催化活性[128-129]。Aigner等[130]在大肠杆菌里成功表达组装完整的植物RuBisCO,实现了CO2固定,使在原核体系里对RuBisCO改造或构建新的代谢通路成为可能。
综上,提高光能利用效率的核心是提高冠层光能利用效率:在各类高光效元件实现以后,可以创造“聪明冠层”,即利用植物感受光强、光质、相对湿度、CO2浓度等环境因子的能力,动态调整冠层中不同层次的光合作用特征,从而实现不同环境下的冠层光能利用效率的最大化[131](图1)。
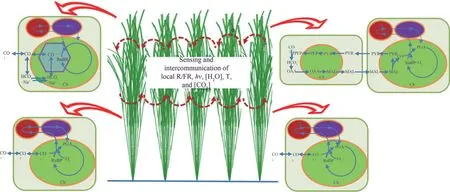
图1 聪明冠层[聪明冠层中的叶片可以感受并传递周边的环境参数,比如红光与远红光的比例(F/FR)、光质、光强、湿度、温度和CO2浓度等。基于这些环境信息,叶片可以动态调整其光合特性及代谢通路,以优化光合光能利用效率。其中可以进行调整的光合特征包括光合天线大小、C3代谢(下左与下右图)与C4代谢途径(上右图)或者藻类CO2浓缩机制(上左图)之间的转换。]PEP—磷酸烯醇式丙酮酸;PYR—丙酮酸;MAL—苹果酸;OAA—草酰乙酸;PGA—3-磷酸甘油酸;RuBP—1,5-二磷酸核酮糖;M—线粒体;Ch—叶绿体;P—过氧化物酶体Fig.1 The concept of a smart canopy[Leaves in a smart canopy are capable of sensing and intercommunicating the local red/far-red ratio(R/FR),light wavelength and photon flux density(hν),humidity,temperature and[CO2].Based on these information,a leaf in a smart canopy is capable of adjusting photosynthetic properties and metab‐olism for optimized photosynthetic energy conversion efficiency.These adjustments may include changing antenna size,switching between C3 photosyn‐thesis(bottom left and bottom right figures)and C4 metabolism(upper right)or algae-type CO2 concentrating mechanism(upper left figure).]PEP—phosphoenolpyruvate;PYR—pyruvate;MAL—malate;OAA—oxaloacetate;PGA—3-phosphoglycerate;RuBP—ribulose 1,5-bisphosphate;M—mitochondria;Ch—chloroplast;P—peroxisome
2.3.3 人工光合作用
人工光合作用是效仿植物光合作用的整体或部分过程,实现人工高效光解水将太阳能转化成可以利用的能量形式,并将CO2转化成各种有机物。人工光合作用最大的难点是裂解水,将太阳能转换成电子势能。光合作用光反应的原初反应中,PSⅡ的锰簇氧化复合体结合水分子,在常温常压下实现水分子的高效裂解并释放质子和氧气[92]。当前人工光合作用还无法利用化学方法实现如此高效温和的水裂解[90,132],有研究用Ru、Pd等金属氧化复合物溶液环境中实现温和条件光解水[133-134],但成本较高。
当前很多研究聚焦于半人工光合作用,利用部分植物光合反应元件或通路,结合化学材料形成光驱动的碳固定体系,或者联用光伏发电与燃料电池以CO2为原料合成有机物[135-136]。Yang团队[137-139]一直致力于将硅纳米线材料结合固碳细菌共培养的人工光合作用体系,由硅纳米线转换光能驱动细菌将CO2合成为乙酸盐,同时释放氧气,目前最高能量转换效率可达3.6%,达到C3植物的水平。Xiong等[140]构建了基于外源电子通过蓝细菌PSⅠ驱动的碳固定体系,将光合微生物固碳体系与光伏电池偶联互补太阳光吸收波段,不依赖PSⅡ的裂解水提供电子实现生物光电合成乙酸。
Erb等[141]提取菠菜的叶绿体类囊体,利用微流控技术将类囊体包裹在油滴内模拟叶绿体,在光照下连续固定CO2转化为有机酸,利用天然的光反应体系结合人工组分实现了半人工叶绿体原型。另一方面,在微生物或无细胞体系中重构光合作用碳反应的碳固定体系也取得了诸多进展。Milo等[142]将卡尔文-本森循环导入大肠杆菌当中,通过进化筛选实现仅由CO2为碳源合成糖和其他有机物。Ma等[143]实现了在无细胞体系中,以CO2为碳源从头合成淀粉,该人工合成通路较玉米中淀粉合成速率高约8.5倍。无论是基于植物光反应和碳反应重组的光合系统,还是结合光电转换材料的人工光合作用体系,都已具备成功的原型设计,将在碳中和进程中发挥重要作用(部分光合作用合成生物学改造案例总结见表2)。

表2 部分光合作用合成生物学改造案例Tab.2 Some synthetic biology examples for improving photosynthesis
2.4 碳汇植物创制
植物合成生物学对于未来碳中和的另外一个关键作用是创制碳汇植物。碳汇植物的主要特征包括高生物量、强大根系、根系抗降解能力、耐逆境等特征[144]。为创制碳汇植物,一方面可以利用已知作物进行改造,同时也可以利用野生植物进行从头驯化[145]。无论用哪一种途径,都需要对碳汇植物的代谢、调控、结构等特征进行精准设计和改造。植物系统生物学模型指导的合成生物学改造将在未来碳汇植物创制过程中起到重要作用。
植物系统生物学旨在对植物生长全过程进行定量化阐释,建立模型描述植物细胞的发育调控、组织器官的协同联系、代谢分配与稳态维持到植物与环境互作关系等多尺度的系统机理,其中一个重要的目标就是建立数字植物(ePlant)实现对植物全方位生命活动的模拟[146]。与之相辅相成,植物合成生物学在数字植物模型的基础上,依据设计指导植物的改造,优化代谢通路和信号调控途径的基因靶点,实现理论预测的新型优良性状乃至创造理想的超级植物[147]。数字植物的设计与改造将帮助我们培育面向“双碳”目标的优良碳汇植物,包括提升光能利用效率、增强抗逆境能力、抵御多种病虫害和生产高附加值产物等。
2.4.1 模型指导的碳汇植物理想株形设计
植物理想株形(IPA)的概念被广泛用于支持主要作物的育种实践,从而使得植物能够获得最佳光能利用效率、最高产量和最适抗逆境能力等[148]。描述作物的理想株型既包括地上部分主要接收光的冠层表型,也包括地下吸收水分和矿质营养的根系表型[149]。迄今为止,已有大量工作鉴定了许多显著影响株形的基因,并针对这些基因的调控模式建立了模型[150-151]。建立整体模型,需要将描述单一组织器官或生理过程的模块模型各自发展,进而组织到一起,并不能自发组织形成整体模型;与此相反,需要建立一个植物整体模型框架,将各个性状模块化组织起来,实现从基因组到代谢组再到表型组串联贯通,最终实现对生长发育过程的准确模拟,并具备设计适用碳汇植物理想株形的能力[152]。
在植物系统模型指导作物改造这方面,光合作用系统模型在近年来发展迅速。现有光合系统模型包括预测光合基因能力的调控网络模型[153-154]、光合产物代谢流的动力学模型[155-157]、组织器官的发育和代谢模型[158-160]、代谢产物分配的源-库流模型[161-163]、群体冠层光合模型等[164-166]。在水稻中这些模型已有指导改造和选育高光效植株的案例[106-107,167]。未来需要进一步将这些模型整合到一起,形成一个整体的植物模型,并用于指导整体理想植株设计(图2)。
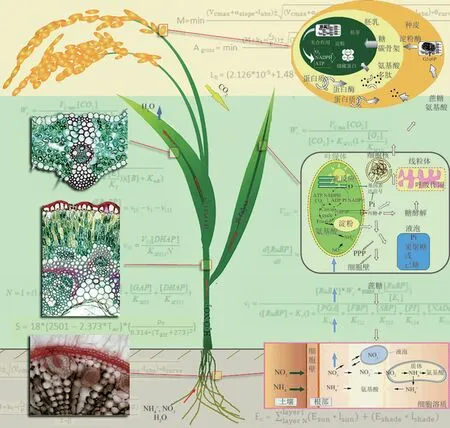
图2 数字植物模型指导碳汇植物的创制(数字植物模型基于植物光合、呼吸、氮同化、同化物分配、水分运输等基本过程,模拟植物生长发育、植物环境互作过程,从而实现对植物生长过程的精确预测,因而可以用于设计粮食或者生物量作物的理想株型、生理及调控特征[170]。碳汇植物具有高生物量、高光能及氮素利用效率、多年生、抗降解等特征。这些特征当前粮食作物具有极大差异。数字植物模型可以用于进行碳汇植物所需的理想株型设计,从而支撑碳汇植物培育)Fig.2 ePlant guided creation of plants for carbon farming(ePlant is a mathematical model to simulate the plant growth and development,the interaction between plant and environment etc.ePlant is based on modeling of photosynthesis,respiration,nitrogen assimilation,assimilate partitioning,water transport etc.ePlant can be used to guide design of ideal architectural,physiological and regulatory features for either food or biomass production[170].Plants for carbon farming has features such as high bio‐mass,high light and nitrogen use efficiencies,perennial and with biomass resistant to degradation.These features differ dramatically from food crops.ePlant can be used to design ideotypes for crops for carbon farming and hence guide breeding such crops)
借鉴在微生物合成生物学中的基因回路设计模式,可以开发一套适用于植物的编程化理想株形设计语言,将各个模型预测的靶点定量化表征,建立一个高通量测试平台筛选出备选元件库,经数字化模拟评估设计效果之后再选取相应的工具方法去改造。我们现在距离这种模块化、标准化的理想株形设计和改造还比较遥远,不仅需要完备系统模型框架,而且还要扩充植物合成生物学的元件和技术储备。
2.4.2 人工调控植物-环境互作体系
植物在进化中不断耐受环境选择压积累了大量抗逆基因储备,但现代农业生产对抗逆境能力有更高需求,因此诞生了人工调控植物-环境互作体系的概念[168]。未来碳汇植物的重要特征之一是其必须有强大的抗逆能力。从20世纪80年代开始的抗病转基因体系[169],到当下热点的提升吸收矿质营养效率以减少化肥使用[170],都是合成生物学改变植物环境响应的尝试。
植物与昆虫的互作关系是最典型的代表,植物一方面需要抵御害虫的侵袭啃食,另一方面很多植物又依靠昆虫传粉,因此需要保持与昆虫的动态平衡关系。现代农业大量使用农药杀虫剂造成严重的环境污染和导致超级耐药害虫出现,至今已有包括木瓜、棉花、玉米、大豆等17种农作物广泛采取了分子农业方法抵御病虫害[171]。
当前农业生产的各个环节都会造成大量超额碳排放,其中能源和化学品使用带来的碳排放比重已由28.02%增至43.66%[172]。特别是化肥和农药有效使用率仅30%左右,农膜残留率超过40%,造成了严重的环境污染和能源浪费问题[173]。植物合成生物学可用于解决农业生产的肥料需求和减少环境污染,例如将豆科植物固氮机制应用到其他植物[174]、利用植物吸收重金属和分解有机聚合物等其他环境污染物[175]和筛选培育耐盐碱和极端气候的作物[176]等都是充满前景的研究方向。
2.5 植物工厂
植物工厂是最新的合成生物学应用概念,根据植物生长发育各个阶段的情况选择最佳培养模式,最终实现工业化大规模生产所需的作物和附加产物,实现环境友好和经济效益的最大化[177]。尤其是植物工厂与光伏产业结合,有望为碳达峰碳中和贡献重要解决方案。
一个完备的植物工厂体系需要兼顾植物生理特征、人工光源照明控制、无土立体栽培技术和自动化监管系统等[178]。20世纪60年代开始美国、奥地利和日本等国就开始进行早期的植物工厂工程试点,迄今为止世界各国建设了大量植物工厂示范项目,但都还处于小型产业化阶段[179]。植物工厂相较于传统农业生产的土地和能量利用效率更高,但植物工厂的研发和运营成本依然高昂,培养的作物品种和产量还很有限[180]。
中国的植物工厂研究虽然起步较晚,但得益于强大的光伏和LED产业资源具有良好的发展前景。我国中西部广大的盐碱地、戈壁滩等虽然不适宜天然农业,但是有充足的太阳能资源,可用于建设光伏+植物工厂,从而打造碳中和经济产业链。下一阶段的植物工厂将创造大型的人工高效植物碳汇系统。该系统最上层能量供给由光伏或风力发电提供,照明单元由智能化不同波长光配比的LED阵列组成,不同植物按生长周期和形态特征分区栽培,采用无土立体密度最大化种植;还可建立自动化环境监测和灌溉体系,按模型精确计算投入消耗资源和预期产出价值;下游设置废水废液净化后回收再循环系统,并将收获后的植物剩余部分(如叶片、秸秆等)作为燃料电池和生物肥料的发酵原料,实现植物全生命周期的高效利用,净增碳汇和经济效益。当前国内一些植物工厂试点项目正在建设中,例如江苏盐城阜宁的高效植物碳汇系统原型将尝试包含光伏农场、组培植物工厂、生物炭生态基地的有机整合。
植物工厂将在应对全球气候变化和维持生态平衡方面发挥重要作用,利用光能来发展可持续的生物制造产业[181]。以植物工厂为基础建立人工生态系统,是未来空间站和星际旅行的重要设施原型[57-58],将助力太空探索事业的发展。
3 助力“双碳”目标的植物合成生物学技术
相较于成熟的微生物和哺乳动物细胞底盘,植物合成生物学体系依然处于早期发展阶段。慢长的生长繁殖周期、庞大而复杂的基因组、不稳定的遗传转化体系等都是制约植物合成生物学发展的因素[182]。尽管如此,近年许多学者在构建植物基因元件标准化体系、设计植物基因线路和尝试植物定向进化体系等方面都取得了突破性进展。
3.1 植物基因元件标准化体系
合成生物学最重要的核心理念就是标准化,将不同基因经过定量表征测试,整合成模块化的工程元件,再按照一定的规范组装以行使功能。这方面已经形成了许多标准化框架,最具代表性的就是基于生物砖块(BioBricks)组装所发展而来的合成生物学开放语言(synthetic biology open language,SBOL)[183],让合成生物学的元件管理和实验流程如同计算机语言一样简洁明确且具有兼容性,最新已经开发到SBOL 2.0版本,并且发布了兼容植物的克隆体系Plant MoClo Syntax[184]。已有学者整理各个植物元件数据库并按SBOL体系构建标准化植物元件库,不断更新补充通过测试的植物元件[185]。
莱茵衣藻(Chlamydomonas reinhardtii)是一种兼具光合自养和化能异养的单细胞真核藻类,基因组较简单,细胞中只有一个大的杯状叶绿体,生长较快,在合适培养条件下约5~6 h可繁殖1代,同时具有无性繁殖和有性生殖,因此成为光合作用研究和植物合成生物学技术开发的重要模式物种[61]。目前在莱茵衣藻中已经建立了一个成熟的符合SBOL标准的标准化元件工具库(Chlamy MoClo Toolkit),该元件库利用Golden Gate标准化克隆体系将119个基因元件按照功能分为13类整合进11个连接位点,可以一次性构建最多10个元件组成的复合载体,为其他植物标准化元件库的开发提供规范的参考案例[186]。近期普林斯顿大学和卡内基研究所等机构的科研人员发布了迄今为止最大的莱茵衣藻突变体资源库,收集了超过58000种突变体在121种不同生长条件或处理下的表型,为衣藻元件和底盘标准化提供了有力支撑[187]。
最近,Mehta等首次成功地将蓝细菌与酿酒酵母融合形成内共生体,模拟真核光合细胞叶绿体起源,在光下由蓝细菌为酵母供给ATP以提供能量,而酵母为内共生的蓝细菌提供必需代谢物[188]。虽然尚未实现完全光合自养,但业已让酵母作为光合作用合成生物学底盘成为可能,有望利用酵母已有的成熟的合成生物学工具测试光合元件并对光合作用进行改造。
3.2 植物基因线路设计
植物基因组相较于微生物和动物普遍更加庞大复杂,信号通路繁复众多,且很多尚未解明,这使得植物的合成基因线路设计更加困难。应用合成生物学技术设计检测激素和短肽等分子信号传感器(biosensor)以了解植物的信号通路和基因调控网络,包括采取荧光共振能量转移(Förster resonance energy transfer,FRET)、双分子荧光互补(bi-molecular fluorescence complementation,BiFC)、双荧光素酶报告体系(dual-luciferase reporter assay,Dual-Luc)等技术,来可视化描绘植物基因线路[189]。更进一步可以改造植物本底的信号通路来执行新的功能,例如有学者改造脱落酸(ABA)受体结构使其能感受外界小分子化学物质,通过喷洒小分子化学物质诱导ABA信号通路响应以提升盐碱地区植物的耐干旱能力[190]。
植物也具备运行复杂合成基因线路的能力。已经有工作利用烟草花叶病毒(TEV)蛋白酶切割不同底物,以调控基因线路状态,从而成功实现在烟草叶片中构建可执行布尔代数运算的逻辑门[191]。植物叶绿体等质体基因组兼具真核和原核基因组特征,如同时含有内含子剪接机制和TATA box转录调控等[192]。在莱茵衣藻叶绿体当中已经测试成功了一些原核合成生物学工具,如在叶绿体中转入大肠杆菌的乳糖操纵子相关调控基因成功实现了IPTG诱导衣藻叶绿体表达外源基因[193],并构建了可用小分子诱导的衣藻叶绿体核糖体开关(Riboswitch)等[194]。
最近,Lister等[195]设计了首个植物细胞中稳定的重编程合成基因线路。该体系在拟南芥中通过不同启动子和终止子调控重组酶,整合一系列植物基因元件,可以对内源信号和外源信号的诱导信号输出和反馈,实现了OR、AND、NOR、NAND等一系列激活和抑制作用的逻辑门。而Brothy等[196]则更进一步,不仅在烟草体系中构建了合成基因线路,而且在拟南芥中实现了用布尔逻辑运算操控基因的空间表达模式以改变根系形态。
3.3 植物基因编辑和定向进化技术
基因编辑技术自从CRISPR/Cas9工具化以来迅速发展,在植物中也已开发了一系列成熟高效的基因编辑工具,为植物合成生物学的发展奠定坚实基础[197-199]。相比功能缺失的基因编辑,更重要的是基因敲入和原位精准编辑,将是未来分子育种的技术基础。Zhu等[200]开发了一系列高效的植物基因片段靶向敲入和替代体系,在水稻中的敲入效率最高可达47.3%[201]。基于碱基替换的先导编辑(prime editing)技术也在植物中迅速发展,例如Li和Gao等[202]开发的在水稻原生质体中较高效率的Dual-pegRNA先导编辑工具,以及Zhu等[203]在番茄中和Chen等[204]在玉米中的先导编辑工具。除了基于CRISPR的基因编辑技术以外,Kim等[205]基于TALEN的基因编辑结合靶向质体的胞嘧啶碱基编辑器实现了对植物的叶绿体和线粒体基因点突变,在生菜和油菜中都实现了高频的C-T碱基替换。
定向进化是人为加速蛋白质的自然变化,按照特定的目的加以有方向性的选择,最终获得相应功能的蛋白质或更高级的组织形式如代谢通路或生物个体[206]。早期的定向进化是随机的、不连续和低通量的,用于改造已有的酶获得更好的动力学参数[207];后来出现了连续的、高通量的定向进化技术,可以改造已有的蛋白来获得预期的功能[208];最新的理念是结合理性设计,完全从头设计出自然界不存在的可执行功能的人工蛋白质[209]。
在微生物中已经建立了许多稳定的连续定向进化技术体系,例如利用噬菌体在大肠杆菌内进行 的PACE(phage-assisted continuous evolution)技术[210]、在酵母中的正交进化体系OrthoRep(an orthogonal DNA polymerase-plasmid pair replication system)[211],在 酵 母 和 哺 乳 动 物 细 胞 中 的eVOLVER框架[212]等。近年来由CRISPR/Cas9基因编辑发展来的先导编辑(prime editing,PE)结合PACE实现了基因组范围内连续定向进化[213-214]。
植物的定向进化技术仍在初期发展阶段,基本上是将需要改造的植物目的蛋白融入微生物的定向进化体系中改造,但也有学者开发了一些在植物本底中的定向进化技术[215]。植物免疫和信号转导中有重要功能的NLR(nucleotide-binding leucine-rice repeat)受体是定向进化改造的重点对象,目前已经报道了很多定向进化选择出来的NLR受体[216]。植物中连续定向进化的代表技术是饱和靶向内源诱变编辑器(saturated targeted endogenous mutagenesis editors,STEME),其结合先导编辑在植物中成功现实对指定基因的原位饱和打靶编辑,经过筛选得到了符合预期的新性状[217]。基于先导编辑的植物定向进化技术已经推广到了水稻、小麦等作物中[218]。
植物定向进化技术的最大制约是大多数高等植物较长的繁殖周期让连续迭代的进化历程难以加速,因此在藻类等繁殖较快的低等植物中更有望开发可靠的连续定向进化技术[219]。定向进化技术有望让RuBisCO改造和C3~C4植物改造等难题获得突破[220](近期报道的植物合成生物学工具案例总结见表3)。

表3 近期已发表的植物合成生物学工具Tab.3 Recently published plant synthetic biology tools
4 总结
到2050年全球的粮食产量需要比现在增加85%才能满足届时的人口需求,但按照目前的粮食增产预估是远达不到的[88]。同时,按照全球碳中和目标来看,植物在整个碳循环生态中扮演着非常重要的角色,且植物光合固碳的提升空间巨大[13]。在太空时代,植物也将是维持星际旅行间的人造生态圈中的重要一环[57]。限于植物本身的代谢及调控限制,要在较短时间内大幅度提升植物固碳能力非常困难;植物合成生物学的发展将在未来碳达峰碳中和实现中发挥重要作用。实现这些目标必然要对植物进行人工设计和改造,需要植物合成生物学的基础研究和配套产业。
在“双碳”目标进程中,植物合成生物学可以从控制碳排放和提升固碳两个方面发挥作用,突破植物本底碳汇限制。上文所提的植物合成生物学的5个应用领域,与面向“双碳”目标的应用场景有机结合,可以为双碳目标实现提供新路径。在未来10年,首先实现碳达峰目标下,着重于控制农业生产过程中的碳排放,以及用更为环境友好的植物生产方式替代一些农业生产中的高排放、高污染环节;在这个目标需求下,基于数字植物设计与改造会指导按照植物生产全周期中最优的能量吸收和营养分配方式去种植,增加产量的同时降低各个环节碳排放,并减少化肥和农药的使用。分子农业和植物天然产物合成也将扮演更重要的角色,以低碳的形式提供多种多样的高价值产物。虽然当前植物生产的成本和规模相比于工业生产还不占优势,但通过优化迭代技术路线提升竞争力,例如提升遗传转化和基因编辑的效率等,可以增加天然产物的产量。到21世纪中叶以后,在进一步实现碳中和的目标进程中,改良光合作用培育具有更强光合能力的碳汇植物将会成为研究的核心。通过优化捕光天线、C3转为C4、引入CCM和建立光呼吸支路等合成生物学改造途径,有望大幅提升作物光能利用效率,提高粮食产量;同时在数字植物模型指导下,创制具有高光效、抗逆、强根系的碳汇植物。在未来,光合作用的改造对象不仅是农业作物,也包括构成森林碳汇的树木和海洋碳汇的藻类。光合藻类更是有望成为零碳乃至负碳排放的清洁能源和工业生产介质。最终一个理想状态是,综合各方面技术形成完备的植物工厂体系,让植物按照预设的最优生长轨迹生长,在植物群体层面符合人工设计,最大限度增加净碳固定。与此同时,完全的人工光合作用技术也是有望为人类提供彻底解决能源问题的可行方案。
到2060年,中国预计每年不得不排放的CO2约为25亿吨。陆地生态系统及海洋生态系统预计分别可吸收13.2亿吨及5.8亿吨,共计约19亿吨CO2[221-222]。其余途径中,利用理化技术封存CO2(例如制造碳化水泥、烟道集碳再利用等)的能力上限约为2亿吨,至此仍有约4亿吨的缺口。农业生态系统中,生物质可以生产生物炭成为重要的碳汇,根据当前生物炭生产能力,2060年农业生物炭可达2亿吨CO2当量。同时,我国还有261.16万平方公里(约39亿亩)荒漠化土地没有开发利用,其中沙漠约25亿亩;改造利用这些地区,发展光伏、风力发电等清洁能源等,同时,利用在盐碱地种植耐盐碱植物,预估固碳潜力可达3亿吨CO2。
前文概述的植物合成生物学应用领域中,天然产物和分子农业领域的发展可以支撑碳达峰,即通过优化次生代谢生产工艺和推广植物光能自然固碳生产附加产物,可以取代化石能源和非可持续原料的消耗。光合作用改造和碳汇植物创制等则支撑未来碳中和的实现,提升作物光能利用效率获得更多的粮食,生产更多的生物炭,改良适应盐碱地等逆境的固碳植物用于利用荒漠土地资源等,都可以用于支撑未来近4亿吨CO2的固定需求。最后,植物工厂通过结合光伏发电、边际土地的植物生产及基于生物质的生物炭生产,可以同时支持碳达峰和碳中和的实现。
植物合成生物学目前仍面临着许多问题。相较于微生物和哺乳动物的基因组研究,当今对植物基因组的认知还远远不够,仍非常缺乏对植物功能基因组学层面的理解,离实现从头设计的植物合成基因组学还有漫长路途。植物合成生物学研究的成果转化和配套的产业化进程也才刚刚起步,大环境尚未建立,没有形成市场体系。虽然当前植物研究的经费呈逐年增长趋势,但相较其他领域还是偏低,并且合成生物学思想和方法还没在植物学研究中成为主流。另外,植物合成生物学研究和应用面临一系列的法律和伦理争议,需要尽快弥补相关法律空白并引导宣传公众正确认识对待植物合成生物学。最后,植物合成生物学的人才缺口是巨大的,需要相关政策支持农林专业教育和科研。
在我国乃至国际上实现碳中和的历程中,从基础科研的技术突破到符合低碳要求的产业升级转型都将极大推动植物合成生物学的发展。以空间转录组和高通量单细胞多组学为代表的新技术将加快植物基因组解码,这将与基因组合成技术结合从而加速植物工程化改造。目前,已有一批企业以碳中和为目标,启动植物碳汇技术的开发和成果转化。植物合成生物学有望在实现碳达峰和碳中和的过程中起到至关重要的作用,并迎来自身快速发展的巨大契机。

