北戴河海产品中副溶血弧菌的毒力、耐药性和遗传特征
贺胜焜,刘美玲,朱坤鹏,靳连群,董德荣,张丽,张哲,杨超杰*,奉水东*
(1.南华大学公共卫生学院,湖南衡阳 421200)(2.郑州大学公共卫生学院,河南郑州 450000)(3.中国人民解放军疾病预防控制中心,北京 100071)
副溶血弧菌(Vibrio parahaemolyticus)是革兰氏阴性细菌,嗜盐,常见于海水和海产品中,1951年在日本首次报导了由副溶血弧菌引起的食源性胃肠炎,是由于当地居民经常生食海鲜引起的[1],此后世界各地都有副溶血弧菌胃肠炎暴发的报道[2-5]。在中国,常见因食用海产品造成食物中毒的现象,而副溶血弧菌是引起食物中毒的主要病原体,Li等[6]报道了2003~2017年期间国家食源性疾病暴发监测系统报告的数据,在已知病因的13 307起疫情中,11.30%的疫情是由副溶血弧菌引起的,仅次于毒蘑菇(31.80%)。
副溶血弧菌引起的食物中毒在夏季多发,通常是因为食用了受病原菌或细菌毒素污染的食物,主要与不同种类的海产品有关,包括螃蟹、虾、贝类、梭鱼、鱼类和牡蛎等[7,8]。人感染副溶血弧菌毒素的常见临床症状包括胃痛、腹泻、恶心、呕吐、发热、寒战和水样大便。副溶血弧菌在感染过程中,利用其粘附因子与宿主细胞上的纤维连接蛋白和磷酸结合,释放不同的效应物和毒素到细胞质中,造成细胞损伤和严重的疾病[9]。目前已知副溶血弧菌可产生三种溶血素,分别由tdh,trh和tlh基因编码的热稳定直接溶血素(Thermostable Direct Hemolysin,TDH),TDH相关溶血素(TDH-Related Hemolysin,TRH)和热不稳定溶血素(Thermolabile Hemolysin,TLH)[10]。临床分离株和环境分离株均含有tlh,又由于tlh的高度保守性,研究表明tlh可用于检测副溶血弧菌[11]。
由于在人群和水产养殖系统中过度使用抗生素[12],许多抗生素在治疗副溶血弧菌感染过程中已不再有效[13]。如包括氨苄西林在内的第一代抗生素在水产养殖中被广泛使用,导致在治疗副溶血弧菌感染过程中出现致病菌对氨苄西林敏感性降低,引起疗效低下[14]。海产品是日常生活中很常见的食物,而研究副溶血弧菌的耐药性趋势,并建立适当的监测方案对确保海产品的安全至关重要。综上所述,对海产品中的副溶血弧菌的毒力及耐药性研究具有重要意义。
1 材料与方法
1.1 材料与试剂
1.1.1 样品及菌株
26份样品为采自食堂留样和自采的虾仁、花蛤、鱿鱼、皮皮虾等样品,其中食堂样本18份,海边自采样本8份。菌株为上述水产中的10株副溶血弧菌分离株。副溶血弧菌标准菌株(Vibrio parahaemolyticus,ATCC17802)与质量控制菌株大肠埃希菌(Escherichia coli,ATCC25922)为本实验室保存。
1.1.2 培养基与试剂
硫代硫酸盐柠檬酸胆汁蔗糖琼脂(Thiosulfate Citrate Bile Sucrose Aga,TCBS)培养基、3wt%氯化钠碱性蛋白胨水、氧化酶试纸、3wt%氯化钠胰蛋白胨大豆琼脂平板、三糖铁琼脂斜面均购自青岛海博生物;DNA Marker DL2000、2×Taq MasterMix(Dye)购自北京康为世纪;革兰氏阴性菌药敏鉴定复合板、PHOENIX鉴定肉汤、PHOENIX 药敏指示剂、PHOENIX 药敏肉汤管均购自美国BD 公司;细菌DNA 提取试剂盒购自天根生化科技有限公司。
1.2 仪器与设备
DYY-12 电泳仪、电泳槽,购自北京六一仪器厂;PCR 仪、凝胶成像仪,购自美国Bio-Rad 公司;台式离心机、自动移液枪,购自德国Eppendorf 公司;恒温培养箱购自上海一恒公司;自动微生物鉴定和药敏分析系统购自美国BD 公司;浊度仪购自美国赛默飞公司。
1.3 方法
1.3.1 菌株的分离与初步鉴定
分离与纯化参考《GB 4789.7-2013 食品安全国家标准 食品微生物学检验副溶血弧菌检验》,取样品匀液1 mL 注入3wt%氯化钠碱性蛋白胨水中,置恒温箱内37 ℃过夜培养。对显示生长的增菌液,接种于TCBS琼脂培养基,37 ℃培养18 h 后记录菌落颜色与形态。挑取可疑菌落(半透明、表面光滑的绿色菌落),接种于3wt%氯化钠胰蛋白胨大豆琼脂,37 ℃培养18 h。
挑取上述纯培养的单个菌落进行初步鉴定,接种3wt%氯化钠三糖铁琼脂斜面并穿刺底层,37 ℃培养24 h 记录观察结果;进行氧化酶试验,将氧化酶试纸用蒸馏水浸湿,用接种环挑取纯单菌落涂抹于试验纸后观察颜色变化;进行16S rDNA 鉴定实验,将DNA 模板进行PCR、产物电泳、测序确认。
1.3.2 药敏与鉴定
将经过初步鉴定的可疑菌株使用BD 自动微生物鉴定和药敏分析系统进行分析,在药敏肉汤中滴加一滴药敏指示剂,从培养箱中取出平板后使用无菌棉签挑取适量菌落至鉴定肉汤管,混匀5 s 等待气泡消失后使用比浊仪调整菌液浓度至0.5~0.6 麦氏浊度。从鉴定肉汤管中转移25 μL 菌悬液至药敏肉汤管中,轻柔颠倒混匀。将鉴定肉汤与药敏肉汤分别倾倒入鉴定/药敏复合板。使用BD 自动微生物鉴定和药敏分析系统进行培养与分析,革兰氏阴性菌鉴定药敏复合板包括18 种抗生素:氨苄西林(Ampicillin)、哌拉西林(Piperacillin)、四环素(Tetracycline)、莫西沙星(Moxifloxacin)、氯霉素( Chloromycetin )、甲氧苄啶( Trimethoprim/Sulfonamides )、环丙沙星(Ciprofloxacin)、头孢吡肟(Cefepime)、头孢噻肟(Cefotaxime)、庆大霉素(Gentamicin)、氨苄西林/舒巴坦(Ampicillin/sulbactam)、氨曲南(Aztreonam)、阿米卡星(Amikacin )、阿莫西林/ 克拉维(Amoxicillin/Clavulanate)、美罗培南(Meropenem)、哌拉西林/他唑巴坦(Piperacillin/tazobactam)、头孢他啶(Ceftazidime)、亚胺培南(Imipenem)。依据美国临床实验室标准化协会的标准判定药敏结果。质量控制菌株为大肠埃希菌标准菌株ATCC25922。
1.3.3 DNA 模板的制备
挑单菌落接种至5 mL 的3wt%氯化钠碱性蛋白胨水,37 ℃摇菌过夜培养,使用TIANGEN 细菌DNA提取试剂盒提取DNA,提取所得DNA 使用紫外分光光度计检测浓度与纯度后,-20 ℃保存样本DNA 模板用于后续实验。
1.3.4 毒力基因检测
对样本进行4种关键毒力基因的检测,tdh、trh、tlh、toxR。其中毒力基因的引物参考文献[15,16],16S rDNA引物参考文献[17],引物合成与PCR产物测序委托北京天一辉远生物公司完成,引物详情见表1。

表1 副溶血弧菌PCR扩增引物信息Table 1 List of Vibrio parahaemolyticus genes and primers
1.3.5 全基因组测序及分析
提取菌株的DNA 后利用Qubit 3.0 检测所得DNA的浓度,用超声打断仪将核酸打断,对DNA进行片段化处理,随后进行末端修复和3'端加Adapter,用磁珠对片段进行筛选,然后进行PCR 扩增,最后对片段进行磁珠纯化,形成测序文库。文库质检合格后,利用Illumina MiSeq 平台进行测序。使用SPAdes(v2.04)[18]软件进行组装,采用Prokka[19]进行注释。所采用的副溶血弧菌参考菌株来自参考文献,这些菌株的基因组从美国国家生物技术信息中心(https://www.ncbi.nlm.nih.gov)获得,用于基因组分析。本研究所用到的基因组序列信息见表2。
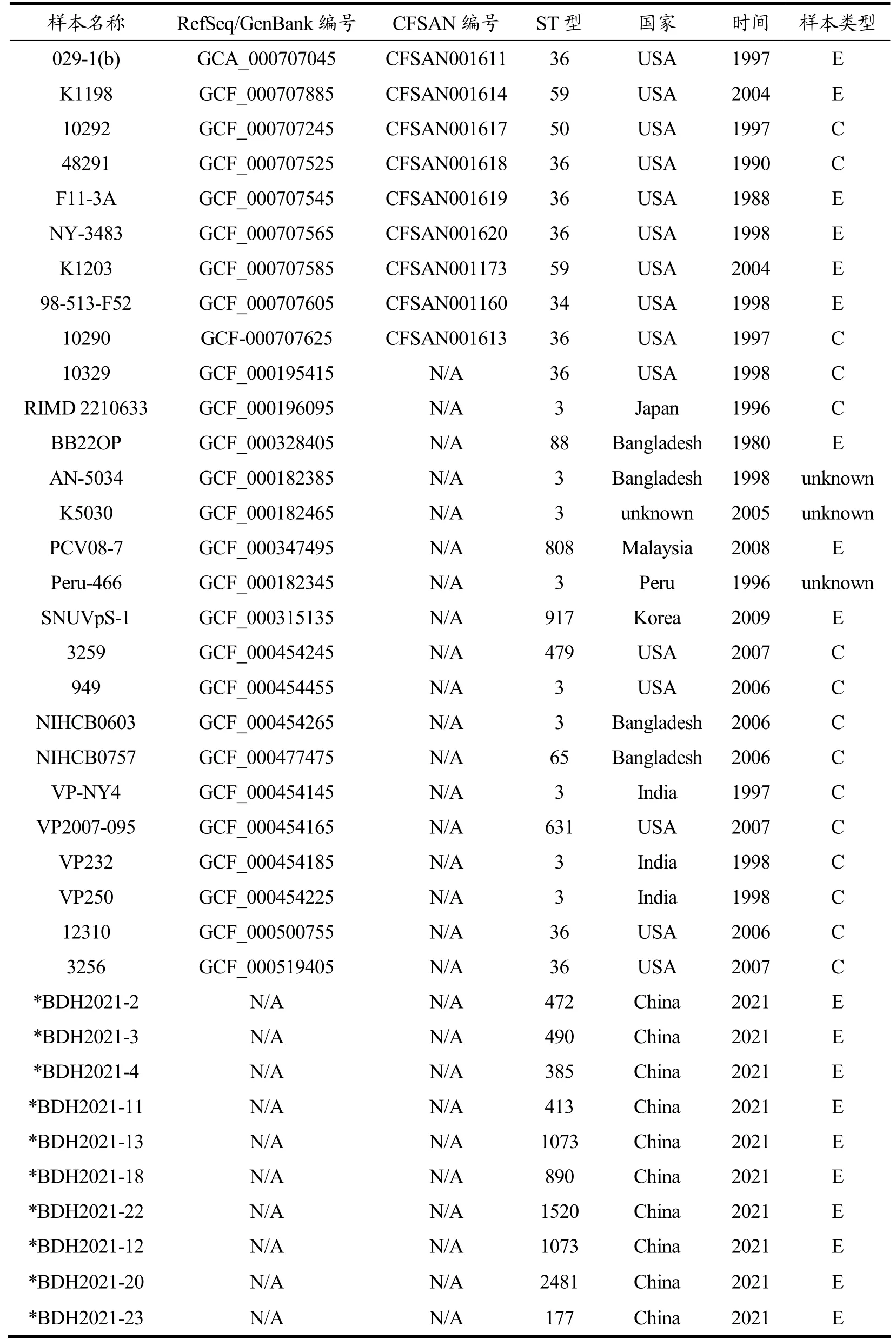
表2 美国国家生物技术信息中心提供的副溶血弧菌分离基因组用于系统基因组分析Table 2 Locally and globally diverse Vibrio parahaemolyticus isolates genomes used for phylogenomic analyses available at the National Center for Biotechnology Information
使用Snippy(v4.6.0)[20]构建基于核心单核苷酸多态性(single nucleotide polymorphism,SNP)的系统发育树,副溶血弧菌RIMD2210633 作为参考菌株。即BWA MEM 1.2.0[20]将自身的基因组映射至参考菌株序列,Freebayes(v1.3.5)[21]识别SNPs,Gubbins(v2.4.1)[22]识别并去除同源重组,SNP-sites(v2.5.1)[23]提取核心SNP,使用IQ-tree(v2.1.4)[24]软件构建最大似然树,采用一般时间可逆核酸替代模型和GAMMA 的替代模型,ITOL 网站(https://itol.embl.de/)美化发育树。
使用Resistance Gene Identifier(RGI,v5.1.1)[25]与综合抗生素耐药数据库(Comprehensive Antibiotic Resistance Database,CARD)[26]进行比对。使用BLAST[27]与毒力因子数据库(Virulence Factor Database,VFDB)[28]进行毒力基因比对。
1.3.6 数据处理
使用Excel 软件进行数据结果统计与表格编辑,制作基因注释结果的文本文件上传至ITOL 网站可视化为系统发育树热图。
2 结果与讨论
2.1 菌株分离与鉴定结果
初筛结果显示10 株分离菌在TCBS 培养基上呈典型副溶血弧菌特征,圆形、半透明、表面光滑的绿色菌落,用接种环轻触,有类似口香糖的质感;上述分离株还具备如下特征:在3%氯化钠三糖铁琼脂时反应变黄,不产气;氧化酶试验阳性;考虑到各检测方法的局限性,在上述实验结果基础上再结合自动微生物鉴定和药敏分析系统结果与16S rDNA 鉴定综合分析,最终确定样本中检出的分离株为副溶血弧菌。
样本分离鉴定情况见表3,对餐饮以及海产品采样的26 份样本中,其中10 份样本分离鉴定出副溶血弧菌,检出率为38.46%。花蛤样本中检出最多,采样6份,分离出5 株副溶血弧菌。分离株检出情况受采样地点、样品类型和检测方法影响较大。Xie 等[29]在对511 份中国即食食品的研究中分离鉴定出了39 株副溶血弧菌,检出率为7.63%。Ying 等[30]在来自中国11 个省的504 份海鲜样本中检出98 株副溶血弧菌,检出率为19.44%。受条件所限,本研究中的样本采集数量较少,分离检出率高于其它研究,特别是在花蛤样本中,而花蛤是北戴河地区最常见的食用海产品。
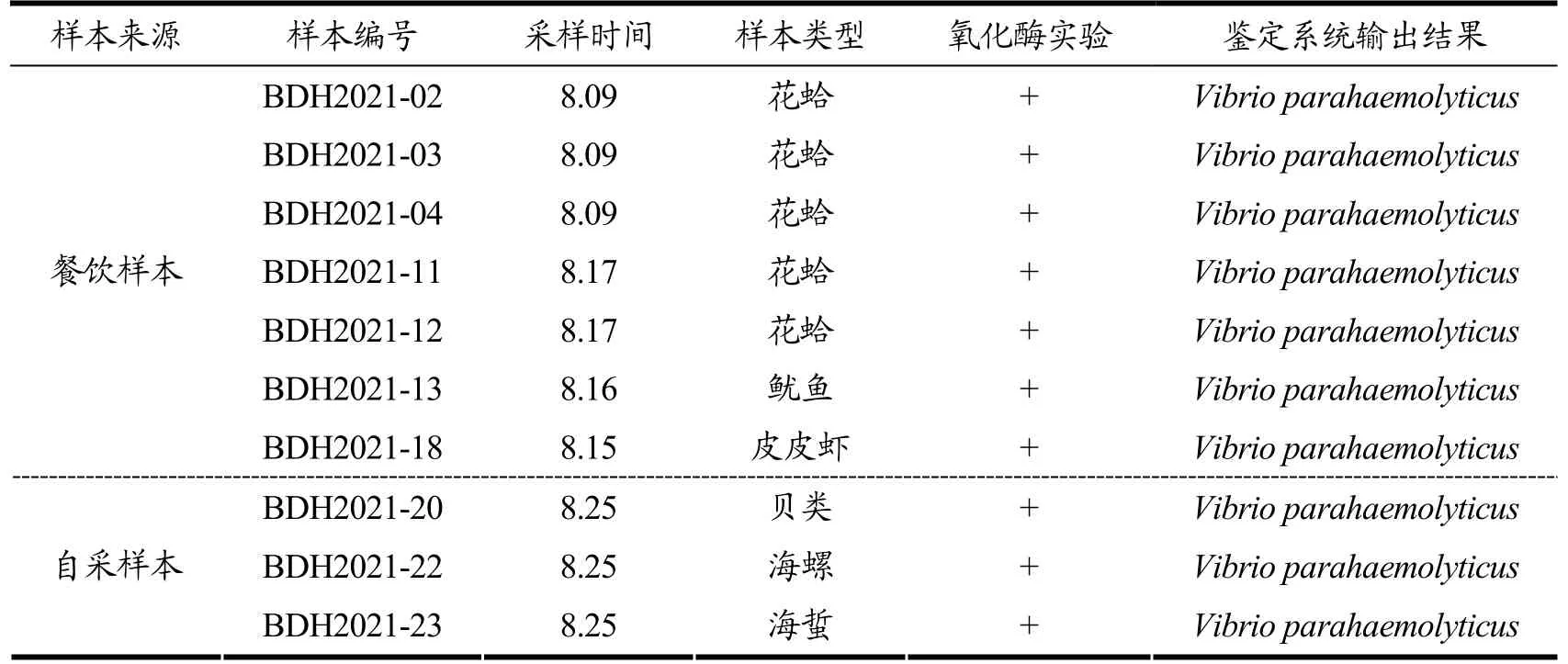
表3 海产品样本中副溶血弧菌的检出情况Table 3 Detection of Vibrio parahaemolyticus in seafood samples
2.2 药敏实验结果
如表4所示,用鉴定药敏复合板对10 株副溶血弧菌进行了18 种抗生素的药敏实验,结果显示,分离株对β-内酰胺类抗生素氨曲南耐药率为100.00%,氨苄西林中介耐药率为100.00%,对其余16 种抗生素敏感。随着亚洲水产养殖业的稳步扩张,为了增加产量,水产养殖者使用不同的抗生素来预防和治疗水产品中的致病菌感染[31]。既往的研究中,不同国家来源的副溶血弧菌的耐药性模式存在差异。与本文结果相似,Pazhani 等[32]报导了链霉素和氨苄西林耐药副溶血弧菌。Elmahdi 等[12]发现一些菌株对氯霉素、四环素或环丙沙星表现出耐药性,其中部分为临床治疗中使用的一线药物。

表4 10 株副溶血弧菌药敏实验结果Table 4 Antimicrobial resistance of 10 Vibrio parahaemolyticus isolates
2.3 毒力基因检测结果
10 株副溶血弧菌的毒力基因分布情况见表5。由表4可知,tlh基因携带率为100.00%、toxR基因携带率为100.00%,所有分离副溶血弧菌均不携带tdh基因或trh基因。与本文相似,Xie 等[29]调查了中国511 份即食食品样品,发现所有分离株均不携带tdh和trh。Li 等[33]调查了我国15 个省份的905 份食品(含即食食品、鱼类和虾类)样本,分离株中tdh、trh或两者均为阳性的菌株分别为9.90%、19.80%和3.96%;Ying 等[30]报道华南海产品分离株中tdh和trh基因的携带率分别为8.16%和12.24%;于纪棉等[34]报道宁波口岸进口水产品中副溶血弧菌的tdh和trh携带率分别为0.78%和0%。但亦有研究报道,大约10.00%的临床菌株不含tdh和/或trh[32],而环境分离的不携带tdh和/或trh的副溶血弧菌也能对人类胃肠道细胞产生高度的细胞毒性[35-37]。早期研究发现toxR作为霍乱毒素操纵子的调控基因[38],其在副溶血弧菌的表达能够调节TDH、TRH的产生[39-41]。Li 等[33]报道了检出的202 株副溶血弧菌,toxR携带率为100.00%,这与本研究结果一致。

表5 10 株副溶血弧菌的4 种毒力基因鉴定结果Table 5 Identification results of 4 virulence genes of 10 Vibrio parahaemolyticus
2.4 全基因组分析结果
2.4.1 遗传特征分析
分离株的序列类型(Sequence Type,ST)结果如表6所示,副溶血弧菌是一个高度多样化的微生物[42],共鉴别出9 种不同的ST 型(ST413、ST1073、ST890、ST490、ST385、ST2481、ST472、ST1520、ST177)。如图1所示的系统发育树,结合样本来源进行分析,10 株分离株除了BDH2021-11 与BDH2021-02,其余菌株聚成一簇;BDH2021-23 为海边自采样品分离出的菌株,与一部分的副溶血弧菌亲缘关系较近,这些菌株基本上来源于邻近国家的临床样本,如:日本、印度、孟加拉国;两食堂餐饮样本分离株BDH2021-12、BDH2021-13 为相同的ST1073,基因序列相似程度高,亲缘关系较近并与海边自采样本分离株BDH2021-22聚成一簇。
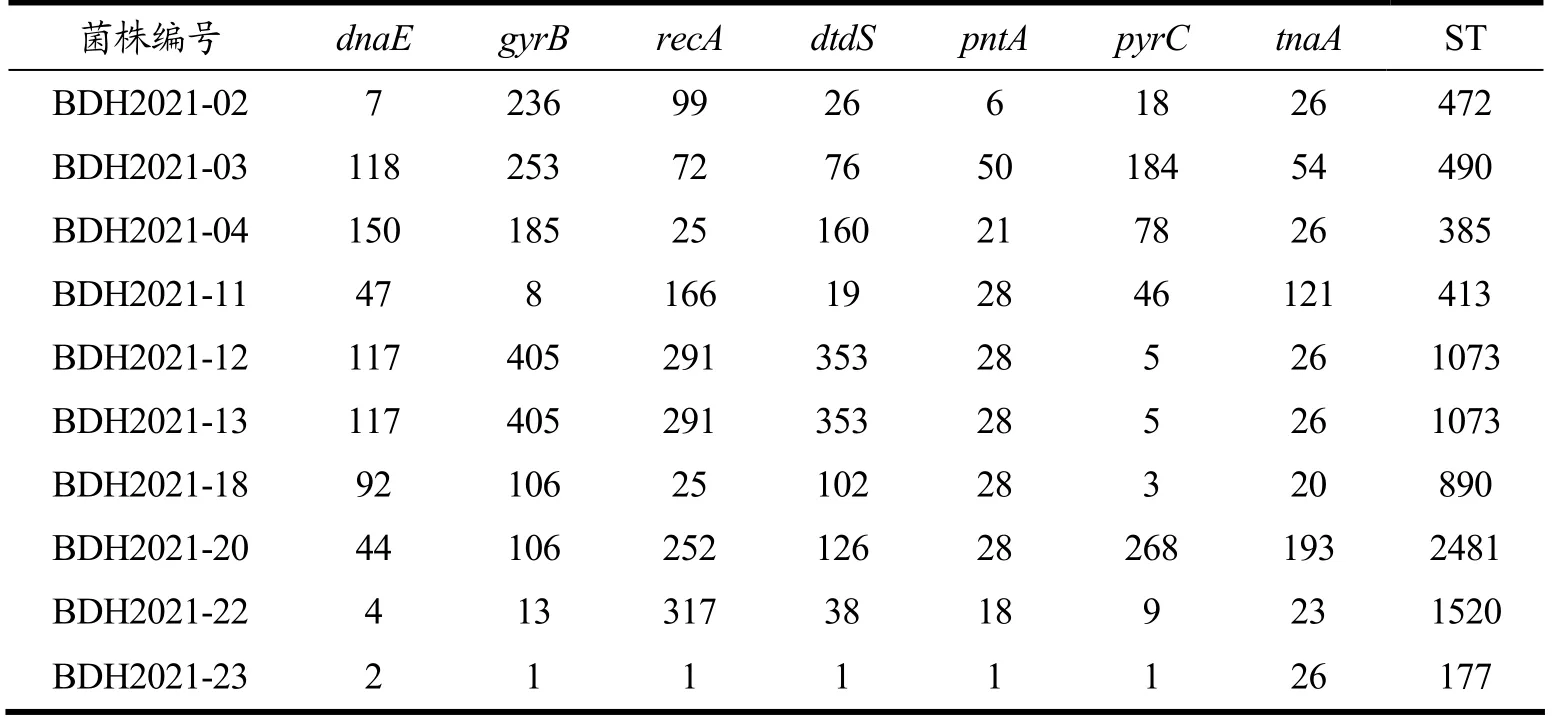
表6 副溶血弧菌的多位点序列分析结果Table 6 The multilocus sequence analysis result of Vibrio parahaemolyticus
2.4.2 耐药基因分析
如图1中耐药基因分布,本研究的10 株副溶血弧菌分离株都含有β-内酰胺类耐药基因CARB-18,都不含CARB-20、CARB-21,而参与比对的大部分美国菌株含有CARB-21;参与比对的大部分菌株含有四环素类抗生素耐药基因TXR;1 株分离菌(BDH2021-04)含有抗生素外排相关基因mexE,其它菌株不含有,在副溶血弧菌相关研究中也少有报导。对副溶血弧菌进行18 种抗生素的药敏实验,全部分离株表现为对β-内酰胺类抗生素氨曲南耐药,对氨苄西林中敏。分离株都含有耐药基因CARB-18,其编码能使抗生素失活的β-内酰胺酶。与本文相似,Felipe 等[43]从巴西里约热内卢的一个热带河口分离出1 株多重耐药副溶血弧菌中检测到CARB-18。NCBI 数据库提示,关于CARB-18的报道主要是关于副溶血弧菌,在其它类型菌株的基因组中较少被报道。结合上文所述耐药表型推测,此基因可能是导致本研究所检出副溶血弧菌对β-内酰胺类抗生素耐药性增强的重要基因。
分离株BDH2021-04 不同于被分析的其它副溶血弧菌,其基因组中含有抗生素外排相关基因mexE,其在副溶血弧菌中报道较少。抗生素外排可导致细菌出现多药耐药表型,被认为是促进细菌早期适应感染部位抗生素的重要因素,例如酶抗性或靶突变[44]。mexE在铜绿假单胞菌相关研究中被报道较多,膜融合蛋白mexE为铜绿假单胞菌多重耐药外排系统的主要组分之一[45]。其在分离的耐药副溶血弧菌中被检出,需引起关注。
2.4.3 毒力基因分析
如图1中毒力基因分布,本研究分离株不含tdh、trh,这与毒力基因的PCR 扩增实验结果一致。即使在没有这些溶血素的情况下,副溶血弧菌仍然具有致病性,表明存在其他毒力因素。不同菌株可能采用不同的机制实现致病性[46]。Mahoney 等[47]报道了缺乏tdh和/或trh的副溶血弧菌环境分离株产生了其它毒性因素,如细胞外蛋白酶、生物膜、铁载体,并对人类细胞具有高度的细胞毒性。所以除了被报道较多的tdh、trh毒力基因,通过基因组分析毒力基因,关注了其它可能导致副溶血弧菌致病的毒力基因。本研究分离株与参比的国外副溶血弧菌相比,差异主要表现在甘露糖敏感的血凝素(Mannose-sensitive Hemagglutinin,MSHA)菌毛相关基因,分离株BDH2021-11 同时含有mshB、mshC、mshD;亲缘关系较近的BDH2021-12、BDH2021-13、BDH2021-22 同时含有mshC、mshD;大部分菌株还含有较多鞭毛相关基因(flgA、flgN、flgM、flgB、motA、motB、motY、lafB、lafE等)、亚铁转运相关毒力基因(vctD、vctP、vctF)和其它毒力基因。研究报道副溶血弧菌MSHA 菌毛具有凝集素功能,能激活三型分泌系统(Type Three Secretion System,TTSS)介导的致病性,MSHA 菌毛在细菌-宿主细胞粘附和随后对Caco-2人肠上皮细胞的致病中起重要作用[48]。所以缺乏毒力基因tdh或trh的副溶血弧菌的高检出率也给饮食健康带来安全隐患,日后需加强监测。

图1 不同国家来源副溶血弧菌进化树与耐药因子、毒力因子分布热图Fig.1 Phylogenetic tree and distribution of drug resistance and virulence factors of Vibrio parahaemolyticus from different countries
3 结论
对10 株副溶血弧菌分离株进行18 种抗生素耐药分析,分离株对β-内酰胺类抗生素的耐药性增强,抗生素氨曲南耐药率为100.00%,氨苄西林中介耐药率为100.00%;对分离株基因组进行耐药基因分析,分离株都含有β-内酰胺类耐药基因CARB-18,都不含CARB-20、CARB-21,这与耐药表型相对应,推测此基因是导致本研究所检出副溶血弧菌对β-内酰胺类抗生素耐药性增强的重要基因;与之不同的是,国外分离株携带的主要基因型为CARB-20、CARB-21;发现一株含有抗生素外排相关基因mexE副溶血弧菌,此基因在同类研究中较少报道,在铜绿假单胞菌相关研究中报道较多。
对10 株副溶血弧菌分离株进行4 种主要毒力基因检测,分离株都不携带tdh和trh,tlh基因携带率为100.00%,toxR基因携带率为100.00%;对分离株基因组进行毒力基因分析,大部分菌株含有较多鞭毛相关基因(flgA、flgN、flgM、flgB、motA、motB、motY、lafB、lafE等)、亚铁转运相关毒力基因(vctD、vctP、vctF)和其它毒力基因;一株分离株同时含有MSHA菌毛相关基因mshB、mshC、mshD。
食堂样本、自采样本副溶血弧菌分离株的耐药表型和毒力基因扩增结果都未出现差异,差异主要体现在菌株间的遗传多样性,对10 株副溶血弧菌共鉴定出9 个ST 型。
对副溶血弧菌进行遗传特征分析,其中食堂分离的部分菌株与当地海洋生物分离株同源性较高,部分菌株与纳入分析的国外菌株同源性较高,提示当地副溶血弧菌来源比较复杂。同时,我们在对周边海鲜市场调查过程中发现,随着人们生活水平的提高,北戴河市售海产品种类丰富、来源广泛,其中还存在有大量进口商品。这为外来海产品携带副溶血弧菌进入北戴河海鲜市场创造了条件。需警惕可能存在国外副溶血弧菌污染源,加强对进口海产品中副溶血弧菌的监测。
4 展望
食源性病原菌副溶血弧菌引起的腹泻是一个长期存在的公共卫生问题。北戴河地区海产品中副溶血弧菌的检出率高,这引起了我们的重视,但因时间和条件所限,未进行大规模采样。副溶血弧菌的相关研究仍然有很多工作需要进一步深入,例如:毒力基因缺乏株与致病性之间的联系及致病机制;对即食食品中副溶血弧菌流行情况的监测相对缺乏;多耐药株的流行分布规律及其耐药机制的研究,以期为今后副溶血弧菌感染的治疗和防控提供科学依据。
——以青岛市为例

