基于网络药理学及分子对接技术分析六味地黄丸治疗狼疮肾炎的作用机制*
陈一鸣,李桓,武上雯,龚晓红,陆超群,李松伟
1.河南中医药大学,河南 郑州 450046; 2.泗阳康达医院,江苏 泗阳 223700; 3.河南中医药大学第二附属医院/河南省中医院,河南 郑州 450002; 4.河南中医药大学第一附属医院,河南 郑州 450000
系统性红斑狼疮(systemic lupus erythematosus,SLE) 是一种自身免疫功能受限介导的慢性炎症性疾病,能在不同的血管及组织中引起免疫复合物沉淀,最终导致器官病变[1]。肾脏受累在SLE患者中很常见,狼疮肾炎(lupus nephritis,LN)是SLE总体发病率和病死率高的主要危险因素[2]。目前,临床针对LN的治疗和预后方面取得的效果有限,肾衰竭的比例仍然居高不下[3]。中医药具有多靶点、多系统的调节作用,可作为治疗LN的一种重要手段,但具体分子机制尚不明确。
古代医学中未有LN病名的明确记载,而现代医学将LN归属为“红蝴蝶疮”“肾脏风毒”“阴阳毒”“水肿”等范畴[4]。本病多属素体禀赋不足,阴阳失调,肾阴本亏[5]。六味地黄丸是临床治疗肾阴亏虚的代表方剂。有研究表明,其可显著提高环磷酰胺和糖皮质激素对LN的治疗效果,并能有效减轻使用糖皮质激素和环磷酰胺的不良反应[6]。激素类药物联合六味地黄丸可通过降低其晚期糖基化终产物(receptor of advanced glycation end products,RAGE)、单核细胞趋化蛋白-1(monocyte chemotactic protein 1,MCP-1)及分形趋化因子(fractalkine,FKN)的表达水平,提高LN的治疗效果[7]。另有研究表明,其还能够有效降低SLE患者血清白细胞介素-4(interleukin-4,IL-4)及单核细胞趋化蛋白-4(monocyte chemotactic protein 4,MCP-4)水平、恢复辅助性T细胞1(Th1)和辅助性T细胞2(Th2)免疫平衡[8]。目前,六味地黄丸治疗LN的临床研究已得到多方验证,但其具体作用机制尚不清楚。
本研究通过网络药理学和分子对接的方法,旨在探究六味地黄丸治疗LN的药物有效成分及其潜在的治疗作用机制,为后续LN的相关研究提供理论依据。
1 资料与方法
1.1 有效成分的收集与筛选及其相关靶点的获取使用中药系统药理学数据库和分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP,https://tcmsp-e.com/)检索六味地黄丸中熟地黄、山药、山茱萸、牡丹皮、泽泻和茯苓的化学成分。根据口服利用度(oral bioavailability,OB)≥30%和类药性(drug-likeness,DL)≥0.18筛选出六味地黄丸的有效成分的作用靶点。通过Uniport数据库标准化处理获得与作用靶点匹配的基因。
1.2 LN疾病靶点获取以“lupus nephritis”为关键词,使用OMIM(http://www.omim.org/)、GeneCards(http://www.genecareds.org/)、DrugBank(https://www.drugbank.ca/)等数据库,获取与LN相关的疾病靶点。
1.3 获取六味地黄丸治疗LN相关的潜在靶点利用在线平台Venny 2.1(https://bioinfogp.cnb.csic.es/)将上述1.1与1.2获得的靶点绘制韦恩图,交集基因即为六味地黄丸治疗LN相关的潜在靶点。
1.4 构建潜在靶点的蛋白相互作用(protein-protein interaction,PPI)网络收集1.3获得的潜在靶点上传STRING数据库(https://www.string-db.org/),种属设置为“Homosapiens”,获得PPI网络,并通过Cytoscape(3.8.2)进一步绘制,节点即有效成分与疾病潜在的靶点,边即节点与节点之间的相互关系,构建六味地黄丸治疗LN的潜在靶点的网络关系图。
1.5 富集分析使用R语言的“BiocManager”,“org.HS.eg.db”,“clusterProfiler”等程序包,进行基因本体(gene ontology,GO)功能富集分析、京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)信号通路富集分析,以确定靶基因的分子功能和作用机制,并通过气泡图将结果可视化。
1.6 分子对接筛选得到六味地黄丸中相应的药物活性成分,通过PubChem(https://pubchem.ncbi.nlm.nih.gov/)下载其对应的2D结构;PDB(http://www.rcsb.org/)获得核心靶点3D结构。使用AutoDock、Vina软件进行分子对接,利用PyMOL 软件对结果进行可视化处理。
2 结果
2.1 六味地黄丸有效成分收集、筛选及相关靶点获取通过数据库分析获得六味地黄丸组方中的化学有效成分共计69个(熟地黄2个,山茱萸20个,山药16个,牡丹皮11个,茯苓15个,泽泻10个)。通过Uniprot数据库对靶点蛋白标准化,共获得六味地黄丸有效成分靶点基因210个。将中药、化合物成分及靶点导入Cytoscape 3.8.2中,构建六味地黄丸组方的化学有效成分及预测靶点的关系网络图,见图1。

图1 中药-化合物-靶点网络图
2.2 疾病作用靶点获取结果通过1.2中的数据库检索获取LN的相关靶点1 357个与六味地黄丸的210个靶点绘制LN疾病靶点与药物有效成分靶点韦恩图,见图2。
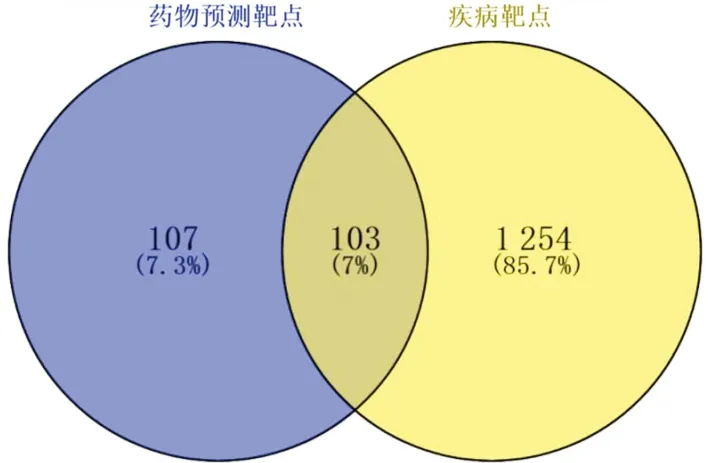
图2 药物预测靶点与疾病靶点的韦恩图
2.3 蛋白相互作用网络的构建将2.2获得的103个交集基因,上传String在线数据库,通过Cytoscape3.8.2,绘制PPI网络图,见图3。共有103个节点和1 879条边,获得度中心性(degrree centrality,DC)前10位的核心基因:蛋白激酶B1 (AKT1)、血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)、IL-6、肿瘤抗原p53(TP53)、IL-1β、转录因子AP-1(transcription factor AP-1,JUN)、半胱天冬酶3(CASP3)、前列腺素G/H合酶2(prostaglandin G/H synthase and cyclooxygenase 2,PTGS2)、基质金属蛋白酶9(matrix metalloprotein 9,MMP9)、CXC趋化因子配体8(CXC chemokine ligand 8,CXCL8),见表1。

图3 六味地黄丸治疗LN的PPI网络

表1 六味地黄丸治疗LN的关键靶点(节点度值排序前10位)
2.4 GO功能、KEGG信号通路富集分析采用GO功能、KEGG信号通路富集技术,对获得的103个参与六味地黄丸治疗LN潜在靶点的基因进行宏观生物学评价。共有4 481个GO功能,包括与对脂多糖、对细菌来源分子的反应以及活性氧代谢过程等3 812个生物学过程(biological process,BP)相关;与膜筏、膜微区及膜区等245个细胞成分(cellular component,CC)密切相关;与细胞因子受体结合、细胞因子活性及DNA结合转录因子结合等424个分子功能(molecular function,MF)有关,见图4。

图4 六味地黄丸治疗LN关键靶点的GO功能富集分析
2.5 六味地黄丸治疗LN关键靶点KEGG信号通路分析KEGG分析结果表明,关键靶点参与的信号通路242条,主要包括IL-17信号通路、TNF信号通路、Th17细胞分化、HIF-1信号通路等,见图5。

图5 六味地黄丸治疗LN的KEGG信号通路富集分析气泡图
其中,在前30位通路中,AKT1、JUN、IL-6、TP53和IL-1β涉及15个以上的通路(图6),且在PPI网络核心基因中均位列前10位,这表明AKT1、JUN、IL-6、TP53和IL-1β可能为六味地黄丸治疗LN的关键靶点。

图6 六味地黄丸治疗LN的KEGG弦图
2.6 活性成分与核心靶点的分子对接采用分子对接技术分析六味地黄丸中主要活性成分与AKT1、JUN、IL-6、TP53和IL-1β蛋白的相互作用。从PBD数据库中获得靶点蛋白相对应的晶体结构。分别下载其PDB Formant 格式文件,运用AutoDock、Vina软件进行分子化合物依次虚拟对接,结果见表2。若结合能小于-7 kcal·mol-1,则表示具有强烈的结合活性。选取山柰酚(MOL000322)与AKT1(PDBID:3mv5),槲皮素(MOL000098)与JUN(PDBID:5t01),薯蓣皂苷元(MOL000546)与 IL-6(PDBID:4zs7),薯蓣皂苷元(MOL000546)与 IL-1β(PDBID:3ltq),薯蓣皂苷元(MOL000546)与TP53(PDBID:5o1h),借助Pymol2.5.0软件分别进行分子对接可视化分析,见图7。

表2 活性成分与核心靶点的分子对接

图7 分子对接模式图
3 讨论
《类经》曰:“然正本拒邪,正气不足,邪反随之而入,故曰相引”“盖邪气多有余,正气多不足。”肾虚是LN发病的内在因素,而长期使用激素以及细胞毒类药物,极易产生热毒,内邪、外邪杂至,灼伤营阴,加重病情发展[9]。
采用网络药理学及分子对接技术揭示六味地黄丸治疗LN的协同作用机理,发现六味地黄丸中的多种药物活性成分可以通过多个靶点蛋白发挥治疗LN的作用。研究表明,六味地黄丸治疗LN的活性成分包括槲皮素、山柰酚、薯蓣皂苷元、谷甾醇、β-谷固醇、豆甾醇等。
槲皮素是一种分布广泛且具有多种药理学作用的黄酮类化合物[10]。研究表明,槲皮素具有抗氧化、抗炎、抗癌、抗纤维化等多种生物学功能[11]。周小刚等[12]证明,槲皮素可能通过调节自身免疫,减少炎症因子生成,抑制补体系统过度激活从而对红斑狼疮小鼠模型有明显的保护作用。
山柰酚也是一种广泛存在于多种水果、蔬菜以及中草药等天然植物中的黄酮类化合物,具有抗氧化、抗炎、抗癌及抑制蛋白激酶等多方面的药用价值[13]。山柰酚可以增强调节性T细胞(Tregs)的抑制功能,通过老鼠动物实验发现,其可提高Tregs的叉头盒P3(transcription factor forkhead box P3,FOXP3)表达水平,并防止由胶原蛋白引起关节炎的组织病理改变,同时能减少PIM1介导的FOXP3磷酸化S422,尤其是对一系列炎症性疾病(如类风湿关节炎、系统性红斑狼疮和强直性脊柱炎等)的预防和治疗提供参考[14]。
薯蓣皂苷元是一种广泛分布于葫芦巴属及薯蓣属植物中天然甾体皂苷元,常被用作合成甾体药物的前体[15]。薯蓣皂苷元在降血脂、降血糖、抗氧化、抗炎和抗增殖活性等方面发挥重要作用[16]。薯蓣皂苷元可以通过抗氧化、免疫等方面改善庆大霉素诱导的大鼠肾毒性,血清肌酐、尿素氮、白蛋白和总蛋白水平升高,尿电解质水平升高,促炎细胞因子、抗氧化参数显著下降,并表现出明显的剂量依赖性肾脏保护作用[17]。
GO功能富集分析显示,多个生物学进程涉及AKT1、JUN、IL-6、TP53和IL-1β等核心靶点。其中,AKT是一种丝氨酸/苏氨酸蛋白激酶,又叫作蛋白激酶B,是磷脂酰激醇3-激酶(phosphatidylin-ositol-3-kinase,PI3K)/AKT信号转导通路上控制细胞增殖、存活和细胞周期的主要下游靶蛋白,同时磷酸化的AKT还可调控下游因子介导炎症反应[18]。并且可以通过激活AKT/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路,与SLE的发病机制密切相关[19]。IL-6是重要的免疫调节因子和炎症因子,可以刺激B细胞分化。实验证明,IL-6表达水平与系统性红斑狼疮发病密切相关[20]。TP53基因拥有广泛的生物学功能,生物信息学分析表明,miR-564在SLE患者中得到了调节,而TP53是miR-564的核心靶基因[21]。IL-1β是一种多效性免疫调节细胞因子,它被证明是一种有效的促炎药物,在炎症反应中也是有重要作用的细胞因子[22]。其也被证明与SLE的易感性和活动度密切相关[23]。
KEGG信号通路富集分析显示,六味地黄丸可通过IL-17信号通路、TNF信号通路、Th17细胞分化和HIF-1信号通路等发挥生物学作用,以影响LN疾病进程。既往研究发现,狼疮模型小鼠的 miR-23b能够通过抑制IL-17/核因子κB(nuclear factor kappa-B,NF-κB)的激活来保护机体,而IL-17能降低细胞中miR-23b的表达,激活IL-17信号通路,从而促进自身免疫性疾病的发展[24]。TNF是一种介导自身免疫反应的重要效应因子,在狼疮患者血清中水平较高[25]。狼疮患者的TNF-α信号通路被激活,并通过NF-κB激活炎症信号通路,造成局部炎症暴发、组织损伤坏死和自身抗原暴露,加速疾病的发生和发展[26]。Th17细胞分化水平与SLE活动度密切相关[27]。潘海峰[28]发现,SLE患者Th17通路相关因子血清水平及mRNA水平表达均有异常,表明Th17通路调节异常与SLE的疾病进展密切相关。HIF-1能调控与代谢相关基因或酶的表达,具有调节免疫细胞分化的作用[29]。通过上调HIF-1水平,狼疮小鼠模型肾小球系膜细胞增殖明显,系膜细胞凋亡减少,说明HIF-1能促进细胞的增殖从而加重狼疮的病理变化[30]。
综上所述,六味地黄丸可能通过槲皮素、山柰酚、薯蓣皂苷元等多种化学活性成分,对LN起防治作用。

