灯盏花素保护大鼠免受糖尿病肾病侵害的作用机制研究
王 静 李 敏 何立明 张志佳 檀增桓
(邯郸市中心医院内分泌科,邯郸,056000)
糖尿病肾病(Diabetic Nephropathy,DN)是糖尿病患者微血管病变常见并发症之一,是导致终末期肾功能衰竭的最主要原因[1]。高血糖引起的氧化应激和炎症反应,以及细胞凋亡是导致糖尿病慢性肾病的关键因素[2-5]。因此,DN的主要治疗策略是通过控制血糖、高血压和血脂异常,以预防微量白蛋白尿,降低病死率[6]。但目前的临床药物不但可能引起不良反应,而且多数患者仍然无可避免地发展成终末期肾脏疾病[7]。
灯盏花素(Breviscapine)是从灯盏花[Erigeronbreviscapus(Vant.)Hand.-Mazz.]中提取的一种黄酮类化合物,具有抗癌、抗炎、抗高血脂和降血糖特性,其显著的抗氧化作用已在多种疾病模型被证实,包括逆转视神经损伤,抑制炎症反应和细胞凋亡对四氯化碳诱导急性肝损伤小鼠显示出肝脏保护作用,增强H9c2细胞中蛋白激酶B和内皮型一氧化氮合酶的磷酸化逆转缺血再灌注损伤[8-11]。因此,被广泛用于治疗各种心血管疾病,包括高血压、冠心病和心绞痛等[12]。然而,灯盏花素对糖尿病肾脏损伤的作用及其潜在分子机制的研究仍然有限。
本研究旨在通过大鼠模型确定灯盏花素干预是否可以改善糖尿病肾脏侵害,并阐明其分子机制。
1 材料与方法
1.1 材料
1.1.1 动物 24只雄性Wistar大鼠,体质量250~280 g,购自河北省实验动物中心[SCXK(冀)2018-004]。饲喂AIN93标准饲料,保证饮用水连续不间断,每周换水3~5次,每周更换垫料清洗鼠笼1~2次,饲养室保证安静通风,光暗周期12/12 h(光照时间8:00~20:00),恒湿度50%±5%,恒温(24±2)℃。本研究已通过邯郸市中心医院科研伦理委员会审查(伦理审批号:2019080163)。
1.1.2 药物 灯盏花素粉末(上海源叶生物科技有限公司,批号:116122-36-2)。
1.1.3 试剂与仪器 链脲佐菌素(上海源叶生物科技有限公司,货号:18883-66-4);2-硫代巴比妥酸(TBA)(上海源叶生物科技有限公司,货号:504-17-6);血清胰岛素酶联免疫吸附试验检测试剂盒(联迈生物公司,货号:LM-12573-ES);脂联素酶联免疫吸附试验检测试剂盒(南京森贝伽生物科技有限公司,货号:SBJ-R0701);游离脂肪酸(Free Fatty Acid,FFA)酶联免疫吸附试验检测试剂盒[上海邦景实业有限公司,货号:BJ-(elisa)-2520];白蛋白酶联免疫吸附试验检测试剂盒(艾美捷科技有限公司,货号:589801-96);肌酐酶联免疫吸附试验检测试剂盒(上海圻明生物科技有限公司,货号:R31871);超氧化物歧化酶(Superoxide Dismutase,SOD)酶联免疫吸附试验检测试剂盒(上海研生生化试剂有限公司,货号:XGH4891);PRO-PREPTM蛋白提取液(英文特生物技术北京有限公司,货号:SD-001/SN-002);聚偏二氟乙烯(Polyvinylidenefluoride,PVDF)膜(Immobilon Millipore)(上海益启生物科技有限公司,货号:IEVH00005);抗p-AMP活化蛋白激酶抗体(赛默飞世尔科技,美国,货号:700241)、抗AMP活化蛋白激酶抗体(赛默飞世尔科技,美国,货号:MA5-15815),抗磷乙酰辅酶A羧化酶(Phospho-acetyl-CoA Carboxylase,p-ACC)抗体(赛默飞世尔科技,美国,货号:PA5-17725),抗β-actin(赛默飞世尔科技,美国,货号:MA5-15739-1MG)、抗核因子E2相关因子2(Nuclear Factor erythroid 2[NF-E2]-related Factor 2,Nrf2)(赛默飞世尔科技,美国,货号:PA5-27882)、抗Keap1(赛默飞世尔科技,美国,货号:MA5-17106)、抗血红素加氧酶-1(Heme Oxygenase-1,HO-1)(赛默飞世尔科技,美国,货号:MA1-112)、抗血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF)(赛默飞世尔科技,美国,货号:36-0900)、抗肿瘤特异性生长因子-β1(Tumor-specific Growth Factor-β1,TSGF-β1)[Abcam中国-艾博抗(上海)贸易有限公司,货号:ab215715]、抗固醇调节元件结合蛋白(Sterol Regulatory Element-binding Protein,SREBP)1(赛默飞世尔科技,美国,货号:MA5-11685)、抗SREBP2(赛默飞世尔科技,美国,货号:PA1-338),抗脂肪分化相关蛋白(Adipose Differentiation-related Protein,ADRP)抗体(亚诺法生技股份有限公司,货号:MAB14484);抗P-GSK-3β抗体(亚诺法生技股份有限公司,货号:MAB1373),抗BAX(BCL-2-相关X蛋白)抗体[Abcam中国-艾博抗(上海)贸易有限公司,货号:ab32503],抗裂解胱天蛋白酶-3(Cleaved Caspase-3)抗体[Abcam中国-艾博抗(上海)贸易有限公司,货号:ab32042],蛋白酶K(上海碧云天生物技术有限公司,货号:ST532);ACCU-CHEK血糖仪[罗氏诊断产品(上海)有限公司,爱尔兰,型号:ACCU-CHEK® Active];荧光检测器(湖北捷岛科学仪器有限公司,型号:Prominence RF-20A/20Axs);光学显微镜[尼康映像仪器销售(中国)有限公司,日本,型号:Nikon Eclipse E600 Ti2-U];透射电子显微镜[日本电子株式会社(JEOL)捷欧路(北京)科贸有限公司,日本,型号:JEM-1200EX II];图像分析仪(天津西纳国际贸易有限公司,德国,型号:Gerix 1015);X射线胶片处理器(Taixing Suxing Company,型号:SX380-E)。
1.2 方法
1.2.1 分组与模型制备 将24只Wistar大鼠分为对照组(n=6)、模型组(n=9)和灯盏花素干预组(n=9)。除对照组外,其余大鼠均建立1型糖尿病模型,方法:将4 g灯盏花素粉末溶于700 mL 0.1% EDTA-2Na。然后加入少量NaHCO3调节pH至7.0~7.5,再加水定容至1 000 mL,最后溶液过滤、灭菌,封装在安瓿瓶中备用。使用链脲佐菌素按65 mg/kg剂量一次腹腔注射诱导1型糖尿病大鼠模型。注射1周后,连续2 d上午同一时间尾静脉取血测随机血糖,第3天空腹8 h,尾静脉取血测空腹血糖。连续2次随机血糖>16.7 mmol/L,且第3天空腹血糖>11.0 mmol/L即判定为建模成功。
1.2.2 给药方法 灯盏花素干预组大鼠每日按照80 mg/kg的剂量给予腹腔注射灯盏花素,1次/d,连续干预8周;对照组和模型组大鼠每日同一时间点给予腹腔注射等量的生理盐水,1次/d,连续干预8周。在干预实验结束后,使用3%异氟烷麻醉大鼠。收集血液、尿液和肾脏。其中一个肾脏在液氮中冷冻后保存于-80 ℃备用。另一个肾脏经磷酸盐缓冲液和10%甲醛灌注,用于后续组织病理学研究。
1.2.3 检测指标与方法
1.2.3.1 尿液中丙二醛含量检测 尿液样品用40 mL 2-硫代巴比妥酸预处理,再97 ℃加热反应1 h。然后将溶液在冰上放置20 min以终止反应。加入甲醇和20%三氯乙酸缓冲液混匀,13 000×g离心6 min。荧光高效液相色谱法测定上清液丙二醛含量,将荧光检测器设置为525 nm激发波长,运行时间2 min,流速1 mL/min。
1.2.3.2 酶联免疫吸附试验法测定血清胰岛素、脂联素、游离脂肪酸,以及尿液白蛋白、肌酐和SOD水平 按照试剂盒使用说明书,采用血清胰岛素、脂联素酶联免疫吸附试验检测试剂盒,游离脂肪酸酶联免疫吸附试验检测试剂盒,白蛋白、肌酐酶联免疫吸附试验检测试剂盒,以及SOD酶联免疫吸附试验检测试剂盒进行各种因子的含量测定。
1.2.3.3 组织病理学分析 将石蜡包埋肾脏组织制备成5 μm厚切片,使用苏木精-伊红染色。在光学显微镜下以100、200、400和1 000放大倍数检查组织切片。随后通过图像分析系统测量每只大鼠40个肾小球的面积,并通过Weibel和Gomez公式计算肾小球体积[13]。
1.2.3.4 电子显微镜测量肾小球基底膜厚度及足细胞足突间狭缝孔密度 每个肾脏超薄切片在透射电子显微镜下随机拍摄5~10个30 000×肾小球电子显微照片,肾小球基底膜厚度为从内皮细胞边界到周围基底膜上皮细胞边界的垂直距离(mm),使用图像分析仪对肾小球基底膜上足细胞足突之间狭缝孔的数目进行计数,再除以肾小球基底膜厚度,来确定狭缝孔密度。
1.2.3.5 蛋白质印迹法分析 使用PRO-PREPTM蛋白提取液提取肾皮质总蛋白,通过Bio-Rad蛋白质检测试剂盒进行定量。30 μg蛋白质样品通过12% SDS聚丙烯酰胺凝胶电泳分离后,在280 mA条件下转移至PVDF膜。然后将膜与5%脱脂牛奶于室温下在PBS-T缓冲液中孵育1 h封闭。将膜与抗体p-AMP活化蛋白激酶(1∶1 000)、AMP活化蛋白激酶(1∶1 000)和p-ACC(1∶1 000),或β-actin(肌动蛋白)(1∶1 000)、Nrf2(1∶1 000)、Keap1(1∶1 000)、HO-1(1∶1 000)、VEGF(1∶1 000)、TSGF-β1(1∶1 000)、SREBP1(1∶1 000)、SREBP2(1∶1 000)和ADRP(1∶1 000)在封闭缓冲液中于4 ℃孵育过夜。用1×PBST洗涤3次后,再将膜与对应辣根过氧化物酶(Horseradish Peroxidase,HRP)标记的山羊抗小鼠二抗在室温下孵育1 h。使用电化学发光溶液检测印迹。使用X射线胶片处理器拍照记录。经NIH成像程序(ImageJ)分析每种蛋白质OD值。
1.2.3.6 免疫组织化学染色 肾脏组织切片在0.01%柠檬酸钠缓冲液(pH 6.0)中微波处理10~15 min。冷却后用磷酸盐缓冲液(Phosphate-Buffered Saline,PBS)洗涤3次,将组织切片浸入0.1% Triton X-100孵育15 min。为阻断内源性过氧化物酶,所有组织切片与3%过氧化氢在黑暗中孵育10 min。再将组织切片与10%山羊血清37 ℃孵育60 min,然后与对应一抗P-GSK-3β(1∶200)、BAX(1∶100)和Cleaved Caspase-3(1∶100)在4 ℃孵育过夜。阴性对照切片用PBS代替一抗孵育。将所有切片与HRP标记的山羊抗小鼠二抗在37 ℃下孵育60 min,然后用DAB和苏木精染色。通过光学显微镜分析染色的载玻片,褐色区域判定为阳性。使用Image-Pro Plus 5.0进行半定量分析。
1.2.3.7 TUNEL染色 肾脏组织切片经梯度乙醇脱水后,与蛋白酶K在37 ℃下温育15 min,用PBS洗涤5 min;模型组和灯盏花素干预组用50 μL TdT+450 μL荧光素标记的dUTP液;而对照组仅加50 μL荧光素标记的dUTP液。加盖玻片后于37 ℃下反应60 min。用PBS洗涤3次,再用4′,6-二脒基-2-苯基吲哚染色10 min,中性树胶封片,置于Nikon Eclipse E600 Ti2显微镜观察记录。

2 结果
2.1 灯盏花素对1型糖尿病大鼠血糖和糖化血红蛋白水平的影响与对照组比较 模型组大鼠血糖及糖化血红蛋白含量明显升高(P<0.05);灯盏花素干预组大鼠血糖及糖化血红蛋白水平与模型组比较显著降低(P<0.05),接近对照组水平。见图1。

图1 各组大鼠血糖和糖化血红蛋白检测结果
2.2 大鼠肾脏组织病理学分析 肾小球HE染色分析结果显示,与对照组比较,模型组大鼠有明显肾小球肥大,肾小球体积显著增加(P<0.05),伴有肾小管空泡化,足细胞足突消失;而灯盏花素干预组大鼠肾小球损伤与模型组比较显著减少,并且肾脏形态恢复到与对照组相似(P<0.05)。镜检结果显示,与对照组比较,模型组大鼠出现节段性足突融合,肾小球基底膜厚度明显增加(P<0.05),足细胞足突之间狭缝孔密度明显下降(P<0.05);灯盏花素干预组大鼠肾脏组织病变显著减轻。见图2。
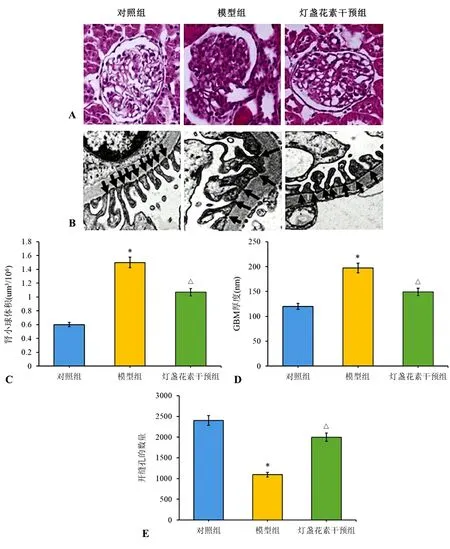
图2 灯盏花素对大鼠肾脏组织形态变化的影响
2.3 氧化应激水平分析 大鼠尿液中SOD和丙二醛水平检测结果显示,与模型组比较,灯盏花素干预组大鼠尿液中SOD水平显著升高,丙二醛水平显著降低(P<0.05)。蛋白质印迹法检测结果显示,与对照组比较,模型组大鼠中Nrf2/Keap1蛋白比值和HO-1蛋白表达水平显著降低(P<0.05);与模型组比较,灯盏花素干预组大鼠中Nrf2/Keap1蛋白比值和HO-1蛋白水平均明显升高(P<0.05)。见图3。
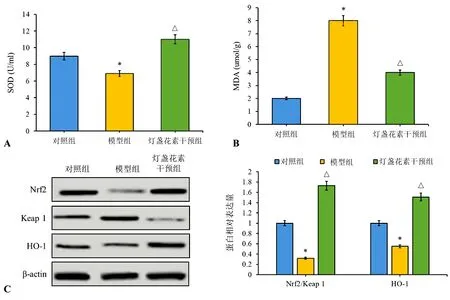
图3 灯盏花素对大鼠SOD、丙二醛、Nrf2/Keap1和HO-1蛋白表达的影响
2.4 灯盏花素对糖尿病大鼠肾脏脂质代谢的影响 蛋白质印迹法检测结果表明,与对照组比较,模型组大鼠肾皮质组织中AMP活化蛋白激酶和ACC蛋白磷酸化水平均明显下调,SREBP-1、SREBP-2和ADRP蛋白表达水平均显著上调(P<0.05)。与模型组比较,灯盏花素干预组大鼠肾皮质组织中AMP活化蛋白激酶和ACC蛋白磷酸化水平显著上调,SREBP-1、SREBP-2和ADRP蛋白表达水平均显著下调(P<0.05)。见图4。

图4 灯盏花素对糖尿病大鼠肾脏脂质代谢的影响
2.5 灯盏花素下调P-GSK-3β、BAX和Cleaved Caspase-3蛋白表达以抑制糖尿病大鼠肾脏细胞凋亡 与对照组大鼠比较,模型组大鼠凋亡细胞数更多,灯盏花素干预组大鼠相较于模型组TUNEL阳性细胞数量显著减少(P<0.05)模型组大鼠肾脏组织P-GSK-3β、BAX和Cleaved Caspase-3蛋白表达水平显著高于对照组(P<0.05);灯盏花素干预组大鼠肾脏组织P-GSK-3β、BAX和Cleaved Caspase-3蛋白表达水平显著低于模型组(P<0.05)。见图5。
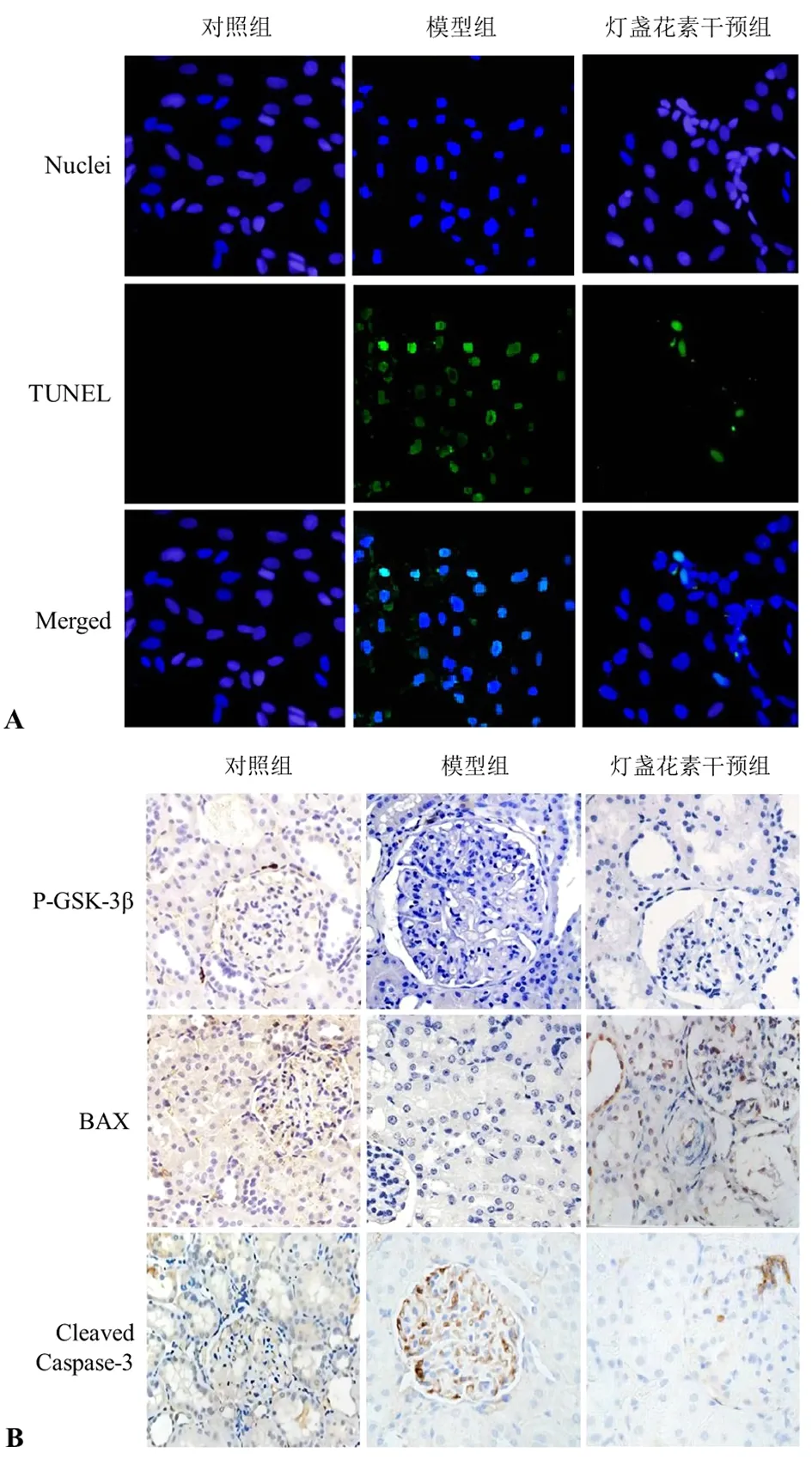
图5 大鼠肾脏组织切片原位TUNEL和免疫组织化学(B)检测
3 讨论
随着研究不断深入,越来越多的证据表明氧化应激和细胞凋亡与糖尿病引起的肾功能损害紧密关联[14-15]。高血糖会导致肾功能不全,包括尿素氮和血清肌酐升高,尿蛋白增加[16]。肾小球系膜扩张,肾小球基底膜增厚和肾小管损伤是DN的主要组织形态学改变,这些病理改变均与氧化应激和细胞凋亡有关[17]。因此,抑制氧化应激和细胞凋亡可能是治疗DN的潜在机制。SOD活性和丙二醛水平是氧化应激的典型标志[15,18],本研究结果表明灯盏花素可以通过增加SOD活性和抑制丙二醛水平来减轻肾脏组织的氧化应激。
越来越多的证据将肾组织的病理变化与高糖刺激联系起来,但其潜在机制尚未阐述清楚[16,19]。本研究采用HE染色和透射电子显微镜观察了灯盏花素干预对糖尿病大鼠模型肾脏形态和超微结构的影响。结果显示,灯盏花素能够逆转糖尿病引发的肾小球系膜扩增、肾小球基底膜厚度增加、足细胞足突消失,以及足突狭缝孔密度明显下降的病理损伤。这表明,灯盏花素可保护糖尿病大鼠肾脏组织免受高血糖损害。
尽管DN通常以高血糖引起的代谢和血流动力学变化为特征,但也有证据指出,脂质代谢紊乱在DN的发展进程中发挥着至关重要的作用[20-21]。在糖尿病肾小管上皮细胞中游离脂肪酸的积累,脂肪酸作为重要能源来源,表明DN存在能量过剩状态[22]。脂肪酸代谢产物(例如二酰基甘油和神经酰胺)在非脂肪器官中的积累,会导致细胞毒性和细胞死亡[23-24]。先前研究表明,在DN模型中检测到激活脂肪酸合成的SREBP-1,以及激活胆固醇生物合成的SREBP-2蛋白表达显著上调[25];Soetikno等[26]报道,提高AMP活化蛋白激酶磷酸化和下调SREBP-1蛋白表达,可减少肾脏三酰甘油积累。灯盏花素在本研究中可显著下调糖尿病大鼠肾脏SREBP-1和SREBP-2蛋白表达水平。ACC磷酸化是AMP活化蛋白激酶调控脂肪酸氧化的重要效应靶点。ACC将乙酰辅酶A转化为丙二酰辅酶A,阻止脂肪酸氧化[27]。因此,ACC是一种促进脂肪合成的限速酶。本实验结果显示,灯盏花素能逆转糖尿病诱导的ACC磷酸化抑制。
高血糖诱导细胞凋亡是导致肾脏结构和功能损伤的重要诱因,而这种损伤和功能障碍的潜在机制仍不清楚[28-29]。蛋白激酶B磷酸化可以提高糖尿病模型的抗凋亡和抗氧化能力,但氧化应激也能抑制蛋白激酶B磷酸化[30-31]。当蛋白激酶B磷酸化降低时,其下游因子GSK-3β被磷酸化激活,其他凋亡相关因子如BAX和Cleaved Caspase-3表达增加[32-34]。原位TUNEL细胞凋亡测定结果表明,高糖诱导大鼠肾脏细胞TUNEL阳性率明显升高;免疫组织化学分析结果显示,灯盏花素干预组p-GSK-3β、BAX和Cleaved Caspase-3蛋白表达水平显著下调。这些数据表明,灯盏花素改善糖尿病肾损伤与激活AKT信号通路有关。
综上所述,灯盏花素通过AMPK信号转导通路降低肾脏脂质积累,提高SOD活性,激活Nrf2信号通路降低糖尿病大鼠肾脏氧化应激,激活AKT信号通路抑制高血糖刺激诱导的细胞凋亡,以改善肾小球的病理损伤,从而发挥肾脏保护作用。

