婴儿4S 期神经母细胞瘤伴肝脏或皮肤转移的临床及CT 影像分析
陈欣,王浩入,李青
(1.重庆医科大学附属儿童医院放射科 国家儿童健康与疾病临床医学研究中心 儿童发育疾病研究教育部重点实验室儿科学重庆市重点实验室,重庆 400014;2.重庆市綦江区妇幼保健院放射科,重庆 401420)
神经母细胞瘤起源于交感神经链,是儿童期常见的颅外恶性实体瘤[1]。儿童神经母细胞瘤国际委员会分期系统(International Neuroblastoma Staging System,INSS)基于跨越中线、淋巴结受累及手术切除程度等术后资料,将神经母细胞瘤划分为5 个时期[2]。其中,4S 期是一个特殊的独立时期。4S 期神经母细胞瘤是指发病年龄小于12月,原发灶局限,表现为1 期或2期,但已播散至肝脏、皮肤或骨髓的神经母细胞瘤,且骨髓转移以微量浸润(小于10%)为主[3]。4S 期神经母细胞瘤有时可自然消退,临床治疗可采用手术切除或最小剂量化疗,预后通常较好[3]。文献报道4S 期神经母细胞瘤引起肝脏弥漫性增大或出现皮肤广泛结节时,需要与遗传代谢性疾病或婴儿血管内皮瘤等疾病相鉴别[4-5]。本研究通过回顾性观察并分析婴儿4S 期神经母细胞瘤伴肝脏或皮肤转移的临床特征及CT 影像表现,以提高对该时期神经母细胞瘤的认识。
1 资料与方法
1.1 临床资料
回顾性收集2016 年1 月—2021 年2 月在重庆医科大学附属儿童医院收治的9 例4S 期神经母细胞瘤伴肝脏或皮肤转移患儿的临床及术前影像学资料,所有病例均依据INSS 分期系统纳入并经病理证实或临床高度怀疑。其中8 例经手术病理最终证实,1 例经影像学检查、实验室检查及临床表现诊断。男5例,女4 例;年龄0.1~4.0月,平均年龄(2.4±1.5)月。其中2 例于母体妊娠后期产前超声发现腹部包块,余以腹胀(4 例)、腹胀伴皮肤结节(1 例)、皮肤结节(1 例)和因其他疾病发现(1 例)就诊,出现皮肤结节者均为身体双侧分布。入院治疗后随访日期截止于2021 年12 月。
1.2 CT 检查
采用GE Lightspeed 64 排和Philips Brilliance 256 层螺旋CT 扫描仪。管电压80~120 kV,管电流自动调节,扫描层厚5.0 mm,间距5.0 mm。增强扫描经外周静脉注射碘海醇等渗对比剂,剂量1.5~2.0 mL/kg,流率0.6~2.5 mL/s,碘浓度300 mg/mL,注射后20~30 s、60~70 s 进行双期扫描。对于无法配合上述检查的患儿,由麻醉科行右美托咪定滴鼻镇静。
1.3 图像分析
由两名具有10 年以上工作经验的儿科影像诊断医师共同评估患儿CT 图像,观察原发及转移病灶的部位、大小、形态、边界以及密度等特点。
2 结果
2.1 实验室检查
7 例患儿行尿香草苦杏仁酸(Vanillylmandelic acid,VMA)检测,其中4 例升高;8 例行神经特异性烯醇化酶(Neuron-specific enolase,NSE)检测,其中7 例升高;9 例行乳酸脱氢酶(Lactate dehydrogenase,LDH)检测,其中6 例升高;7 例行甲胎蛋白(Alpha fetoprotein,AFP)检测,其中5 例升高;8 例检测MYCN 基因扩增和1p36/11q23 基因缺失状况,均未见扩增或缺失;9 例行骨髓细胞学检查,其中2例出现肿瘤侵犯骨髓。
2.2 CT 表现
9 例神经母细胞瘤原发灶均位于肾上腺区,其中左侧5例,右侧4 例。瘤体均表现为形态规则、边界清楚的类圆形肿块,直径不等,约为1.98~5.50 cm,中位数3.25 cm。6 例原发灶为实性;3 例为囊实性,其中1 例以实性为主。瘤体均未见包埋邻近血管,仅2 例推移邻近肾动静脉。所有病例均未见跨越中线生长。5 例肿瘤平扫密度较均匀,CT 值为29~49 HU,中位数38 HU,均低于同一层面背部肌肉密度;4 例肿瘤密度不均匀,其中1 例肿瘤内见点状细小钙化,3 例见囊性成分,实性部分密度也均低于背部肌肉。
增强扫描后,6 例肿瘤实性部分强化不均匀,呈轻-中度强化,强化程度与背部肌肉相当或稍高,静脉期强化较动脉期明显,主要表现为周边区域强化高于中心区域。6 例肝脏弥漫增大(图1a),其中5 例平扫期可见结节状低密度影散在分布,增强后呈渐进性强化,1 例未见结节,仅出现肝脏强化不均匀;3例肝脏体积大小正常,可见多个大小不等的类圆形低密度影(图1b)。2 例患儿可见皮下脂肪层结节影,增强后中度强化(图1c~1g)。
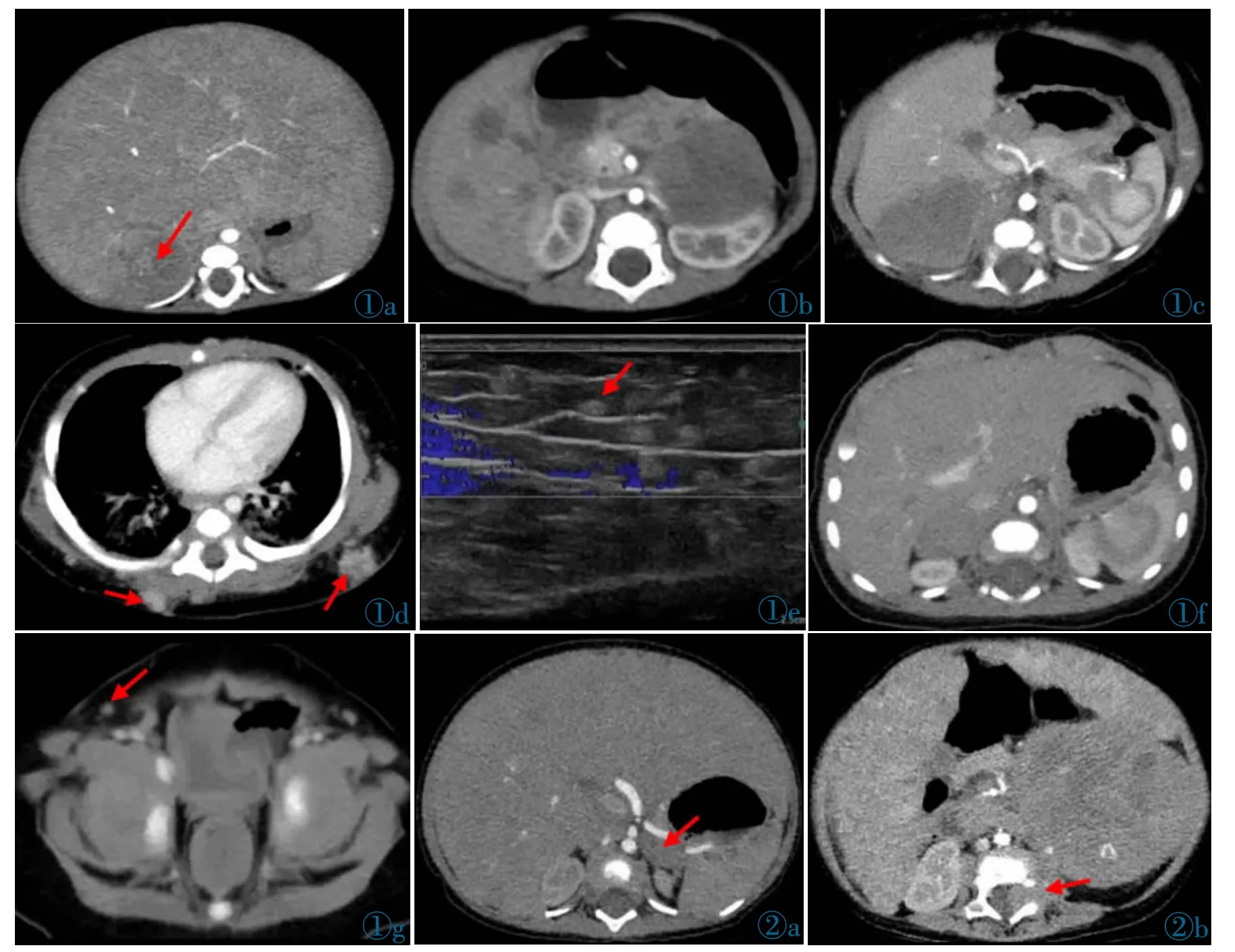
图1a 男,3月,低分化型神经母细胞瘤,右侧肾上腺区可见一类圆形肿块影(箭),强化不均匀,肝脏弥漫性增大,动脉期可见强化结节影。图1b 女,2月,低分化型神经母细胞瘤,左侧腹膜后可见一类圆形肿块影,肝脏大小正常,内可见数个转移结节。图1c~1e 女,4月,分化差型神经母细胞瘤,右侧肾上腺区可见一密度均匀的肿块影(图1c),背部皮下脂肪层可见数个强化的转移结节(箭,图1d),超声探及皮下脂肪层弥漫分布的强回声结节(箭,图1e),彩色多普勒显示其内血流信号。图1f,1g男,4月,分化差型神经母细胞瘤,右侧肾上腺区可见一密度均匀的类圆形肿块影(图1f),腹股沟区皮下脂肪层可见转移结节(箭,图1g)。图2 女,2月,以腹胀就诊。初次就诊时肝脏弥漫性增大,增强后密度尚均匀,左侧腹膜后可见一直径较小、密度均匀的类圆形肿块影(箭);随访8 月后,病灶较前明显增大,跨越中线,并向邻近椎间孔侵犯(箭,图2b),肝脏增强后出现不均匀强化。Figure 1 a.Male,3 months,poorly differentiated neuroblastoma.A round mass was in the right adrenal area(arrow),with uneven enhancement and diffuse enlargement of liver,and enhanced nodules could be seen in the arterial phase.Figure 1b.Female,2 months,poorly differentiated neuroblastoma.A round mass could be seen behind the left peritoneum.The liver size was normal and several metastatic nodules could be seen inside.Figure 1c~1e.Female,4 months,poorly differentiated neuroblastoma.There was a homogeneous mass in the right adrenal area (Figure 1c),and several enhanced metastatic nodules in the subcutaneous fat layer of the back (arrow,Figure 1d).Ultrasonography was performed to detect the diffused hypo-echoic nodules in the subcutaneous fat layer (arrow,Figure 1e).Figure 1f,1g.Male,4 months,poorly differentiated neuroblastoma.There was a homogeneous round-shape mass in the right adrenal area(Figure 1f),and metastatic nodules in the subcutaneous fat layer in the inguinal area(arrows,Figure 1g).Figure 2.Female,2 months,presented with abdominal distension.At the first visit,the liver was diffusely enlarged and uniform enhancement.A circular mass with small diameter and uniform density was seen behind the left peritoneum (arrow).After 8 months of follow-up,the primary lesion was significantly enlarged,crossed the midline and invaded the adjacent intervertebral foramen (arrow,Figure 2b),and uneven enhancement of the liver was observed after enhancement.
2.3 病理表现
手术切除原发灶8例,大体病理见灰白、灰褐色软组织包块,质软,部分包膜完整、表面光滑。显微镜下见大量小圆形肿瘤细胞弥漫分布,局部呈菊形团状排列,部分可见神经原纤维及神经毡样结构,瘤细胞核浓染、胞浆缺如或稀少,核分裂象可见,中至高等核分裂-核碎裂指数,1 例肿瘤组织中可见坏死出血,1 例可见神经节细胞散在分布。免疫组织化学染色:Syn(+),CgA(+),ALK(+),NSE(+),CD56(+),S-100 散在(+),Ki67 密集区1%~80%不等(+),β-cantenin 灶性浆(+),C-MYC(-)或弱(+)。病理诊断:4 例为分化差型神经母细胞瘤,3 例为低分化型神经母细胞瘤,1 例为混合型节细胞神经母细胞瘤;8 例预后病理分型均为预后良好型。
2.4 治疗及预后
5 例患儿就诊入院后即行手术切除肿块,1 例患儿接受两个疗程新辅助化疗后行手术切除肿块,2例患儿随访半年后行手术切除肿块,1 例患儿因病情危重而家属放弃治疗。7 例患儿手术切除后接受化疗。在2 例术前观察随访的患儿中,随访5 月的患儿神经母细胞瘤原发灶密度、边界、体积大小及皮下结节转移灶均无明显变化。另1 例随访8 月的患儿,由4S 期进展为4期,神经母细胞瘤原发灶体积较前明显增大,跨越中线生长且包埋左肾动静脉,并向椎管内突入,出现邻近椎体骨质破坏等新病灶,肝脏转移灶平扫及增强CT 表现较前改变(图2)。本组病例治疗后随访时间19~68月,1 例死亡,其余患儿生存,原发灶均无复发。至末次门诊随访,3 例残留肝脏转移灶,2 例仍见皮肤转移灶。
3 讨论
3.1 临床特点
4S 期神经母细胞瘤约占所有神经母细胞瘤的7%~10%,临床表现因受累器官不同而异[3]。患儿可表现为呼吸急促、面色苍白或嗜睡,而肝脏肿大可能是唯一的临床表现[4]。4S 期神经母细胞瘤的转移部位较固定,仅局限于肝脏、皮肤和骨髓[6]。患儿出现皮肤转移时,表现为无触痛、浅蓝色或红色的皮肤结节,因此当患儿就诊于皮肤科时,应警惕该病的可能[5]。本组患儿多以腹胀就诊,尿儿茶酚胺代谢物和LDH 多数升高,但也存在实验室筛查指标正常的情况。尽管VMA 能在一定程度上作为筛查神经母细胞瘤的标志物,但易受患儿饮食因素的影响,而Ma等[7]提出的神经母细胞瘤疑似患儿转诊流程,结合影像与实验室检查则有助于其及时诊断。
尽管4S 期神经母细胞瘤也可发生骨髓转移,但其浸润程度常小于10%[6]。受检测技术及取样误差的影响,骨髓微量浸润常常难以确定,肝脏和皮肤转移则较容易观察[8]。当4S 期神经母细胞瘤出现肝脏弥漫性增大时,患儿的肿瘤负荷较大,但经积极治疗后,总体预后较好,长期生存率可达92%[9]。但如果4S 期神经母细胞瘤的发病年龄越小,肝脏转移早期快速进展的风险越高,肝脏体积与腹腔容积的比例越大,易出现重要器官功能障碍、凝血功能异常或腹腔间隔室综合征而危及生命[10]。在本组病例中,除1例放弃治疗外,其余患儿均生存。该例放弃治疗的患儿2 月龄,肝脏体积较大,出现呼吸困难等症状,全身状况极差。因此,对于肝脏弥漫性增大的低龄患儿,常需要对其诱导化疗或低剂量放疗以减轻负荷。
文献报道大约50%的4S 期神经母细胞瘤可以在没有任何治疗干预的情况下自发消退,随访观察或是积极手术存在争议[10]。但有研究表明,10.4%的4S 期神经母细胞瘤在未经治疗的情况下也可进展为4期[11]。4S 期神经母细胞瘤进展的危险因素常包括染色体节段畸变等预后不良生物学因素。在以往的研究队列中,4S 期进展为4 期的神经母细胞瘤出现二倍体核型和1p 染色体节段缺失的比例更高[11]。但本组病例中,出现疾病进展的肿瘤基因检测未见异常,是否与4S 期神经母细胞瘤的起源方式不同有关尚不可知[12]。因此,当选择对4S 期神经母细胞瘤随访观察时,应结合影像密切观察病灶的演变进展,以达到及时干预的目的。
3.2 CT 影像表现
文献报道4S 期神经母细胞瘤多发生于新生儿期,病灶小且局限,多位于肾上腺区,多数为实性,仅小于2%的病灶表现为囊性[13]。本组病例神经母细胞瘤原发灶均位于肾上腺区,6 例(66.67%)表现为实性肿块,病灶均较小且规则,与前述报道相仿,但瘤体也可表现为囊实性。本组3 例表现为囊实性的患儿均为新生儿,同时仅1 例见细点状钙化,符合杨双风等[14]报道新生儿神经母细胞瘤多表现为实性或囊实性肿块,且钙化率较低。新生儿时期肾上腺神经母细胞瘤常需要与肾上腺血肿鉴别,肾上腺血肿增强后内容物常不强化[14]。当同时出现肝脏弥漫增大时,应首先考虑4S 期神经母细胞瘤的可能。
4S 期神经母细胞瘤出现肝脏转移时,可表现为弥漫性浸润或局灶性结节[14-15]。本组病例以肝脏弥漫肿大为主,间以弥漫分布小结节,增强后主要表现为渐进性强化,尚未见到牛眼征的表现。有个案报道4S 期神经母细胞瘤也存在出现肝脏弥漫性增大,但在影像学上无法找到原发灶的情况[4]。在本组病例中,神经母细胞瘤原发灶大小不等,最小者直径仅1.98 cm,但肝脏已广泛肿大。因此,由于4S 期神经母细胞瘤存在“未见其人,先闻其声”的转移特性,原发灶的出现可能与患儿的就诊时间有关,如当患儿在肝脏弥漫增大的早期阶段就诊时,神经母细胞瘤原发灶可能难以发现,这时应结合临床表现和实验室检查综合判断。
虽然INSS 分期系统能较好划分神经母细胞瘤患儿的临床分期,但其以术后资料为基础,不利于患儿术前危险度分层及治疗计划制定。在另一套以影像学为基础的儿童神经母细胞瘤危险度分层系统(International Neuroblastoma Risk Group Staging System,INRGSS)中,4S 期对应的是Ms期[6]。4S 期与Ms 期发生转移的部位均局限于皮肤、肝脏和骨髓,但年龄的定义存在差异[2]。4S 期是指小于12 月的婴儿,而Ms 期则小于18 月。本组病例也符合INRGSS分期系统Ms 期的定义。因此,影像学在儿童神经母细胞瘤的诊断和治疗中扮演着重要角色。
综上所述,4S 期神经母细胞瘤出现肝脏或皮肤转移时,患儿多以腹胀或皮肤结节就诊,原发灶多位于肾上腺区,相关实验室筛查指标多异常。原发灶多较小,以局限性实性病灶为主,囊变及坏死少见,较少出现钙化;增强后肿瘤实质多强化不均匀,静脉期强化程度高于动脉期,以实质周边强化较明显为主。肝脏多弥漫增大,与原发灶的大小不成比例,其内可见广泛结节转移灶或仅表现为弥漫性浸润;皮肤转移结节多广泛分布于脂肪层,大小不等,增强后表现为渐进性均匀强化。患儿预后总体较好,当选择对此期患儿保守观察时,应结合影像密切观察病灶的变化情况。

