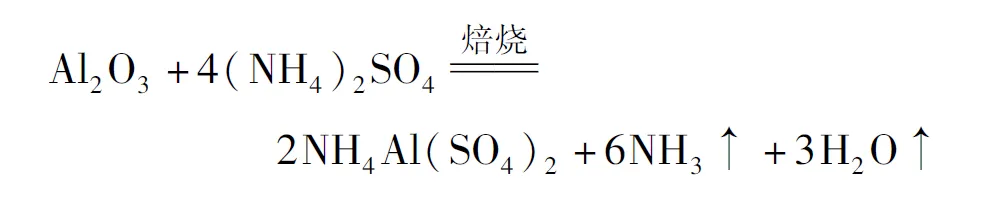例谈高考试题中陌生情境下化学(离子)方程式的书写策略
周学兴
(湖南省常德市第一中学 415000)
1 四步法
“四步法”的具体过程如下:
第一步:根据元素化合价的升降,判断还原剂和氧化产物、氧化剂和还原产物.
第二步:按“氧化剂+还原剂→还原产物+氧化产物”写出化学方程式,根据得失电子守恒配平.
若是书写离子方程式,则后续步骤如下:
第三步:根据电荷守恒和环境的酸碱性,在离子方程式左边或右边补充H+或OH-以配平电荷.
第四步:根据质量(原子或离子)守恒配平反应,最后配H、O原子.并进行检查.
若是书写化学方程式,则后续步骤如下:
第三步:根据确定系数变价物质中的金属元素、酸根离子(团)(一般是非氢原子非氧原子),利用金属离子或酸根离子(团)的守恒,写出对应的化学式(如K+,到反应物中寻找相应的阴离子,若是没有则匹配OH-,即产物写KOH).
第四步:根据原子守恒,配平化学方程式.并进行检查.
例1(2020年全国卷化学,节选)苯甲酸可用作食品防腐剂.实验室可通过甲苯氧化制苯甲酸(甲苯与苯甲酸的有关数据见表1),其反应原理简示如下:
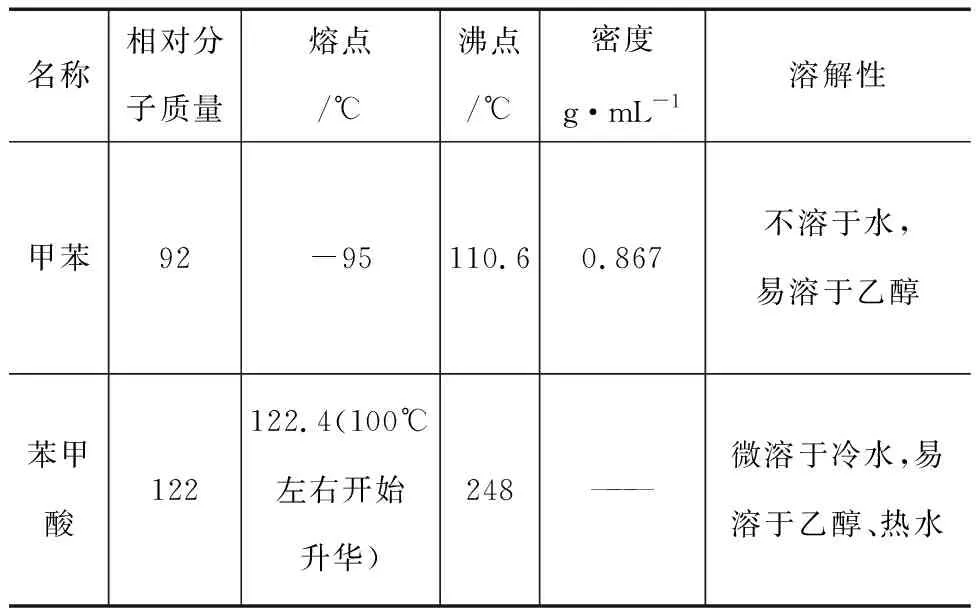
表1
实验步骤:
(1)在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5 mL甲苯、100 mL水和4.8 g(约0.03 mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠.
(2)停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣.合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全.将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥.称量,粗产品为1.0 g.
(3)纯度测定:称取0.122 g粗产品,配成乙醇溶液,于100 mL容量瓶中定容.每次移取25.00 mL溶液,用0.01000 mol·L-1的KOH标准溶液滴定,三次滴定平均消耗21.50 mL的KOH标准溶液.
回答下列问题:
加入适量饱和亚硫酸氢钠溶液的目的是____;该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理____.
分析加入适量饱和亚硫酸氢钠溶液的目的是除去过量的高锰酸钾,避免盐酸酸化时产生氯气,草酸(H2C2O4)也可用于除去KMnO4,与之发生氧化还原反应.按照“四步法”(如图1所示)可快速写出其反应的离子方程式.根据碳元素的化合价为+3,且化合价升高,则升至+4,酸性条件下产物为CO2.

图1
例2 (2021年湖南高考,节选)滤渣Ⅱ的主要成分为FePO4,在高温条件下,Li2CO3、葡萄糖(C6H12O6)和FePO4可制备电极材料LiFePO4,同时生成CO和H2O,该反应的化学方程式为____.
分析如图2所示:
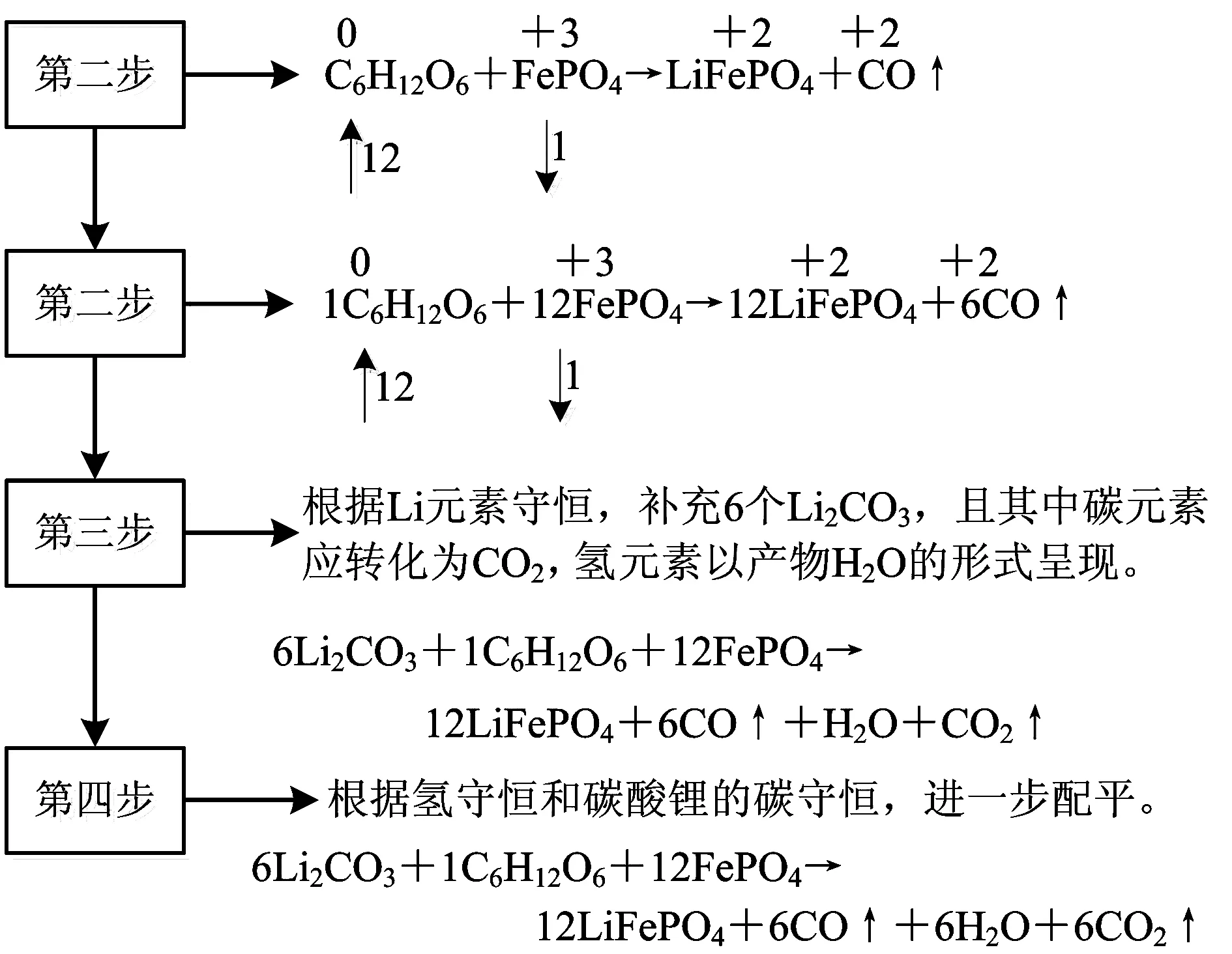
图2
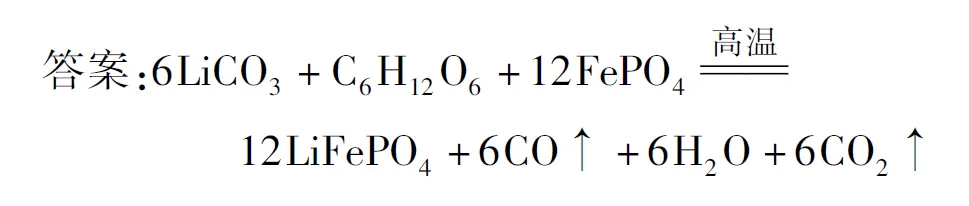
2 抓重点物质法
近年出现了较为复杂的非氧化还原型的离子方程式书写,知识点主要为盐与盐之间的复杂水解的内容,一般该陌生情境中的产物较为复杂,产物富含多种离子,甚至含有“n”不确定的数字.抓重点物质法的要领是将复杂产物的化学计量数定为1,再利用离子守恒确定其它微粒的化学计量数.
例3 (2019年全国1卷化学,节选)硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺.一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如图3所示.

图3
回答下列问题:
在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为____.

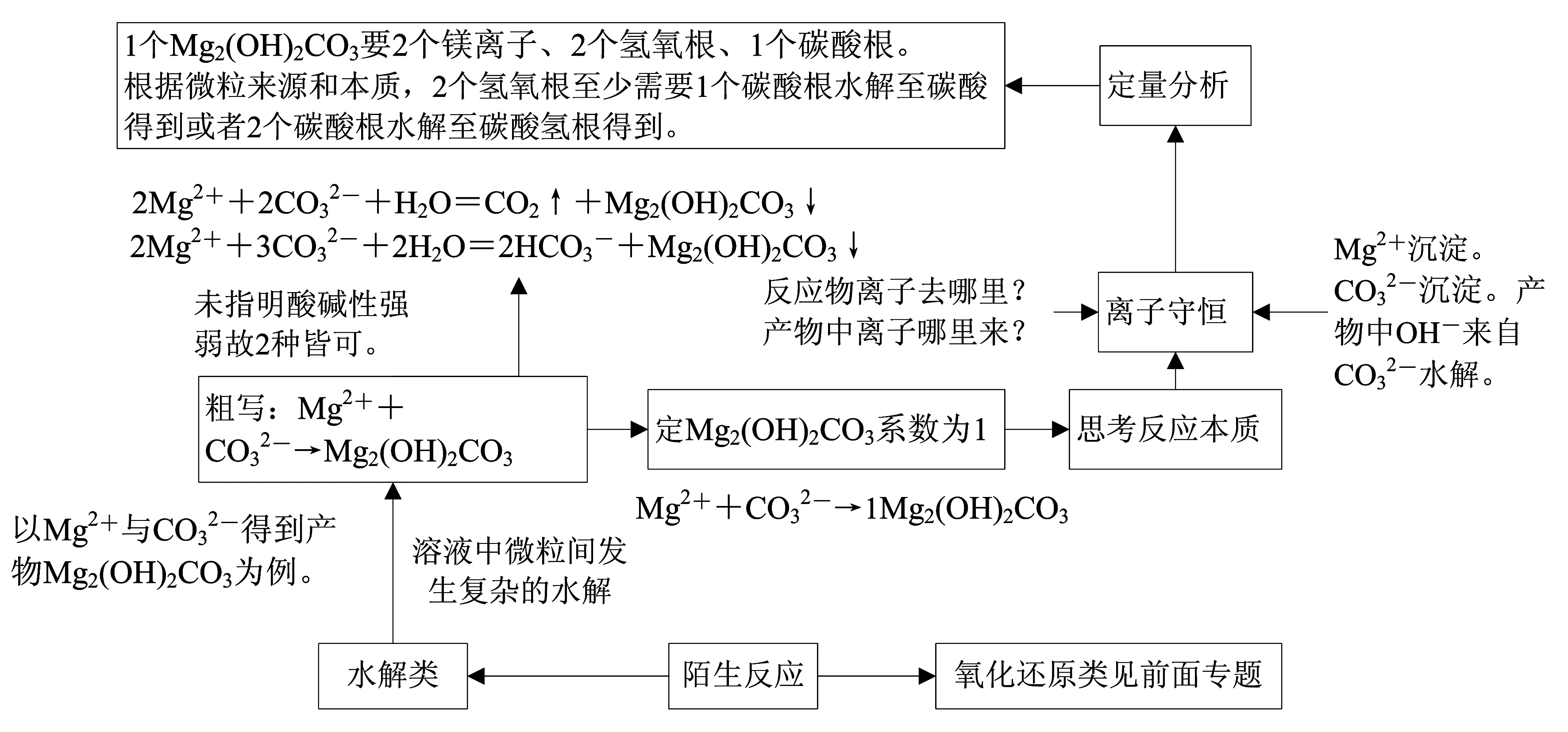
图4
3 微观本质探析法
微观本质探析法的要点是利用微观离子间的反应本质及其反应比例关系来快速分析书写化学或离子方程式的方法.该法在分析非氧化还原反应和非变价元素的守恒中有重要的使用价值.微观本质探析法主要是从离子的相互结合角度分析,用以分析出产物和快速配平.
例4 (2021年全国乙卷,节选)磁选后的炼铁高钛炉渣,主要成分有TiO2、SiO2、Al2O3、MgO、CaO以及少量的Fe2O3.为节约和充分利用资源,通过如图5所示工艺流程回收钛、铝、镁等.该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见表2.回答下列问题:

图5

表2
“焙烧”中,TiO2、SiO2几乎不发生反应,Al2O3、MgO、CaO、Fe2O3转化为相应的硫酸盐.写出Al2O3转化为NH4Al(SO4)2的化学方程式:____.

答案: