聚苯乙烯微塑料对水中汞离子的吸附研究
雷雅杰,李雪,常春艳,毛雪飞*
中国农业科学院农业质量标准与检测技术研究所/农业农村部农产品质量安全重点实验室,北京 100081
2014年,联合国环境规划署将微塑料(MPs)污染列入全球十大环境问题之一,越来越多的国家开始关注 MPs的环境污染问题(Cózar et al.,2014)。自然环境条件下,特别是洋流、太阳辐射、机械磨损、生物降解以及船只与生物的相互作用,会导致塑料物品缓慢降解并碎裂成不溶于水的固体塑料颗粒、碎片、纤维或聚合物基质,其形状规则或不规则,从纳米尺寸以及1 µm—5 mm不等,这类塑料碎片一般统称为微塑料(Thompson et al.,2004;Ng et al.,2018;Wang et al.,2021)。MPs比表面积大、表面疏水性高,且耐久性强,不仅能够释放塑料单体,还会造成有毒添加剂释放以及重金属污染等更严重的环境问题(Law et al.,2014;Ma et al.,2016;Wright et al.,2017)。研究证实,MPs一旦在水环境中大量存在,其吸附和运输污染物的能力也会随着水的流动性而增强,进入生物体会损害消化道等器官的功能,减缓生长速度,抑制某些酶的产生,降低类固醇激素的水平,影响繁殖并导致暴露于毒性更大的塑料添加剂,还可以通过食物链进入人体内(Wright et al.,2013;Costa et al.,2016),因此MPs对水环境以及人体健康构成了潜在威胁。聚苯乙烯微塑料(PS-MPs)是一种在水生环境中常被检测到的新型污染物,以绝缘特性和低重量而闻名,而其与重金属共同暴露导致的健康风险也是人们目前重点关注的环境问题之一(Barus et al.,2021)。
重金属可以随生物链从环境进入人体,并对生命体产生致癌、致畸等毒性效应(Järup,2003)。微塑料在水环境中对重金属具有极高的亲和力,是重金属离子的良好载体,如果吸附重金属的微塑料更多的进入食物链,则会对水生生物以及人体健康造成更大威胁(Mason et al.,2016)。汞(Hg)是最常见的金属污染物之一,为生物非必需元素,很容易被水生生物吸收和积累(Langston et al.,1998)。世界卫生组织(WHO)规定饮用水中允许的最大汞质量浓度为0.001 mg·L-1,中国《污水综合排放标准》(GB 8978—1996)中将污水中总汞的最高允许排放浓度设定为 0.05 mg·L-1(国家环境保护局,1996)。在水环境中汞大部分以Hg2+形态存在(Risher et al.,2007),Hg2+可以与生物蛋白质的半胱氨酸结合,通过硫酸盐甲基化形成有机汞,最终在食物链中造成高生物蓄积(Xia et al.,2019)。并且,一定环境条件下的物理和化学吸附可能会造成水体中 Hg2+浓度升高,从而增加生物体的Hg2+暴露风险,而微塑料就是非常重要的吸附载体之一。
目前Naqash et al.(2020)探讨了PS-MPs对重金属铅(Pb)、锌(Zn)、镉(Cd)、铬(Cr)、铜(Cu)等重金属的吸收效果,但鲜有研究报道PS-MPs与重金属Hg的吸附作用和相关物化参数。鉴于水环境中PS-MPs和Hg的存在对人类健康存在的潜在风险,本研究将探讨水体系中PS-MPs对Hg2+的吸附行为,解析PS-MPs和Hg2+的相互作用机制,为实际环境中聚苯乙烯微塑料和重金属汞的混合污染治理提供理论参考,进一步为评价聚苯乙烯微塑料与水环境中汞的环境行为提供科学依据,有助于拓展对微塑料生态环境效应的理解。
1 材料与方法
1.1 材料与试剂
供试微塑料为来自上海源叶生物科技的聚苯乙烯树脂,根据Zhou et al.(2022)微塑料吸附试验用的粒径尺寸,使用经过6 h研磨后得到的平均粒径为 60 μm(40—120 μm,下文简称 60 μm)和经过10 h研磨后得到的平均粒径为400 nm(390—460 nm,下文简称400 nm)的PS-MPs颗粒(具体粒径参数见2.1.2)。试验所需的Hg2+溶液由硝酸汞配制而成,购自中国计量科学研究院,纯度为99.99%。调节pH的光谱纯盐酸和分析纯氢氧化钠分别购自北京化学试剂研究所和麦克林生化科技有限公司。用于离子强度试验的氯化钠购买自麦克林生化科技有限公司。所有实验器皿在30%的硝酸浸泡24 h以上,用超纯水洗净后备用。
1.2 实验方法
1.2.1 溶液制备
60 μm PS-MPs悬浮液和Hg2+标准溶液现用现配,参考Zhou et al.(2021)的PS-MPs悬浮液质量浓度,设置为 1 mg·mL-1。Hg2+标准溶液质量浓度为100 ng·mL-1,于4 ℃避光保存。实验过程中溶液的pH均用0.1 mol·L-1NaOH和HCl溶液调节,用pH计测量(S210,Mettler Toledo,上海)。超纯水由纯水仪提供(Millipore-Q,美国Millipore)。
1.2.2 吸附动力学
将 1 mg·mL-1的 60 μm PS-MPs悬浮液和 100 ng·mL-1的 Hg2+标准溶液装入离心管中,调节溶液pH均为6.0(±0.1),混合均匀后用封口膜和锡箔纸作密封避光处理。离心管放入恒温水浴振荡器中(SHA-B,天津赛得利斯实验分析仪器制造商),设置温度为25 ℃,振动频率为180 r·min-1。分别在第5、10、20、30、40、60、120、240、480、720、1440分钟时取出相应样品,迅速用0.22 μm聚醚砜滤器和1 mL注射器过滤,然后测试样品中Hg的浓度。在同样的条件下设置60 μm PS-MPs和Hg2+空白组。
1.2.3 等温吸附线
将1 mg·mL-1的60 μm PS-MPs悬浮液装入离心管中,分别加入0.1、0.2、0.4、0.6、0.8、1、2、5、10 mg·L-1的Hg2+标准溶液,pH调节、密封处理、水浴和振荡处理同1.2.2。在吸附4 h时将样品取出,取出的样品迅速用0.22 μm聚醚砜滤器和1 mL注射器过滤,然后测试样品中Hg的浓度。在同样的条件下设置60 μm PS-MPs和Hg2+空白组。
1.2.4 溶液pH及离子强度影响实验
在 1 mg·mL-1PS-MPs和 100 ng·mL-1Hg2+标准液浓度下进行溶液pH及离子强度影响实验。设置pH分别为3.0、4.0、5.0、6.0、7.0,NaCl溶液质量浓度分别为1、10、100 mg·L-1。在同样的条件下设置60 μm PS-MPs和Hg2+空白组,其他实验条件同1.2.2。
1.2.5 聚苯乙烯微塑料粒径影响实验
Hg2+标准液浓度为 100 ng·mL-1,1 mg·mL-1的PS-MPs粒径分别为60 μm和400 nm条件下进行实验,其他实验条件同1.2.2。
1.2.6 温度影响实验
在 1 mg·mL-1PS-MPs和 100 ng·mL-1Hg2+标准液浓度下进行溶液温度影响实验。温度分别设置为4、10、25、40、50 ℃,其他实验条件同1.2.2。
1.2.7 分析检测
采用直接进样测汞仪(5E-HGT2321,长沙开元仪器有限公司)测定样品中Hg浓度。PS-MPs的比表面积、孔容、平均孔径用比表面积分析仪(BET,BELSORP-max,麦奇克拜尔,日本)进行测量。PS-MPs的平均粒径及Zeta电位用激光粒度分析仪(DLS,Mastersizer2000,Malvern,英国)测量。PS-MPs的特征分析用傅里叶变换红外光谱仪(FTIR,Vertex70,布鲁克,德国)测量。PS-MPs的显微电镜图像和吸附 Hg2+后微塑料的能量谱图通过场发射扫描电镜-能谱仪(SEM,HITACHI-SU8010,日立,日本)测量。
1.2.8 数据处理及吸附模型拟合
所有实验设3组平行,应用Origin Pro 2021和 SPSS软件进行数据处理和绘图,Origin Pro 2021进行吸附动力学和吸附等温线数据的拟合,拟合所用的2种吸附动力学方程和2种吸附等温线方程如下:
(1)准一级动力学:

(2)准二级动力学:

(3)Langmuir等温线:

(4)Freundlich等温线:

式中:
Qt——t时刻 PS-MPs的吸附量(ng·mg-1);
Qe——吸附平衡时 PS-MPs的吸附量(ng·mg-1);

V——溶液的体积(L);
ρ0和ρe——初始和吸附平衡时溶液中Hg2+质量浓度(ng·mL-1);
ms——PS-MPs的质量(mg);
k1——准一级动力学常数(min-1);
t——吸附时间(min);
k2——准二级动力学常数(g·ng-1·min-1);
KL——吸附常数(mL·ng-1),与吸附剂和被吸附物的性质有关,该值越高,表明吸附剂的吸附能力越强,主要描述发生在固定吸附位点上的单分子层吸附,吸附剂表面均匀,吸附位点分布均匀(Godoy et al.,2019);
Qmax——Hg2+的最大吸附量(ng·mg-1);
Kf——描述吸附质与吸附剂之间存有相互作用力的非均匀吸附过程(mL3·ng-1);
n——吸附指数,一般在0—1之间,表示非线性程度,n偏离1越大,固体表面不均匀性越大,非线性也表明吸附过程中存在孔隙填充机制(Mead,1981;Li et al.,2022)。
2 结果与讨论
2.1 聚苯乙烯微塑料的表征
2.1.1 比表面积分析
通过BET分析仪测得60 μm的PS-MPs的比表面积为 30.183 m²·g-1,孔容为 0.071 cm³·g-1,平均孔径为 11.260 nm。其比表面积、孔容、平均孔径分布见图 1。根据国际纯粹与应用化学联合会(IUPAC)分类的6种吸脱附等温线(Rahman et al.,2019),图1a MPs的N2吸附-脱附等温线属于“Ⅳ”型凸形等温线,在低压段吸附量平缓增加,在相对压力P/P0=0.5时,达到最大吸附,此时N2分子以单层到多层吸附在介孔的内表面,对有序介孔材料,相对压力P/P0=0.20—0.50时,吸附和脱附的相对吸附量差值达到最大,适合计算该材料的比表面积,PS-MPs的比表面积为 30.183 m²·g-1。P/P0=0.5—0.7时吸附量出现突增,该段的位置反映了样品孔径的大小,其宽窄程度可作为衡量中孔均一性的根据,结合图 1b得知 PS-MPs的孔容为 0.071 cm³·g-1,平均孔径为11.260 nm。在更高P/P0时有第三段上升,这时脱附等温线与吸附等温线不重合,脱附等温线在吸附等温线的上方,根据“介孔回滞环”的类型(Toncón-Leal et al.,2021),为H3型迟滞环,可以说明等温线没有明显的饱和吸附平台,材料堆积形成了介孔,使得PS-MPs的孔结构不完整(Sing et al.,1985)。
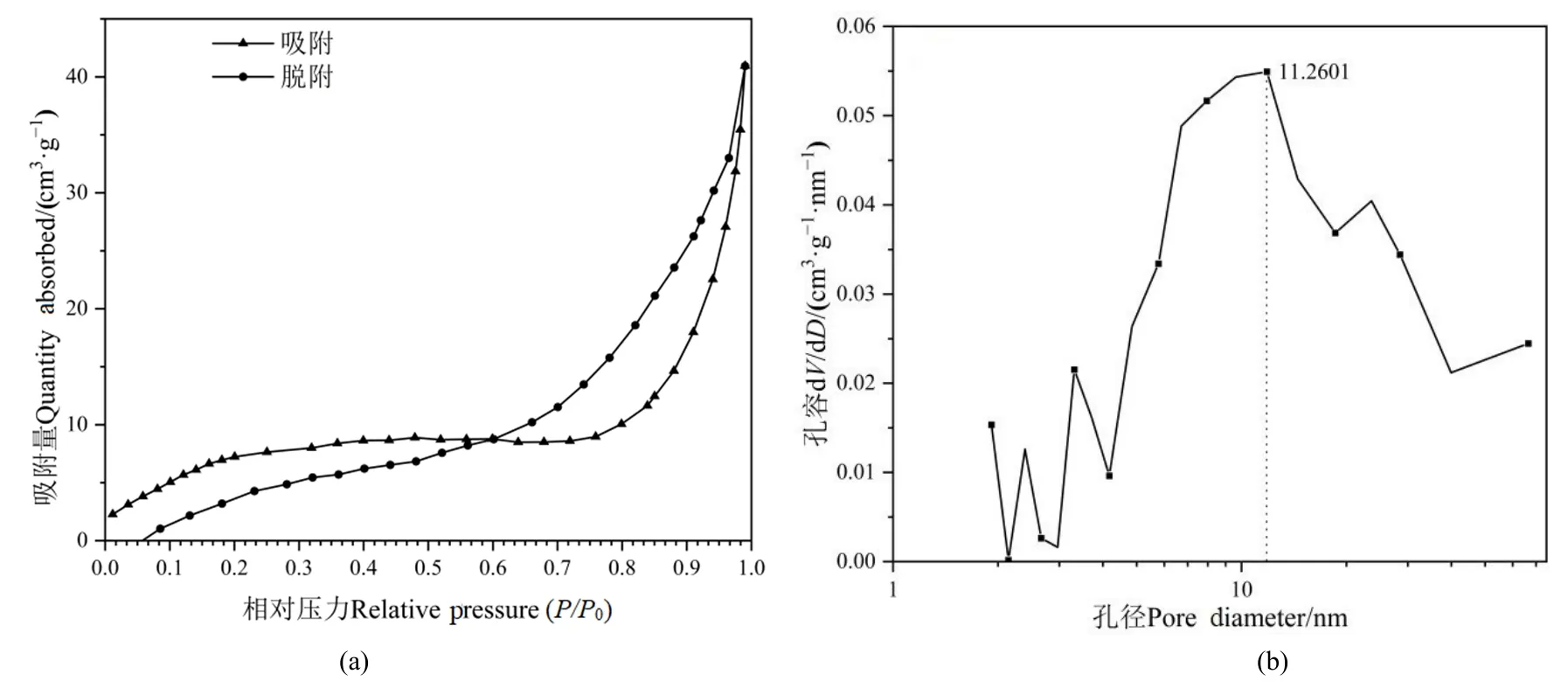
图1 不同N2相对压力下的吸附和解吸附曲线(a)和不同孔径下的孔容(b)Figure 1 Adsorption and desorption curves under different N2 relative pressures (a) and pore volume under different pore diameters (b)
2.1.2 粒度分析和Zeta电位分析
DLS 分析仪测得 1 mg·mL-1的 60 μm PS-MPs和400 nm PS-MPs悬浮液在超纯水中的平均粒径分别为60.30 μm和404.60 nm,电位分别为9.8和20.3,其粒径分布见图2,Zeta电位图见图3。由图2a可知,60 μm PS-MPs的粒径主要分布在44.77—126.19 μm,占比为72.18%;由图2b可知,400 nm PS-MPs的粒径主要分布在 396.06—458.67 μm,占比为75.19%。聚苯乙烯(PS)由苯乙烯单体经自由基缩聚反应合成,而苯乙烯中的苯基和乙烯基所含的碳以sp2杂化轨道成sigma键,轨道中包含的s成份大于 sp3轨道,电子云的分布更加靠近核电荷,因此电负性大于sp3轨道杂化的碳,有诱导吸电子效应,使PS-MPs带有负电荷,所以PS-MPs在水中通常带有负电荷。然而,目前研究表示,聚苯乙烯微塑料在研磨、老化过程中,其表面电性可能会改变,且表面电荷还会受到pH、腐殖酸等影响(Lu et al.,2018;Chen et al.,2022)。图3所示为PS-MPs在不同pH下的Zeta电位图,结果显示60 μm和400 nm PS-MPs在酸性条件下的Zeta电位均大于零,说明PS-MPs带正电;另外60 μm PS-MPs进入碱性条件时,Zeta电位小于0,且60 μm PS-MPs的零电点对应pH为7.8,这也验证了微塑料在研磨过程中表面电性会改变。
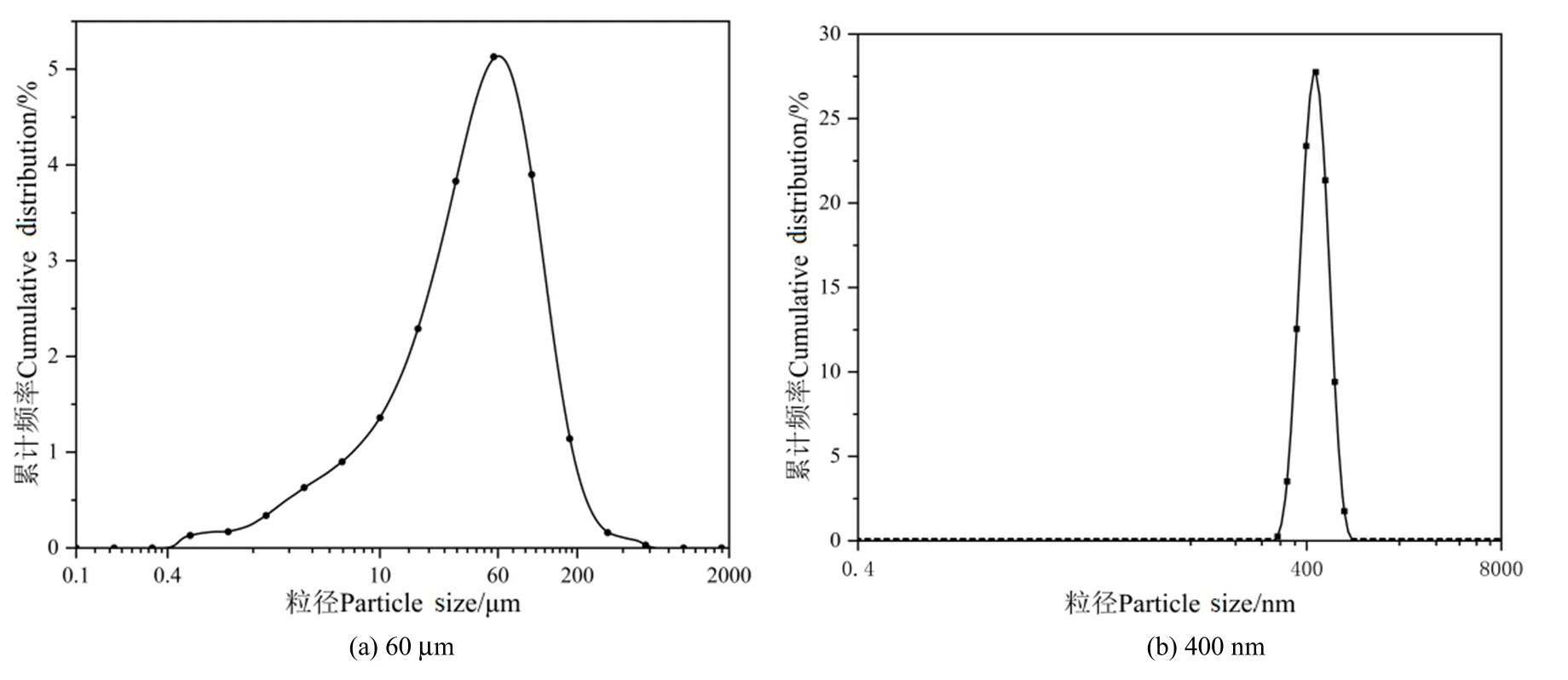
图2 PS-MPs的粒径分布图Figure 2 Particle size distribution of PS-MPs
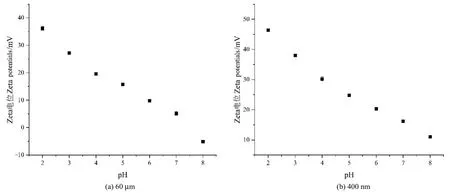
图3 不同pH下PS-MPs的Zeta电位Figure 3 Zeta potentials of PS-MPs at different pH values
2.1.3 扫描电镜分析
SEM的结果如图4所示,其中图4a为60 μm PS-MPs的电镜图,图4b为400 nm PS-MPs的电镜图。研磨后的60 μm和400 nm聚苯乙烯树脂变成小颗粒碎屑状微塑料,表面粗糙且充满不规则裂缝,粒径大小分布不均匀,对比结果可知,本实验使用的聚苯乙烯微塑料是由机械研磨引起的,符合自然环境中微塑料颗粒形貌特征(Chen et al.,2022)。

图4 不同粒径PS-MPs的扫描电镜图Figure 4 SEM image of PS-MPs with different particle sizes
2.1.4 红外谱图分析
为了获取PS-MPs在吸附Hg2+时的化学键或官能团信息,使用傅里叶变换红外光谱仪测定PS-MPs吸附Hg前后在400—4000 cm-1的红外光谱。结果表明,3500—3600 cm-1处的吸收峰可能为-OH拉伸振动或羧基部分以及分子之间的氢键,这表明氢键是一种可能的吸附机制,此处峰强度的明显变化可能是PS-MPs吸附汞试验干燥不彻底造成的;在3000—3100 cm-1处的吸收峰可能为苯环=C-H伸缩振动,但是吸附汞后的PS-MPs出峰位置发生了明显的右移(从3053—3041 cm-1),说明苯环双键发生了断裂,可能是汞取代所造成的;2981 cm-1和 2865 cm-1可能是-CH2-不对称伸缩振动和-CH2-对称伸缩振动;1700—1900 cm-1吸收峰存在C=O拉伸振动,但是吸附汞后的PS-MPs出峰位置发生了明显的右移(从 1717 cm-1右移至 1704 cm-1),此处可能存在汞的络合吸附;1400—1600 cm-1可能是-CH2-变形和骨架振动造成的,1068、1028 cm-1附近是单取代苯环=CH面内变形;在芳香族特征峰991 cm-1处,吸附汞后的PS-MPs的出峰位置右移到981 cm-1,说明此处苯环上可能存在特殊的取代反应;756、657 cm-1是单取代苯环—CH面外变形(Saha et al.,2015;Fang et al.,2019;Lang et al.,2020;Chen et al.,2022)。由图 5 可知,微塑料吸附Hg之后并没有形成新的化学键和官能团,但反应前后的峰能量强度以及出峰位置有明显偏移,特别是吸附Hg后的一些含氧官能团峰能量强度和出峰位置,这可能与PS-MPs和Hg2+共存后发生的多种吸附过程有关。
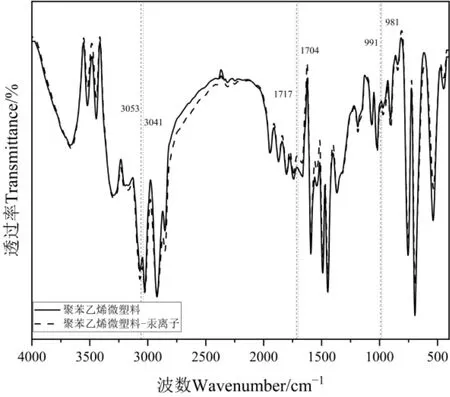
图5 PS-MPs吸附Hg2+前后红外光谱Figure 5 Infrared spectra of PS-MPs before and after Hg2+ adsorption
2.2 吸附动力学
不同时间下PS-MPs对Hg2+的吸附曲线见图6。由吸附动力学模型可以看出,PS-MPs对Hg2+表现出良好的吸附能力,在开始的5 min内对Hg2+有大量吸附,60 min内的吸附量呈直线上升,60 min后吸附速率开始趋缓,在4 h内基本达到吸附平衡。采用准一级动力学方程和准二级动力学方程模拟吸附过程,其中准一级动力学模型假设内部扩散过程是速率控制步骤,而准二级动力学模型认为吸附质分子化学吸附到活性吸附位点是速率控制步骤(Yu et al.,2017)。具体参数如表1所示,对比表中决定系数R2可知,准一级、二级吸附动力学模型拟合的R2分别为0.955、0.967,两个动力学模型都能够很好地拟合吸附过程,但从决定系数可以看出,准二级吸附动力学模型更符合本次吸附过程,Chen et al.(2022)结合准二级吸附动力学模型得出聚苯乙烯微塑料与汞的相互作用为化学吸附(离子交换),但是,结合红外数据以及拟合的准一级和准二级曲线可以推测,PS-MPs对Hg2+的吸附是一个复杂的过程,可能包括物理静电吸附和化学络合吸附(Yin et al.,2018;Liu et al.,2019;Nanthamathee et al.,2021)。
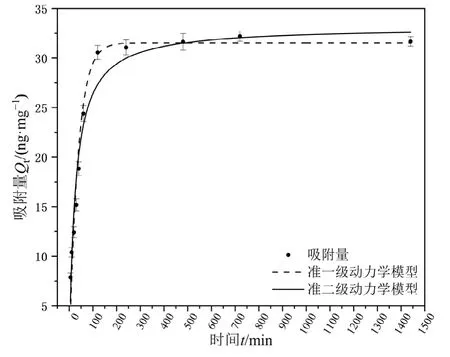
图6 PS-MPs对Hg2+的吸附动力学Figure 6 Adsorption kinetics of Hg2+ on PS-MPs

表1 PS-MPs吸附Hg2+的吸附动力学拟合参数Table 1 Fitting parameters of adsorption kinetics of Hg2+on PS-MPs
2.3 吸附热力学
PS-MPs对不同浓度Hg2+的平衡吸附量见图7。PS-MPs吸附 Hg2+的等温热力学吸附曲线,采用Langmuir和Freundlich两种等温热力学吸附模型。对 PS-MPs吸附 Hg2+的数据进行拟合(表 2),Langmuir和Freundlich模型中的R2分别为0.945和0.952,得知PS-MPs吸附Hg2+更符合Freundlich模型,吸附容量随着 Hg2+浓度的增加而增加,直至最大吸附容量,该结果与Holmes et al.(2012)研究微塑料和痕量金属(Cr、Co、Ni、Cd、Pb)的吸附等温线模型相一致。因此,PS-MPs对Hg2+之间吸附位点和吸附质并不是理想中一一对应的等温吸附过程,而是多分子层吸附。由SEM结果可知,PS-MPs表面不均匀且有孔隙,且PS-MPs吸附Hg2+的n值远小于1,进一步证明PS-MPs表面吸附位点分布不均匀,对 Hg2+可能是非均匀表面多层吸附。而且拟合的最大吸附容量达到了291.03 ng·mg-1,这些差异可能与微塑料的粒径、表面粗糙度有关。
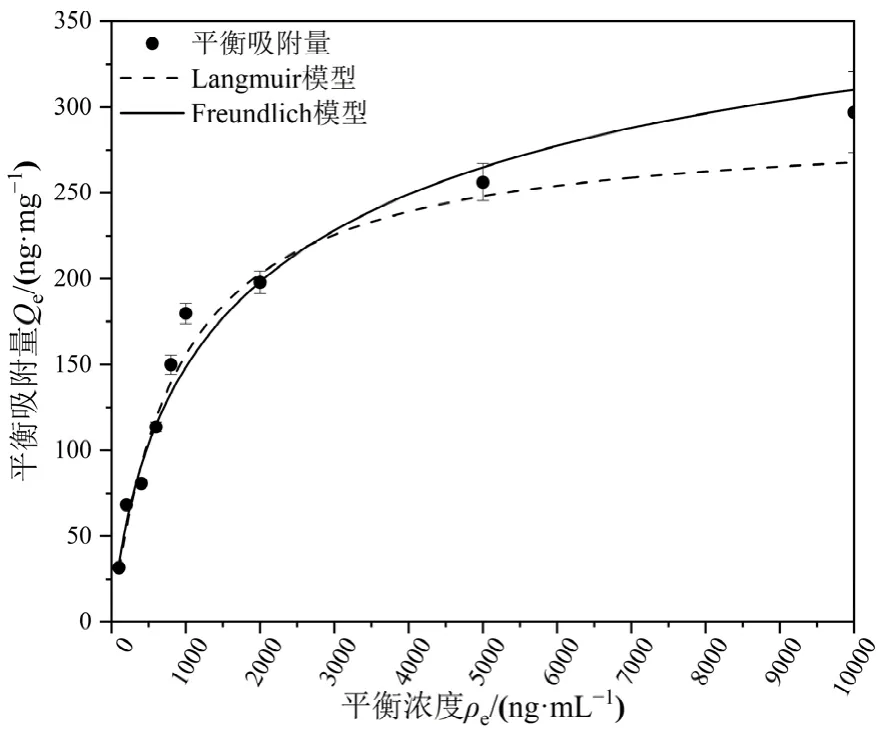
图7 PS-MPs对Hg2+的吸附热力学Figure 7 Adsorption thermodynamics of Hg2+on PS-MPs

表2 PS-MPs吸附Hg2+的吸附等温线参数Table 2 Adsorption isotherm parameters for the adsorption of Hg2+ by PS-MPs
2.4 pH对微塑料吸附Hg2+的影响
在不同pH下,PS-MPs材料表面的性质会发生变化,而且金属离子形态也可能变化,从而影响PS-MPs对Hg2+的表面吸附量。如图8所示,通过测定滤液中汞含量发现,pH=7.0的条件下,PS-MPs对Hg2+的吸附量最大,为41.51 ng·mg-1。pH在3.0—7.0之间时,溶液中 Hg2+的主要存在形式可能有HgOH-、HgOHCl、Hg(OH)2,这些化合态的比例随pH升高而呈指数增加(Yin et al.,1996),Hg-OH相对于Hg-Cl更容易吸附(Naughton et al.,1974);另外,pH对PS-MPs表面电荷的影响较大,Zeta电位结果显示pH值从3.0升至7.0,PS-MPs表面正电荷逐渐减少,汞离子带有正电荷,静电斥力因此也逐渐下降,此时静电相互作用主导了吸附行为(Tang et al.,2021)。因此,在较低pH时,H+容易与Hg2+产生竞争吸附,占据PS-MPs表面吸附位点,pH升高后,H+竞争作用减弱,PS-MPs对Hg2+的吸附量增加。因此在pH值介于3.0—7.0之间时,pH的升高,对 Hg2+的吸附量随之增大,结果也与聚苯乙烯微塑料吸附 Cd、As和 Pb的结果相一致(Dong et al.,2020;Yu et al.,2021;Lin et al.,2021)。
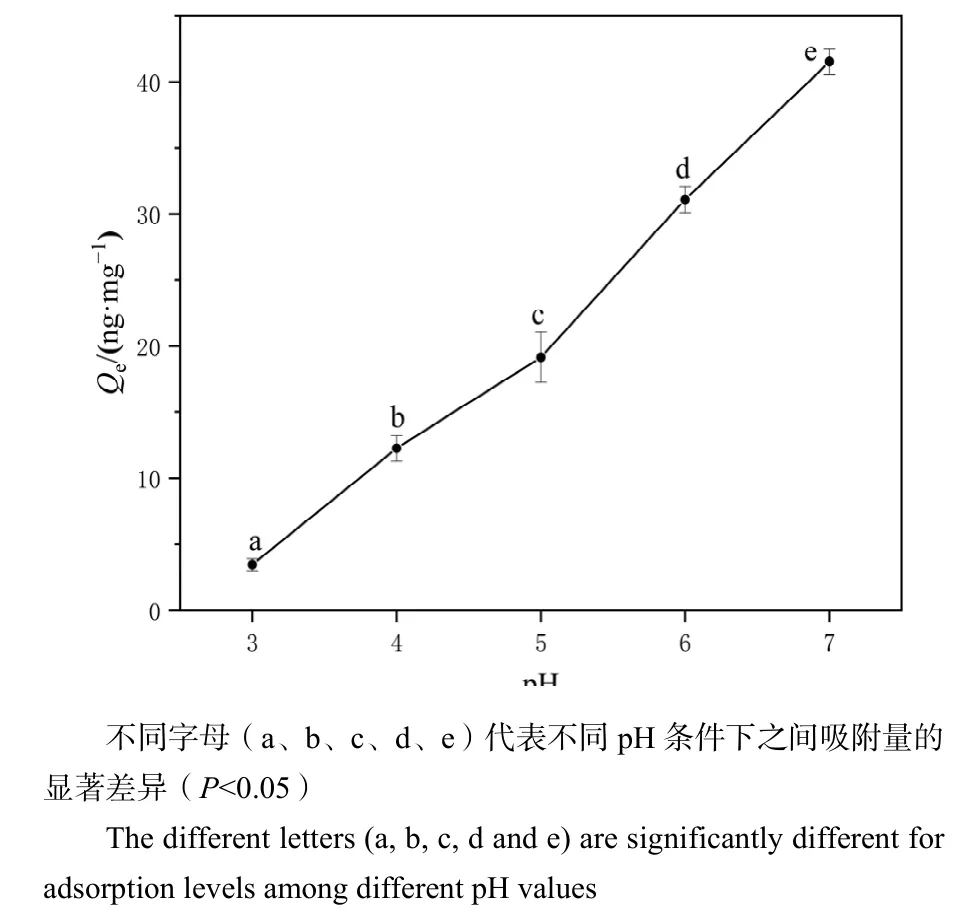
图8 PS-MPs在不同pH条件下对Hg2+的吸附Figure 8 Adsorption of Hg2+ by PS-MPs under different pH values
2.5 离子强度对微塑料吸附Hg2+的影响
盐(NaCl)浓度对PS-MPs吸附Hg2+的影响如图9。随着水中NaCl浓度的增加,PS-MPs对Hg2+的平衡吸附量逐渐降低,由 39.98 ng·mg-1降低到4.95 ng·mg-1。在较低的 NaCl浓度下(如 1 mg·L-1),PS-MPs对 Hg2+的平衡吸附量影响相对较小,而较高的离子强度明显抑制了Hg2+的吸附,100 mg·L-1的 NaCl浓度下,Hg2+的平衡吸附量仅为 4.95 ng·mg-1。有研究报道,盐度会影响MPs和污染物之间的吸附行为(Hu et al.,2017),重金属Cd、Co和Ni的吸附随着盐度的增加而降低(Holmes et al.,2014),本研究结果也证明了盐度对 Hg2+吸附的影响。这一现象可能是由于微塑料在高浓度盐离子环境中的凝聚行为,微塑料发生团聚形成致密的结构使其比表面积减小,吸附位点减少,吸附能力下降;同时,随着盐浓度增大,由于阳离子 Na+竞争,会对 Hg2+产生竞争吸附而进一步降低 Hg2+吸附量(Li et al.,2018;Liu et al.,2019)。此外,含盐量高的溶液具有较高的竞争性和离子密度,会导致吸附在 PS-MPs表面的 Hg2+更难释放(Barus et al.,2021)。
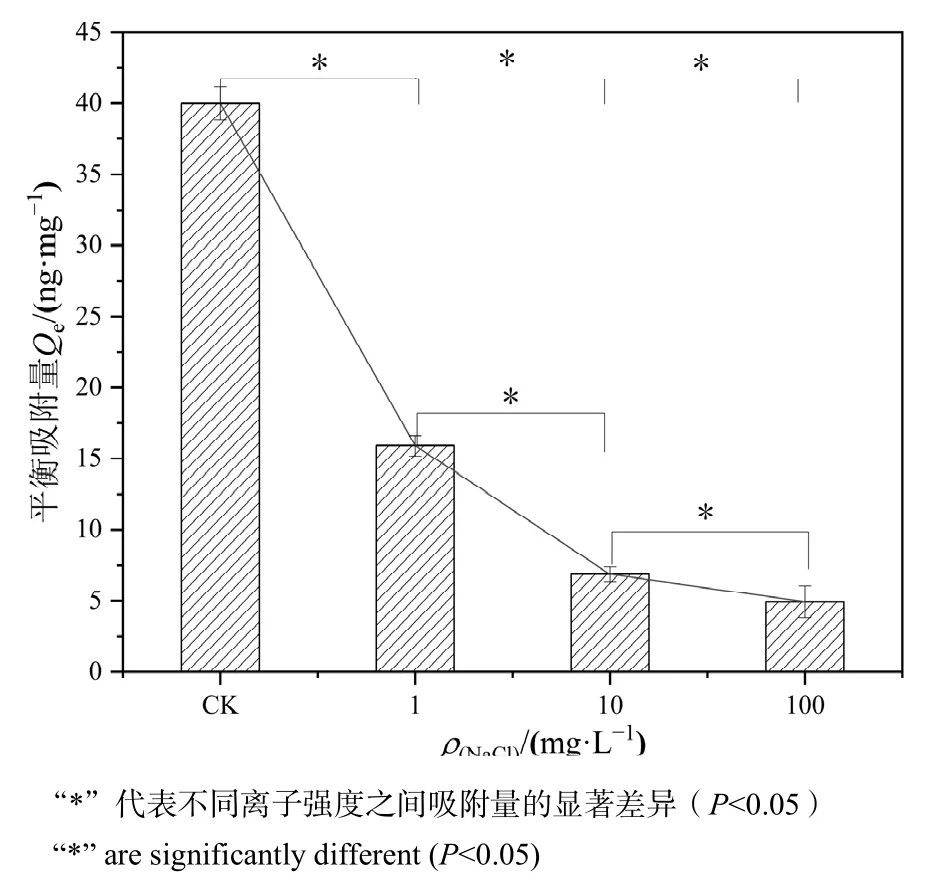
图9 PS-MPs在不同离子强度条件下对Hg2+的吸附Figure 9 Adsorption of Hg2+ by PS-MPs under different ionic levels between adsorption levels and different ionic levels
2.6 不同粒径PS-MPs吸附Hg2+的情况
由实验结果可知,在两种不同粒径PS-MPs的吸附过程中,400 nm的PS-MPs对Hg2+的平衡吸附量最大,达到了28.84 ng·mg-1,而60 μm的最小,为26.73 ng·mg-1,说明粒径越小,对Hg2+的平衡吸附量越大。这与之前研究结论基本一致(Gao et al.,2019;Qiao et al.,2019;Wang et al.,2019),其认为MPs粒径的减小造成比表面积增大,表面吸附位点增加,进而增加了金属离子的吸附量,说明金属离子在固体颗粒上的吸附与颗粒大小有关(Yuan et al.,2020)。
2.7 温度对PS-MPs吸附Hg2+的影响
由图10可知,PS-MPs对Hg2+的平衡吸附量变化的整体趋势是随温度升高而增加的,其中 50 ℃时平衡吸附量最大,为 49.632 ng·mg-1,说明高温确实促进了Hg2+的吸附。杨宏旻等(2006)研究表明,温度越高,吸附剂对Hg2+的吸附效果更好,强化了吸附剂对 Hg2+的化学吸附,抑制了 MPs表面活性位点的物理吸附,进一步可以说明PS-MPs对Hg2+的吸附是化学吸附和物理吸附共同作用的结果。在4—25 ℃时,平衡吸附量基本处于一个水平,其中25 ℃时的吸附量最少(30.630 ng·mg-1),可能是实验误差造成的。
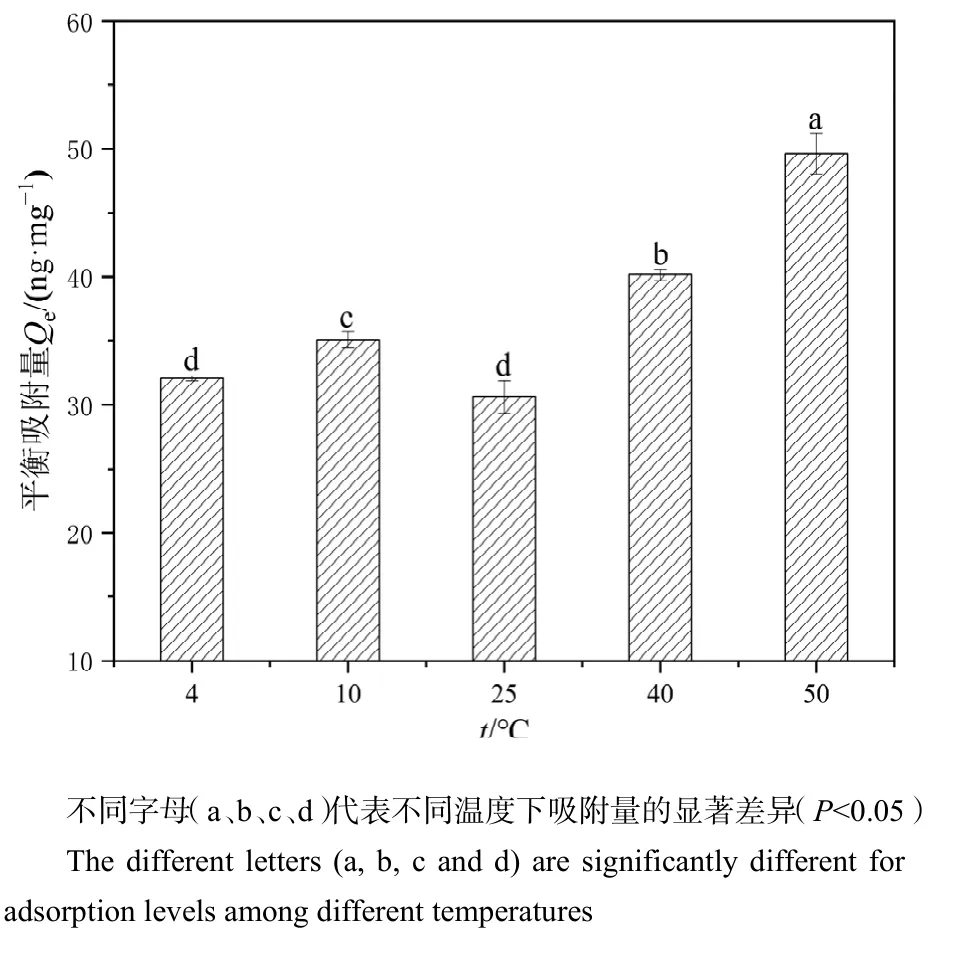
图10 PS-MPs在不同温度情况下对Hg2+的吸附Figure 10 Adsorption of Hg2+ by PS-MPs at different temperatures
2.8 SEM-EDS对PS-MPs吸附Hg2+的能谱分析
SEM-EDS分析结果显示了 60 μm和 400 nm PS-MPs在吸附Hg2+前后汞元素的平均质量数和平均原子数变化,详细数据见表 3。在吸附前可以在PS-MPs上检测到极其微量的Hg,可能是购买的聚苯乙烯树脂材料本身含有一定量的汞。但在吸附处理之后,Hg的信号强度显著增强,这可以直接证明PS-MPs确实对Hg2+产生了吸附。
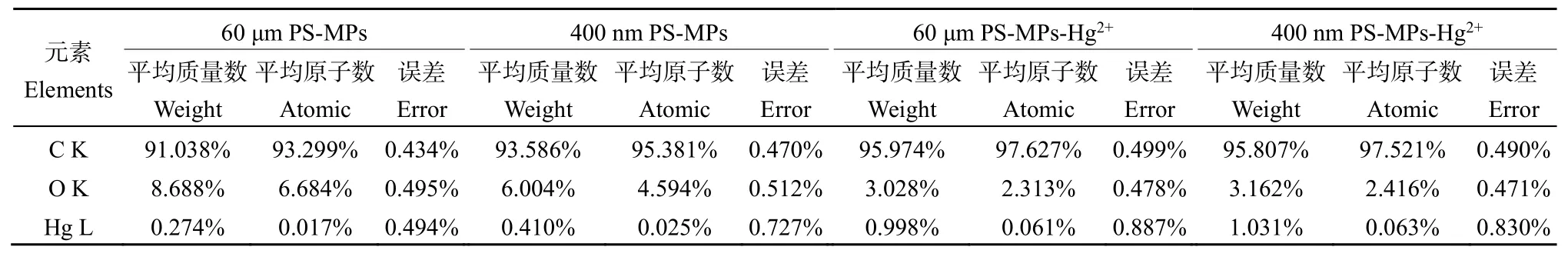
表3 PS-MPs吸附Hg2+前后的平均质量数和平均原子数Table 3 Average mass number and average atom number before and after adsorption of Hg2+ by PS-MPs
3 结论
本研究结果表明,60 μm PS-MPs能够在数分钟内快速吸附重金属Hg2+,在4 h达到吸附平衡。PS-MPs表面 Hg2+达到的最大吸附量与体系中Hg2+浓度呈正相关,Hg2+浓度越高,PS-MPs对其吸附量越大直至到达吸附最大容量。60 μm PS-MPs吸附 Hg2+的行为符合准二级动力学模型和 Freundlich吸附等温线模型,通过红外光谱和能谱可以发现,PS-MPs与Hg2+的相互作用主要为非线性多分子层吸附,该类型的吸附是由物理静电吸附、范德华力和化学络合吸附共同作用的结果。PS-MPs的尺寸效应研究以及溶液的 pH、离子强度、温度等实验分析发现 PS-MPs表面官能团、表面电荷和表面活性位点发生变化,都会影响其与Hg2+的吸附行为。本研究结果可为PS-MPs与重金属汞之间的吸附机制提供科学依据,同时有助于了解重金属汞在环境中的迁移和转化模式。然而,受限于诸多因素,供试材料与实际水环境中的微塑料性质必然存在一定差异,因此未来有必要对真实环境下的微塑料和汞离子的相互作用予以研究。

