社区老年男性居民肌肉减少与代谢相关脂肪性肝病的相关性
张爽 刘晓慧 王罡 张丽 吴剑 张晶
肌少症是与年龄相关的进行性骨骼肌量减少,伴有肌肉力量和(或)肌肉功能减低[1],在老年人群中流行率更高。肌少症不但可增加跌倒的发生率,导致骨折等,而且增加老年人残疾和丧失生活自理能力的风险[1]。鉴于肌少症的危害巨大,目前已经越来越重视肌少症的筛查和诊断。
近年来研究表明,肌少症与代谢相关脂肪性肝病(metabolic associated fatty liver disease,MAFLD)的发生和发展密切相关。一项来自韩国的调查结果显示,肌少症与脂肪肝的发病风险增加相关[2]。另一项研究通过肝组织穿刺活检脂肪肝的队列验证了肌少症与肝纤维化的相关性[3]。目前研究亚洲人群肌少症与脂肪肝的数据大部分来自于韩国,在中国老年人群中相关数据较少。为此,我们在北京某社区老年体检人群进行横断面调查,观察肌肉减少与MAFLD之间的相关性。
资料与方法
一、研究对象
本项目的研究对象是北京某社区65岁以上进行常规体检的男性居民,原则上MAFLD和非MAFLD患者入组比例为1∶1。调查时间为2020年11月—2021年1月。入选标准:①男性患者,年龄≥65岁;②签署知情同意书。排除标准:①缺乏必要的人口学指标、身体测量指标、检验学指标;②缺乏必要的既往史及用药史;③恶性肿瘤及其他器官系统严重疾病;④体内放置金属支架或起搏器,无法进行体成分分析检测。本研究经首都医科大学附属北京佑安医院伦理委员会批准(京佑科伦字[2020]133号),入选患者均签署知情同意书。
二、研究方法
(一)一般情况和身体测量 收集患者年龄、性别、既往病史、腹部超声等临床资料,安排专人测量其身高、体质量、腰围、臀围,并计算体质指数(body mass index, BMI)和腰臀比。
(二)实验室检查 所有研究对象禁食12 h后清晨抽取静脉血,测定肝肾功能、血脂、血糖、糖化血红蛋白、空腹胰岛素、超敏C反应蛋白(hypersensitive C-reactive protein, hs-CRP)等指标,计算稳态模型评估胰岛素抵抗指数(homeostasis model assessment of insulin resistance, HOMA-IR), HOMA-IR = 空腹血糖 (mmol/L) ×空腹胰岛素 (μU/mL)/22.5。
(三)肝脏脂肪变和肝纤维化评估 使用FibroScan 502(Echosens,法国),测量肝脏脂肪控制衰减参数(controlled attenuation parameter, CAP)和肝脏硬度值(liver stiffness measurement, LSM)。此外还采用FIB-4指数[4]和NAFLD纤维化评分(NAFLD fibrosis score, NFS)评估肝纤维化严重程度[5]。
(四)肌肉减少定义 体成分分析使用Inbody720型身体成分测试仪(Biospace,韩国),测量上臂围度、ASM、体脂率、内脏脂肪面积、基础代谢率等指标。使用经体质量校正的ASM(ASM%)评估肌肉减少,ASM%=ASM(kg)/体质量(kg)×100。肌肉减少的定义为ASM%<29.1[6]。
(五)MAFLD诊断 在明确肝脏脂肪变性的基础上,满足BMI≥23 kg/m2;或糖尿病;或以下7条中的2条:①腰围>90 cm;②血压≥130/85 mmHg或特定药物治疗中;③甘油三酯≥1.7 mmol/L,或特定药物治疗中;④高密度脂蛋白胆固醇<1.0 mmol/L;⑤糖尿病前期:空腹血糖水平为5.6~6.9 mmol/L,或餐后2 h血糖7.8~11.0 mmol/L,或糖化血红蛋白为5.7%~6.4%;⑥HOMA-IR≥2.5;⑦超敏C反应蛋白(hs-CRP)>2 mg/L[7]。
三、统计学分析
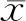
结 果
一、肌少症组和无肌少症组临床特征
共入组男性老年居民232例,其中少肌组65例(28.0%),非少肌组167例(72.0%)。少肌组ASM%(27.41±1.17)年龄、BMI、体脂率、内脏脂肪面积、hs-CRP、空腹血糖、糖化血红蛋白、HOAM-IR均显著高于非少肌组ASM%(31.47±1.86),且ALT[24.0(18.0, 33.0)vs. 20.0(16.0, 26.0)]、CAP[(290.4±60.4)vs. (256.4±53.6)]及LSM[(5.30(4.20, 6.80)vs. 4.45(3.80, 5.90))]均高于非少肌组,基础代谢率、HDL-C低于非少肌组(P均<0.05)。见表1。两组之间代谢综合征、糖尿病、高血压、血脂异常、脑卒中的患病率无显著差异。
表1 社区老年男性居民少肌组和非少肌组临床特征比较

续表1
二、少肌组和非少肌组MAFLD患者比例比较
在全部患者中,少肌组MAFLD患者50例(76.9%),非少肌组MAFLD患者84例(50.3%),少肌组MAFLD患者比例高于非少肌组(χ2=13.593,P<0.001)。
三、男性MAFLD患者少肌组和非少肌组临床特征比较
本研究中共入组MAFLD患者134例(57.8%)。在男性MAFLD患者中,少肌组BMI、腰围、臀围、腰臀比、上臂维度、体脂率、内脏脂肪面积、CAP高于非少肌组(均P<0.05),年龄、ASM、实验室指标、LSM、无创肝纤维化评分组间差异无统计学意义。见表2。
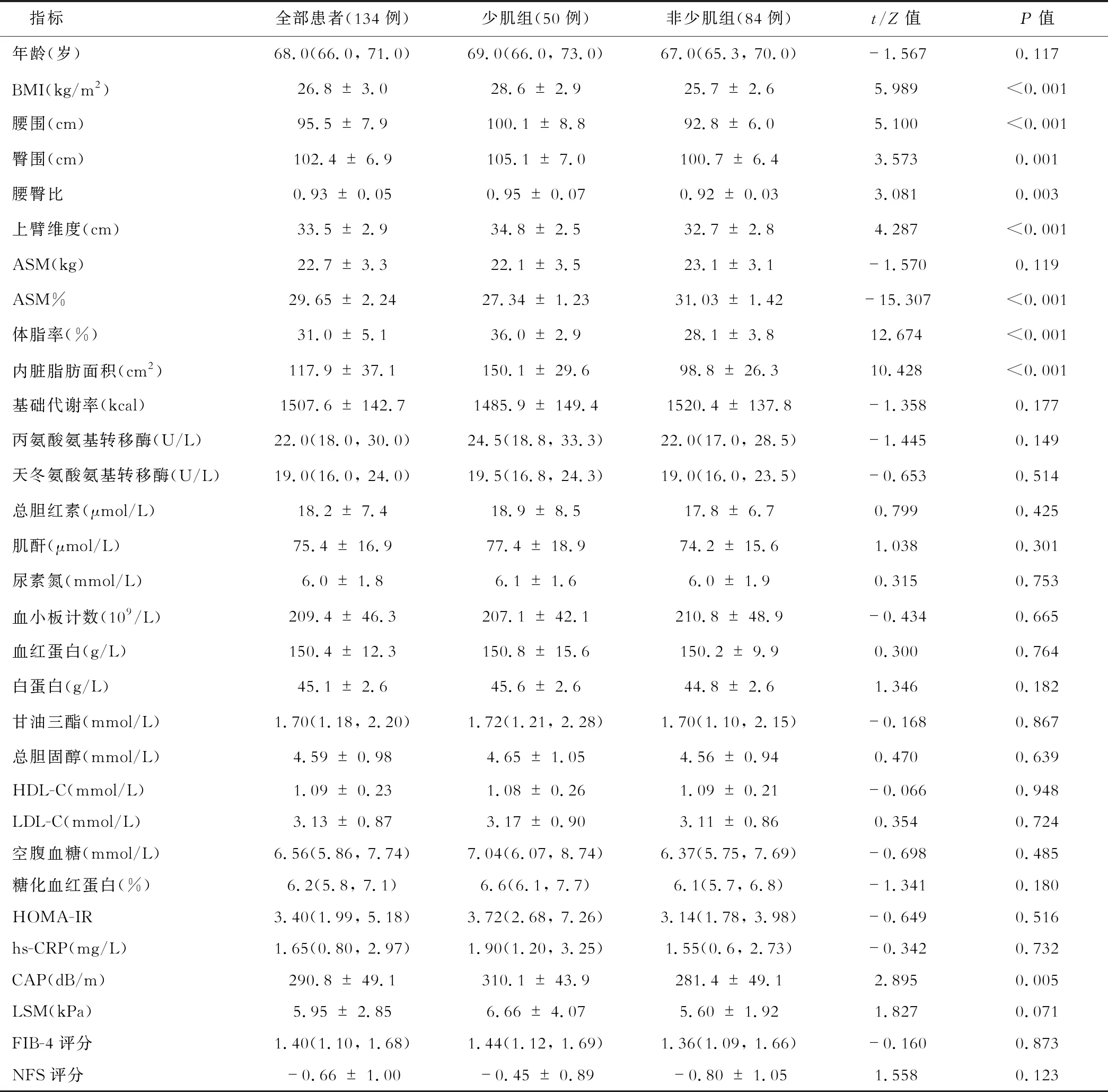
表2 男性MAFLD患者肌少症组和无肌少症组临床特征比较
四、全部患者根据ASM%四分位间距分组的MAFLD特征及代谢特征比较
将全部患者根据ASM%水平由低到高均分为4组(Q1-Q4组),MAFLD患者比例、CAP、空腹血糖、糖化血红蛋白、HOMA-IR、hs-CRP四组间差异有统计学意义(均P<0.05)。见图1。

图1 全部患者根据ASM%四分卫间距分组的MAFLD特征及代谢特征比较
讨 论
本研究发现,老年社区男性居民肌肉减少患者代谢异常更加显著,并且MAFLD比例更高。在MAFLD患者中,合并肌肉减少的患者占37.3%,这些患者肝脏脂肪含量更高,提示脂肪肝更严重。
本研究是以研究肌肉减少和MAFLD的相关性为目的进行的横断面调查,因此更倾向于入组有MAFLD的患者。最终入组的MAFLD和非MAFLD患者分别为134例和98例。因此,本研究中肌肉减少的患者比例偏高达28%,可能与入组了较多的MAFLD伴有肌肉减少的患者有关。亚洲肌少症工作组2019年报告, 亚洲老年人群肌少症的患病率为5.5%~25.7%, 男性的患病率(5.1%~21.0%)高于女性(4.1%~16.3%)[8]。目前我国针对老年男性进行的肌少症患病率调查结果差异较大,从9.5%~19.2%不等[9, 10],结果差异可能与患者选择、地域差异、肌少症的诊断标准和肌肉量测量方法有关。本研究采用经体质量校正的四肢骨骼肌质量定义肌肉减少,目前欧洲肌少症工作组、亚洲肌少症工作组和美国国立卫生研究基金会都制定了肌少症的诊断标准[8, 11-12]。但是,尚未明确哪一种更适合亚洲老年人群,上海低骨骼肌质量与脂肪肝关系研究[13]、北京肌少症与肾功能减退关系研究[14]、韩国少肌性肥胖流行病学调查[15]等研究均与本研究采用相同的方法。
肌少症既往被认为是伴随老龄化出现的退行性病变,近年来,人们认识到它是一种伴随代谢功能紊乱的进展性疾病。一项在2型糖尿病人群中的研究表明,肌少症患者较无肌少症患者糖尿病病史更长,空腹血糖和糖化血红蛋白更高,肾小球滤过率降低[16]。本研究对社区老年男性居民少肌组和非少肌组的临床特征进行比较,少肌组患者年龄更大,肥胖相关指标更高,糖脂代谢指标更差。在低ASM%四分位组的患者中,空腹血糖、糖化血红蛋白、HOMA-IR水平均较高ASM%四分位组的患者高,进一步验证了肌少症与代谢功能紊乱密切相关。
肌少症与MAFLD的发生和发展密切相关,二者相互促进,互为因果。一项来自韩国全国健康和营养调查的研究显示,肌少症与脂肪肝的发生风险和进展期肝纤维化相关,并且这种相关性独立于肥胖和胰岛素抵抗[2]。另一项来自欧洲的研究结果表明,肌少症与脂肪肝患者肝纤维化和脂肪变性的严重程度有关,肌少症患者严重肝纤维化(≥F3)的比例显著高于无肌少症的患者(45.9% vs. 20.4%,P<0.001),并且肌少症患者中存在严重脂肪变性(66%以上的肝细胞脂肪变)的比例高于无肌少症的患者(38.3% vs. 24.6%,P=0.006)[17]。本研究结果显示,在男性肌肉减少的患者中MAFLD的比例明显高于无肌肉减少的患者,表明肌肉减少与MAFLD的发生具有相关性。MAFLD合并肌肉减少的患者与无肌肉减少的患者相比肝脏脂肪变性程度更重,低ASM%四分位组的患者比高ASM%四分位组的患者具有严重的肝脏脂肪变,表明肌肉减少与MAFLD脂肪变性的严重程度相关。
肌少症与脂肪肝有共同的病理生理机制,包括低体力活动、肥胖、胰岛素抵抗(insulin resistance, IR)、维生素D缺乏、肌肉因子失衡[18]。缺乏体力活动会导致肌肉质量的下降,也是脂肪肝的风险因素,体育锻炼可以降低肌少症的风险(OR 0.45; 95%CI: 0.37~0.55)[19]并改善脂肪肝。肌少症伴随肥胖定义为少肌性肥胖。一项纵向研究表明,内脏型肥胖与未来的骨骼肌衰减相关[20]。胰岛素抵抗是脂肪肝和肌少症的主要病理机制。骨骼肌IR导致肌肉降解增加,线粒体含量、功能和氧化能力降低[21]。肝脏IR可使过量的葡萄糖在肝脏转化为甘油三酯,导致脂肪肝的发生[22]。维生素D参与钙平衡、骨骼代谢和肌肉生长。维生素D在改善肌少症与脂肪肝中有共同的作用机制,包括改善胰岛素抵抗、缓解炎症和调节免疫、调节转化生长因子β、影响自噬、影响脂肪因子分泌[23]。在华东地区的一项横断面调查中,维生素D缺乏增加54%的脂肪肝发生风险[24]。骨骼肌具有自分泌和内分泌的作用,例如骨骼肌分泌的鸢尾素(Irisin)与肝脏中甘油三酯的浓度呈负相关[25],提示肝脏和肌肉之间存在紧密的内在联系。但是肌少症和脂肪肝之间相互影响的机制尚未完全阐明。
MAFLD的预防和治疗主要通过控制膳食热量摄入和有氧运动,但是在减重过程中容易出现肌肉减少,特别是对于老年人,更应该注意减重过程中保持肌肉质量。本研究发现了肌肉减少与MAFLD之间的联系,提示应该对MAFLD患者进行肌肉质量的检查,在干预过程中预防或治疗肌肉减少。此外在老年男性中,肌肉减少通常伴随着更严重的代谢异常和肝脏脂肪变,提示对于肌肉减少的老年人应注意代谢异常和MAFLD的筛查,以利于早期发现和及时治疗。
利益冲突声明:所有作者均声明不存在利益冲突。

