巨桉EgrCIN1响应非生物逆境的分析
李芳燕,夏晓雪,吴梦洁,洪家都,程龙军
(浙江农林大学 林业与生物技术学院,浙江 杭州 311300)
低温是限制植物生长和发育的主要逆境因子。较低的温度会损伤植物细胞的膜结构,抑制酶活性,诱导活性氧产生,破坏代谢平衡等,引起植物生长受阻、早衰甚至死亡[1]。世界上只有三分之一的陆地面积温度在冰点以上,却有42%的陆地会经历−20 ℃以下的低温,因此低温也是限制植物地理分布的重要因素[2]。为了应对低温胁迫,植物在长期进化过程中逐渐形成了低温适应机制,用来提高植物耐受低温逆境的能力,降低低温胁迫伤害。在代谢层面上,植物可以通过提高可溶性糖、游离脯氨酸等小分子渗透调节物,以及抗氧化酶过氧化物酶(POD)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)等的活性来增加对低温的耐受力[3]。分子层面上,低温下植物细胞膜的流动性降低,膜蛋白的构象发生改变,进而使膜刚性增加,细胞膜的这些物理变化为膜上低温受体对低温的感受提供了基础。植物细胞的受体感受低温信号后,通过提高细胞质中的钙离子(Ca2+)水平,并与Ca2+结合蛋白结合,作为二级信号激活抗寒相关转录因子,调控耐寒相关基因,实现低温胁迫响应[4]。目前,低温响应的分子调控途径中,ICE1-CBF-COR途经被认为是植物响应耐寒胁迫的主要途径[5]。低温通过Ca2+信号引发蛋白激酶磷酸化脱落酸(ABA)信号调控途径中的蛋白激酶OST1 (open stomata1,气孔开放1)/SnRK2.1 (SNF1-related protein kinase 2.1,SNF1相关蛋白激酶2.1),磷酸化的OST1与bHLH类转录因子ICE1结合并将其磷酸化,稳定ICE1的活性,使其稳定结合在CBF (C-repeat binding factor,C-重复结合因子)基因上,激活它们的表达。CBF转录因子会进一步启动冷响应相关基因CORs (cold responsive,低温响应),如编码渗透调节物质合成酶以及低温保护蛋白COR、LT1 (low temperature 1,低温1)和CIN (cold-induced,冷诱导)基因等,提高植物的低温适应性[6−7]。除此之外,植物激素[8]和ROS (reactive oxygen species,活性氧)[9]也参与了植物低温响应的调控。
植物细胞中,低温的响应和调控主要发生在细胞质和细胞核中,但叶绿体在低温响应中也发挥了重要作用。叶绿体不仅是低温响应二级信号分子ROS产生的主要场所[10],还参与水杨酸(SA)[11]、茉莉酸(JA)[12]、ABA[13]以及脯氨酸[14]等的生物合成。这些物质在植物低温响应中都产生了积极效应。因此,参与叶绿体生物活性的相关基因在低温逆境响应中也发挥了重要的功能。近年来,研究者发现叶绿体产生的ROS等信号分子可以通过逆行性信号传递途径进入细胞核来调控核基因的表达,以实现植物对环境的适应[15]。但叶绿体参与低温胁迫响应的具体分子机制大多不清楚。随着人们对植物逆境生物学研究重视程度的提高,越来越多参与植物非生物逆境响应的基因被挖掘出来,这些基因中有些响应特异逆境,也有些能够响应多种逆境,表明植物响应逆境的分子机制非常复杂的。尽管已经确定了相当数量逆境响应基因的功能,但仍有很多功能未知的基因响应非生物逆境胁迫[16]。
桉Eucalyptus树是世界上生长最快的木本植物之一,作为重要的用材树种广受欢迎,但大部分桉树对低温的耐受程度比较差。以桉树为材料研究它们的耐低温分子机制,深入挖掘低温胁迫响应相关的基因资源,对桉树的栽培和育种都有促进作用[17]。EgrCIN1 (cold induced 1)是一个随低温处理时间延长表达不断增强的基因。亚细胞定位表明其表达的蛋白定位在巨桉Eucalyptus grandis叶绿体中。本研究通过对该基因及其编码蛋白序列特征的分析和在拟南芥Arabidopsis thaliana中异源过表达后转基因株系对低温的响应等实验,分析该基因响应低温胁迫的功能。
1 材料与方法
1.1 植物材料
巨桉为保存于浙江农林大学苗圃的G5扦插无性系材料。拟南芥野生型为哥伦比亚生态型,生长于浙江农林大学智能实验楼拟南芥生长室,生长条件为25 ℃ 16 h光照/22 ℃ 8 h黑暗,相对湿度为65%,光照强度为 100 μmol·m−2·s−1。
1.2 EgrCIN1基因、编码蛋白序列及启动子顺式作用元件分析
根据EgrCIN1的编号 (Eucgr.B02882)在 phytozome (https://phytozome-next.jgi.doe.gov)中获取其基因、蛋白序列。使用ProtParam (http://web.expasy.Org/protparam/)分析EgrCIN1蛋白的相对分子量、理论等电点;使用PSIPRED (http://bioinf.cs.ucl.ac.uk/psipred/?disopred=1)在线预测其二级结构;使用TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)进行跨膜结构预测;利用Plant-mPLoc (http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)对EgrCIN1在细胞中的表达位置进行预测;同时截取EgrCIN1基因起始密码子ATG上游1 500 bp的序列作为其启动子,使用在线分析网站Plant Care (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析EgrCIN1基因启动子上的顺式作用元件。
1.3 定量分析实验设置
1.3.1 4 ℃低温不同处理时间下的表达分析 取6个月苗龄的巨桉G5无性系幼苗,于低温生长箱(Snijder,荷兰)中进行0.5、2.0、6.0、12.0、24.0、48.0 h的4 ℃低温处理。8 h光照/16 h黑暗,相对湿度为 60%,光照强度为 150 μmol·m−2·s−1。同时分别以正常温度 (白天 26 ℃,晚上 22 ℃,湿度、光照与处理相同)条件下生长的G5无性系幼苗为对照(ck)。3株幼苗为1个处理组,设置3次重复。处理结束后,取叶片置于液氮速冻。
1.3.2 组织特异性分析 分别取6个月苗龄的巨桉G5无性系幼苗根、茎、嫩叶(顶端新生叶片)以及成熟叶片各100 mg,置于液氮速冻,待测。
1.3.3 干旱、高盐、ABA、茉莉酸甲酯(MeJA)处理下的表达分析 选取长势一致、6个月苗龄的巨桉G5无性系幼苗,分别进行干旱、高盐、ABA、MeJA等4种胁迫处理。干旱、高盐处理:干旱组不浇水即可;高盐处理组每次浇灌300 mmol·L−1氯化钠(NaCl)溶液200 mL,间隔12 h续浇1次;对照组浇灌等量清水,连续处理1周。ABA、MeJA处理:分别配制浓度为100 μmol·L−1的ABA和MeJA溶液,均匀喷洒在幼苗叶片上,对照组喷施等量清水,12 h处理1次,共处理24 h。每个处理3个植株,重复3次。处理结束后选择相同叶位的成熟叶片取样。
1.3.4 RNA提取 使用TIANGEN总RNA提取试剂盒(DP432),利用PrimerScript TM RT reagent Kit(TaKaRa,日本)试剂盒将RNA反转录为cDNA。设计引物(表1),以EgrACTIN为内参,用TB Green Premix ExTaqⅡ(Tli RNaseH Plus)试剂盒(TaKaRa,日本)进行EgrCIN1基因表达的实时荧光定量PCR(RT-qPCR)实验,分析EgrCIN1在巨桉不同组织中及不同逆境处理后的表达情况。

表1 引物列表Table 1 Primers
1.4 EgrCIN1蛋白亚细胞定位
以改造过的pCAMbia1300-GFP载体为骨架,在phytozome上获得EgrCIN1的转录本序列,去掉终止密码子后使用Primer Premier 5设计上下游引物并在引物2端分别添加KpnⅠ和XbaⅠ酶切位点及保护碱基(表1),基因克隆后进行EgrCIN1:GFP融合载体构建。重组的阳性克隆提取质粒后,利用电转法转入农杆菌Agrobacterium tumetacieGV3101中。瞬时转化烟草Nicotiana tabacum叶片,共培养2 d后用激光共聚焦显微镜(ZEISS,LSM510,德国)观察并拍照。GFP荧光观察激发光波长设置为488 nm,吸收光波长为500 ~525 nm;观察叶绿素荧光时激发光波长设置为552 nm,吸收光波长则为620 ~650 nm。
1.5 EgrCIN1超表达载体构建及拟南芥异源转化
以含35S启动子的pCAMBIA1301为载体骨架,选取多克隆位点处的XbaⅠ和KpnⅠ作为酶切位点,设计EgrCIN1带酶切位点的全长基因引物(表1),PCR扩增,鉴定后进行35S:EgrCIN1载体构建。电击转化农杆菌GV3101,蘸花法侵染拟南芥。种子收获后,在含25 μg·mL−1潮霉素B (Hygromycin B,罗氏,瑞士)的1/2 MS培养基进行阳性株系筛选,获得的阳性株系培养一段时间后,提取叶片基因组DNA,利用EgrCIN1基因特异引物(表1)进行分子鉴定。阳性株系继续繁殖、筛选,直至获得T3代转基因纯合株系。
1.6 转基因拟南芥株系中EgrCIN1的表达
经筛选获得3个超表达EgrCIN1转基因纯合株系,纯合株系植株种植10 d后,提取叶片RNA,反转录为cDNA,设计引物(表1),以AtACTIN为内参,进行半定量PCR实验。
1.7 EgrCIN1拟南芥过表达转基因株系低温和ABA处理
野生型和EgrCIN1过表达株系种子经体积分数为75%乙醇消毒后,播种在1/2 MS培养基上,4 ℃春化处理2 d。低温处理:培养基上培养1周后的野生型和转基因株系幼苗分别移栽至育苗盆中,每盆中野生型和1个转基因株系各移栽4株。生长2周后,在低温培养箱中−6 ℃处理12 h后移至正常生长条件下恢复1周,观察表型并拍照。每个株系处理3盆,重复3次。实验结束后统计野生型(COL)和各株系的存活率。ABA处理:野生型和3个过表达株系分别播于含0.5 μmol·L−1ABA的培养基上,生长10 d后,观察表型并拍照。
1.8 数据处理
定量结果采用2-ΔΔCt[18]方法计算;作图软件为GraphPad Prism ver 6.01;使用SPSS 16.0进行显著性检验,分析方法选择单因素方差分析,默认置信区间95%。
2 结果与分析
2.1 EgrCIN1基因的筛选及在4 ℃低温不同处理时间下的表达分析
课题组前期从巨桉4 ℃低温处理2 h的转录组中筛选到1个表达受到低温强烈诱导的基因,将其命名为EgrCIN1 (cold induced 1)。Phytozome数据库中该基因的序列号为Eucgr.B02882。为进一步了解EgrCIN1对低温的响应,利用RT-qPCR技术对4 ℃不同处理时间(0.5、2.0、6.0、12.0、24.0、48.0 h)的巨桉无性系幼苗进行EgrCIN1表达特性分析。结果表明(图1):除了处理0.5 h的植株中EgrCIN1基因的表达水平与未处理植株(对照)相比没有显著差异外,随处理时间的延长,EgrCIN1的表达水平逐渐升高,处理48.0 h时,其表达水平已经达到了对照的48.6倍。48.0 h后,叶片萎蔫严重,明显受到低温生理伤害,故未进一步取样分析。可见,EgrCIN1表达明显受低温诱导,且随处理时间的延长表达有增强的趋势。
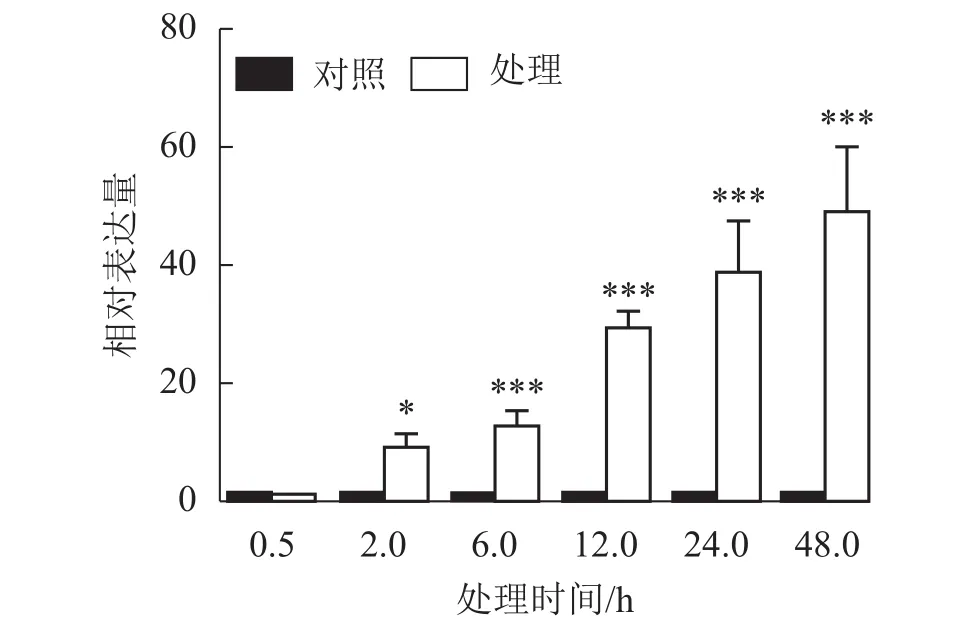
图1 4 ℃低温处理不同时间下EgrCIN1的定量表达Figure 1 Relative expression of EgrCIN1 gene under 4 ℃ low temperature treatment for different time
2.2 EgrCIN1基因、蛋白序列分析
根据巨桉数据库获取信息和相关分析可知:该基因开放阅读框全长579 bp,不含内含子。编码含有192个氨基酸的蛋白,等电点为6.98,相对分子量为20.80 kDa。该基因编码的蛋白既没有旁系同源物,也没有直系同源物,是巨桉中特有且唯一的蛋白。
利用PSIPRED对EgrCIN1编码的蛋白的二级结构预测表明:该蛋白含有2个β转角和7个ɑ螺旋,其余部分则为无规则卷曲(图2A)。利用TMHMM对EgrCIN1蛋白序列跨膜结构的预测则表明:序列中所有氨基酸序列位点的跨膜概率均小于0.02,没有明显跨膜区域(图2B),说明其不是膜蛋白。亚细胞定位预测结果显示:EgrCIN1编码的蛋白可能在叶绿体、线粒体、细胞质及细胞核中都能表达。

图2 EgrCIN1蛋白二级结构(A)和跨膜结构(B)预测Figure 2 Prediction of EgrCIN1 protein secondary structure (A) and transmembrane structure (B)
2.3 EgrCIN1基因启动子顺式作用元件分析
对EgrCIN1的启动子上分布的顺式作用元件进行了分析,发现在EgrCIN1启动子上分布着多个与植物非生物逆境胁迫响应密切相关的顺式作用元件(表2),其中脱落酸应答元件(ABA response element,ABRE) 2个,乙烯响应元件(ethylene response element, ERE) 1个,低温响应元件(low temperature response element, LTR) 1个,植物转录因子MYB识别序列(MYB recongnition site)、MYC结合序列均为干旱和ABA响应元件,分别有4和6个。表明该基因的表达可能受到逆境胁迫的调控。

表2 EgrCIN1基因启动子上的顺式作用元件Table 2 Cis-elemtents in the promoter of EgrCIN1
2.4 EgrCIN1组织特异性表达分析
通过RT-qPCR分析EgrCIN1在不同组织中的表达情况,结果表明:EgrCIN1在嫩叶、成熟叶和茎中都有表达,且在茎中的表达量最高,而在根中却没有表达(图3)。

图3 EgrCIN1在巨桉不同组织中的定量表达Figure 3 Quantitative expression of EgrCIN1 in different tissues of E.grandis
2.5 EgrCIN1蛋白亚细胞定位
由于EgrCIN1为巨桉特有的基因,尚无其功能信息的研究,本研究构建了EgrCIN1:GFP表达载体,针对其编码蛋白在细胞中发挥功能的位置进行了亚细胞定位分析。结果表明:EgrCIN1蛋白与烟草叶片中的叶绿体具有共定位效应,表明EgrCIN1是在叶绿体中发挥作用的蛋白(图4)。

图4 EgrCIN1蛋白在烟草表皮细胞中的表达(标尺为50 μm)Figure 4 Expression of EgrCIN1 protein in tobacco epidermis cell(the bar is 50 μm)
2.6 拟南芥过表达转基因株系中EgrCIN1的表达
通过遗传转化后,从中筛选获得3个转基因株系:EgrCIN1-OE3、EgrCIN1-OE7和 EgrCIN1-OE9。利用RT-qPCR技术对这3个株系中EgrCIN1的基因表达情况进行分析,结果表明:EgrCIN1在3个株系中都有明显的表达(图5)。
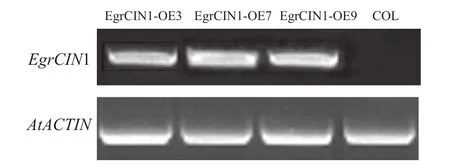
图5 野生型和EgrCIN1过表达转基因株系中EgrCIN1的半定量PCRFigure 5 Semi-quantitative PCR of EgrCIN1 in wild type and EgrCIN1 overexpression transgenic lines
2.7 低温处理下EgrCIN1过表达转基因株系的表型分析
对3个拟南芥过表达转基因株系进行−6 ℃低温处理12 h,随后置于正常生长条件下生长1周。结果发现:−6 ℃低温处理对转基因株系和野生型都会造成低温伤害,但转基因株系的恢复情况明显好于野生型(图6A)。统计不同株系的存活率发现,野生型存活率为30.53%,而EgrCIN1-OE3、EgrCIN1-OE7和EgrCIN1-OE9等3个转基因株系分别达到了77.77%、86.07%和88.83% (图6B),表明EgrCIN1的超表达在一定程度上可以提高植株的抗寒性。

图6 野生型和EgrCIN1转基因株系低温处理后的表型(A)和存活率(B)Figure 6 Phenotype (A) and survival (B) of wild-type and EgrCIN1 transgenic lines after cold treatment
2.8 ABA处理下EgrCIN1过表达转基因株系的表型分析
植物低温响应分子调控途径有ABA依赖型和ABA非依赖型。针对EgrCIN1参与的抗寒性途径是否有ABA参与的这一问题,对转基因株系进行了ABA处理。结果表明:在0.5 μmol·L−1ABA处理10 d后,3个转基因株系受到的ABA抑制作用明显强于野生型(图7),说明ABA也参与了EgrCIN1功能的发挥。
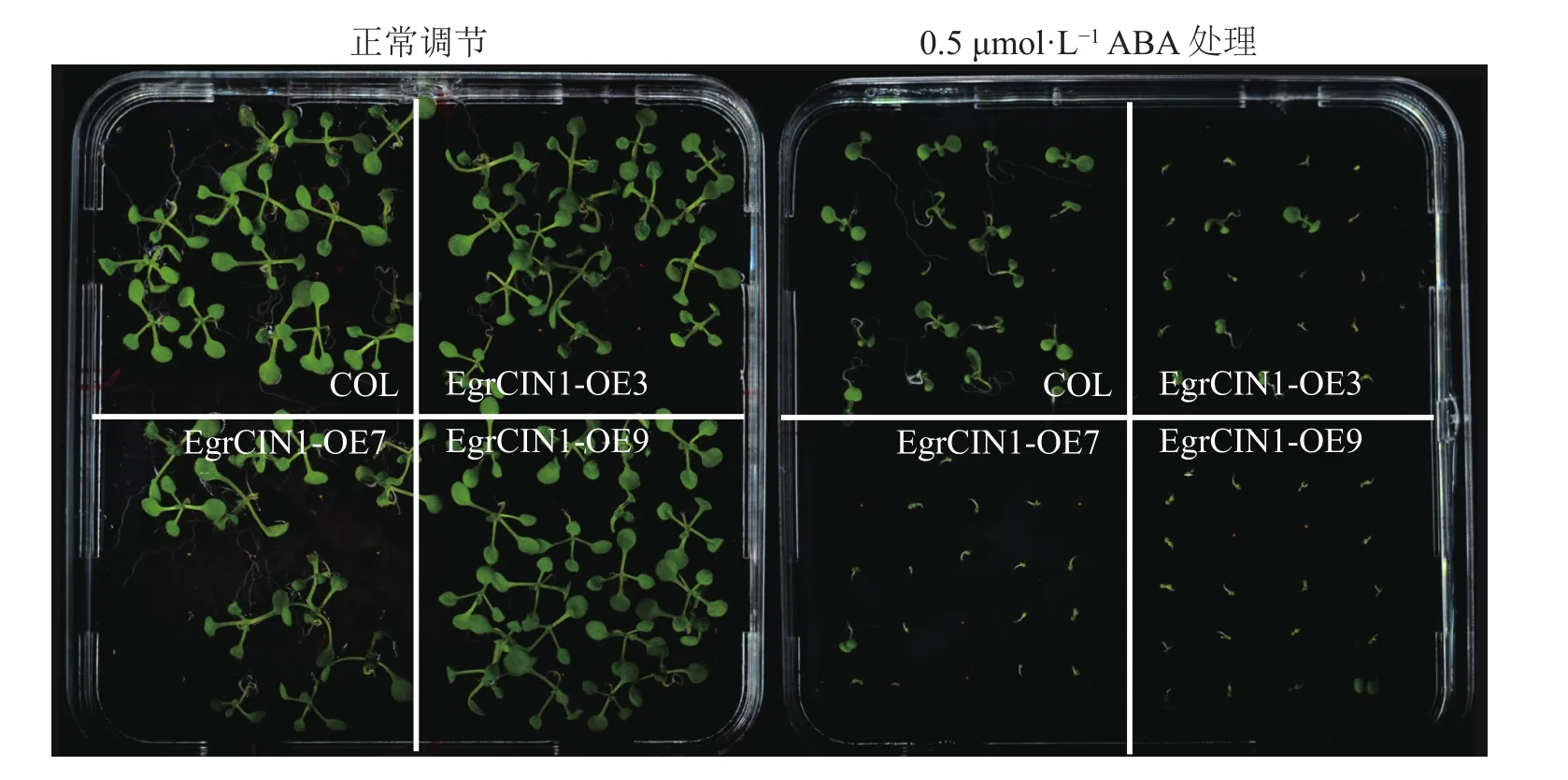
图7 野生型和EgrCIN1过表达株系0.5 μmol·L−1 ABA处理10 d后的表型Figure 7 Phenotypes of wild-type and EgrCIN1 overexpression lines treated with 0.5 μmol·L−1 ABA after 10 days
2.9 干旱、高盐、ABA和MeJA等其他非生物逆境处理下EgrCIN1的表达分析
由于不同非生物逆境因子之间往往存在相互作用,为了进一步了解其他非生物逆境因子对EgrCIN1的影响,分别分析了EgrCIN1在巨桉幼苗干旱、高盐、ABA和MeJA处理下的表达情况。结果表明:干旱和高盐处理都能诱导EgrCIN1的表达,干旱处理下EgrCIN1的表达量是对照的35.1倍;300 mmol·L−1NaCl处理下EgrCIN1表达量则上调了16.4倍(图8A)。但EgrCIN1的拟南芥过表达转基因株系在干旱和高盐处理下与野生型相比没有显著的表型差异。此外,外源喷施ABA也能促进EgrCIN1的表达,而100 μmol·L−1MeJA处理下,和对照相比EgrCIN1的表达并未发生显著变化(图8B)。
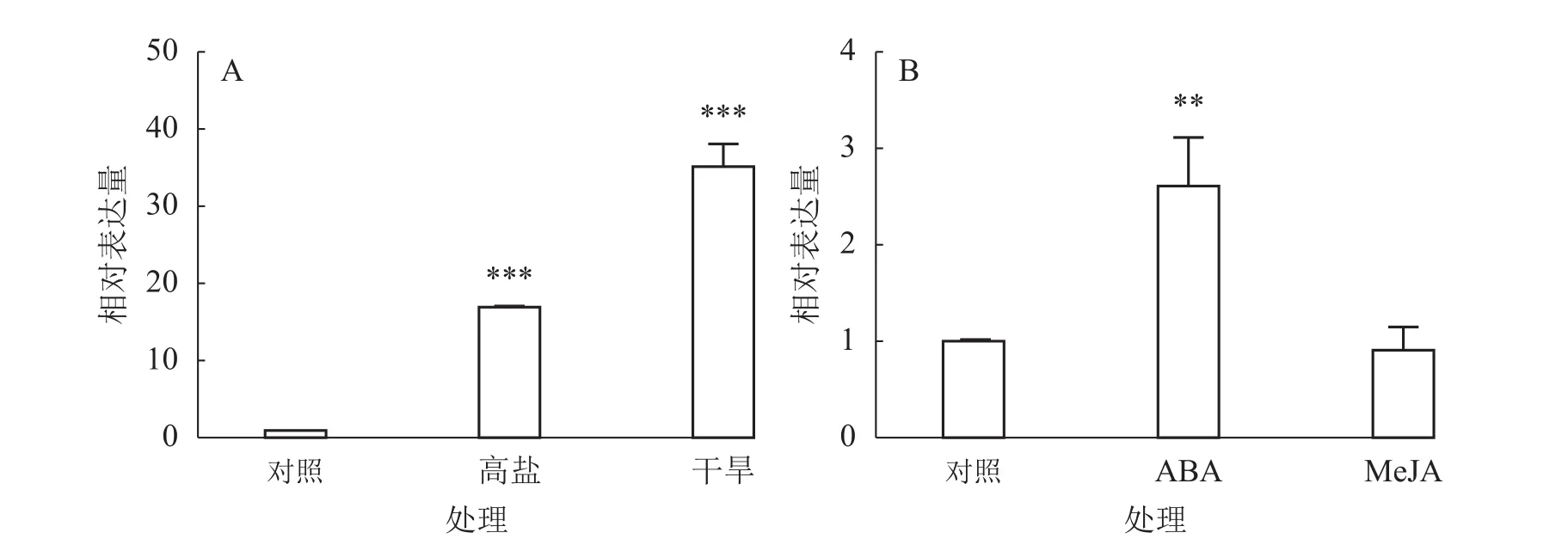
图8 巨桉幼苗高盐、干旱(A)和ABA、MeJA(B)处理下EgrCIN1的定量表达Figure 8 Quantitative expression of EgrCIN1 in E. grandis seedlings under high salt, drought (A) and ABA, MeJA (B) treatments
3 讨论
EgrCIN1是巨桉中一个受低温诱导的未知功能的基因,本研究表明:它随着低温处理时间的延长,表达水平不断提高,显示其参与了巨桉的低温胁迫响应。基因、蛋白质序列的结构特征分析,以及多序列比对和可能功能域的搜索结果都表明该基因是巨桉中一个特有的新基因。启动子上顺式作用元件的预测也表明其表达可能受低温相关因素和信号的影响。组织特异性表达分析则表明该基因主要在巨桉茎和叶中表达,而根中没有表达。显示其可能主要在植株地上部分发挥作用。对于EgrCIN1功能的进一步研究有可能为揭示桉树低温适应性新机制提供基础。
叶绿体在植物低温响应过程中处于中心枢纽的位置,一方面植物抵抗低温的能力取决于低温下的叶片光合活性。另一方面,叶绿体中参与光合作用的光反应中心酶活性受到抑制,进而引发PSⅡ的光能溢出效应,导致ROS积累,产生控制核基因表达的逆行性信号,调控低温响应基因表达,提高植株适应性[19]。在一定程度上,叶绿体的抗低温程度与整体植株的抗寒性密切相关。因此,叶绿体冷诱导相关的基因受到了极大的关注和重视。很多冷诱导基因在叶绿体中表达,并参与植物的低温逆境响应。针叶福禄考Phlox subulata中PsCor413im1蛋白在叶绿体膜上表达,超表达PsCor413im1的拟南芥株系在低温和冷冻逆境下,存活率和种子发芽率都有较大程度的提高[20]。拟南芥中的NAC102在叶绿体中作为抑制因子参与叶绿体基因的表达,并介导ROS对低温响应基因ZAT6、ZAT10和ZAT12等的调控[21−22];冷调控蛋白COR15A和COR15B在低温条件下也可以通过结构的改变稳定叶绿体的膜结构,实现拟南芥对低温的适应性[23]。这些结果表明:叶绿体中表达的低温诱导基因有可能成为植物低温驯化的重要靶标。尽管利用生物信息学软件预测EgrCIN1编码蛋白在叶绿体、线粒体、细胞质以及细胞核中都可能存在,但亚细胞定位结果表明其可能仅在叶绿体中表达。因此被低温强烈诱导的EgrCIN1基因表达的蛋白也定位在叶绿体中,表明其在桉树中同样有可能是叶绿体中参与低温耐受性提高的重要候选基因。拟南芥中过表达EgrCIN1株系低温处理下的结果说明了该基因的确参与了植物的低温胁迫响应,能够提高植株对低温的耐受程度。另外,该基因在不同叶绿体中表达的强度有所差异,同时并非所有叶绿体中都有该基因的表达。这可能与瞬时表达过程中该基因在不同叶绿体中表达的强度不同有关,也可能是该基因在叶绿体不同发育阶段表达模式不同。
ABA在植物低温响应中也发挥了重要作用[24−25],包含叶绿体在内的质体是ABA生物合成开始的场所[13]。ABA在叶绿体中与逆境胁迫相关基因表达的蛋白互作调控植物对逆境的适应性。如小立碗藓Physcomitrella patens中,ABA介导了叶绿体蛋白PpCOR413im对植物低温逆境适应性的调控[26]。拟南芥中过表达匍匐剪股颖Agrostis stolonifera叶绿体定位蛋白AsHSP26.8a,可以通过调控ABA信号途径提高转基因植株对低温的抗性水平[27]。EgrCIN1的过表达株系对外源ABA表现出敏感性提高的表型,同时转基因植株对低温的抗性也得到了增强,这与AsHSP26.8a作用相似。暗示ABA合成或者信号途径可能也参与了EgrCIN1对低温逆境响应的调控。同时,在巨桉中,ABA的处理也能在一定程度上诱导EgrCIN1的表达,表明ABA合成或者信号途径可能也参与了EgrCIN1功能发挥的调控。因此,EgrCIN1一方面可能受到低温等非生物逆境信号诱导而参与ABA生物合成或者信号转导对逆境响应的调控;另一方面,ABA也极可能直接影响EgrCIN1的表达,参与其功能的调控。另外,干旱、高盐也能强烈诱导EgrCIN1的表达,但实验过程中EgrCIN1拟南芥过表达转基因株系并未表现出明显的耐旱、耐盐表型,显示EgrCIN1在拟南芥和巨桉的非生物逆境响应中发挥的功能可能不同,同时也表明EgrCIN1在植物非生物逆境响应中发挥的功能比较复杂,需要进一步研究以揭示其在巨桉低温等非生物逆境响应中的功能。
本研究表明:EgrCIN1是巨桉中特有的一个基因,受低温强烈诱导,在叶绿体中表达。其拟南芥过表达转基因株系提高了对低温的耐受性,同时对ABA的敏感程度也被增强。这表明EgrCIN1有可能是存在叶绿体中,通过与ABA互作,以ABA依赖形式的途径参与了植物对低温逆境的响应。但仍有很多问题需要进一步深入研究,如EgrCIN1是否与叶绿体的发育有关系,与ABA采用什么样的互作方式共同参与植物对低温逆境适应性的调控,在干旱、高盐等其他非生物逆境响应中的作用等。

