血清骨代谢标志物实验室检测基于生物学变异的允许总误差在可比性验证中的应用
高自颖,何玲鸽,甄拴平
(1.宝鸡市中心医院检验科,陕西宝鸡 721008;2.宝鸡市中医医院检验科,陕西宝鸡 721001)
可比性验证是实验室经常性的任务,是质量保证过程的一部分。根据《医疗机构临床实验室管理办法》和ISO15189的要求,用于检测临床样本的每个检测系统都应进行可比性验证(也称仪器间比对)。可比性验证的可接受标准应满足临床需要,同时要考虑检测系统的性能状态。目前血清骨代谢标志物检测项目的可比性验证质量标准尚没有行业标准和地方法规可供应用。长期以来本实验室在实施检测系统可比性验证时,甲状旁腺素(PTH)、25-羟维生素D[D3(25-OH)]参照国家卫生健康委临床检验中心室间质量评价(external quality assessment, EQA)的允许总误差(tatal error, TEa)为可接受质量标准,而骨钙素、总Ι型胶原氨基端延长肽(TP1NP)、β-胶原特殊序列(β-CTX)目前尚没有能力验证(proficiency test,PT)和EQA的TEa可供参考,只是参考应用已发表的专业推荐,如Tonks提出实验的允许误差应不能大于1/4的正常范围[1]。然而使用EQA固定限和已发表的专业推荐作为质量规范通常是基于专家观点和可达到的标准而不是适当的(期望的)标准,不利于及时发现问题。本实验将基于生物学变异的最佳的、适当的和最低的TEa质量规范应用于血清骨代谢标志物的可比性验证中,有利于推进测量系统性能改进,为区域检验结果互认奠定基础。
1 材料与方法
1.1 研究对象 收集2021年11~12月血清骨代谢标志物实验室常见检测项目包括骨钙素,TP1NP,β-CTX,PTH和D3(25-OH)某次试剂更换批次(lot number,Lot)比对数据和2021年12月无室间质评替代方案(实验室间比对)数据作为研究对象。
1.2 仪器与试剂 罗氏Cobas e 601电化学发光分析仪;Cobas原装配套试剂、校准品。
1.3 方法
1.3.1 试剂更换批次的可比性验证数据收集:依据CLSI EP26-A[2]描述的方法学,确认当日质控在控,取备用或当日患者血清样本5人份,使其浓度尽可能覆盖线性范围;用原批次试剂和新批次试剂检测备用血清各1次,操作方法按试剂盒说明书进行;计算两组数据的相对偏倚:相对偏倚=(X1-X2/X1)×100%。
1.3.2 实验室间可比性验证数据收集:依据EP31-A-IR[3]描述的方法学,选择使用相同检测方法的实验室为比对实验室,确认当日质控在控,选取足够量新鲜血清样本5人份,使其浓度尽可能覆盖线性范围,等分为2份,-20℃保存备用;按照仪器操作说明两实验室在相同时段同时检测;计算两组数据的相对偏倚:相对偏倚=(X1-X2/X1)×100%。
1.3.3 验证结果可接受质量标准的确定:通过www.westgard.com/guest17.htm或王治国主编《临床检验生物学变异与参考区间》附录2[4]获取血清骨代谢标志物基于生物学变异的TEa质量指标;以国家卫生健康委临床检验中心2021年第2次EQA反馈报告[5],获取室间可比性验证的TEa质量标准,将可比性验证结果用此两种来源质量指标做符合要求率判断。
1.4 统计学分析 采用MedCalc 19.1软件进行分析,计数资料以率表示,组间率的比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 血清骨代谢标志物检测项目基于两种来源TEa质量规范 见表1。
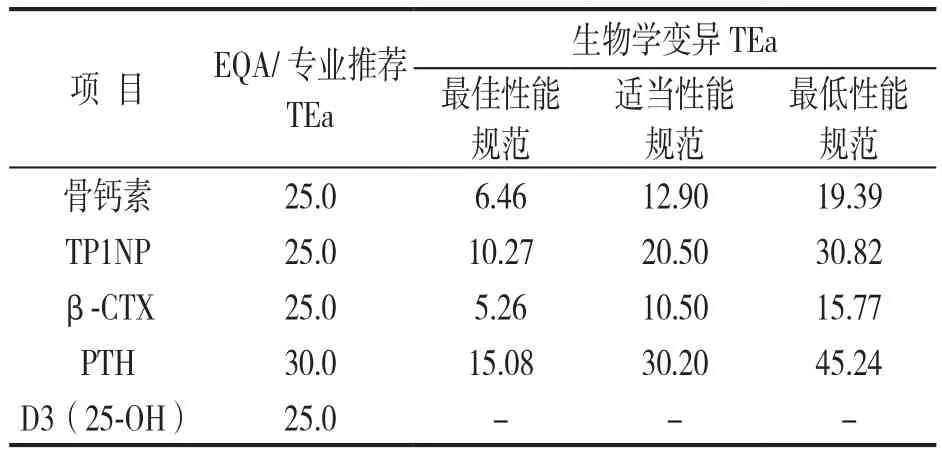
表1 血清骨代谢标志物两种来源TEa质量规范(%)
2.2 试剂更换批次可比性验证结果 见表2。CNAS-CL02-A003 医学实验室质量和能力认可准则在临床化学检验领域的应用说明规范性附录A.5[6]要求:样本数n≥5,覆盖测量范围,至少4份样品测量结果的偏差<1/3TEa。当以EQA允许总误差为质量标准时,血清骨代谢标志物5个检测项目可接受标准基本一致,为<8.33%,<8.33%,<8.33%,<10.0%,<8.33%,此时验证结果符合要求率为80%~100%,一致性验证通过;而基于生物学变异TEa的判断标准分为3级:即最佳性能标准、适当(期望)性能标准和最低性能标准,5个项目可接受标准差异较大。当以最低质量标准作判断时,比对符合要求率为80%~100%,此时两种来源判断标准结果符合要求率的差异无统计学意义(χ2≥1.000, 均P> 0.05),一致性验证是通过的;当以适当质量标准作判断时,则β-CTX和骨钙素比对符合要求率分别为20%和40%,此时两种来源判断标准符合要求率的差异有统计学意义(χ2=0.048, 0.246,P=0.024, 0.046, 均P<0.05),一致性验证不可接受。

表2 血清骨代谢标志物试剂更换批次验证结果相对偏倚、基于两种来源TEa判断标准结果比较
2.3 室间可比性验证结果 见表3。CNASCL02-A003医学实验室质量和能力认可准则在临床化学检验领域的应用说明5.6.3.2替代方案[6]要求:样品数至少5份,包括正常和异常水平;判定标准为应有≥80%的结果符合要求。同样的情况,当以基于EQA/专业推荐的TEa为标准作判定时,5个项目可接受标准基本一致,为<25.0%,<25.0%,<25.0%,<30.0%,<25.0%,此时验证结果符合要求率均为100%,可比性验证是通过的。以生物学变异最低质量标准作判断时,室间比对符合要求率均为100%,两种来源质量标准结果符合要求率的差异无统计学意义(χ2≥1.000, 均P> 0.05),可比性验证是通过的。当以适当质量标准作判断时,室间比对β-CTX和骨钙素比对符合要求率分别为60%和80%,两种来源质量标准符合要求率的差异无统计学意义(χ2=0.444,1.000,P=0.222,0.500,均P> 0.05),但符合率60%的β-CTX可比性验证不能通过。
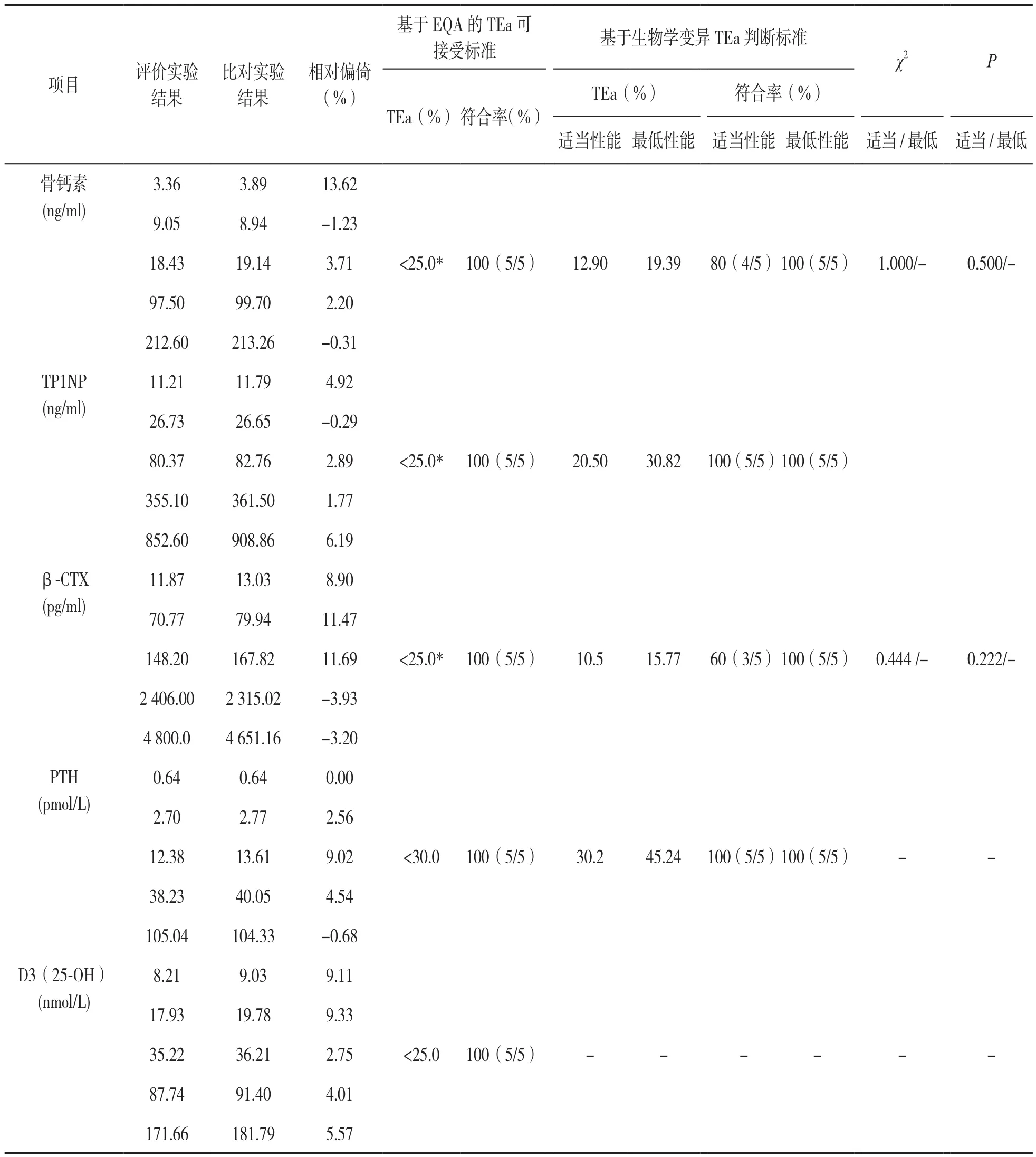
表3 血清骨代谢标志物室间可比性验证结果相对偏倚、基于两种来源TEa判断标准结果比较
3 讨论
临床检验是分析领域中影响因素最多的一种测量,每一个检测系统都存在着使用过程固有的变异来源,下列情况可能会改变一个检测系统的偏倚:校准物批号的改变,试剂批号以及其他耗材批号的改变,仪器部件更换或故障维护等。根据《医疗机构临床实验室管理办法》和ISO 15189的要求,用于检测临床样本的每个检测系统都应进行可比性验证。目前尚没有评价可比性检验结果的通用可接受的质量标准,大多数实验室通常以国家卫生健康委临床检验中心EQA的允许总误差为质量标准。血清骨代谢标志物定量检测项目如骨钙素、P1NP,β-CTX,PTH,D3(25-OH)的允许总误差(TEa)没有行业标准和地方法规可供使用,尤其骨钙素、P1NP,β-CTX目前尚没有开展PT/EQA,其允许总误差只是参考应用已发表的专业推荐:如Tonks提出实验的允许误差应不能大于1/4的正常范围,以此来判断实验室在中、长期的时间内同一个人的样品检测结果是否有一致性和可比性。PTH和D3(25-OH)国家卫生健康委能力验证允许总误差分别为±30%,±25%,本实验室既往长期应用此允许总误差评价检测系统分析性能。骨钙素、P1NP,β-CTX本实验室参考应用已发表的专业推荐均为±25%。结果间差异不超过规定的可接受标准时,可认为结果具有可比性。
可比性验证的可接受标准应满足临床需要,同时应考虑检测系统的性能状况,系统性能无法满足规定的比对标准,可比性验证将会经常失败。因此,在临床实际工作中,选择何种TEa尤为重要,国家卫生健康委临床检验中心允许TEa(国标)来源于1988年美国临床实验室改进修正法案(CLIA’88),年代比较久远,是完全根据经验,是基于可达到标准而不是适当的标准,质量评价标准比较宽松[7]。基于生物学变异的质量规范,其有三种质量规范模式可供选择,它能满足以下这些标准[8]:①根据医学要求;②可用于所有的实验室,而不考虑实验室的大小、类型或场所;③适用、简单,易于理解的模式产生;④受到该领域的专业人员信服并广泛地被接受。目前可获得大约300多个分析项目的个体内和个体间生物学变异及其精密度、偏移和总误差目标的数据库信息。本次收集的实验结果以基于EQA或专家推荐的TEa为质量标准时,血清骨代谢标志物试剂更换批号、室间比对的符合要求率均为100%,比对全部通过;以基于生物学变异TEa的最低质量标准判断,试剂更换批号、室间比对符合要求率80%~100% ,比对全部通过;而以基于生物学变异TEa适当质量标准判断时,则5个项目符合要求率为20%~100%,β-CTX、骨钙素试剂更换批号比对符合要求率分别为20%和40%,比对不能通过,室间比对的符合要求率60%~100%,β-CTX比对不能通过。
国标WS/T407-2012[9]文件对实验室可比性验证的时机和方法给出指南说明。CNAS-CL02-A003[9]条款对实验室可比性验证分析性能做出具体要求。本实验室通过www.westgard.com/guest17.htm或王治国主编《临床检验生物学变异与参考区间》附录2获取血清骨代谢标志物基于生物学变异的TEa质量指标与基于EQA的TEa质量指标作比较,从表3可以看出,以基于EQA的TEa为判断标准和以基于生物学变异的最低TEa质量标准判断,5个检测项目可比性验证比对符合要求率100%;但是以基于生物学变异的适当的和最佳的TEa质量标准判断,则β-CTX比对符合率分别为60%和40%,比对不能通过。从5个检测项目不定期比对(试剂更换批号比对)结果比较表2可以看出,以基于室间质评1/3TEa为质量标准判断,骨代谢标志物此次评估的5个检测项目,在试剂更换批号时均比对合格,系统一致性良好,无需改进现有的试验条件。但是,以基于生物学变异的适当TEa质量标准判断,则骨钙素、β-CTX均不能通过一致性验证,新批号试剂的启用有待重新评价。我们认为造成批间差的因素主要涉及:试剂运输、储存是否规范,试剂装载过程是否规范,校准品是否在有效期,运输储存、取用过程是否规范等等。实际工作中应认真检查以上因素,重新做比对,如果依然不能满足适当TEa的质量标准,则可以用最低的TEa质量标准判断。但在解释患者测定结果时应考虑试剂批号更换和校准品因素引入的偏差。
血清骨代谢标志物检测主要用于各种类型骨质疏松、骨软化症的诊断和治疗观察。血清骨钙素、P1NP是反映骨形成的指标,血中骨钙素浓度不仅可以直接反映成骨细胞活性和骨形成情况,而且对观察药物治疗前后的动态变化有一定的参考价值。β-CTX是反映骨吸收的指标,血清β-CTX水平是破骨细胞性胶原降解的灵敏指标,可评估检测骨质疏松或其他骨骼疾病抗骨吸收治疗的有效性。人体PTH,D3(25-OH),降钙素等参与血液中钙、磷、镁的调节,共同协调成骨细胞和破骨细胞的功能,进而影响骨的形成和溶解。当检测结果用于诊断、发现、初筛病例时,偏倚是影响诊断的关键因素。当用于监测和评估治疗时对结果的可比性要求更高。骨代谢类疾病起病隐匿、就诊率低。检测标本量较少,造成试剂在机时间长,试剂和校准品开盖后分装保存时间长。患者不同时段的标本随机在实验室测定,出现大于允许误差要求的实验结果势必给诊断和疗效观察带来困惑和影响。基于生物学变异的质量规范有助于更好地掌握实验检测系统状态和对诊断、治疗的影响。需要指出的是基于生物学变异质量指标评价可比性的方法没有基于临床结果,不能获得所有分析物的参数,如血清D3(25-OH)目前尚没有生物学变异数据和基于此的TEa质量标准。需要实验室根据临床需要制定自己的质量要求,制定的质量要求应不低于国家标准。
综上所述,推荐实验室首选基于生物学变异来源的TEa,判断不同检测系统、不同检测环境相同检测项目的可比性,我们建议以基于生物学变异的适当的TEa质量指标作为骨代谢标志物可比性验证的可接受标准,最低的TEa质量指标作为改进指标,最佳的TEa质量指标作为目标指标,不断优化和改进检测系统性能,提高检验人员的操作水平和医疗机构诊疗水平,节约医疗资源,更好地为患者服务。

