野生灵芝分离鉴定、生物学特性及活性成分分析
雷 萍,张文隽,郝 哲,马婧嘉,梁海燕,李雅茹,吴亚召
(1.陕西省微生物研究所,西安 710043;2.榆林市农垦服务中心,陕西榆林 719000)
灵芝(Ganodermalucidum)隶属担子菌门(Basidiomycota)伞菌纲(Agaricomycetes)多孔菌目(Polyporales)灵芝科(Ganodermataceae)灵芝属(Ganoderma),别称赤芝、红芝、木灵芝、万年蕈、灵芝草等[1],是一类珍贵的药用大型真菌。在中国已有2000多年的记载和应用历史[2],据《神农本草经》记载:灵芝主治胸中结、益心气、增智慧、不忘、延年[3]。现代研究表明灵芝含有多糖、三萜类、甾醇类、黄酮类、酚类、氨基酸类、糖苷类等活性成分[4-5],其具有抗肿瘤、抗衰老、抗氧化、保肝护肝、降血糖血脂、治疗慢性肾病等显著的药理功效[6-13],已被开发成多种药品和保健品,成为现代医学研究的热点。
目前,中国已发现灵芝科4个属种质资源103种,占世界已知灵芝科种类的88%[14]。但现阶段中国人工栽培的灵芝菌株基本引自韩国和日本等地,存在菌种活性退化、产量低、品质差、抗杂抗病能力不强等问题,适宜中国各产地栽培、具有自主知识产权的优良品种缺乏[15]。同时野生灵芝形态特征常受外部环境影响而发生变化,不同灵芝科的不同种经常共有许多鉴别性特征,仅利用传统的形态学鉴定较为困难,有必要利用分子生物学技术鉴定其种属。本研究对采自陕西省安康市平利县山区的一株野生灵芝进行ITS序列分析鉴定,并系统研究其适合生长的培养条件,分析比较人工栽培子实体主要活性成分,以期为野生灵芝种质资源的科学开发利用提供理论基础。
1 材料与方法
1.1 材 料
1.1.1 供试菌株 2020-06-28于陕西省安康市平利县山区一棵枯树桩基部采集野生灵芝子实体,组织分离获得纯菌丝,编号为灵芝-LG;对照菌株灵芝SW01和泰山灵芝为陕西省微生物研究所微生物技术研究中心保藏菌种。
1.1.2 培养基 PDA培养基:马铃薯(去皮、浸汁)200 g,葡萄糖20 g,琼脂粉20 g,蒸馏水1 000 mL,pH自然;基础培养基:葡萄糖20 g,蛋白胨5 g,磷酸二氢钾1 g,硫酸镁0.5 g,维生素B110 mg,琼脂粉20 g,蒸馏水1 000 mL,pH自然;栽培培养基:木屑44%,棉籽壳44%,麸皮5%,玉米粉5%,蔗糖1%,石膏1%,料水比1∶1.2。
1.2 基于ITS序列分析的生物学鉴定
1.2.1 基因组DNA提取 取0.5 g菌丝体置于研钵,加入液氮充分研磨,将样品粉末移入盛有CTAB的小管55~65 ℃孵育1 h,放置室温后加入等体积氯仿/异戊醇抽提,12 000 r/min、室温离心10 min取上清液,加入1倍体积NaAC和异丙醇沉淀DNA,12 000 r/min、4 ℃离心20 min弃上清液,70%乙醇洗涤沉淀2次,干燥后加入TE缓冲液溶解,以0.8%琼脂糖凝胶电泳检测DNA质量和浓度。
1.2.2 ITS序列扩增及检测 采用通用引物ITS4(5′-TCCTCCGCTTATTGATATGC-3′)和ITS5(5′-GGAAGTAAAAGTCGTAACAAGG-3′)进行rDNA ITS区段的PCR扩增[16]。扩增条件:94 ℃预变性4 min,94 ℃变性60 s,56 ℃退火40 s,72 ℃延伸40 s,30个循环;72 ℃反应10 min,10 ℃终止。用1.0%的琼脂糖凝胶电泳对PCR产物进行电泳检测。
1.2.3 rDNA ITS序列克隆与测序 扩增产物经1.5%琼脂糖凝胶电泳分离,以PCR纯化试剂盒回收后连接入pEASY○R-T1载体,使用TOP10转化连接产物,培养1 h后涂平板培养,随机挑选阳性克隆送至北京天一辉远生物公司进行序列 测定。
1.2.4 分子鉴定与系统发育分析 对所得ITS序列进行校正,在GenBank核酸序列数据库中进行同源性比较搜索(BLASTn)。根据搜索结果下载与之相关的序列,以ClustalX(1.83)进行序列比对,采用MEGA 7.0进行系统学分析,构建系统发育树。
1.3 生物学特性试验
1.3.1 碳源选择试验 按照基础培养基,分别以葡萄糖、蔗糖、甘露醇、乳糖、D-麦芽糖、可溶性淀粉、玉米粉各20 g/L作为碳源,以不加碳源作为对照。采用直径80 mm的培养皿,每个培养皿分别加入20 mL培养基,制备好平板培养基后于中央接种一块直径0.5 cm的菌种块,26 ℃恒温培养,每个处理6次重复,观察记录菌丝生长情况。
1.3.2 氮源选择试验 按照基础培养基,分别以蛋白胨、酵母膏、硝酸钾、硫酸铵、硝酸铵、尿素、麸皮各5 g/L作为氮源,以不加氮源作为对照。方法同上。
1.3.3 无机盐选择试验 按照基础培养基,分别以磷酸二氢钾、硫酸镁、氯化钠、氯化钾、氯化钙、硫酸钠各1 g/L作为无机盐,以不加无机盐作为对照。方法同上。
1.3.4 初始pH选择试验 配制PDA培养基,以浓度1 mol/L HCl和1 mol/L NaOH调节初始pH分别为:5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5和9.0。方法同上。
1.3.5 温度选择试验 以PDA培养基制备平板,采用直径80 mm的培养皿,每个培养皿分别加入20 mL培养基,制备好平板培养基后于中央接种一块直径0.5 cm的菌种块,分别于18 ℃、 20 ℃、22 ℃、24 ℃、26 ℃、28 ℃、30 ℃、32 ℃和 34 ℃条件下恒温培养,每个处理6次重复,观察记录菌丝生长情况。
1.3.6 正交优化试验 在单因素筛选的基础上,选择最佳碳源(葡萄糖∶蔗糖=1∶1)、氮源、无机盐及初始pH进行四因素三水平正交试验,试验因素及其各水平见表1。
1.3.7 测定方法 待菌丝萌发2 d后,采用十字交叉法测量菌落直径,继续培养5 d再测量一次并计算菌丝生长速度。计算公式如下:
菌丝生长速度(mm/d)=菌落半径增长度(mm)/菌丝生长时间(d)
1.4 活性成分分析
1.4.1 样品制备 按照栽培培养基制备栽培袋,分别接入待测菌种和对照菌种,菌丝满袋成熟后常规管理方法出芝,待子实体成熟采收。于65 ℃鼓风干燥箱中烘干至恒质量,粉碎,过孔径为 0.25 mm(60目)筛网,收集粉末密封保存,备用。

表1 L9(34)正交试验的因素及水平Table 1 Factors and its levels in L9(34) orthogonal test
1.4.2 多糖含量测定 准确称取样品0.5 g于250 mL具塞锥形瓶中,加入15 mL蒸馏水,95 ℃水浴提取2 h,过滤,滤液置50 mL容量瓶,滤渣重复提取1次,过滤,合并两次滤液于同一容量瓶中,加入蒸馏水定容至刻度,摇匀,即得水提液。吸取5 mL水提液加入95%乙醇20 mL,4 ℃醇沉24 h,离心,沉淀用蒸馏水定容至10 mL,摇匀,即得供试品溶液。以葡萄糖为标准品,采用蒽酮-硫酸法测定多糖含量[17]。
1.4.3 三萜含量测定 参考《中国药典》2020年版灵芝三萜含量测定方法[18]。准确称取样品2.0 g于250 mL具塞锥形瓶中,加入90%乙醇50 mL,超声处理(功率140 W,频率42 kHz)45 min,过滤,滤液置100 mL容量瓶,90%乙醇分次洗涤滤器和滤渣,洗液并入同一容量瓶中,加入90%乙醇定容至刻度,摇匀,即得供试品溶液。以齐墩果酸为标准品,采用香草醛-冰醋酸法测定三萜含量。
1.4.4 蛋白质含量测定 准确称取样品0.25 g放入凯氏定氮瓶中,同时加入6 g硫酸钾和0.4 g硫酸铜,然后加入10 mL浓硫酸,充分摇匀。采用微量凯氏定氮法测定蛋白质含量[19]。
1.5 数据分析
采用ClustalX(1.83)和MEGA 7.0软件,对待测菌株和与之相关的ITS序列进行系统发育分析;采用SPSS 17.0数据处理系统,对相关试验数据进行差异显著性分析。
2 结果与分析
2.1 基于ITS序列的系统发育分析
通过ITS序列检测分析,确定灵芝-LG菌株的ITS片段序列长度为635 bp;通过GenBank数据库同源性比对,结果表明灵芝-LG与Ganodermalucidum(GenBank号EU021456.1)序列同源性为100%;下载与之相关的灵芝属菌株ITS序列,利用MEGA 7.0构建系统发育树,由图1可以看出,灵芝-LG与Ganodermalucidum以100%支持率聚在一起,系统发育树结果与同源性比对结果表现出较高的一致性,进一步说明系统进化树的可靠性。因此,可以确定该野生菌株灵芝-LG为赤芝[Ganodermalucidum(Curtis) P.Karst.]。

图1 基于rDNA ITS序列的系统发育树Fig.1 Phylogenetic tree based on rDNA ITS sequence
2.2 菌丝生物学特性
2.2.1 碳源对灵芝-LG菌丝生长的影响 试验考察不同碳源对灵芝-LG菌丝生长的影响,结果如表2所示,灵芝-LG菌丝在7种培养基上均能生长,且优于空白对照。其中以玉米粉为碳源时菌丝生长速度最快(7.69 mm/d),但菌丝生长势较差,菌丝白色、较纤弱无力、较稀疏、边缘较整齐;当以葡萄糖、蔗糖为碳源时,菌丝生长速度次于前者,分别为5.59 mm/d和5.56 mm/d,两者之间差异不显著,且菌丝生长势均较好;以乳糖作为碳源时,菌丝生长速度最慢(2.95 mm/d),菌丝生长势也较差,菌丝白色、较纤弱无力、较稀疏、边缘较整齐。因此,综合考察菌丝生长速度和生长势,灵芝-LG菌丝生长最适碳源为葡萄糖和蔗糖。
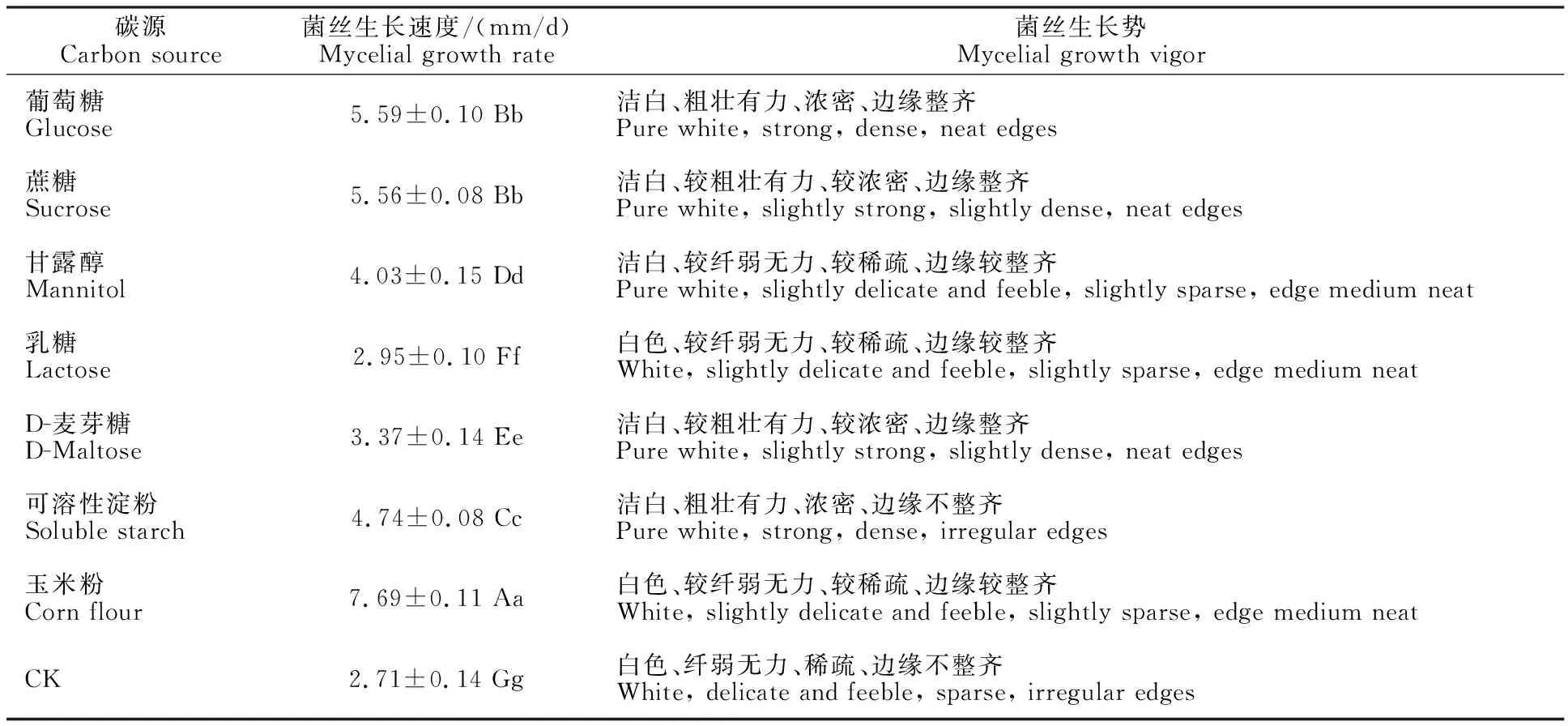
表2 碳源对灵芝-LG菌丝生长的影响Table 2 Effect of carbon source on mycelia growth of G.lucidum-LG
2.2.2 氮源对灵芝-LG菌丝生长的影响 试验考察不同氮源对灵芝-LG菌丝生长的影响,结果如表3所示,从表中可以看出灵芝-LG在7种培养基上均能生长,不添加任何氮源则菌丝几乎不生长,各组之间差异显著。其中,以酵母膏为氮源时菌丝生长速度最快(7.30 mm/d),菌丝生长势好,洁白、粗壮有力、浓密、边缘整齐;以麸皮为氮源时菌丝生长速度次之(7.01>mm/d),但菌丝生长势差,菌丝白色、纤弱无力、稀疏、边缘较整齐;以硝酸铵为氮源时菌丝生长速度最差(2.91 mm/d),菌丝白色、较纤弱无力、较稀疏、边缘不整齐。因此,综合考察菌丝生长速度和生长势,灵芝-LG菌丝生长最适氮源为酵母膏。
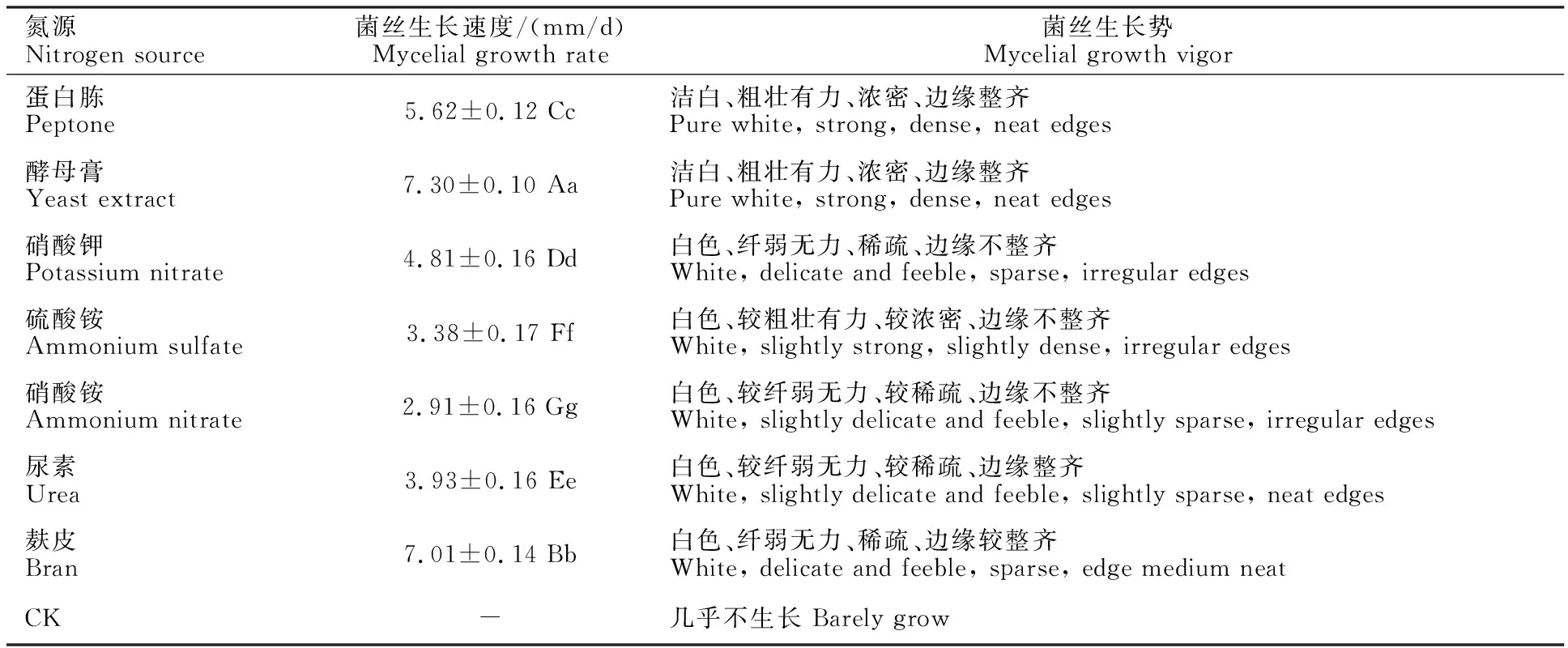
表3 氮源对灵芝-LG菌丝生长的影响Table 3 Effect of nitrogen source on mycelia growth of G.lucidum-LG
2.2.3 无机盐对灵芝-LG菌丝生长的影响 考察不同无机盐对灵芝-LG菌丝生长的影响,结果如表4所示,从表中可以看出灵芝-LG在6种无机盐培养基上均能生长,且不添加任何无机盐时菌丝仍然可以正常生长,各组之间差异显著。其中,以磷酸二氢钾为无机盐时菌丝生长速度最快(5.43 mm/d),菌丝生长势好,洁白、粗壮有力、浓密、边缘整齐;以硫酸镁为无机盐时菌丝生长速度次之(5.04 mm/d),菌丝生长势也好;以氯化钠、氯化钾、氯化钙、硫酸钠为无机盐时,菌丝生长速度均较不添加任何无机盐时还差,其中以氯化钾效果最差,菌丝生长速度2.74 mm/d,菌丝生长势也较差,菌丝洁白、较纤弱无力、较稀疏、边缘较整齐。因此,综合考察菌丝生长速度和生长势,灵芝-LG菌丝生长最适无机盐为磷酸二氢钾。
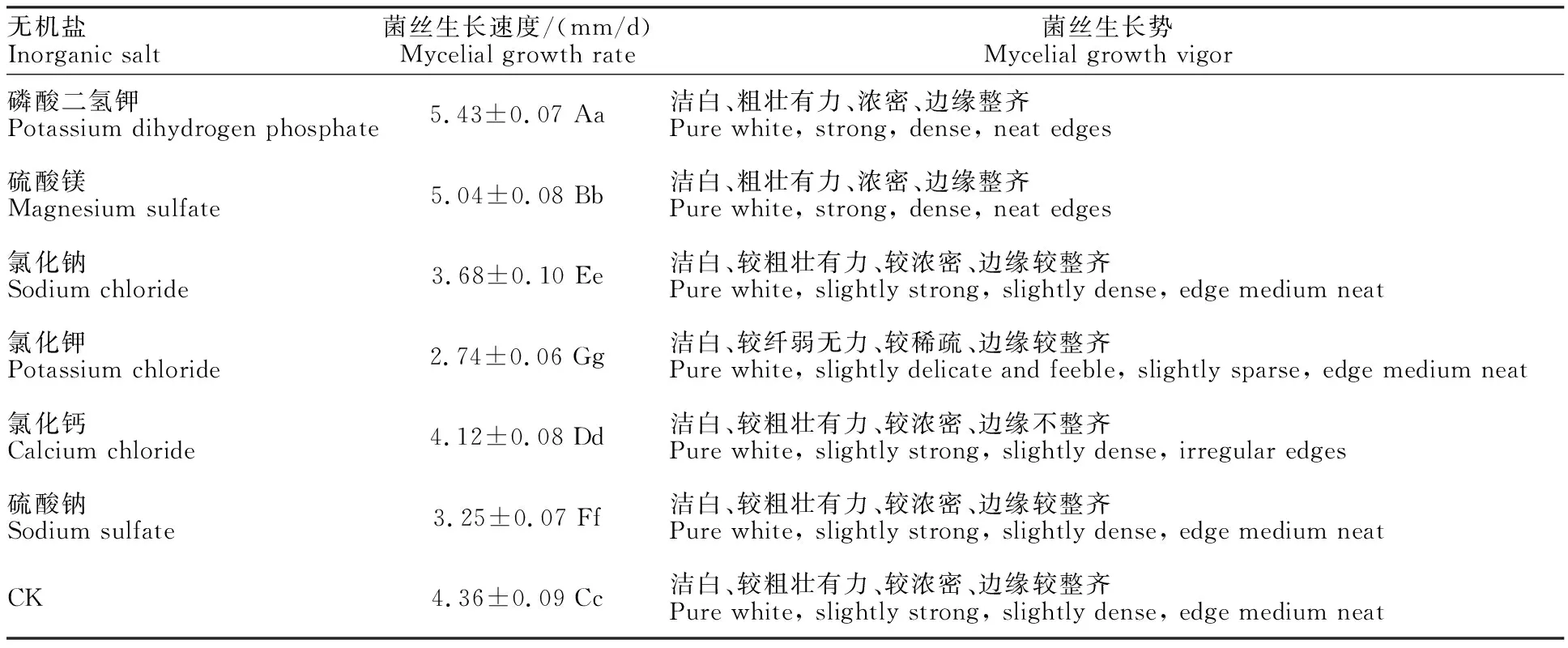
表4 无机盐对灵芝-LG菌丝生长的影响Table 4 Effect of inorganic salts on mycelia growth of G.lucidum-LG
2.2.4 初始pH对灵芝-LG菌丝生长的影响 考察培养基不同初始pH对灵芝-LG菌丝生长的影响,结果如表5所示。灵芝-LG在初始pH 5.0~9.0之间均能生长,其中初始pH为7.0时菌丝生长速度最快(6.32 mm/d),菌丝生长势好,洁白、粗壮有力、浓密、边缘整齐;初始pH为7.5时菌丝生长速度次之 (6.01 mm/d),菌丝生长势较好,洁白、较粗壮有力、较浓密、边缘较整齐;当初始pH为5.5和5.0时,菌丝生长速度均最差,两者之间差异不显著,但初始pH 5.0的菌丝生长势更差,菌丝洁白、较纤弱无力、较稀疏、边缘较整齐。因此,综合考察菌丝生长速度和生长势,灵芝-LG菌丝生长最适初始pH为7.0。
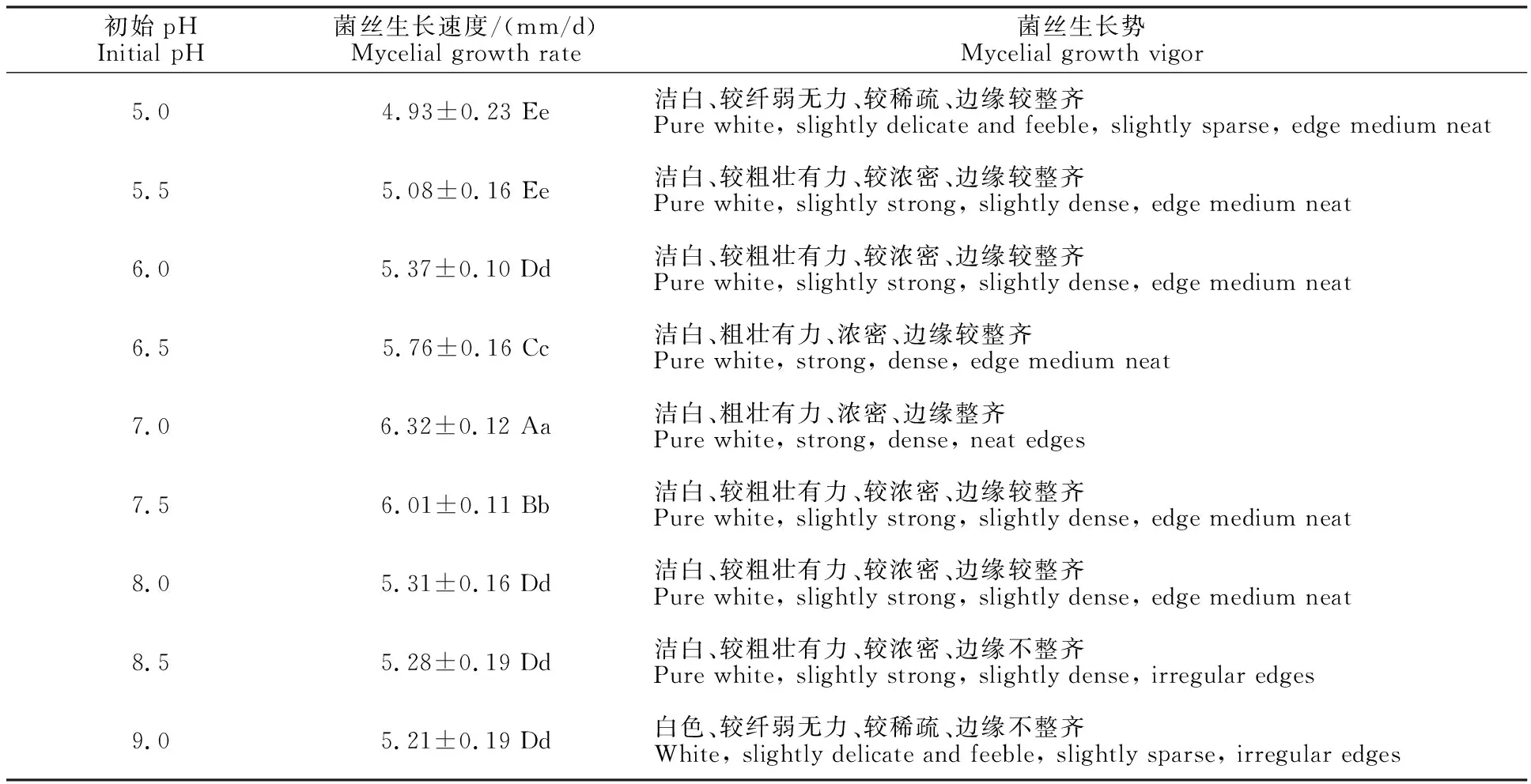
表5 初始pH对灵芝-LG菌丝生长的影响Table 5 Effect of initial pH on mycelia growth of G.lucidum-LG
2.2.5 温度对灵芝-LG菌丝生长的影响 考察不同培养温度对灵芝-LG菌丝生长的影响,结果如表6所示。灵芝-LG菌丝在温度18~34 ℃之间均能生长,其中26 ℃、 28 ℃条件下菌丝生长速度均最快,两者之间无显著差异,分别为5.23 mm/d和5.17 mm/d,菌丝生长势均较佳;培养温度为30 ℃时菌丝生长速度次之(3.12 mm/d),但菌丝生长势较弱,24 ℃菌丝生长速度较前者稍慢(2.75 mm/d),但菌丝生长势较好;18 ℃时菌丝生长速度与生长势均最差。因此,综合考察菌丝生长速度和生长势,灵芝-LG菌丝生长适宜温度为26~28 ℃。
2.2.6 正交试验优化结果与直观分析 根据单因素筛选试验结果,选取最佳碳源、氮源、无机盐及初始pH进行四因素三水平正交试验,结果见表7。由表中可以看出,4个因素碳源、氮源、无机盐和初始pH的极差R分别为2.19、1.23、0.89和0.92,所以影响灵芝-LG菌丝生长的因素依次为A(碳源)>B(氮源)>D(初始pH)>C(无机盐);其中,碳源均值由大至小依次为X3>X2>X1,氮源为X2>X1>X3,无机盐为X2>X1>X3,初始pH为X1>X3>X2,可以得出最佳因子组合为A3B2C2D1,即灵芝-LG的最佳培养条件为葡萄糖15 g/L、蔗糖15 g/L、酵母膏5 g/L、磷酸二氢钾1 g/L、初始pH 6.5。
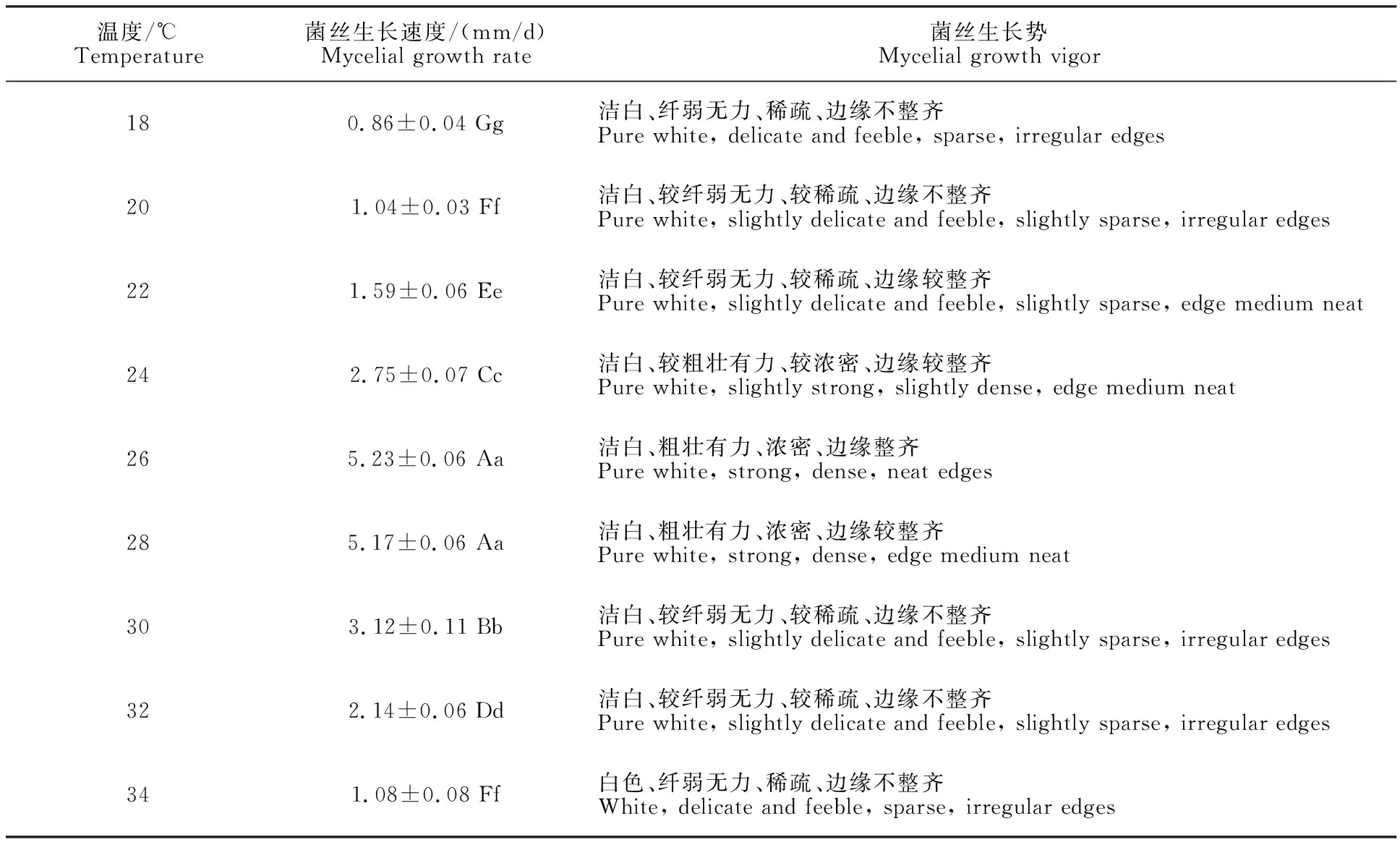
表6 温度对灵芝-LG菌丝生长的影响Table 6 Effect of temperature on mycelia growth of G.lucidum-LG
2.3 主要活性成分
考察试验菌株灵芝-LG与对照菌株灵芝SW01、泰山灵芝人工栽培子实体主要活性成分含量,结果见表8。同等培养条件下,灵芝-LG的多糖含量最高(1.42%),泰山灵芝次之,灵芝SW01最差,三者之间差异显著;灵芝-LG的三萜含量也最高(3.05%),灵芝SW01和泰山灵芝次之,前者与后两者之间差异显著,后两者之间无显著差异;灵芝-LG的蛋白质含量为17.74%,稍低于对照菌株灵芝SW01(18.43%),泰山灵芝最差,三者之间差异显著。综合考察3种主要活性成分多糖、三萜和蛋白质的总含量,灵芝-LG明显高于2个对照菌株灵芝SW01和泰山灵芝,为一株活性成分含量较高的栽培品种。
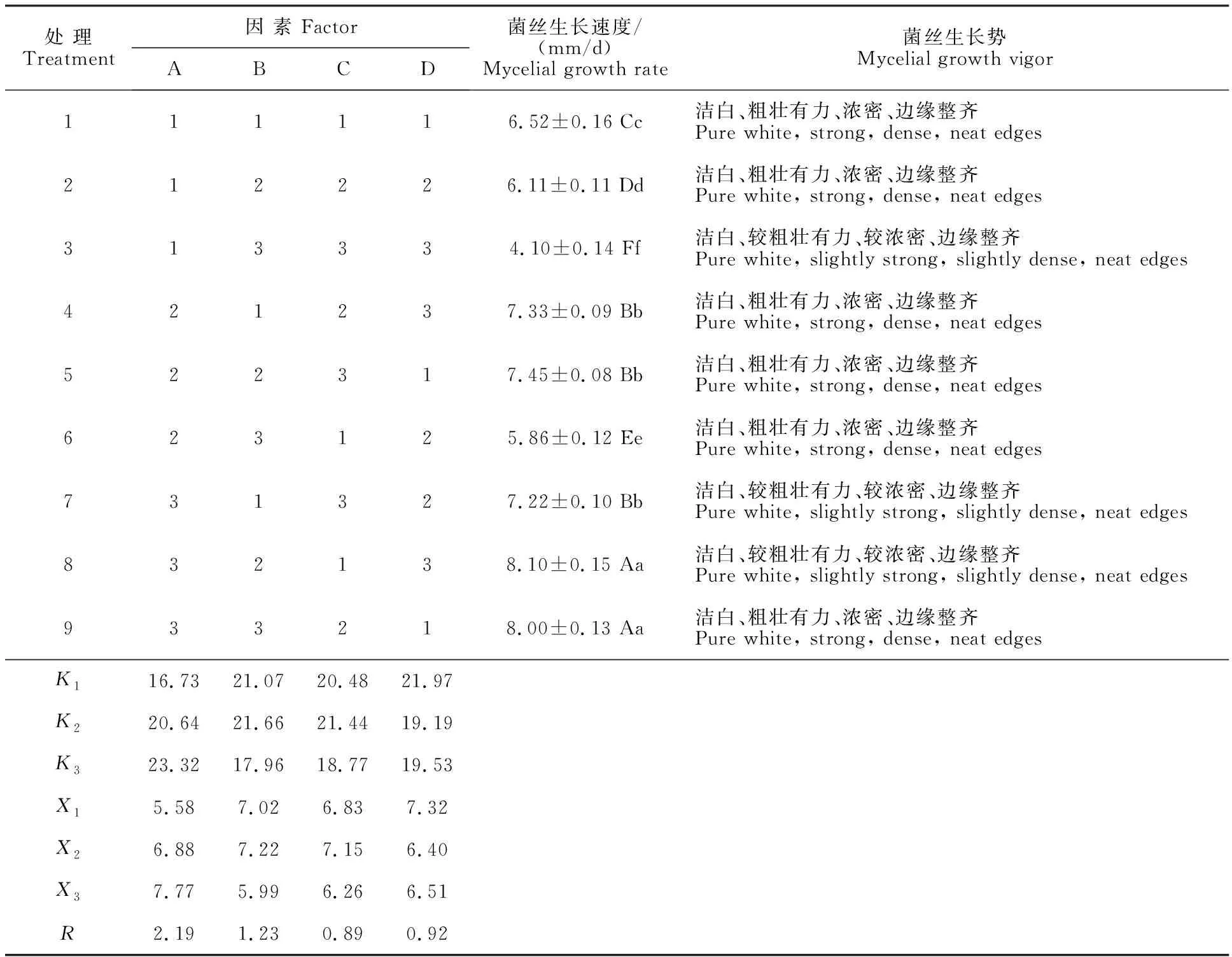
表7 L9(34)正交试验结果直观分析表Table 7 Intuitive analysis table for result of L9(34) orthogonal test

表8 不同灵芝活性成分含量比较Table 8 Comparison of active components of different kinds of G.lucidum
3 讨 论
灵芝是一类具有重要经济价值的药用真菌,在我国应用历史悠久,目前文献记载可栽培或有利用价值的灵芝属种类大约有17种。灵芝属传统分类方法以子实体的外部特征、形态结构解剖及担孢子的特征为主,易受环境因素影响,无法客观的区别各菌株间的类源关系,分子生物学鉴定手段具有客观性、稳定性、准确性,是传统分类手段的重要补充[20]。本研究采用ITS序列分析技术对灵芝-LG菌株的ITS序列进行同源性比对和系统发育树构建,确定采集自陕西省安康市平利县山区的野生菌株灵芝-LG为赤芝[Ganodermalucidum(Curtis) P.Karst.],明确了该野生菌株的分类学地位。
菌丝生长速度和长势是优质菌株选择的重要指标之一[21]。本研究通过单因素试验,确定了野生菌株灵芝-LG菌丝生长最适碳源为葡萄糖和蔗糖,最适氮源为酵母膏,最适无机盐为磷酸二氢钾,最适初始pH为7.0,适宜培养温度为26~ 28 ℃;进一步正交优化得到最佳培养条件:葡萄糖15 g/L,蔗糖15 g/L,酵母膏5 g/L,磷酸二氢钾1 g/L,初始pH 6.5。与其他研究结果对比发现不同种类的灵芝培养条件有一定差异,马博等[22]报道有柄灵芝最适碳源为果糖或葡萄糖,氮源为酵母提取物,温度为30 ℃,pH 5.5;陈旭等[23]报道鹿角灵芝优质碳氮源分别为可溶性淀粉、蛋白胨,最佳培养条件为初始pH 6.0和 30 ℃;兰玉菲等[24]报道灵芝、树舌灵芝和紫芝的最适碳源分别为蔗糖、葡萄糖和麦芽糖,最适氮源均为酵母膏,灵芝菌丝最适培养温度为25 ℃,树舌灵芝和紫芝为25~30 ℃。不同灵芝菌株菌丝培养条件之所以存在差异,可能和菌株所在生境长期驯化有关。因此,只有研究明确野生菌株的生物学特性,才有利于进一步研究应用。
中国野生灵芝种质资源丰富,但由于其不合理的开发利用,近年来成功商业栽培的灵芝种类有限,部分菌种出现菌种退化现象,有必要选择性能优良的野生菌株进行进一步驯化栽培,开发活性物质高的栽培品种[25]。本研究中同等培养条件下,灵芝-LG人工栽培子实体多糖、三萜含量分别为1.42%和3.05%,明显高于对照菌株;蛋白质含量为17.74%,虽稍低于对照菌株灵芝SW01,但3种主要活性成分多糖、三萜和蛋白质的总含量明显高于2株对照菌株灵芝SW01和泰山灵芝。综上所述,野生菌株灵芝-LG为一株活性成分含量较高的栽培品种,可进一步系统研究其栽培特性和药理功效,以期通过科学的栽培管理更好的提高活性成分含量,并充分开发利用其药用价值。
——化工原料、农副产品

