福建省猪源多黏菌素耐药基因mcr-1阳性细菌的耐药特性及分布特征
车勇良,陈秋勇,陈如敬,吴学敏,王隆柏,刘玉涛,周伦江
(福建省农业科学院 畜牧兽医研究所/福建省畜禽疫病防治工程技术研究中心,福建福州 350013)
由于抗生素的滥用,细菌对抗生素的耐药性日趋严重,尤其是多重耐药细菌或“超级”细菌的产生,导致临床上无药可用,给全世界的公共卫生安全带来严峻挑战[1-2]。耐药性病原菌引起的感染性疾病的发生率和死亡率大大增加,给人类和动物的健康造成了巨大威胁[3]。多黏菌素是一种阳离子多肽,临床上主要包括多黏菌素B和多黏菌素E,其因对机体有一定的肾毒性,导致在临床上的使用受限,以前仅用于肠道感染严重的病例。然而近年来,多黏菌素作为治疗病原菌感染的最后一道防线,常用于治疗一些多重耐药、尤其是感染产碳青霉烯酶菌株的患者。多黏菌素的使用已有几十年的历史,但由于其未曾广泛用于临床,因此有关其耐药性问题仅有一些零星报道。近几年,由于多重耐药菌株的增多,多黏菌素的使用也随之增加,有关其耐药情况的报道亦随之增多[4-7]。据报道,细菌对多黏菌素耐药的主要机制是,细菌染色体编码的二元调控系统pmrAB和phoPQ的突变以及相关调控基因mgrB的失活导致细菌脂多糖上的脂质A被修饰,从而降低了细菌对多黏菌素的亲和力,引起耐药[8]。2015年底多黏菌素耐药基因mcr-1首次被发现[9],该基因是由质粒介导、可以在不同细菌间水平传播的耐药基因。mcr-1耐药基因一经报道,就引起了世界公共卫生领域研究者的广泛关注,但对mcr-1基因阳性菌的耐药特性和分布特征却报道甚少。因此,掌握多黏菌素耐药菌的耐药特性和分布特征,对预防和控制此类耐药菌的感染有重要意义。本研究从福建省7地市的21家猪场采集粪便样品,应用PCR方法筛选、分离和鉴定mcr-1基因阳性细菌,采用K-B琼脂药敏试验和PCR方法分析其耐药性和耐药表型,用多位点序列分型(multilocus sequence typing,MLST)方法鉴定mcr-1基因阳性大肠杆菌的类型,并用脉冲场凝胶电泳分析(pulsed field gel electrophoresis,PFGE)方法对这些大肠杆菌进行聚类分析,探明细菌间的亲缘关系,旨在为多黏菌素耐药菌的防控提供参考。
1 材料与方法
1.1 主要材料
1.1.1 粪便样本和药敏试验质控菌 2017-2021年,从福建省南平、龙岩、三明、平潭、宁德、漳州和福州等7个地市的21个猪场,用专用粪便收集管采集猪粪便样本313份;药敏试验质控菌株为大肠杆菌ATCC25922,购自中国兽医药品监察所。
1.1.2 主要试剂 TSA、TSB培养基,购自OXOID公司;绵羊血,购自郑州九龙生物科技有限公司;PCR试剂、蛋白酶K,均购自Promega公司;限制性内切酶XbaⅠ,购自宝生物(大连)有限公司;细菌基因组DNA提取试剂盒,购自北京天根科技有限公司;Gelred,购自美国Biotium公司。
1.1.3 药敏纸片 阿莫西林、链霉素、头孢噻肟、氟苯尼考、亚胺培南、林可-壮观、利奈唑胺、新霉素、多黏菌素B、磺胺甲基异恶唑、替加环素、万古霉素、强力霉素、恩诺沙星、呋喃妥因药敏纸片,均购自温州市康泰生物科技有限公司。
1.2 方 法
1.2.1mcr-1基因阳性细菌的分离与鉴定 将采集的新鲜猪粪便在24 h内低温运送至实验室,向每份粪便管中加入2 mL无菌TSB培养基,振荡器振摇2 min,用接种环挑取粪便液划线接种于体积分数10%绵羊血平板,倒置于37 ℃培养箱培养36~48 h。挑取培养后的混合菌于1.5 mL离心管(预置1 mL的无菌PBS缓冲液),振荡器振摇混匀2 min,加热煮沸5 min,12 000 r/min离心5 min,吸出上清液于新的离心管中,-20 ℃保存备用。以获得的上清液为DNA模板,采用PCR检测mcr-1基因,试验所用引物见表1。PCR反应体系为:2×PCR mix 12.5 μL,无菌水9.5 μL,上游引物(20 nmol/L) 0.5 μL,下游引物(20 nmol/L) 0.5 μL,DNA模板 2 μL。反应程序为: 94 ℃ 5 min;94 ℃ 1 min,58 ℃ 1 min,72 ℃ 1 min, 35个循环;72 ℃ 10 min,4 ℃保存。对mcr-1基因阳性的混合菌样品进行纯化筛选,获得单一mcr-1基因阳性细菌,并通过16S rRNA序列测定、同源性比较鉴定该细菌种属。将纯化后的细菌于-80 ℃冻存备用。

表1 福建猪源mcr-1基因阳性细菌耐药基因检测中所用引物的信息
1.2.2 分离细菌的药物敏感性试验 按照K-B纸片琼脂扩散方法对分离细菌进行药物敏感性试验,并根据CLSI(美国临床和实验室标准协会)第4版(VET01-A4)推荐的方法[10]进行结果判断。使用大肠杆菌ATCC25922作为质控菌株。计算耐药率(耐药菌株数占mcr-1基因阳性菌株数的比例)。
1.2.3 细菌基因组DNA的提取 复苏细菌,挑取冻存细菌接种于绵羊血琼脂平板,37 ℃培养箱培养过夜;挑取培养后的单个菌落接种于TSB液体培养基,37 ℃摇床振荡培养至菌液在260 nm处吸光度(OD260)为0.6,8 000 r/min离心5 min,弃掉上清,沉淀用PBS重悬后转移到1.5 mL离心管,8 000 r/min再次离心5 min,弃上清,应用细菌DNA提取试剂盒提取沉淀细菌的DNA。
1.2.4mcr-1基因阳性细菌耐药基因的检测 应用PCR方法对如下耐药基因进行检测:磺胺类耐药基因(dfrA1、dfrA3、dfrA5、dfrA7、dfrA12、dfrA、sul1、sul2、sul3)、喹诺酮类耐药基因(aac(6′)-Ib-cr、qepA、qnrA、qnrB、qnrC、qnrD、qnrS)、氯霉素耐药基因(cmlA、fexA、fexB、pexA、Cat1、Cat2、Cat3)、替加环素耐药基因(tet(X)1、tet(X)2)、多黏菌素耐药基因(mcr-1)、金属β-内酰胺酶耐药基因(NDM-1)、多药耐药基因(cfr)、氟苯尼考耐药基因(floR)。PCR所用引物信息见表1。
1.2.5mcr-1基因阳性大肠杆菌的MLST分型试验 参照MLST数据库[11]确定分离细菌ST、反应体系及参数。首先选取与大肠杆菌分型相关的7个管家基因(adk、fumC、gyrB、icd、MDH、purA、recA)作为目的基因,分别进行PCR扩增与测序,各基因引物来自MLST数据库。反应体系为:TaqPCR Mix 25 μL,上游引物(10 μmol/L)1 μL,下游引物(10 μmol/L)1 μL,加双蒸水补足至50 μL。反应参数为:94 ℃ 5 min;94 ℃ 40 s,50~55 ℃ 40 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。PCR产物经琼脂糖凝胶电泳后,采用胶回收试剂盒回收目的片段,送至福州尚亚生物科技有限公司测序。
将7个不同管家基因序列提交至MLST数据库中进行检索比对,得到每种等位基因的序列号,即序列分型号(ST)。
1.2.6mcr-1基因阳性大肠杆菌的PFGE同源聚类分析 根据美国CDC大肠杆菌标准化实验室PFGE分子分型操作规程[12],先采用限制性内切酶(XbalⅠ)对细菌基因组进行酶切,然后进行脉冲场凝胶电泳(PFGE)分析,使用Gelred染液染色后成像,用BioNumerics软件包(Version 8.0,Applied Maths,Belgium)进行处理,经统一的分子质量标准(分子量标准用沙门菌H9812经过XbalⅠ酶切后的片段)标定条带位置,识别图像条带,必要时进行人工校正。每两个图像之间的相似性系数用Dice系数表示,出现不同条带即判为不同的型别。根据每两个图像之间的相似性系数,用非加权配对算术平均法(unweighted pair-group method using arithmetic averages,UPGMA)进行聚类,构建聚类树。
2 结果与分析
2.1 猪源mcr-1基因阳性细菌的分离与鉴定
福建猪源mcr-1基因阳性细菌分离鉴定结果见表2。由表2可知,从福建省南平、龙岩、三明、平潭、宁德、漳州和福州7个不同地市21个猪场的313份猪粪便中,分离鉴定得到mcr-1基因阳性的细菌共43株,分离率达到13.7%(43/313),猪场阳性率达到47.6%(10/21)。这43株菌均为肠杆菌科的细菌,其中大肠杆菌39株、肺炎克雷伯菌1株、弗格森埃希菌2株和坂崎肠杆菌1株。

表2 福建猪源mcr-1基因阳性细菌的分离与鉴定
2.2 猪源mcr-1基因阳性细菌的药敏试验
由表3可以看出,mcr-1基因阳性细菌对磺胺类抗生素(磺胺甲基异恶唑)的耐药率最高,达到了90.1%;其次是氟苯尼考、氨基糖苷类抗生素(链霉素),耐药率分别为83.7%和74.4%;再次是四环素类抗生素(强力霉素)、喹诺酮类抗生素(恩诺沙星)、β-内酰胺类抗生素(阿莫西林),耐药率分别达到了67.4%,67.4%和53.5%;对头孢噻肟、林可-壮观的耐药率分别达到了39.5%和34.9%;对碳青霉烯类抗生素(亚胺培南)、呋喃类抗生素(呋喃妥因)的耐药率分别只有11.6%和4.6%;对替加环素、利奈唑胺完全敏感。
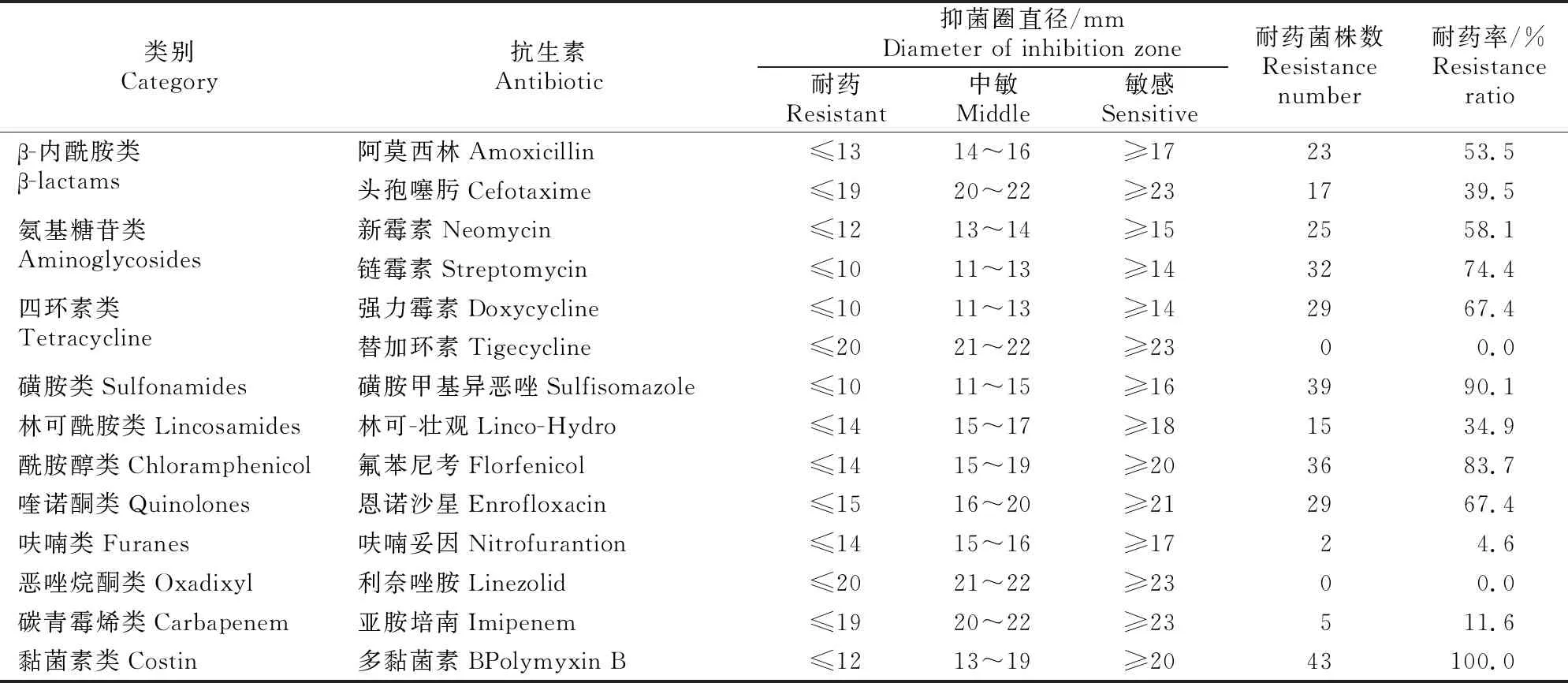
表3 福建猪源mcr-1基因阳性细菌的药敏试验结果
2.3 猪源mcr-1基因阳性细菌的耐药基因检测
福建猪源mcr-1基因阳性细菌不同耐药基因的检测结果见表4。

表4 福建猪源mcr-1基因阳性细菌不同耐药基因的检出率
由表4可知,磺胺类耐药基因sul1、sul2和sul3的检出率分别达到81.4%,90.7%和74.4%,dfrA12、dfrA7的检出率分别达到62.8%和37.2%,dfrA3和dfrA未检出。喹诺酮类耐药基因qnrS、aac(6′)-Ib-cr的检出率分别达到51.2%和30.2%,qnrA、qnrB、qnrC、qnrD、qepA未检出。氯霉素类耐药基因Cat2、cmlA和pexA的检出率分别达到86.0%,74.4%和34.9%。替加环素耐药基因未检出。氟苯尼考耐药基因floR的检出率为83.7%,金属β-内酰胺酶耐药基因NDM-1的检出率为23.2%,多药耐药基因cfr的检出率为7.0%。
2.4 猪源mcr-1基因阳性大肠杆菌的MLST分型
应用大肠杆菌的7个管家基因序列,对福建39株猪源mcr-1基因阳性大肠杆菌进行MLST分型,结果(表5)发现39株大肠杆菌中,除4株不能分型外,其他35株共分为19个ST型,其中ST10型的菌株最多,共有9株菌,ST29和ST2505各有3株菌, ST156、ST602、ST410和ST101各有2株菌,其他ST型各有1株菌。
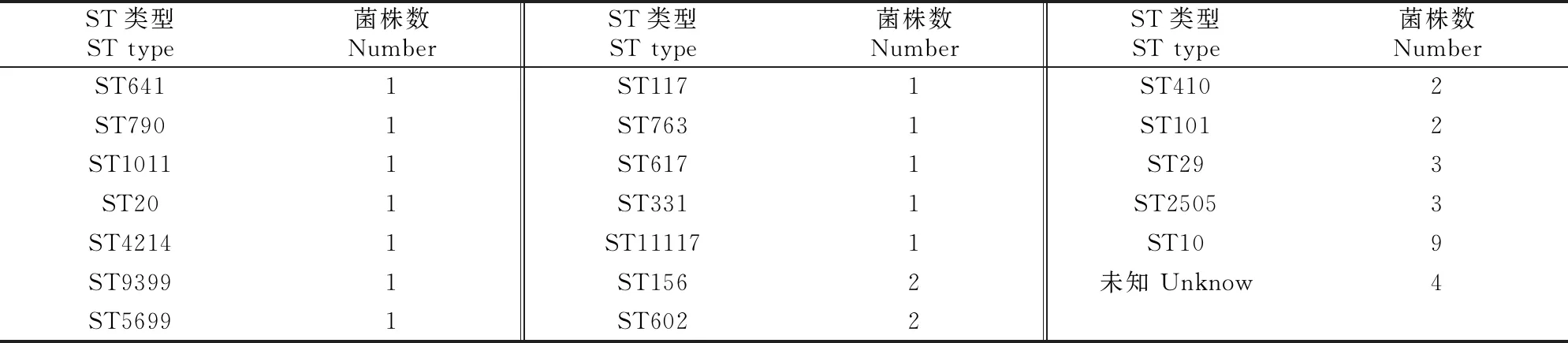
表5 福建39株猪源mcr-1基因阳性大肠杆菌的多位点序列分型(MLST)结果
2.5 猪源mcr-1基因阳性大肠杆菌同源性聚类分析
应用脉冲场凝胶电泳分析(PFGE)方法,对福建39株猪源mcr-1基因阳性大肠杆菌菌株进行分型和聚类分析。PFGE图谱(图1)显示,39株菌共获得30种PFGE谱型,具有高度多样性,形成了6组克隆群。ST10型中的6株细菌(菌株编号EC6、EC7、EC8、EC9、EC10和EC11)表现出同一克隆关系,2株ST410(菌株编号EC33和EC37)和2株ST2505(菌株编号EC35和EC38)类型菌株也分别表现出同一克隆关系,但3株ST29型菌株中有1株(菌株编号EC17)与ST117和ST5699类型菌株表现出同一克隆关系。ST10菌株主要分布在福建龙岩地区,其他ST类型菌株没有明显的地域性。mcr-1基因阳性细菌主要分布在福建龙岩和南平地区,在福建省其他地区分布较少。
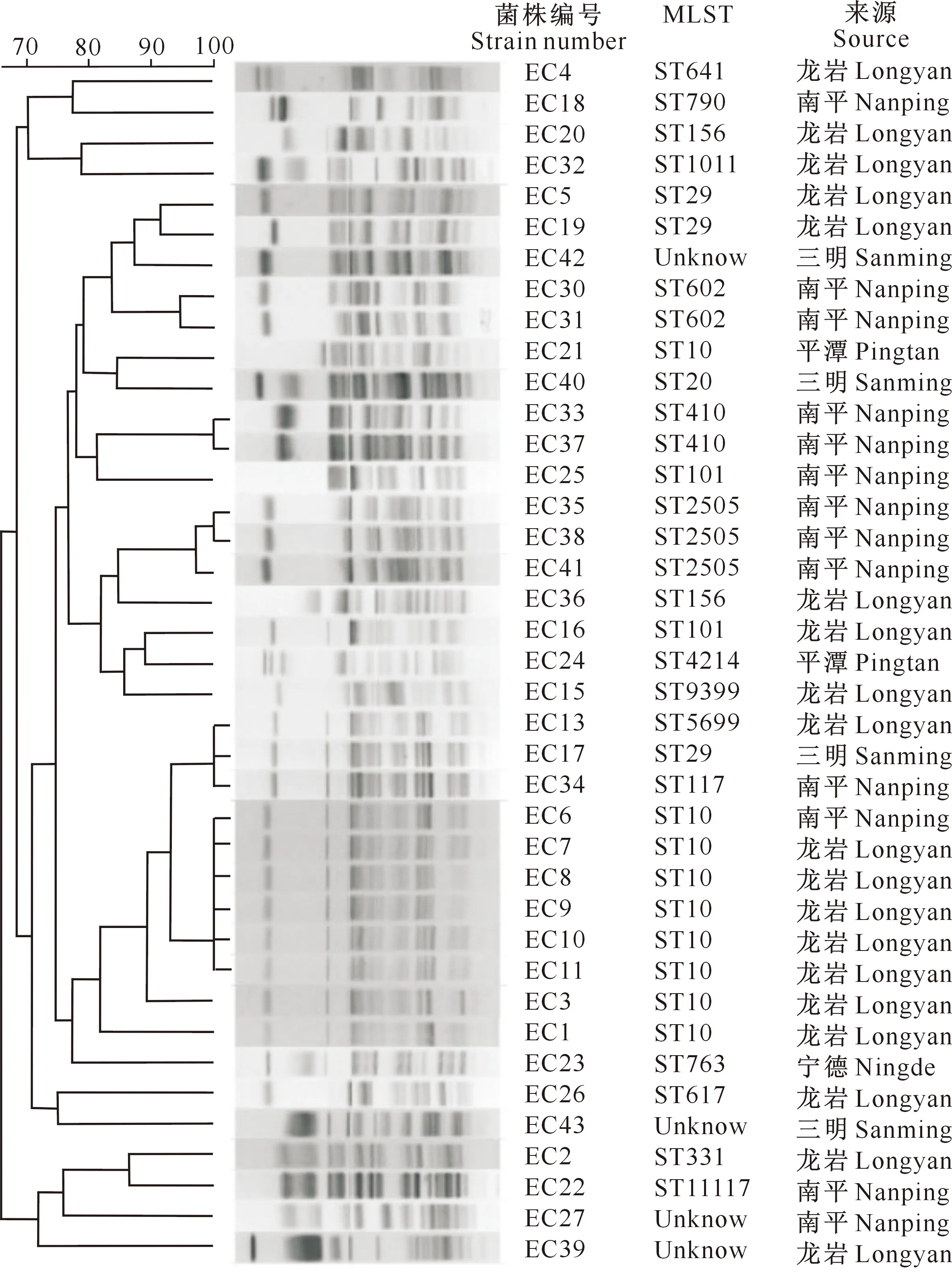
图1 福建猪源mcr-1基因阳性大肠杆菌的同源聚类结果
3 讨 论
多黏菌素作为一种多肽类抗生素,被认为是治疗革兰氏阴性菌感染的“最后一道防线”[13]。然而,多黏菌素耐药基因mcr-1自从2016年被发现以来[9],已在全世界多种病原菌中广泛传播[14],严重影响了该药的临床应用效果[15]。为了防止多黏菌素耐药菌的进一步泛滥,我国在2016年7月份,禁止在饲料中添加多黏菌素,以期降低该抗生素的耐药率;在2020年7月份,禁止在饲料中添加任何抗生素[16],防止出现无药可用的局面。
本研究在2017-2021年从福建省7个地市采集了313份粪便样品,从中共分离获得43株mcr-1基因阳性细菌,阳性率达到13.7%,其中39株为大肠杆菌,其余4株为肠杆菌科的其他菌属,这与前人相关研究得出的mcr-1基因仅存在于肠杆菌科细菌中的结论[9,17-21]一致。mcr-1基因阳性率偏高的原因是,携带mcr-1基因的细菌可随食物、水环境和土壤进行传播扩散[22-24]。
多黏菌素耐药基因mcr-1的发展趋势自2016年以来,一直受到研究者的广泛关注,而对mcr-1基因阳性细菌的耐药性和耐药趋势却研究甚少。本研究的药敏试验结果显示,磺胺甲基异恶唑、氟苯尼考、链霉素、新霉素、强力霉素、恩诺沙星和阿莫西林的耐药菌率均达到50%以上,且二重或多重耐药现象严重,这是因为这些药物在猪场使用频繁,导致猪源细菌的耐药率居高不下;而亚胺培南、呋喃妥因、替加环素和利奈唑胺的耐药率很低或无耐药性,这是因为这些药物均为人医使用抗生素,而不是兽用抗生素,因此猪源细菌对这些抗生素的耐药率很低。
mcr-1基因阳性细菌的耐药性多种多样,且其耐药机制复杂。为了阐明mcr-1基因阳性细菌的耐药机制,首先必须掌握这些细菌的耐药基因。本研究中,磺胺类抗生素耐药基因sul1、sul2和sul3的检出率较高,均在74%以上;喹诺酮类抗生素耐药基因仅有qnrS和aac(6′)-Ib-cr被检出;氯霉素类抗生素耐药基因中,Cat2的检出率最高,cmlA和pexA也被检出;值得注意的是,氟苯尼考耐药基因floR的检出率高达83.7%,但其在mcr-1基因阴性细菌中的检出率却较低;金属β-内酰胺酶耐药基因NDM-1的检出率达23.2%,这可能是因为饲料中禁用抗生素后,猪细菌性疫病暴发,因此大量头孢类抗生素及其他抗生素被使用,引发了超级耐药菌的出现;多药耐药基因cfr的检出率很低,这与其他研究报道[25]一致。
MLST是一种常用的细菌分子分型方法,在细菌学研究领域应用广泛,具有分辨率高、重复性强、可积累等优势[26-27]。本研究对分离自福建省部分地市的39株猪源大肠杆菌进行MLST分型,除4株细菌不能分型外,其他35株共分为19种不同序列型,这表明同一地市的mcr-1基因阳性大肠杆菌具有高度多样性。在这35株细菌中,ST10型菌株最多,共有9株,其他类型菌株均少于等于3株,可见ST10是优势型。PFGE也是一种微生物基因分型方法,具有重复性好、特异性强、分辨率高等特点,被广泛应用于微生物的分型和溯源[28-29]。有研究以相似性80%作为同一谱型的划分依据[30],即谱型系数大于80%为有克隆关系,低于80%则视为无克隆关系。本研究PFGE分型结果显示,39株mcr-1基因阳性大肠杆菌分离株共有30种PFGE谱型,表明这些分离株带型具有多态性;且由EC13、EC17、EC34、EC23和大部分ST10菌株(EC6、EC7、EC8、EC9、EC10、EC11、EC3、EC1)组成的克隆群为ST10型菌株占优势的克隆群(ST10克隆群)。EC13(ST5699,龙岩)、EC17(ST29,三明)和EC34(ST117,南平)菌株虽然ST类型不同,但都来源于龙岩的优势克隆群ST10,这可能是因为生猪引种引起了细菌传播[26]。EC5(ST29,龙岩)、EC19(ST29,龙岩)、EC42(未知型,三明)、EC30(ST602,南平)、EC31(ST602,南平)也都具有克隆关系,表明这3地也可能存在同一细菌的互相传播。而不能定型的菌株EC27、EC39和EC43与其他已定型菌株的同源性较差,亲缘关系较远,是3株新发现的分离株。
4 结 论
从福建省分离的猪源mcr-1基因阳性菌株绝大部分为大肠杆菌,只有少部分为肠杆菌科其他细菌。这些分离株分别对磺胺甲基异恶唑、氟苯尼考和链霉素等具有严重的共同耐药特性,尤其是对氟苯尼考共同耐药。mcr-1基因阳性菌株的磺胺类抗生素耐药基因以sul为主,喹诺酮类抗生素耐药基因以qnrS和aac(6′)-Ib-cr为主,氯霉素抗生素耐药基因以Cat2为主。mcr-1基因阳性大肠杆菌的ST类型复杂多样,其中以ST10为优势序列型。PFGE谱型表明,mcr-1基因阳性大肠杆菌带型具有多态性,其在地市的分布也具有高度多样性。

