寒旱区湖泊浮游植物优势种生态位分析——以包头南海湖为例
姚 植,刘奕杰,何桂豪,朱 蓉,杨文焕,孙 涛,冯栋栋,李卫平*
寒旱区湖泊浮游植物优势种生态位分析——以包头南海湖为例
姚 植1,刘奕杰2,何桂豪1,朱 蓉2,杨文焕1,孙 涛3,冯栋栋1,李卫平1*
(1.内蒙古科技大学,内蒙古 包头 014010;2.中冶西北工程技术有限公司,内蒙古 包头 014010;3.德州市水利局,山东 德州 253041)
【目的】明确寒旱区湖泊浮游植物群落变化与湖泊富营养化的响应关系。【方法】2017年12月—2018年11月对南海湖水体及浮游植物群落进行取样、计数,采用生态位分析方法对浮游植物优势种生态宽度和生态重叠进行描述,利用灰色关联分析确定水环境因子对浮游植物的作用。【结果】冰封期和非冰封期分别鉴定出浮游植物7门38属95种和7门47属106种,浮游植物主要群落结构为蓝藻-绿藻-硅藻型。冰封期优势种的生态宽度值和生态重叠值都比非冰封期小,非冰封期浮游植物的竞争能力更强。灰色关联分析显示,化学需氧量(CODCr)、酸碱度(pH)与全年浮游植物丰度均表现出较为显著的相关性,总磷(TP)对冰封期的浮游植物种群变化影响较大;而水温(WT)对非冰封期浮游植物种群变化影响比较大。【结论】南海湖浮游植物种类在不同阶段受到多种生态因素的影响,有机污染物和磷营养盐是影响浮游植物群落结构的主要环境因子,研究结果可为寒旱区湖泊浮游植物结构特征变化机理提供依据。
寒旱区;生态位;浮游植物;灰关联分析;城市湖泊
0 引 言
【研究意义】浮游植物作为湖泊水生态系统中最重要的初级生产者,能将水体里的无机物转化为满足自身所需的营养物质,从而为其他生物提供物质和能量,是食物链和食物网不可或缺的一部分。浮游植物的群落特征时空变化能够反映湖体环境状况,而优势种的生物量和演替对环境条件变化的反应更为敏捷[1],这种指示作用使其在水环境监测中表现出明显优势。因此,开展浮游植物群落特征与环境条件间相关性的研究,能够更好地理解浮游植物与水生态系统之间的响应关系。
【研究进展】对于浮游植物群落结构与生态因子相关关系的研究,主要的研究方向有浮游植物群落结构、浮游植物功能群和优势种群生态位理论等,前两种方向主要侧重于对浮游植物群落的划分来进行分析,而忽略浮游植物种属之间的相互作用与分布,而优势种群生态位理论通过对浮游植物优势种进行生态宽度与生态重叠的计算分析,能够了解浮游植物的分布状况、对资源的利用程度以及对环境的适应能力,在理解浮游植物群落的生物多样性、种间关系、群落的演替及种群进化等方面有重要的意义[2]。
关于生态位理论在浮游植物方面的研究应用,大多集中于气候温暖的南方地区湖泊,例如,吴佳梦等[3]基于生态分析和种间联结,探讨了浙江舟山护城河道浮游植物优势种的季节变化,生态位分化以及种间联结性的强弱;郭坤等[4]基于淡水富营养化湖泊浮游植物生态位分析,揭示湖北长湖浮游植物的演替规律并预测其的发展趋势;徐春艳等[5]基于生态位分析,揭示亚热带浅水湖泊浮游植物优势种利用环境资源的状况及其相互关系。国外学者对生态位的研究开展较早[6],但多数研究均针对海洋,对淡水水域的研究仍为少数[7-9]。【切入点】独特区域和气候特征的寒旱区湖泊的相关研究分析比较少,冰封期的寒旱区湖泊具有冰封时间长、冰层厚和水流量少的特点,能使湖泊水环境发生剧烈的变化,其中南海湖属于典型的寒旱区城市湖泊,对该湖泊开展浮游植物的相关研究分析,对认识寒旱区湖泊浮游植物群落结构的变化特征具有重要意义。【拟解决的关键问题】本文以寒旱区湖泊——南海湖为例,利用生态理论分析湖区优势种在冰封期和非冰封期生态位宽度的变化特征及种群间生态重叠关系,探索各时期寒旱区湖泊浮游植物物种间的相关关系及其对湖泊生态因子变化的响应关系,以期为寒旱区的水环境生态系统的稳定和富营养化治理提供参考依据。
1 材料与方法
1.1 研究区概况与采样点设置
南海湖(40°30′8″—40°33′32″N,109°59′26″—110°2′26″E)位于包头市东河区南侧,地处于半干旱草原地区,属半干旱温带大陆性气候,是黄河流域内蒙古段的重要组成部分。南海湖曾属于九曲黄河的一部分,河水改道后形成水面和滩头草地,占地面积2 000 hm2,其中水域面积约580 hm2,湖深0.9~3.5 m。在自然和人为共同影响下,南海湖整体呈中度富营养化状态,是寒旱区湖泊典型的富营养化研究系统,也是我国西北部寒旱区的代表性湖泊之一。
结合南海湖水文水质的特点和现场勘查情况,参照《湖泊富营养化调查规范》,湖区共设置4个研究区,分别为进水口区、旅游区、湖心区和水草区。采用网格布点法,以200 m×200 m为尺度进行正方形网格化,在交汇点自西向东共设12个采样点,样点分布示意图如图1,其中1号和2号点位于南海湖进水口附近,3、4、5号和6号点邻近旅游开发区,东接湖心岛。7、8号和9号点位于湖心区,水深平均大约为3 m,受外界影响较小。10、11号和12号点接近芦苇区,湖畔四周生长着芦苇荡,并且湖区大部分的鸟类生活于此。
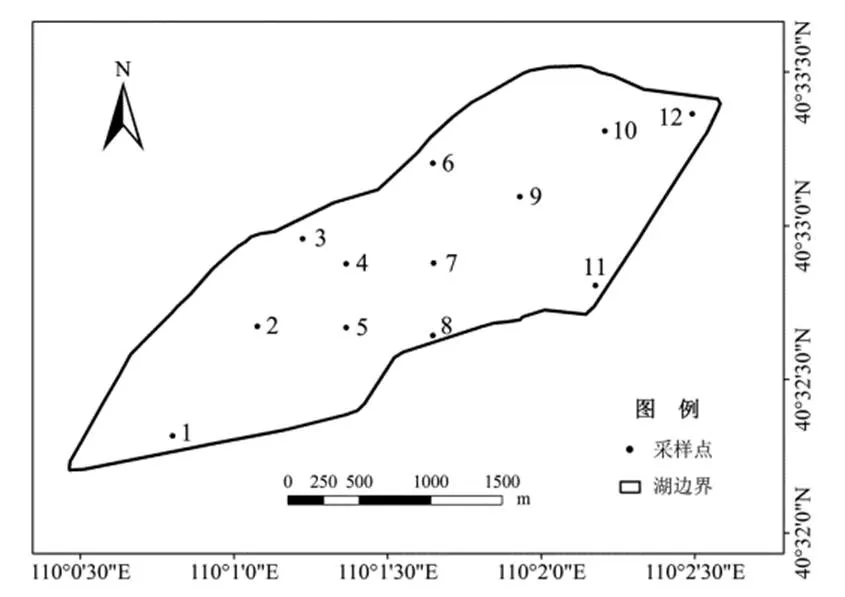
图1 南海湖浮游植物采样点分布
1.2 样品采集与处理
从2017年12月开始到2018年11月结束,每月月末去南海湖进行样品采集,根据GPS获取12个采样点的准确位置,浮游植物定量样品在表层水深0.5 m处取1 L水样,添加鲁哥试剂固定,静淀48 h后,浓缩至50 mL,取0.1 mL于浮游植物计数框中,在显微镜下鉴定,计数[10],每个样品每次计数50个视野,计数至少3次,取其平均值作为最后结果。参照《中国淡水藻类:系统、分类及生态》[11]及《淡水微型生物图谱》[12]等的方法,对浮游植物种类进行鉴定。浮游植物数量换算公式,见式(1)。
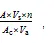
式中:为每升水样中浮游植物数量(个/L);为计数框面积(mm2);s为1 L水样浓缩后的体积(mL);为计数所得浮游植物个数;c为计数面积(mm2);a为计数框体积(mL)。
为明确南海湖水质对浮游植物群落特征的影响,同步采集水样测水质,每个采样点设置2个平行样以避免单次采样的偶然性。其中水温(WT)、pH值、溶解氧(DO)等指标用水质分析仪(PONSEL,法国)现场测定;每个样点水样的总氮(TN)、总磷(TP)和化学需氧量(CODCr)在室内参照《水和废水监测分析方法》[13]进行测定。
1.3 数据分析
1)优势度用以表示一个种在群落中的地位与作用,浮游植物的优势种以优势度指数≥0.02进行确定,浮游植物的优势度指数[14]计算式为:

式中:n为样点中第种浮游植物的个体数;为样点中所有浮游植物的总数;f为该种属在各样点中出现的频率。
2)生态位宽度采用修正后的Levins指数[8],计算式为:
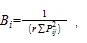
式中:B为种的生态位宽度;P=n/N,代表种i在第个资源状态下的个体数占该种所有个体数的比例;为样点数。
3)生态重叠采用Petraitis指数[15],计算式为:
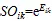

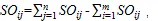


4)灰色关联分析法[16]是通过灰色关联度来分析和确定系统诸因素间的影响程度或因素对系统主行为的贡献程度的一种方法,关联度的大小根据事物或因素的序列曲线的相似程度确定,若序列曲线的形状彼此相似,则关联度大;反之,关联度就小,灰色关联度是灰色关联分析的基础和工具[17]。为了消除在灰关联分析中不同量纲所带来的影响,本次分析通过均值法对原始数据进行无量纲处理,在DPS软件上进行具体操作。
采用Excel 2016 软件和Origin 2018进行数据统计分析及绘图,研究框架如图2所示。
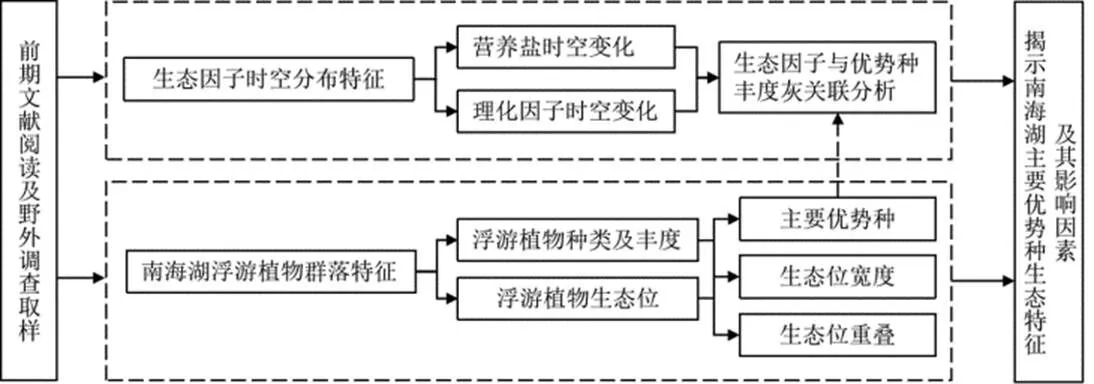
图2 研究框架
2 结果与分析
2.1 浮游植物群落结构特征
南海湖全年共鉴定出浮游植物7门66属151种,其中冰封期鉴定出浮游植物7门38属95种,非冰封期鉴定出7门47属106种,浮游植物各物种类群占比值在冰封期和非冰封期变化差异较小,主要类群为蓝藻门、绿藻门和硅藻门(图3)。

图3 南海湖不同时期浮游植物物种组成比例
图4为南海湖浮游植物各物种丰度的时间分布变化,从图4可以看出,南海湖浮游植物丰度在冰封期和非冰封期有明显的差异,丰度的最大值和最小值分别出现在非冰封期的7月、冰封期的1月,两数值相差14倍。冰封期浮游植物丰度在89.23×106~164.58×106个/L之间,1月份浮游植物丰度值最小,12月的浮游植物丰度值最大,其中绿藻门丰度值占绝对优势地位。非冰封期浮游植物的丰度在111.87×106~1 288.18×106个/L之间,浮游植物丰度的变化呈倒“V”形,先升后降,在7月达到最大值,3月为最小值。绿藻门浮游植物的优势地位逐渐开始动摇,蓝藻门浮游植物丰度逐月增多,在7月丰度达到最大值,并在7—9月占优势地位。与冰封期的丰度值相比,硅藻门和其他藻门在非冰封期丰度值均有所增长,更能适应该时期的环境条件。
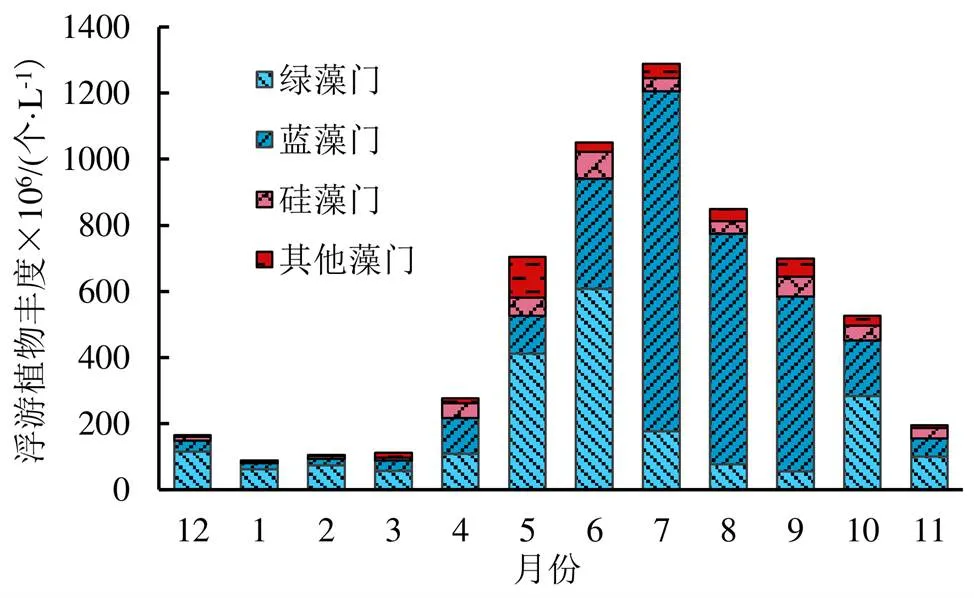
图4 南海湖浮游植物各物种丰度的时间分布变化
2.2 浮游植物优势种及生态位
1)浮游植物优势种
优势度用以表示一个物种在群落中的位置与功能,浮游植物的优势种以优势度指数≥0.02进行确定。根据式(1)进行浮游植物优势度指数计算,南海湖冰封期和非冰封期浮游植物优势种,可以分为3门12种(表1),绿藻门有四尾栅藻、镰形纤维藻、螺旋弓形藻和球衣藻等4种;蓝藻门有微小平裂藻、水华束丝藻、两栖颤藻、微小色球藻、为首螺旋藻、小形色球藻和与舍蓝纤维藻,共7种;硅藻门只有1种,为普通等片藻。浮游植物优势种在全年不同时期既出现重叠又发生演替,冰封期南海湖浮游植物优势种以绿藻门种类为主,这时期绿藻门优势种的优势度指数比其他门优势种的优势度指数都要大,占主要优势地位;其他时期以蓝藻门种类为主且同一优势种的优势度指数比冰封期的都要大。此外,四尾栅藻、镰形纤维藻、微小平裂藻、水华束丝藻和普通等片藻都是这2时期的优势种,其中绿藻门四尾栅藻的优势度指数是这2时期的最大值,这与调查期间四尾栅藻的丰度比较大,分布范围广的情况相符合,且其在冰封期的优势度指数远大于其他优势种的优势度,属于全湖优势度指数最大的主要优势种。冰封期绿藻门优势种的螺旋弓形藻和球衣藻在非冰封期失去优势种的地位,演替其位置的是蓝藻门的两栖颤藻、微小色球藻、为首螺旋藻和小形色球藻,导致蓝藻门优势种居多,与前面南海湖浮游植物群落结构(图4)中蓝藻门在非冰封期的相对丰度占优势呼应。
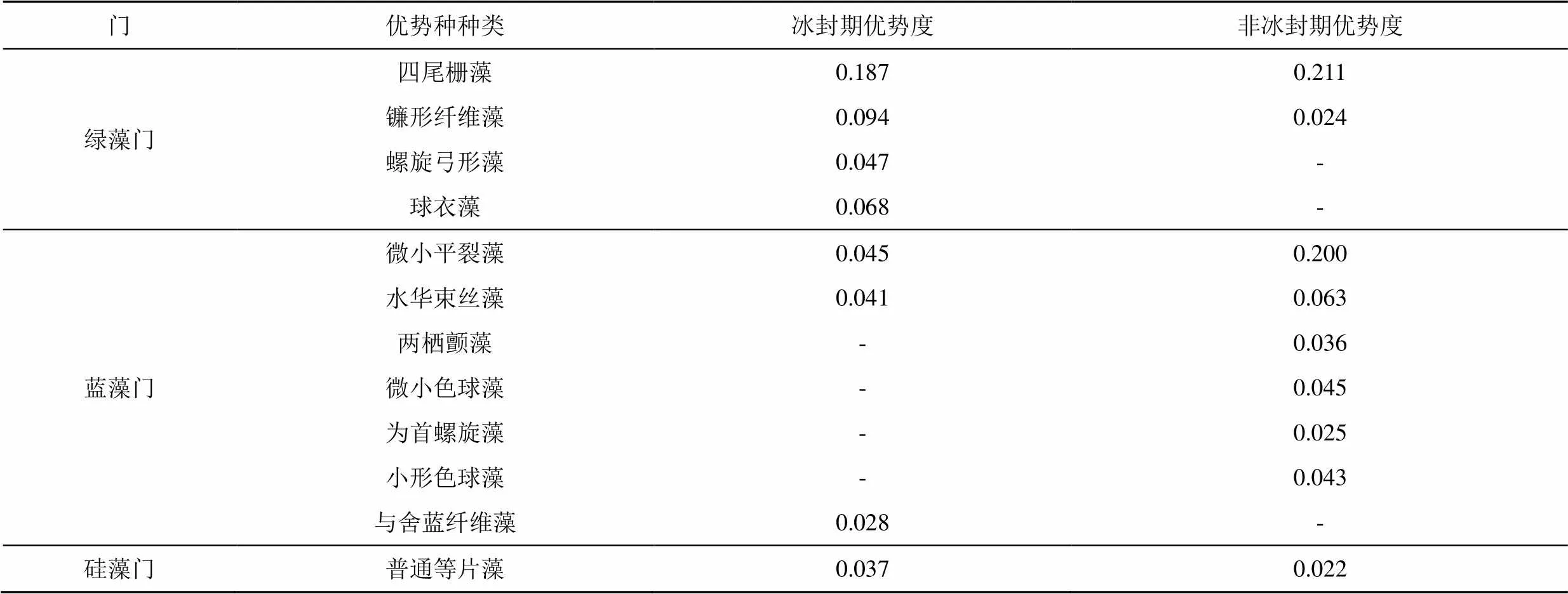
表1 南海湖浮游植物优势种
注 “-”代表该藻种在当月不能成为优势种。
2)南海湖浮游植物生态位
生态宽度是一个种群在生态环境中所获得的各类资源的总量,或指种群获取资源途径的多样性程度,种群获取资源的多样化程度,其值大小较好地反映了物种的分布、种群的生态适应性和资源利用的潜在能力[18]。生态宽度越大表明该种群竞争能力越强,能充分合理地利用各种资源。由表2可知,在冰封期,浮游植物优势种的生态宽度值范围为0.307~0.734,优势种的生态宽度值均较小,多数浮游植物对此时期的水生态环境适应能力较弱,生态适应幅度较窄。只有四尾栅藻、水华束丝藻和与舍蓝纤维藻的生态宽度>0.6并且优势度≥0.02,这3种浮游植物在该时期具有较强竞争能力和环境适应能力,虽然这3种藻类的密度不是最大的,但在各个采样点间分布广,占据资源点位多,适应多样化生境的能力强,能够很好地利用身边的资源,促进自身发展。
在非冰封期,浮游植物优势种的生态宽度值范围为0.424~0.734,与冰封期相比,多数浮游植物优势种的生态宽度值增大,对环境资源和空间的竞争能力得到了增强。另外15~35 ℃之间的水温升高能促进藻类的生长[19],这与南海湖非冰封期的水温相符合,藻类丰度增加,不但种间的竞争加剧,种内的竞争也加剧,各种类的藻类都扩大活动范围,寻找更多的生存资源与空间。绿藻门的镰形纤维藻的生态宽度值为最大值,取代了冰封期四尾栅藻的位置,尽管这时期的四尾栅藻的丰度比较大,但是出现在各样点的频率较低,使其生态宽度值变小。微小色球藻、为首螺旋藻和小形色球藻这些新演变出的优势藻类的生态宽度值>0.5,藻种丰度比较大,分布范围比较广,此时期的水生态环境比较适合藻类生长繁殖。螺旋弓形藻、球衣藻和两栖颤藻只在冰封期或非冰封期中的某一时期成为优势种并且生态宽度值<0.5,这些藻类只依赖于某一时期的生态因子,只出现在特定的时期,应对环境变化的能力比较弱,不能充分摄取生态环境资源。
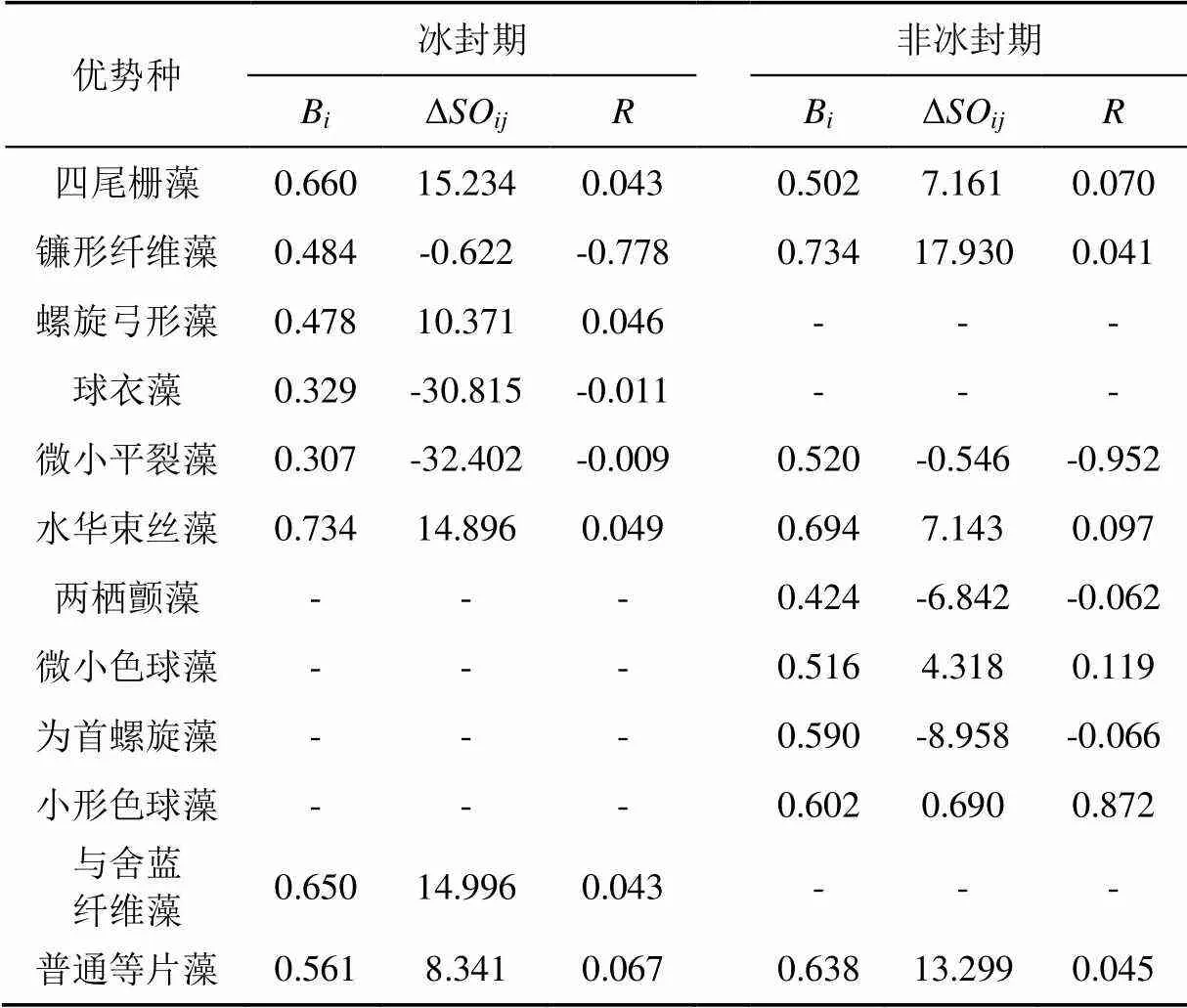
表2 南海湖浮游植物优势种生态位
注 “-”代表该藻种在当月不能成为优势种。
生态位重叠值(ΔSO)不但反映了种类之间利用资源或对环境适应能力的相似程度[20],也体现了物种对资源的利用状况和物种间分布地段的交错程度[21]。如表2所示,在冰封期,镰形纤维藻、球衣藻和微小平裂藻同属于衰退型,生长空间呈缩小的趋势。其中微小平裂藻的生态重叠值的绝对值为两时期的最大值,微小平裂藻在南海湖冰封期的衰退空间最大,其他优势种属的生态重叠值为正,处于发展状态。在非冰封期,镰形纤维藻和微小平裂藻的生态重叠值比冰封期的大,发展空间增大;四尾栅藻、水华束丝藻和普通等片藻的生态重叠值减小,衰弱程度增加。从全年生态重叠值变化来看,非冰封期优势种的生态重叠值比冰封期的大,四尾栅藻和镰形纤维藻分别是两时期的最大值,相对于其他优势种,蓝藻门各优势种与其他优势种的生态重叠程度偏高。
2.3 南海湖生态因子变化特征
影响浮游植物群落结构变化比较明显的是TN和TP,这是因为不同形态的氮磷可以被浮游植物吸收利用,相反氮磷浓度变化亦会影响浮游植物的群落结构。如王振方等[22]发现TN和TP是影响异龙湖不同湖区的浮游植物群落结构变化的主要生态因子;张涛等[23]对夏季的云南中部和南部湖泊的浮游植物群落进行研究,其中方差分解显示营养水平(TN、TP)能够解释30.35%的浮游植物空间变化;李娜等[24]研究发现TN和TP与白洋淀汛期和非汛期的浮游植物群落结构变化的相关性比较高。包头南海湖湿地水体氮磷营养盐普遍较高,对比《地表水环境质量标准》,发现TN、TP含量均超过地表水V类标准,处于富营养化状态,导致藻类大量繁殖。如图5所示,在冰封期,每月平均水温为1.91~2.73 ℃,全湖冰厚40 cm左右,湖泊水体流速变得缓慢,湖泊生物的生命活动受到干扰,从而引起生态因子发生相应的变化,如南海湖的DO、pH、TN、TP和CODCr等生态因子变化较明显,其中TN和TP呈上升趋势,这与同属内蒙古寒旱区的乌梁素海冰封期的氮磷营养盐呈下降趋势不同[25],可能是因为南海湖的进水口和出水口平时处于封闭状态,只在春季抽取黄河水为补充水源,湖泊的自净能力较弱,另外,湖面结冰的过程会发生排盐效应,且湖泊水位下降,所以营养盐质量浓度相应被浓缩。在非冰封期,冰雪消融,人为活动增加,湖泊水环境发生明显变化,可以看到南海湖的生态因子里变化比较明显的是水温、pH和CODCr,其中pH和水温都是先增后减,同时在8月达到最大值,而CODCr却是先减后增,4月质量浓度最小。相较其他城市湖泊,如昆明滇池和上海滴水湖,在相应季节里变化比较明显的分别是DO和Chl-a,造成此差异可能是因为位于寒旱区的南海湖冰封期水温较低,藻类和其他浮游动物生命活动减弱,所以到了非冰封期,气温回暖,水温急剧上升,并且pH增加使得水生生物大量繁殖,从而使物质循环加快运转。对比冰封期和非冰封期南海湖生态因子变化情况,冰封期的水温比非冰封期的低,且全年各月份各样点水温的温差不大;湖泊冰封期各月份的pH平均值小于非冰封期各月份的pH平均值,且冰封期各月份样点间的pH值差异比较大;DO在冰封期呈下降的趋势,而在非冰封期各月平均值相差不大;TN在冰封期的平均值逐月上升,而在非冰封期各月平均值相差不大。

图5 南海湖全年各生态因子变化特征
2.4 南海湖浮游植物优势种丰度与生态因子灰色关联分析
灰色关联分析法[16]是通过灰色关联度来分析和确定因素对系统主行为的贡献程度的一种方法,它能够判断影响系统发展因素的重要性,并能给出研究对象的优劣排名。浮游植物在水生态系统中,受多个生态因子共同作用的影响,有些生态因子的影响是主要的,有些生态因子的影响是次要的,因而分析各个生态因子对浮游植物群落影响大小可以运用灰色关联分析法。在进行灰色关联分析前,首先确定母序列为冰封期和非冰封期浮游植物优势种的丰度,其次评价项为各生态因子——WT、pH、TN、TP、CODCr和DO,针对数据进行均值化处理,计算各时期浮游植物丰度与水生态因子的关联度,根据关联度确定水环境因子对浮游植物的作用,关联度值介于0~1之间,该值越大表示评价项与母序列相关性越强。灰色关联分析结果表明(图6),各门类浮游植物丰度在不同时期与生态因子的关联程度存在差异,其中冰封期绿藻门优势种丰度与DO的相关性比较强,如DO是与镰形纤维藻和球衣藻丰度相关的第一生态因子,关联度分别为0.835、0.930,亦是引起螺旋纤维藻丰度变化的第二生态因子,关联度为0.769;而WT作为绿藻门优势种丰度存在明显相关关系的第二生态因子,其不但是影响螺旋纤维藻丰度的第一生态因子,而且也是与镰形纤维藻和球衣藻丰度变化关系密切的第二生态因子;CODCr是影响四尾栅藻、螺旋弓形藻和球衣藻丰度较强的生态因子,关联度分别为0.889、0.710和0.514;蓝藻门优势种的丰度与TP、TN和pH的相关性比较强,如TP是影响水华束丝藻和与舍蓝纤维藻丰度的第一生态因子,关联度分别为0.871、0.811;而微小平裂藻、与舍蓝纤维藻的丰度与TN的相关性比较强,分别为0.901和0.810;pH是影响微小平裂藻、水华束丝藻和与舍蓝纤维藻丰度的第三生态因子;硅藻门优势种丰度与CODCr、TP和pH的相关性比较强。结合该时期对浮游植物各物种优势种丰度影响比较大的生态因子,CODCr、TP和pH与浮游植物丰度的相关关系比较强。在非冰封期,南海湖浮游植物优势种的丰度与CODCr、TP和WT的相关关系比较强,其中绿藻门优势种的丰度与TP的关联程度比较强,如影响绿藻门四尾栅藻和镰形纤维藻丰度的第一生态因子都是TP,关联度分为0.722、0.625,而蓝藻门优势种丰度与CODCr、WT和pH的关联程度比较大,相比其他生态因子,蓝藻门的水华束丝藻,两栖颤藻和为首螺旋藻与CODCr的关联度是最大的,分别为0.819、0.819和0.718;而微小平裂藻、小形色球藻与WT的关联程度最大,分别为0.794和0.693;pH分别是影响微小平裂藻丰度的第二生态因子,影响水华束丝藻和为首螺旋藻丰度的第三生态因子;与硅藻门优势种丰度相关性比较强的第一、第二、第三生态因子,分别是pH、WT和TN,关联度分别是0.727、0.716和0.715。由此可见,不同时期气候条件的改变,与浮游植物丰度产生紧密关联的生态因子并不相同。结合该时期对浮游植物各物种优势种丰度影响比较大的生态因子,CODCr、WT和pH与浮游植物丰度的相关关系比较强。
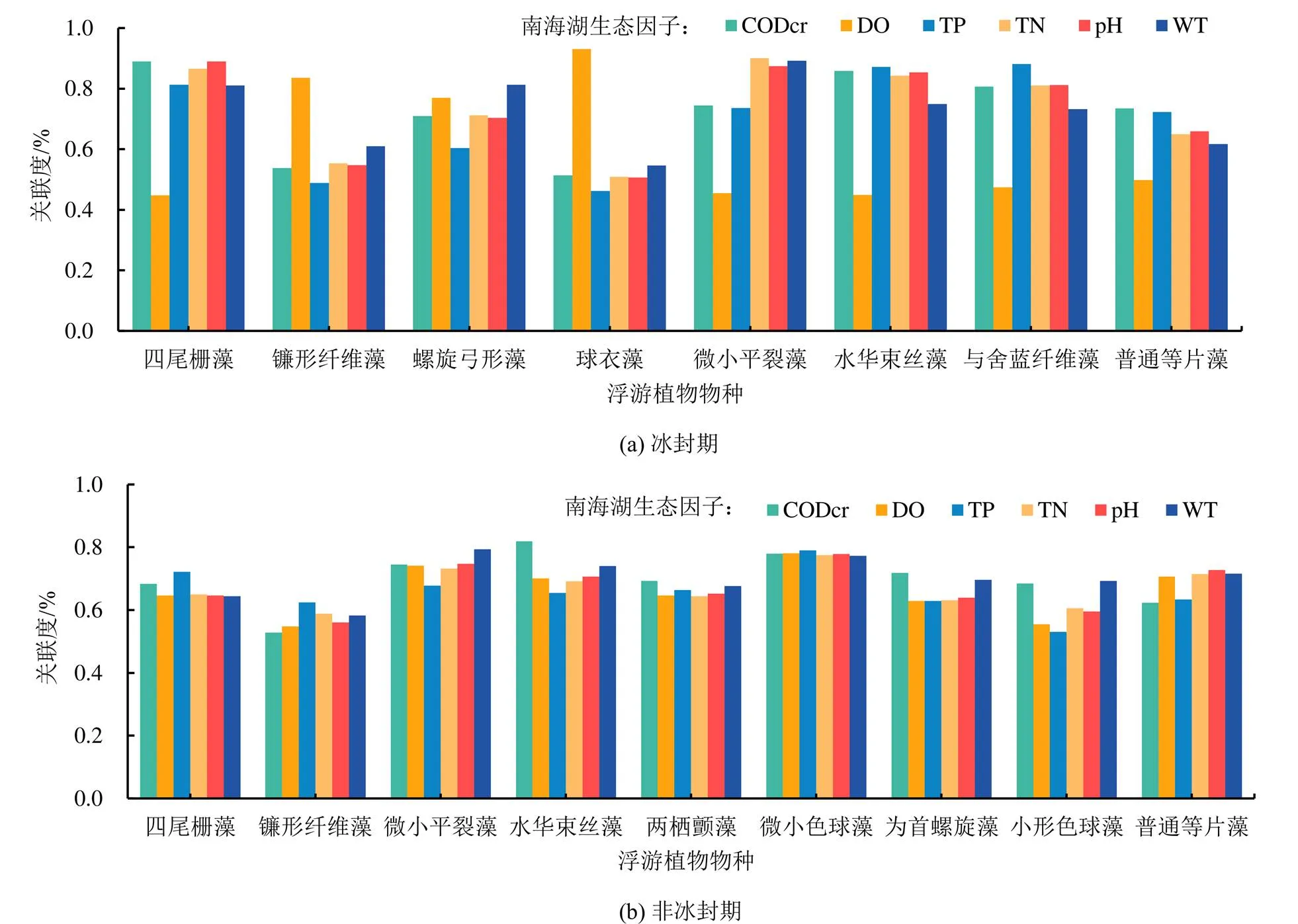
图6 南海湖各时期浮游植物物种与生态因子关联度
3 讨 论
3.1 浮游植物优势种生态位
生态宽度反映了物种在生境中占据的空间资源的多少和活动范围,其值能够体现环境对物种分布和丰度的影响[26]。对南海湖浮游植物优势种进行生态宽度统计分析,反映出寒旱区湖泊浮游植物在冰封期与非冰封期的群落结构和分布变化,如四尾栅藻在丰度上各月维持在较高的丰度值,而且在各采样点出现的频率也比较高,适应多样化生境和摄取资源的能力强,与同属寒旱区的乌梁素海和奈伦湖的四尾栅藻在冰封期的优势度较大和分布范围较广的情况相符合[27],这是因为冰封期水体气候条件形成了特殊的生存环境,对浮游植物的耐受能力要求高,四尾栅藻属于绿藻优势类群,能适应低温和高营养盐浓度环境,有较强的适应能力,更易成为优势种[28-30]。物种生态位宽度值越大,其竞争能力越强和多样化程度越高,冰封期的水华束丝藻,与舍蓝纤维藻和普通等片藻的丰度值虽然不大,但其分布范围较广,令其生态宽度值居于前4,这是由于寒旱区湖泊冰封期湖面结冰,导致水质特征、物资循环和流速结构等发生改变,引起生存资源减少,对藻类提出更高的生存要求,藻类需要通过扩大其活动范围,获取更多的资源。在非冰封期,寒旱区湖泊水体温度上升,南海湖夏季平均水温为22.6 ℃,适合大多数藻类生存繁殖[31],两栖颤藻、微小色球藻、为首螺旋藻和小形色球藻等藻类开始出现并成了优势种,南方湖泊如太湖和淀山湖等亦存在相似情况,浮游植物物种种类和丰度在夏季比冬季更丰富[32-33]。镰形纤维藻、微小平裂藻和普通等片藻这些藻种为了争夺资源,会通过增加其丰度和扩大其活动空间等手段获取更多的生存资源,导致其生态宽度值相比冰封期在一定程度上有所增大。
生态重叠反映了物种资源可利用性与环境适应性的相似性[20],其对浮游植物群落结构的稳定有重要的作用,生态位重叠值越大,说明其可利用生态资源越多,种间的竞争也更为激烈。从冰封期过渡到非冰封期,寒旱区湖泊水环境会发生显著变化,从而引起藻类生存条件的改变,导致藻类不得不调整自身的情况去适应发生改变了的环境[34-35],藻类的生态重叠值也跟着发生改变。在冰封期,冰封低温的水环境不适合大多数藻类的生理特性,如微小平裂藻和球衣藻生态重叠值为负数,生存空间处于衰退状态,说明该藻类无论在种内还是在种间的资源利用上都处于竞争激烈的状态,且在资源竞争过程中生物间的抑制作用会影响浮游植物群落结构与分布。
从南海湖全年浮游植物优势种群相对资源占有量ΔSO来看:生态重叠值较大的浮游植物优势种群,通常具有较广阔的资源获取区域,且基本都是发展型种群,如冰封期的水华束丝藻和非冰封期的镰形纤维藻等;生态重叠值较小的浮游植物优势种群,受生态因子的影响比较大,竞争能力弱,基本属于衰退型种群,如冰封期的微小平裂藻和非冰封期的两栖颤藻等。从浮游植物优势种的生态响应速率来看,非冰封期的小形色球藻发展趋势最强,远超过其他浮游植物种群,可以预测,在未来演替过程中,小形色球藻可能会通过增大生态宽度,加强自身的生态适应性来获取更多的资源,替代其他衰退型的浮游植物,成为绝对优势种群。生态响应速率为负的浮游植物,如镰形纤维藻、球衣藻、微小平裂藻、两栖颤藻和为首螺旋藻等优势种在相应的环境内可能会逐渐消失。因此,寒旱区湖泊不同时期浮游植物呈现发展或衰退趋势是不同优势种群间竞争的必然结果[36]。
3.2 浮游植物优势种生态特征与生态因子
寒旱区湖泊浮游植物不同门类优势种的演替在不同时期有明显差异,而浮游植物群落的组成与生态因子的变化息息相关[35]。通过对南海湖生态因子与各时期浮游植物优势种丰度进行灰色关联分析后,结合两时期与浮游植物丰度相关关系紧密的生态因子,可知CODCr、pH、WT和TP是影响南海湖浮游植物丰度的主要生态因子。pH作为影响浮游植物生态结构的重要因素之一,这与杨文焕等[37]对冻融期寒旱区湖泊研究得出的结果一致。普通等片藻、水华束丝藻和普通等片藻等藻类更适合在弱碱性的水体环境下进行生长和繁殖[38-40],冰封期与非冰封期的过渡会导致水体生态因子产生剧烈的变化,如冰封期水温降低会引起溶解CO2质量浓度增加,HCO3-离子质量浓度减少,pH值降低,水体呈弱碱性。此外冰封期的冰盖虽然会阻碍部分光线进入水体,但浮游植物仍需要通过光合作用合成自身所需的有机物质,而弱碱性的水体环境对浮游植物吸收溶解CO2进行光合作用的生命活动有明显的帮助[41]。将水温与浮游植物丰度作相关性分析,显示存在显著的正相关关系,如蓝藻合适的生长水温为24~30 ℃[42],这使得蓝藻的数量在非冰封期爆发,而在冰封期数量较少,这是因为水温不但能影响浮游植物的生理活动,如呼吸作用、光合作用和摄食活动等,还能够影响底泥里氮磷的释放[43]。水环境温度升高能增强沉积物中的微生物活性,加强底栖生物的活动,提高了生物扰动作用和沉积物的有机物矿化速率,促使有机氮磷向无机态转化,进而使氮磷向水体释放量增加,其中磷是浮游植物许多有机化合物的重要组成成分,如核酸和磷脂等,能够影响藻细胞的细胞体积,营养状态,金属离子量和光合作用效率等。在冰封期,总磷与南海湖浮游植物群落结构变化显著相关,较高磷浓度的湖泊有利于绿藻的生长繁殖[44-45],而冰封期南海湖的磷浓度比较高,所以四尾栅藻和镰形纤维藻等绿藻的数量也比较多,总磷也是影响浮游植物丰度变化的主导因子之一[46]。化学需氧量是表示水中还原性物质量的指标,而有机物作为淡水湖泊主要的还原物质,所以化学需氧量可以作为衡量水中有机物量的指标[47],化学需氧量越大,水体受有机物污染越严重。每年春季,南海湖会接受黄河补水,因黄河“水沙异源”的特点带来了大量的有机质,此外,藻类的降解对湖泊悬浮有机质的贡献也比较大[48],于洋等[49]对太湖,巢湖和滇池的浮游植物进行相关影响因素分析,化学需氧量与浮游植物成正相关,能限制浮游植物生长。因此限制有机污染物和磷营养盐的排放对治理与防治南海湖富营养化至关重要。
本文只能初步反映南海湖浮游植物群落的分布演替,仅从优势种在各个季节的分布、生态位宽度和生态位重叠及其与水环境的变化探讨优势种群落时空变化,若要详细了解浮游植物的演替,种间竞争和水体中其他高等生物对浮游植物群落的影响还需深入探讨。
4 结 论
南海湖浮游植物的群落结构为绿藻-蓝藻-硅藻型。冰封期鉴定出浮游植物7门38属95种,以绿藻门种类为主;非冰封期鉴定出浮游植物7门47属106种,以蓝藻门种类为主。冰封期浮游植物优势种生态宽度值和生态位重叠值均比非冰封期小,非冰封期浮游植物间争夺环境资源更加激烈,更具有竞争能力。南海湖浮游植物不同时期优势种与受不同生态因子影响,CODCr和pH均对全年浮游植物优势种丰度的影响较大;在冰封期,浮游植物丰度与TP的相关性较强;在非冰封期,浮游植物丰度与WT的相关性较强。
[1] SOMMER U, ADRIAN R, DE SENERPONT DOMIS L, et al. Beyond the plankton ecology group (PEG) model: Mechanisms driving plankton succession[J]. Annual Review of Ecology, Evolution, and Systematics, 2012, 43: 429-448.
[2] CARACCIOLO M, BEAUGRAND G, HÉLAOUËT P, et al. Annual phytoplankton succession results from niche-environment interaction[J]. Journal of Plankton Research, 2020, 43(1): 85-102.
[3] 吴佳梦, 徐娜娜, 张文珺, 等. 浙江舟山定海护城河浮游植物优势种生态位与种间联结性季节性分析[J]. 湖泊科学, 2019, 31(2): 429-439.
WU Jiameng, XU Nana, ZHANG Wenjun, et al. Seasonal analysis of the niche and interspecific association of dominant species of phytoplankton in the Dinghai Moat, Zhoushan City[J]. Journal of Lake Sciences, 2019, 31(2): 429-439.
[4] 郭坤, 杨德国, 彭婷, 等. 湖北省长湖浮游植物优势种生态位分析[J]. 湖泊科学, 2016, 28(4): 825-834.
GUO Kun, YANG Deguo, PENG Ting, et al. Ecological niche analysis of dominant species of phytoplankton in Lake Changhu, Hubei Province[J]. Journal of Lake Sciences, 2016, 28(4): 825-834.
[5] 徐春燕, 俞秋佳, 徐凤洁, 等. 淀山湖浮游植物优势种生态位[J]. 应用生态学报, 2012, 23(9): 2 550-2 558.
XU Chunyan, YU Qiujia, XU Fengjie, et al. Niche analysis of phytoplankton's dominant species in Dianshan Lake of East China[J]. Chinese Journal of Applied Ecology, 2012, 23(9): 2 550-2 558.
[6] GRINNELL J. The niche-relationships of the California thrasher[J]. The Auk, 1917, 34(4): 427-433.
[7] AMARAL J H F, BORGES A V, MELACK J M, et al. Influence of plankton metabolism and mixing depth on CO2dynamics in an Amazon floodplain lake[J]. Science of the Total Environment, 2018, 630: 1 381-1 393.
[8] SILVA M N, GRANZOTTI R V, CARVALHO P, et al. Niche measures and growth rate do not predict interspecific variation in spatial synchrony of phytoplankton[J]. Limnology, 2021, 22(1): 121-127.
[9] VILMI A, TOLONEN K T, KARJALAINEN S M, et al. Niche position drives interspecific variation in occupancy and abundance in a highly-connected lake system[J]. Ecological Indicators, 2019, 99: 159-166.
[10] 宋立钧, 郝桂玲, 杜迎欣, 等. 洋河水库浮游植物群落组成分析与水质评价[J]. 南水北调与水利科技, 2011, 9(5): 63-67.
SONG Lijun, HAO Guiling, DU Yingxin, et al. Analysis of phytoplankton community composition and water quality evaluation in Yanghe reservoir[J]. South-to-North Water Diversion and Water Science & Technology, 2011, 9(5): 63-67.
[11] 胡鸿钧, 魏印心. 中国淡水藻类: 系统、分类及生态[M]. 北京: 科学出版社, 2006.
HU Hongjun, WEI Yinxin. The freshwater algae of China: systematics, taxonomy and ecology[M]. Beijing: Science Press, 2006.
[12] 周凤霞, 陈剑虹. 淡水微型生物图谱[M]. 北京: 化学工业出版社, 2005.
ZHOU Fengxia, CHEN Jianhong. Atlas of freshwater microbiota[M]. Beijing: Chemical Industry Press, 2005.
[13] 魏复盛, 国家环境保护总局, 水和废水监测分析方法编委会. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002.
WEI Fusheng, Environmental Protection Administration, The Water and Wastewater Monitoring Analysis Method Editorial Board. Water and Wastewater monitoring analysis method[M]. 4th. Beijing: China Environment Science Press, 2002.
[14] MCNAUGHTON S J. Relationships among functional properties of Californian grassland[J]. Nature, 1967, 216(5 111): 168-169.
[15] 夏霆, 陈静, 曹方意, 等. 镇江通江城市河道浮游植物优势种群生态位分析[J]. 长江流域资源与环境, 2014, 23(3): 344-350.
XIA Ting, CHEN Jing, CAO Fangyi, et al. Niche analysis of phytoplankton in an urban river connected with the Yangtze River, Zhenjiang, China[J]. Resources and Environment in the Yangtze Basin, 2014, 23(3): 344-350.
[16] 覃雪波. 基于灰色关联的寒区湿地春夏季浮游植物数量与环境因子关系[J]. 南方水产, 2009, 5(1): 17-22.
QIN Xuebo. Relationship between phytoplankton quantity and its environmental factors in wetland of cold regions in spring and summer based on the grey association analysis[J]. South China Fisheries Science, 2009, 5(1): 17-22.
[17] 孙玉刚. 灰色关联分析及其应用的研究[D]. 南京: 南京航空航天大学, 2007.
SUN Yugang. Research on grey incidence analysis and its application[D]. Nanjing: Nanjing University of Aeronautics and Astronautics, 2007.
[18] 焦海峰, 施慧雄, 尤仲杰, 等. 渔山岛岩礁基质潮间带大型底栖动物优势种生态位[J]. 生态学报, 2011, 31(14): 3 928-3 936.
JIAO Haifeng, SHI Huixiong, YOU Zhongjie, et al. Niche analysis of dominant species of macrobenthic community at a tidal flat of Yushan Island[J]. Acta Ecologica Sinica, 2011, 31(14): 3 928-3 936.
[19] 李倩倩, 潘杨, 贡丹燕, 等. 无机型城市景观水体表观污染的悬浮颗粒物粒度分布特征: 以中国运河苏州段为例[J]. 环境科学, 2016, 37(12): 4 662-4 670.
LI Qianqian, PAN Yang, GONG Danyan, et al. Grain size distribution characteristics of suspended particulate matter as influenced by the apparent pollution in the inorganic type urban landscape water: Taking the canal of Suzhou section as example[J]. Environmental Science, 2016, 37(12): 4 662-4 670.
[20] 王刚, 赵松岭, 张鹏云, 等. 关于生态位定义的探讨及生态位重叠计测公式改进的研究[J]. 生态学报, 1984, 4(2): 119-127.
WANG Gang, ZHAO Songling, ZHANG Pengyun, et al. On the definition of niche and the improved formula for measuring niche overlap[J]. Acta Ecologica Sinica, 1984, 4(2): 119-127
[21] 王仁忠. 放牧影响下羊草草地主要植物种群生态位宽度与生态位重叠的研究[J]. 植物生态学报, 1997, 21(4): 304-311.
WANG Renzhong. The niche breadths and niche overlaps of main plant populations in leymus chinensis grassland for grazing[J]. Acta Phytoecologica Sinica, 1997, 21(4): 304-311.
[22] 王振方, 张玮, 杨丽, 等. 异龙湖不同湖区浮游植物群落特征及其与环境因子的关系[J]. 环境科学, 2019, 40(5): 2 249-2 257.
WANG Zhenfang, ZHANG Wei, YANG Li, et al. Characteristics of phytoplankton community and its relationship with environmental factors in different regions of Yilong Lake, Yunnan Province, China[J]. Environmental Science, 2019, 40(5): 2 249-2 257.
[23] 张涛, 陈丽, 刘晓曦, 等. 云南中部和南部湖泊夏季浮游植物空间分布及其影响因子[J]. 生态学杂志, 2020, 39(10): 3 350-3 362.
ZHANG Tao, CHEN Li, LIU Xiaoxi, et al. Spatial pattern and influencing factors of phytoplankton in lakes of central and southern Yunnan in summer[J]. Chinese Journal of Ecology, 2020, 39(10): 3 350-3 362.
[24] 李娜, 周绪申, 孙博闻, 等. 白洋淀浮游植物群落的时空变化及其与环境因子的关系[J]. 湖泊科学, 2020, 32(3): 772-783.
LI Na, ZHOU Xushen, SUN Bowen, et al. Spatiotemporal variation of phytoplankton community and its relationship with environmental factors in the Lake Baiyangdian[J]. Journal of Lake Sciences, 2020, 32(3): 772-783.
[25] 李卫平, 徐静, 于玲红, 等. 乌梁素海冰封期营养盐及浮游植物的分布特征[J]. 生态环境学报, 2014, 23(6): 1 007-1 013.
LI Weiping, XU Jing, YU Linghong, et al. Distribution characteristics of nutrients and phytoplankton in Wuliangsuhai Lake during the icebound season[J]. Ecology and Environmental Sciences, 2014, 23(6): 1 007-1 013.
[26] 郭燕, 杨邵, 沈雅飞, 等. 三峡库区消落带现存草本植物组成与生态位[J]. 应用生态学报, 2018, 29(11): 3 559-3 568.
GUO Yan, YANG Shao, SHEN Yafei, et al. Composition and niche of the existing herbaceous plants in the water-level-fluctuating zone of the Three Gorges Reservoir Area, China[J]. Chinese Journal of Applied Ecology, 2018, 29(11): 3 559-3 568.
[27] 王司阳, 张笑欣, 田世民, 等. 黄河流域干旱区湖泊冰封期浮游植物群落结构特征及影响因子研究[J]. 水利学报, 2020, 51(9): 1 070-1 079.
WANG Siyang, ZHANG Xiaoxin, TIAN Shimin, et al. Study on phytoplankton community structure characteristics and its influencing factors of lakes in arid regions of the Yellow River Basin during ice-sealing period[J]. Journal of Hydraulic Engineering, 2020, 51(9): 1 070-1 079.
[28] ELLIOTT J A. The seasonal sensitivity of Cyanobacteria and other phytoplankton to changes in Flushing rate and water temperature[J]. Global Change Biology, 2010, 16(2): 864-876.
[29] SALMASO N, BUZZI F, GARIBALDI L, et al. Effects of nutrient availability and temperature on phytoplankton development: A case study from large lakes south of the Alps[J]. Aquatic Sciences, 2012, 74(3): 555-570.
[30] BOYD P W, LAW C S, WONG C S, et al. The decline and fate of an iron-induced subarctic phytoplankton bloom[J]. Nature, 2004, 428(6 982): 549-553.
[31] SCHABHÜTTL S, HINGSAMER P, WEIGELHOFER G, et al. Temperature and species richness effects in phytoplankton communities[J]. Oecologia, 2013, 171(2): 527-536.
[32] WHITEFORD E J, MCGOWAN S, BARRY C D, et al. Seasonal and regional controls of phytoplankton production along a climate gradient in south-west Greenland during ice-cover and ice-free conditions[J]. Arctic, Antarctic, and Alpine Research, 2016, 48(1): 139-159.
[33] WINDER M, CLOERN J E. The annual cycles of phytoplankton biomass[J]. Philosophical Transactions of the Royal Society of London Series B, Biological Sciences, 2010, 365(1 555): 3 215-3 226.
[34] XU Y Y, CAI Q H, YE L, et al. Asynchrony of spring phytoplankton response to temperature driver within a spatial heterogeneity bay of Three-Gorges Reservoir, China[J]. Limnologica, 2011, 41(3): 174-180.
[35] 杜彩丽, 杨丽, 赵诣, 等. 淀山湖浮游动物群落时空分布特征及其与环境因子的关系[J]. 环境科学, 2019, 40(10): 4 513-4 522.
DU Caili, YANG Li, ZHAO Yi, et al. Temporal and spatial variation of zooplankton community structure and its relationship with environmental factors in Dianshan Lake, Shanghai[J]. Environmental Science, 2019, 40(10): 4 513-4 522.
[36] 李超男, 水玉跃, 田阔, 等. 温州湾春季主要游泳动物生态位与种间联结性[J]. 生态学报, 2017, 37(16): 5 522-5 530.
LI Chaonan, SHUI Yuyue, TIAN Kuo, et al. A study of niche and interspecific association and functional group of major nekton in the spring of Wenzhou Bay[J]. Acta Ecologica Sinica, 2017, 37(16): 5 522-5 530.
[37] 杨文焕, 申涵, 周明利, 等. 冻融期包头南海湖浮游植物群落及优势种生态特征[J]. 湖泊科学, 2020, 32(2): 450-461.
YANG Wenhuan, SHEN Han, ZHOU Mingli, et al. Ecological characteristics of dominant phytoplankton community in Lake Nanhai(Baotou) during freezing-thawing period[J]. Journal of Lake Sciences, 2020, 32(2): 450-461.
[38] 贺玉晓, 刘天慧, 任玉芬, 等. 北运河秋冬季浮游植物群落结构特征及影响因子分析[J]. 环境科学学报, 2020, 40(5): 1 710-1 721.
HE Yuxiao, LIU Tianhui, REN Yufen, et al. Characteristics and influencing factors of phytoplankton community structure in autumn and winter of the North Canal, Beijing[J]. Acta Scientiae Circumstantiae, 2020, 40(5): 1 710-1 721.
[39] 杨波, 储昭升, 金相灿, 等. CO2/pH对三种藻生长及光合作用的影响[J]. 中国环境科学, 2007, 27(1): 54-57.
YANG Bo, CHU Zhaosheng, JIN Xiangcan, et al. Influence of CO2/pH on growth and photosynthesis of three kinds of algae[J]. China Environmental Science, 2007, 27(1): 54-57.
[40] KIM H, SPIVACK A J, MENDEN-DEUER S. pH alters the swimming behaviors of the raphidophyte Heterosigma akashiwo: Implications for bloom formation in an acidified ocean[J]. Harmful Algae, 2013, 26: 1-11.
[41] 王秀娟, 刘米雪, 李胜男, 等. CO2浓度升高对浮游藻类元素化学计量值的影响[J]. 湖泊科学, 2017, 29(6): 1 379-1 385.
WANG Xiujuan, LIU Mixue, LI Shengnan, et al. The effect of CO2enrichment on elemental stoichiometry of phytoplankton under different trophic status[J]. Journal of Lake Sciences, 2017, 29(6): 1 379-1 385.
[42] NALLEY J O, O'DONNELL D R, LITCHMAN E. Temperature effects on growth rates and fatty acid content in freshwater algae and cyanobacteria[J]. Algal Research, 2018, 35: 500-507.
[43] WANG X Y, SUN M J, WANG J M, et al. Microcystis genotype succession and related environmental factors in Lake Taihu during cyanobacterial blooms[J]. Microbial Ecology, 2012, 64(4): 986-999.
[44] 刘俊鹏, 屈亮, 刘信勇, 等. 不同营养条件对地表水藻类生长的影响[J]. 环境工程, 2016, 34(S1): 407-410.
LIU Junpeng, QU Liang, LIU Xinyong, et al. Effects of different nutrient conditions on the growth of algae in surface water[J]. Environmental Engineering, 2016, 34(S1): 407-410.
[45] 张莹莹, 张经, 吴莹, 等. 长江口溶解氧的分布特征及影响因素研究[J]. 环境科学, 2007, 28(8): 1 649-1 654.
ZHANG Yingying, ZHANG Jing, WU Ying, et al. Characteristics of dissolved oxygen and its affecting factors in the Yangtze Estuary[J]. Environmental Science, 2007, 28(8): 1 649-1 654.
[46] 孟睿, 何连生, 过龙根, 等. 长江中下游草型湖泊浮游植物群落及其与环境因子的典范对应分析[J]. 环境科学, 2013, 34(7): 2 588-2 596.
MENG Rui, HE Liansheng, GUO Longgen, et al. Canonical correspondence analysis between phytoplankton community and environmental factors in macrophtic lakes of the middle and lower reaches of Yangtze River[J]. Environmental Science, 2013, 34(7): 2 588-2 596.
[47] 杨福霞, 简慧敏, 田琳, 等. 大辽河口COD与DO的分布特征及其影响因素[J]. 环境科学, 2014, 35(10): 3 748-3 754.
YANG Fuxia, JIAN Huimin, TIAN Lin, et al. Distribution characteristics of COD and DO and its influencing factors in the daliaohe estuary[J]. Environmental Science, 2014, 35(10): 3 748-3 754.
[48] 杨文焕, 周明利, 申涵, 等. 寒旱区湖泊冰封期有机碳氮同位素研究[J].中国环境科学, 2020, 40(2): 789-797.
YANG Wenhuan, ZHOU Mingli, SHEN Han, et al. Organic carbon and nitrogen isotopes of lakes in cold and arid region during the frozen period[J]. China Environmental Science, 2020, 40(2): 789-797.
[49] 于洋, 彭福利, 孙聪, 等. 典型湖泊水华特征及相关影响因素分析[J]. 中国环境监测, 2017, 33(2): 88-94.
YU Yang, PENG Fuli, SUN Cong, et al. Analysis on the characteristics and impact factors of water bloom in the lake[J]. Environmental Monitoring in China, 2017, 33(2): 88-94.
Niche Analysis of the Dominant Phytoplankton Species in Nanhai Lakes in Northwest China
YAO Zhi1, LIU Yijie2, HE Guihao1, ZHU Rong2, YANG Wenhuan1, SUN Tao3, FENG Dongdong1, LI Weiping1*
(1. Inner Mongolia University of Science and Technology, Baotou 014010, China;2. Northwest Engineering and Research Incorporation Limited of China Metallurgical Group, Baotou 014010, China;3. Dezhou Municipal Water Resources Bureau, Dezhou 253041, China)
【Objective】Humanity and temperature are two factors affecting microbial communities not only in terrestrial systems but also in aquatic ecosystems. Taking Nanhai lake in cold-arid Baotou as an example, this paper analyzes the relationship between phytoplankton community and eutrophication in the lake.【Method】 Water samples were taken from December 2017 to November 2018 from the lake. Phytoplankton community in each sample was counted. The ecological breadth and overlap of the dominant phytoplankton species were described by the niche analysis method, from which we calculated the effect of water environmental factors on phytoplankton community using the grey relational analysis.【Result】The dominant phytoplankton species detected from the water samples were 7 phyla, 38 genera and 95 species during the frozen period, and 7 phyla, 47 genera, 106 species during the unfrozen period. The main phytoplankton community comprises cyanobacteria-green algae-diatom. The niche breadth and niche overlap of the dominant species during the frozen period were smaller than those during the unfrozen period, and the competition of phytoplankton for resources was strong during the unfrozen period. The gray correlation analysis showed that the chemical oxygen demand (COD) and pH of the water were strongly correlated with phytoplankton density. Total phosphorus (TP) had a great impact on change in the phytoplankton population during the frozen period, while water temperature impacts the phytoplankton population change during the unfrozen period more greatly. 【Conclusion】The dominant phytoplankton species in the Nanhai Lake are affected by a variety of ecological factors and vary with time. Organic pollutants and phosphorus nutrients are the main factors affecting the phytoplankton community.
cold-arid area; niche; phytoplankton; grey relation analysis; urban lake
姚植, 朱蓉, 何桂豪, 等. 寒旱区湖泊浮游植物优势种生态位分析: 以包头南海湖为例[J]. 灌溉排水学报, 2022, 41(11): 91-100.
YAO Zhi, ZHU Rong, HE Guihao, et al. Niche Analysis of the Dominant Phytoplankton Species in Nanhai Lakes in Northwest China[J]. Journal of Irrigation and Drainage, 2022, 41(11): 91-100.
1672 - 3317(2022)11 - 0091 - 10
X524
A
10.13522/j.cnki.ggps.2022091
2022-02-23
国家重点研发计划项目(2019YFC0409204);内蒙古自治区科技计划项目(2021GG021)
姚植(1996-),男。硕士研究生,主要从事湖泊水生态调查研究。E-mail: 13083776928@163.com
李卫平(1973-),男。教授,主要从事水资源优化及河湖环境修复研究。E-mail: sjlwp@163.com
责任编辑:赵宇龙

