糖尿病对肾小球内葡萄糖转运蛋白1表达的影响
张丽 吴美延 许颖 许钟镐
(吉林大学第一医院肾病科,吉林 长春 130061)
糖尿病肾病(DN)是糖尿病常见的微血管并发症之一,也是终末期肾脏病常见原因之一〔1〕。糖尿病起始原因在于细胞对葡萄糖的摄取功能紊乱,细胞对葡萄糖的摄取需要借助于细胞膜上的葡萄糖转运蛋白(GLUT)〔2〕。GLUT是一类调控细胞外葡萄糖进入细胞内的跨膜蛋白家族,GLUT已经被鉴定出14种蛋白,并表现出广泛的组织特异性调节分布,GLUT蛋白被认为具有12个跨膜结构域。在肾脏组织中,主要分布在血管平滑肌细胞、肾小球系膜细胞、肾小管髓袢升支粗段等部位〔3〕。在培养的肾小球膜细胞中,GLUT1似乎是主要的转运蛋白,但因为GLUT4在培养中不断下调,因此系膜细胞摄取葡萄糖主要依靠GLUT1〔4〕。多数学者认为GLUT表达增多,肾脏细胞内蓄积多余葡萄糖而致系膜细胞肥大,细胞外基质增多,最终导致蛋白尿,因此,GLUT表达及易位异常是DN发生的关键因素之一〔5〕。近年来来自花生四烯酸的12脂氧化酶(12-LO)通路及其活化产物12-氢氧化二十碳四烯酸(HETE),已被证实通过p38丝裂素活化蛋白激酶(MAPK)信号通路介导糖尿病肾小球肥大,参与DN的发生〔6〕。影响12-LO-12(S)-HETE 途径可阻止肾素-血管紧张素系统激活,改善胰岛素抵抗,从而延缓2型糖尿病肾小球肥大和蛋白尿的进展〔7,8〕。有研究表明,在血管平滑肌细胞和血管内皮细胞中,GLUT1、12-LO及12-HETE的表达随着细胞外葡萄糖浓度变化而变化,且具有类似的时间依赖性〔9〕。12-LO在DN肾组织中明显升高,而GLUT1通过非依赖胰岛素方式受葡萄糖浓度调节〔10〕,因此推测在糖尿病中GLUT1与12-LO之间可能存在密切联系,GLUT1对DN的具体作用机制尚不明确,所以对糖尿病肾小球内GLUT1的变化及GLUT1与12-LO之间相关关系的研究具有重要意义。本实验通过高脂饮食联合小剂量链脲佐菌素(STZ)造成2型糖尿病动物模型及肾小球系膜细胞培养来研究在体内及体外高糖(HG)对12-LO和GLUT1的作用。
1 材料和方法
1.1材料 大鼠肾小球系膜细胞系HBZY-1购于上海中乔新舟生物科技有限公司,EMEM培养液、胎牛血清(FBS)购于美国Gibco公司,D-(+)-Glucose购于德国Merck公司,STZ及 β-actin 抗体购于美国Sigma公司,12-LO、GLUT1抗体购于美国Abcam 公司,高脂饲料(含60%脂肪)购于美国Research Diets公司,尿白蛋白酶联免疫吸附试验(ELISA)试剂盒、尿肌酐(UCr)ELISA试剂盒购买于南京建成试剂公司,RT-PCR试剂盒购于美国ABI公司,聚偏二氟乙烯(PVDF)膜、Anti-Rabbit IgG辣根过氧化物酶(HRP)购于美国millipore公司。
1.2肾小球系膜细胞培养 复苏大鼠肾小球系膜细胞后用10% FBS EMEM培养至细胞融汇率达50%~60%,分成对照组和刺激组,对照组用1% FBS EMEM、刺激组用1% FBS EMEM+HG(30 mmol/L),分别在12 h、24 h收集细胞后取RNA,逆转录成cDNA,用于RT-PCR。重复以上实验在12 h、24 h收集细胞后提取总蛋白,用于Western印迹检测。
1.3动物模型建立 建立高脂饮食结合小剂量STZ诱导的DN大鼠模型,于北京维通利华实验动物技术有限公司订购200~220 g雄性SD大鼠45只,随机分成对照组(Control组,n=15)及高脂饮食组(DN组,n=30),Control组给予正常饲料喂养,DN组给予高脂饲料6 w,根据体重采用STZ 35 mg/kg腹腔注射,以血糖>16.7 mmol/L为2型糖尿病造模成功标准,至实验结束时成模并存活大鼠13只。实验期间连续监测大鼠血糖、体重,收集24 h尿液。6 w后处死大鼠,提取大鼠肾脏,进一步做相关指标筛查及测定。
1.4尿蛋白肌酐比值(ACR)等生化指标测定 ELISA试剂盒测定尿微量白蛋白(UALB)、尿肌酐(UCr),ACR=UALB/UCr。取材前称量大鼠重量(BW),取大鼠右侧肾脏盐水冲洗后称重(KW),计算肾脏肥大指数(KW/BW),应用相应检测试剂盒测定血糖(Glu),三酰甘油(TG),总胆固醇(TC),低密度脂蛋白胆固醇(LDL-C)。
1.5Western印迹 大鼠肾组织裂解后提取蛋白,测蛋白浓度。将蛋白加样于聚丙烯酰胺凝胶电泳(约1.5 h),PVDF转膜,5%脱脂奶粉封闭1 h,TBST洗膜后分别加入12-LO(1∶1 000)、抗GLUT1(1∶5 000)、抗β-actin(1∶5 000)的第一抗体进行杂交,4℃震荡过夜,TBST洗膜3次后加入HRP标记的第二抗体(1∶5 000),室温孵育1 h后显影。
1.6RT-PCR Trizol法提取总RNA,RNA浓度及纯度检测,在0.2 ml的Ep管内,按照RT-PCR试剂盒说明书配制反应液,合成cDNA。GAPDH正义引物5′-3′为GGAGAAACCTGCCAAGTATGA,反义5′-3′为TTGAAGTCACAGGAGACAACC;12-LO正义引物5′-3′为CTCCCTCCAAACATGAGATTCC,反义5′-3′为CCAGCTTCTCAGGAGGGTATAA;GLUT1正义引物5′-3′为CTCTGTGGGCCTCTTTGTTAAT;反义5′-3′为CCCAGTTTGGAGAAACCCATAA。
1.7病理学检查
1.7.1过碘酸雪夫(PAS)染色 石蜡切片法制备肾切片。将4 μm切片切至载玻片上,脱蜡、水合和用高碘酸氧化12 min。清洗后,用Schiff染料染色20 min,苏木素反染色(1 min),放入1%盐酸乙醇分化数秒,蒸馏水清洗,氨水返蓝5 s。通过光镜以400倍放大率检查每个切片中的肾小球。
1.7.2免疫组织化学染色(IHC) 对切片进行脱蜡及水化,3%甲醇-H2O2溶液37℃孵育10~15 min,双蒸水冲洗3 min。再进行抗原热修复,室温下用正常羊血清封闭1 h。加用1%BSA抗体稀释液稀释的一抗12-LO抗体(1∶500),于37℃孵育1~2 h。用PBS冲洗3次。HRP结合的第二抗体孵育1 min。苏木素复染,脱水、透明、封片。显微镜下400倍放大率观察。
1.8统计学方法 采用GraphPad Prism7.0软件进行t检验。
2 结 果
2.1细胞实验
2.1.1高糖刺激下12-LO表达变化 与对照组相比,给予HG刺激12 h后,刺激组系膜细胞内12-LO转录水平显著升高,刺激24 h后12-LO表达较12 h下降,但仍明显高于对照组(见表1)。Western结果显示,与对照组相比,给予HG刺激12 h、24 h后12-LO蛋白水平升高。见图1。
2.1.2高糖刺激下GLUT1表达变化 与对照组相比,给予HG刺激12 h后,大鼠系膜细胞内GLUT1转录水平升高,而24 h后GLUT1表达下降(见表1)。Western结果显示,与对照组相比,给予HG刺激后刺激组GLUT1蛋白含量12 h升高,24 h降低。见图1。
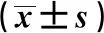
表1 两组12-LO、GLUT1在体内外转录水平
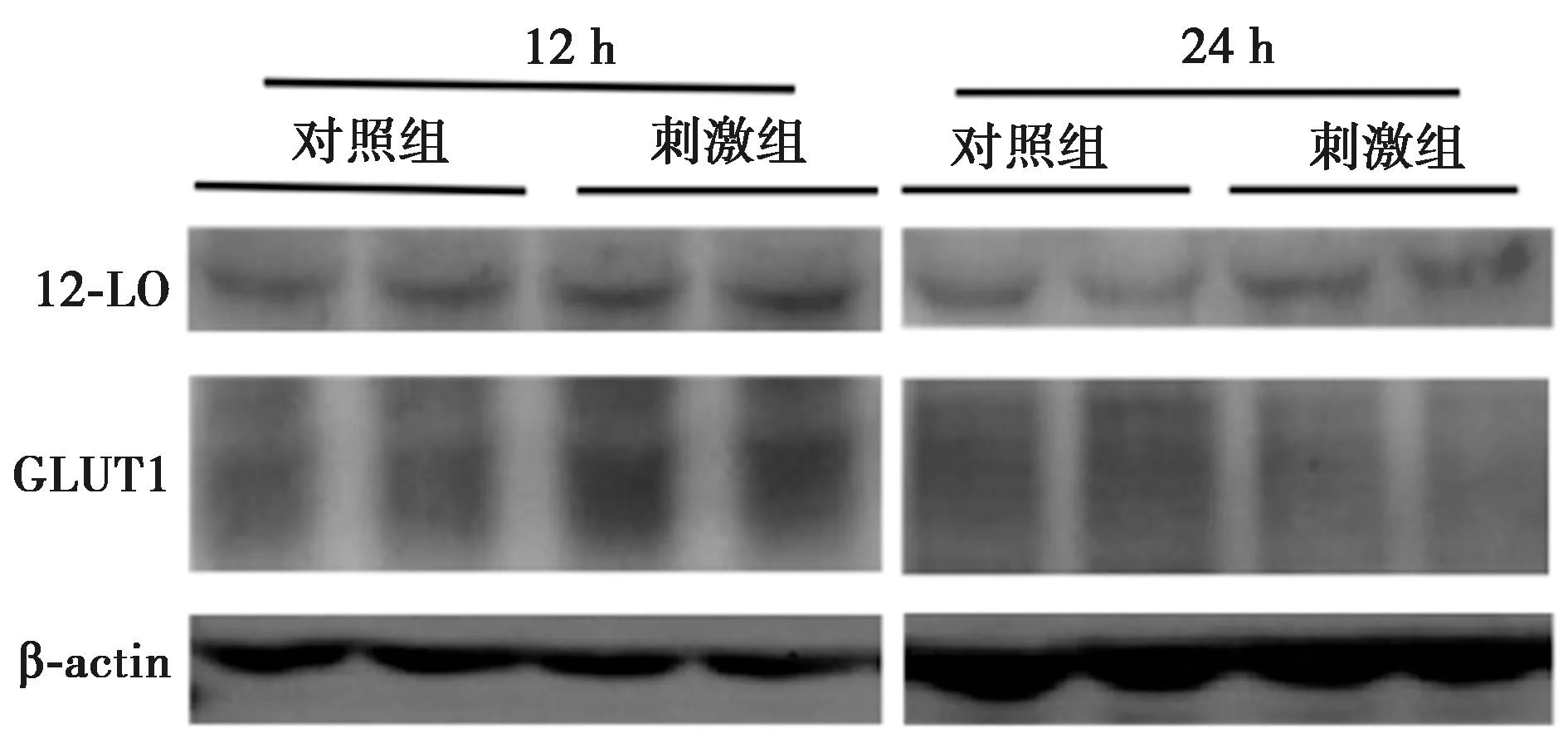
图1 两组肾小球系膜细胞中12-LO及GLUT1表达
2.2动物实验
2.2.112-LO在糖尿病肾小球中的表达变化 与Control组相比,DN组肾组织内12-LO转录水平明显升高(表2,P<0.05),IHC显示DN组肾小球内12-LO表达增加(图2)。
图2 12-LO在两组肾小球内表达(IHC,×400)
2.2.2大鼠生化指标比较 DN组ACR、KW/BW、Glu,TG、TC、LDL-C值均明显高于Control组(P<0.05)。见表2。

表2 两组生化指标比较
2.2.3两组肾脏病理学检查 Control组肾小球、肾小管结构正常,毛细血管清晰,而DN组肾小球体积明显增大,系膜基质增生,囊腔裂隙变窄,肾小管管腔狭窄,肾小管肿胀(图3)。
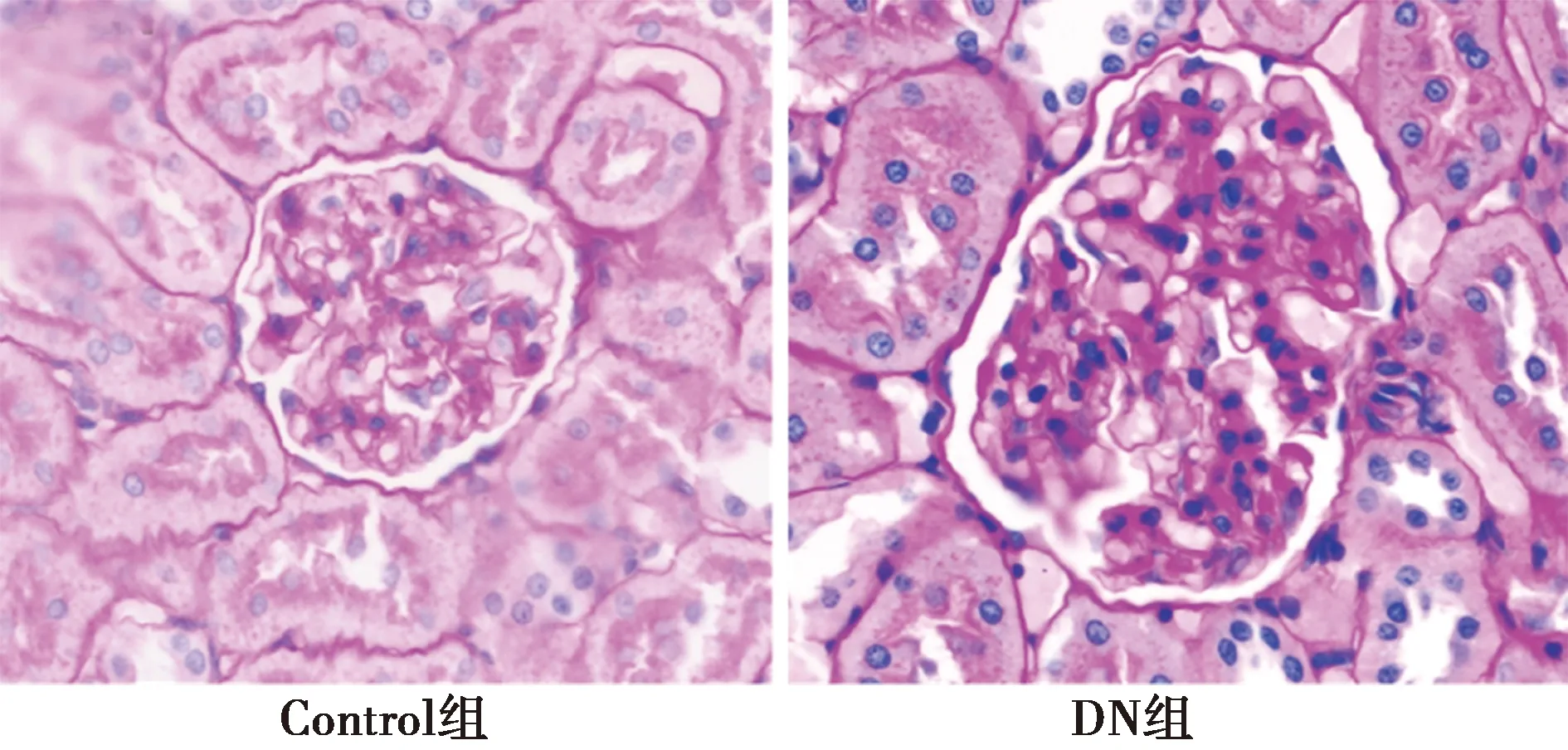
图3 两组肾脏组织PAS染色(×400)
2.2.4GLUT1在DN肾小球内表达变化 与Control组相比,DN组肾小球内GLUT1转录水平下降(表2,P<0.05),IHC结果显示DN组肾小球内GLUT1表达减少(图4)。
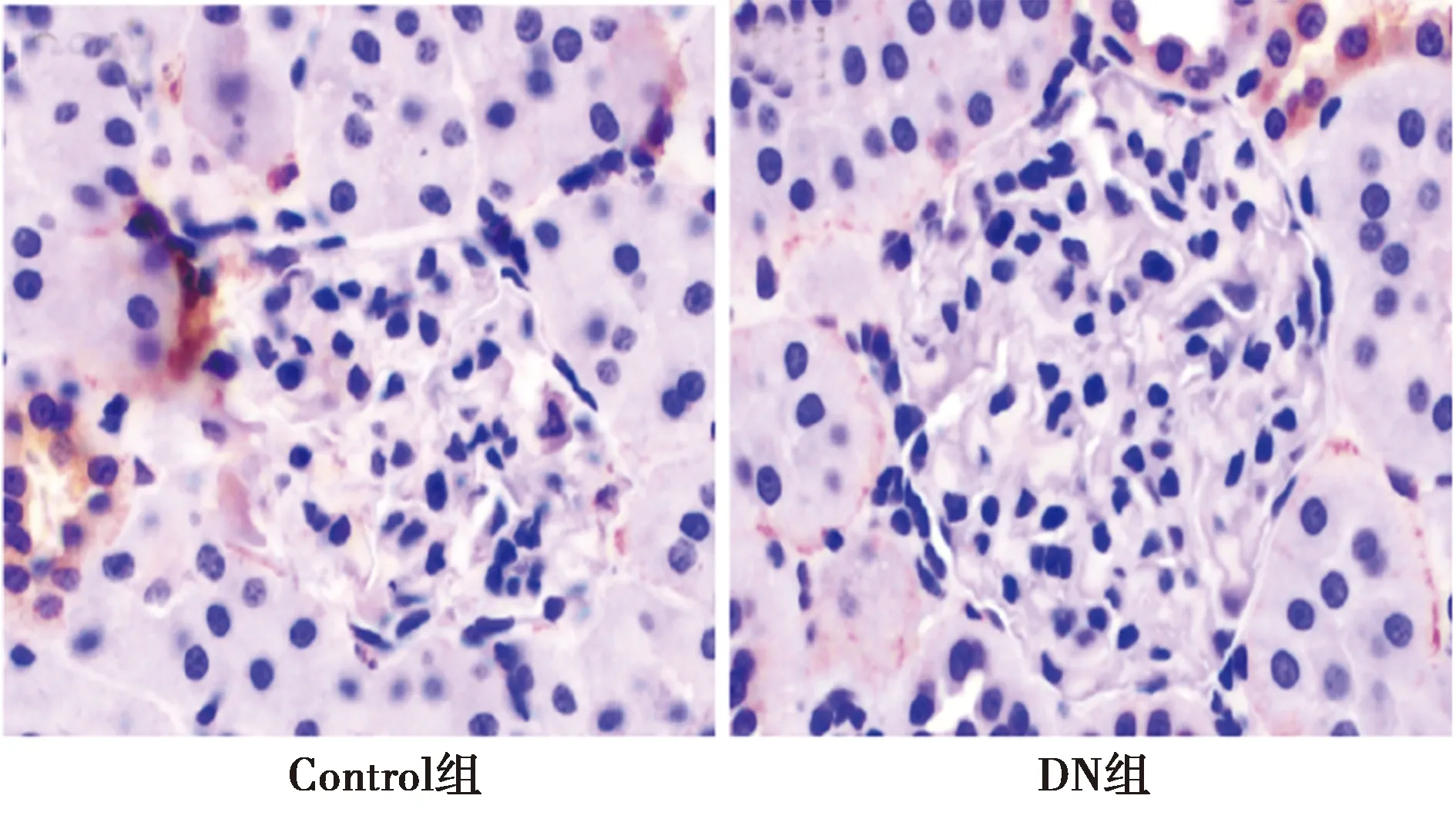
图4 GLUT1在两组肾小球内表达(IHC,×400)
3 讨 论
本研究发现无论在体内还是体外12-LO表达均升高,而GLUT1在HG刺激早期表达升高,晚期下降。本实验动物模型为高脂饮食6 w后糖尿病造模6 w的大鼠,未留取早期肾组织,未能观察早期DN肾小球中12-LO及GLUT1的表达变化及相关关系,在下一步实验将进行进一步验证。
目前,DN的确切发病机制尚不清楚,有研究证明高血糖会加速肾病进展〔11〕,在肾小球系膜细胞中,GLUT1是调控葡萄糖进入细胞的“看门人”,GLUT1的表达是葡萄糖利用的限速步骤〔12〕。目前已知的调节GLUT1基因表达的因素包括葡萄糖、血清生长因子、缺氧和高渗透压〔3〕。然而HG对GLUT1表达水平的调节尚未得到统一结论。有研究发现GLUT1表达增加提高细胞摄入葡萄糖,导致肾小球硬化的信号级联激活〔11,13〕。即使血糖正常,过度表达GLUT1的转基因小鼠仍会发生糖尿病性肾小球硬化〔13〕。相反,GLUT1反义序列的过度表达阻止了在高葡萄糖中培养的肾小球系膜细胞的糖尿病性改变〔14〕,而在糖尿病小鼠中,防止GLUT1表达升高会抑制系膜基质的扩张〔15〕。然而,其他一些研究却得到相反的结论,在足细胞特异性过表达GLUT1的糖尿病大鼠中发现GLUT1表达对糖尿病系膜基质扩张有一定的改善作用〔16〕。此外,罗格列酮通过增加质膜GLUT1的表达来增强培养的足细胞的葡萄糖摄取,已知它可通过过氧化物酶体增殖物激活受体(PPAR)-γ依赖机制可降低肾小球血管内皮生长因子(VEGF)水平,减轻糖尿病肾小球病变,因此罗格列酮可能是通过其对GLUT1和VEGF的影响对DN产生保护作用〔17〕。 研究发现内皮型一氧化氮合酶(eNOS)基因敲除的1型糖尿病小鼠中肾组织GLUT1蛋白水平与对照组比较无明显变化,而给予恩格列净后GLUT1水平明显升高〔18〕,提示恩格列净可能通过提高GLUT1水平实现肾组织保护作用。本实验也发现GLUT1水平在HG状态下先升高后降低。这与血管细胞中研究类似,Alpert等〔19〕发现HG环境下,细胞内12-LO产物12-HETE水平升高,而GLUT1表达下降及质膜丰度下降,从而限制细胞摄入过多葡萄糖及减少其破坏作用。因此,GLUT1表达的下降可能是应对HG刺激下的保护性机制。
综上,体外培养的系膜细胞内12-LO表达升高,GLUT1表达在HG刺激早期升高而晚期下降。DN大鼠肾小球内12-LO表达升高,GLUT1表达减少。DN条件下不同阶段肾小球内12-LO和GLUT1表达不完全同步提示12-LO和GLUT1在DN肾小球损伤过程中可能既有致病作用,又有保护性作用。

