猪伪狂犬病病毒实时荧光定量PCR 检测方法的建立及初步应用
徐凯文,廖 帆,雷 磊,谭 磊
(湖南农业大学动物医学院,湖南 长沙 410128)
猪伪狂犬病(pseudorabies, PR)是由猪伪狂犬病病毒(pseudorabies virus, PRV)感染所致。尽管近年来我国养猪业对猪伪狂犬病防控取得诸多进展,但目前该病在全国各地仍广泛流行,给养猪业造成巨大的经济损失。不同发育阶段猪群感染猪伪狂犬病所表现的临床症状差异较大,但该病对仔猪和妊娠母猪危害最大,可导致仔猪腹泻、呕吐和神经症状等;而妊娠母猪则出现流产、死胎和木乃伊胎等症状[1]。随着PRV在我国猪场广泛流行,该病原接触其他动物甚至是人类的几率也相应提高,由此引发动物或人类感染猪伪狂犬病的报道也受到广泛关注[2]。特别是2020年我国科研人员首次从感染急性脑炎患者脑脊液中成功分离到一株PRV变异株,这证实了PRV可由猪向人进行跨物种传播[3]。
PRV属于双链DNA病毒,其基因组大小约143 kbp,可编码超过70个蛋白。其中部分蛋白与PRV毒力密切相关,如gE、gI和TK等,缺失毒力相关基因(如gE)不影响毒株的免疫原性,但会降低毒力。目前国内广泛应用的PRV疫苗(弱毒疫苗和灭活疫苗)均已将gE等基因(如gE、TK)缺失,得益于此,靶向gE基因序列或抗体设计的分子生物学诊断方法或血清学诊断方法可有效区分PRV野毒感染和疫苗免疫猪群[2]。为了解当前湖南省PRV野毒流行情况,建立一种特异性好、灵敏度高且可操作性强的PRV-gE SYBR Green I 荧光定量PCR检测方法,为PRV的早期诊断与防控提供了有效的方法。
1 材料与方法
1.1 主要材料
pUCmT载体、DL 2 000 DNA Marker和2×PCR easy mix等为宝生物工程(大连)有限公司产品;限制性内切酶(EcoR I和BamH I)、T4连接酶等购自于赛默飞有限公司;大肠杆菌感受态细胞购自于北京金沙生物技术有限公司;电泳缓冲液及琼脂粉等购自于北京索莱宝科技有限公司;DNA/RNA提取试剂盒购自于AXYGEN公司;DNA凝胶回收及质粒提取试剂盒均为美国OMEGA Biotek公司产品。
2021年7—10月15份疑似PRV感染病料(脑组织、淋巴结和扁桃体等)保存于湖南农业大学动物医学院动物疫病防控与动物模型实验室;PRV、猪圆环病毒2型(PCV2)、猪圆环病毒3型(PCV3)、猪流行性腹泻病毒(PEDV)、猪繁殖与呼吸综合征病毒(PRRSV)和猪传染性胃肠炎病毒(TGEV)核酸保存于湖南农业大学动物医学院动物疫病防控与动物模型实验室。
1.2 方法
1.2.1 引物设计与合成 从NCBI网站下载多条PRV gE基因序列,利用DNA Star设计特异性PCR扩增引物,PRV-gE-F:5'-CGGACGCACATGCTCTC TCCG-3';PRV-gE-R:5'-GGTTGGCGGTCACG CCATAG-3',扩增片段长度为300 bp。其后根据获得的序列设计qPCR引物,qPCR-PRV-gE-F:5'-GACCCCGAGGACGAGTTCA-3';qPCR-PRV-gE-R:5'-ACGCCATAGTTGGGTCCATT-3'。以上引物均由长沙擎科生物有限公司合成。
1.2.2 阳性质粒制备 根据DNA/RNA提取试剂盒说明书提取PRV病毒基因组,其后以PRV-gE-F和PRV-gE-R为引物扩增目的片段。凝胶回收PCR产物后将其克隆至pUCm-T载体,连接产物经转化、挑菌和质粒提取,最后通过酶切验证后将阳性质粒送至长沙擎科生物有限公司进行测序。测定阳性质粒浓度,以此确定质粒浓度为4.545×1010拷贝/μL,其后将其进行10倍梯度稀释,取4.545×10-1~4.545×109拷贝/μL共11个稀释度质粒作为标准品。
1.2.3 PRV-gE荧光定量PCR方法建立 选取浓度为4.545×104~4.545×109拷贝/μL标准质粒建立标准曲线,其反应体系为10.0 μL,包括5.0 μL 2×SYBR Green mix、上下游引物(10 pmoL)各0.2 μL、质粒模板1.0 μL及无RNA酶水3.6 μL,每个反应重复3次,并设置阴性对照。反应条件为95 ℃5 min;94 ℃ 30 s,56 ℃ 30s,72 ℃ 15 s,共设置40个循环。
1.2.4 敏感性试验 选取浓度为4.545×10-1~4.545×106拷贝/μL,每个浓度样品重复3次,每次检测均设置3个重复的阴性对照,阴性模板为无RNA酶水,进行荧光定量PCR检验,以确定该方法的最低检测浓度。同时以常规PCR对质粒模板进行扩增,并将PCR产物进行琼脂凝胶电泳,比较两种检测方法的灵敏度。
1.2.5 特异性试验 以PCV2、PPV(猪细小病毒)、PCV3、PRV、PEDV、TGEV和PRRSV基因组进行特异性试验。每个样品3次重复,并设置阴性对照,用所建立的荧光定量PCR方法进行检测,确定其特异性。
1.2.6 重复性试验 选取3个稀释度(104拷贝/μL、105拷贝/μL、106拷贝/μL)作为模板,进行3次批内和批间重复试验,对Ct值进行分析,用以评价所建立的PRV荧光定量PCR检测方法的稳定性。
1.3 检测方法初步应用
选择15份临床疑似PR组织样品,使用DNA/RNA基因组提取试剂盒提取基因组DNA,分别用本文建立的荧光定量PCR方法和普通PCR方法对样品进行检测与分析。
2 结果
2.1 标准质粒双酶切验证
应用PRV-gE-F和PRV-gE-R为引物扩增目的片段,其后将目的片段胶回收并连接至pUCmT载体,经转化、质粒提取和双酶切,取酶切产物进行凝胶电泳。结果如图1所示,酶切后质粒凝胶电泳后可出现2条带,分别为载体本身条带(2 800 bp)和目的片段条带(300 bp),与预期结果相符,证明标准质粒构建成功。
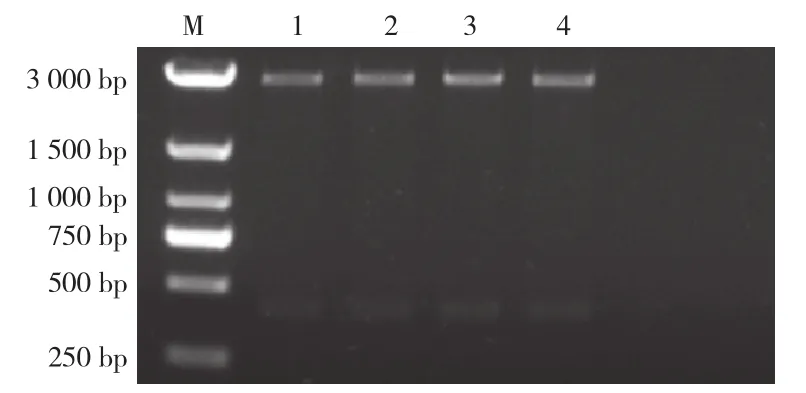
图1 质粒双酶切核酸凝胶电泳
2.2 靶向PRV-gE荧光定量PCR方法标准曲线制备
将阳性质粒测序并确定序列正确,其后将标准质粒进行1 0倍梯度稀释。选择4.545×104~4.545×109拷贝/μL 6个浓度作为模板进行荧光定量PCR反应,并绘制标准曲线图。结果如图2所示,PRV质粒浓度与对应的CT值呈现良好的线性关系:Lg(DNA拷贝/μL)=-0.321x+10.87 (x代表拷贝数),R2=0.994,E=109.509%。且PRV-gE扩增溶解曲线峰值单一,其溶解温度约90 ℃。
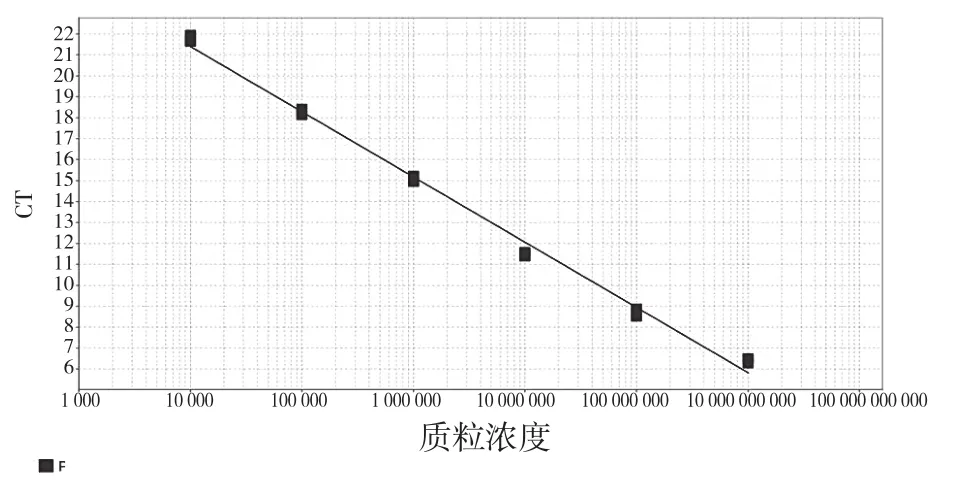
图2 PRV-gE荧光定量PCR标准曲线
2.3 靶向PRV-gE荧光定量PCR灵敏性测定
将所构建的PRV gE标准阳性质粒10倍梯度稀释,选取4.545×10-1~4.545×106拷贝/μL进行荧光定量PCR反应。如图3可见,此方法对4.545拷贝/μL可扩增出特异性曲线,具有较高的灵敏性(图3左)。而PCR反应灵敏度仅为4.545×102拷贝/μL(图3右),说明本研究所建立的荧光定量PCR法较传统的PCR反应灵敏度高近100倍。
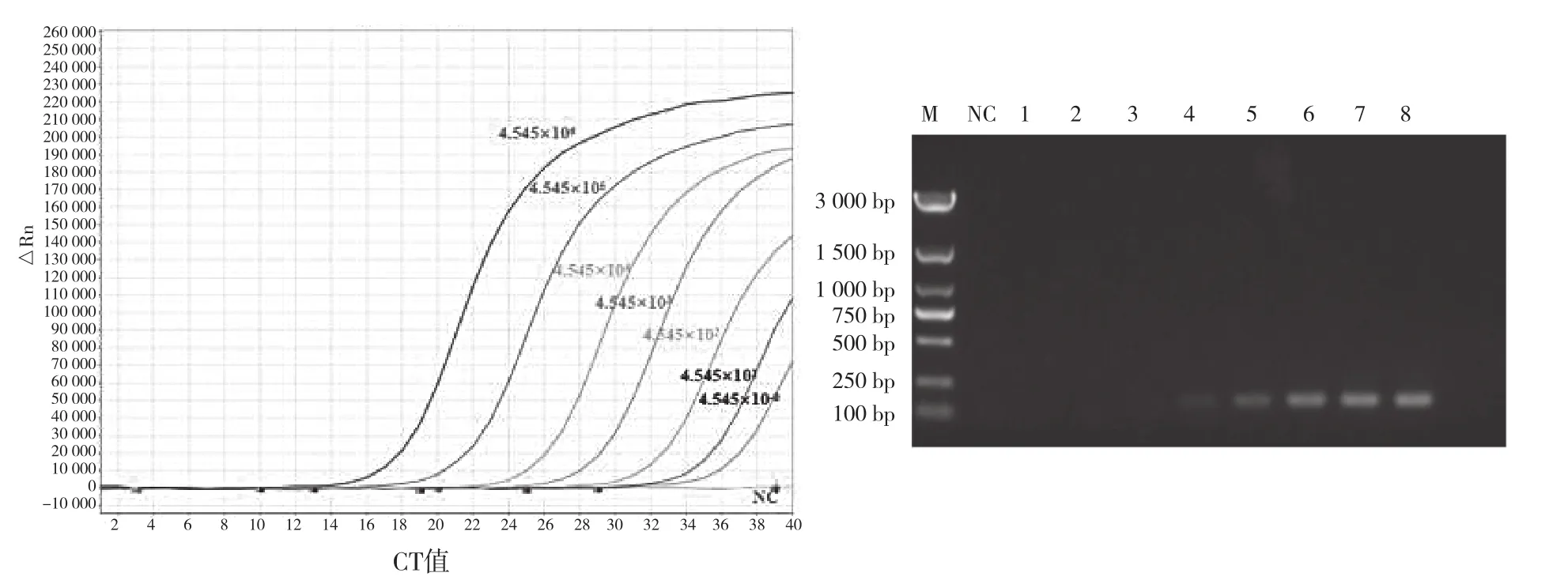
图3 靶向PRV-gE荧光定量PCR(左)和传统PCR(右)灵敏性测定结果
2.4 靶向PRV-gE荧光定量PCR特异性测定
为探究本文建立检测方法的特异性,使用PCV2、PPV、PCV3、PEDV、PRV、TGEV和PRRSV基因组模板为参照,同时设置阳性对照(已知PRV基因组)和阴性对照(无RNA酶水)。结果如图4所示,该方法仅对PRV基因组扩增出特异性曲线,阴性对照及其他病毒基因组均无特异性扩增曲线,表明此方法具有良好的特异性。
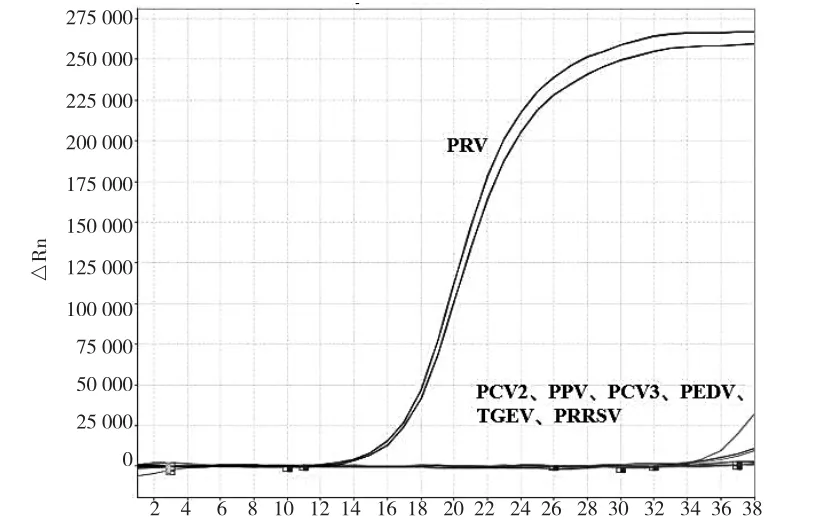
图4 靶向PRV-gE荧光定量PCR法检测不同病毒扩增曲线结果
2.5 靶向PRV-gE荧光定量PCR重复性试验
将标准阳性重组质粒进行10倍比稀释,选取不同浓度质粒(104拷贝/μL、105拷贝/μL和106拷贝/μL)进行重复性试验,每个模板重复3个孔,不同时间进行荧光定量PCR反应,分析组内及组间数据。结果如表1所示,所建立的荧光定量PCR检测方法标准方差均低于0.5,变异系数整体低于2%,说明所建立的方法具有较好的稳定性及重复性。
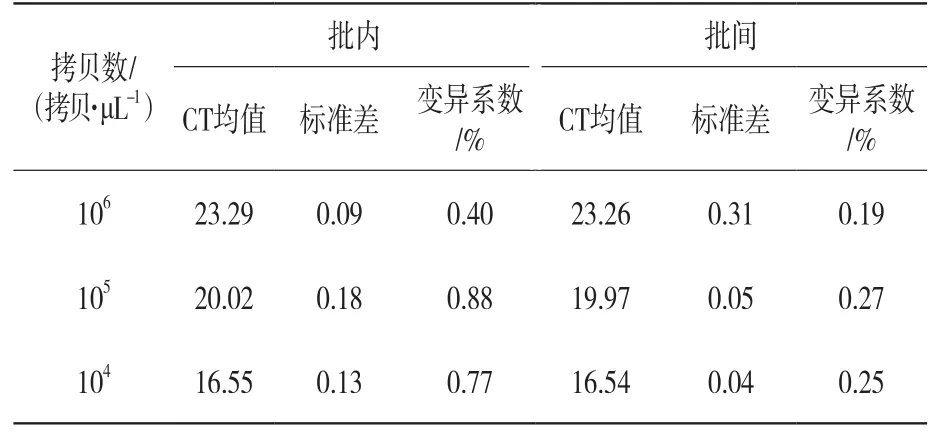
表1 伪狂犬病病毒批内重复结果
2.6 临床样品检测结果
选择湖南农业大学动物医学院动物疫病防控与动物模型实验室保存的15份疑似感染PR临床组织样品,对样品提取基因组后分别使用本文建立的荧光定量PCR和传统PCR进行检测。结果发现,针对PRV gE基因设计的荧光定量 PCR检测方法共确定3份样品为PRV gE阳性,其阳性率为20.0%(3/15);而普通PCR法只能确定2份样品为阳性,阳性率为13.33%(2/15),说明荧光定量PCR法在临床检测上较传统PCR法更为灵敏,更加适合于疾病监测。
3 讨论
当前猪伪狂犬病在全世界仍然广泛流行,其为危害世界养猪业(尤其是我国)的重要病原之一。得益于PRV-gE基因缺失疫苗(弱毒疫苗和灭活疫苗)的广泛应用,靶向gE抗体或基因序列的诊断方法可有效区分疫苗免疫接种猪群和PRV野毒感染猪群。疫苗接种只能避免猪群发生PR,却不能清除潜伏感染的病毒和阻止病毒重新激活[4]。因此,建立一种快速、便捷、准确且灵敏度高的检测方法对于PRV感染早期诊断具有重要意义[5-6]。
相比于传统PCR技术,荧光定量PCR法具有便捷、快速和灵敏等优势,且无需电泳,这不但节省时间,且避免环境污染和降低对人员健康危害[5]。本文基于SYBR Green I所建立的靶向PRV-gE荧光定量PCR法灵敏度为4.545拷贝/µL,其灵敏度与已报道的实时荧光定量PCR法一致,但其较传统PCR灵敏度高近100倍,且特异性和重复性良好。此外,将本方法和传统PCR对15份疑似PR的病料进行检测,发现其检出率较传统PCR高,分别为20.0%(3/15)和13.33%(2/15),说明该方法较传统PCR具有更高的灵敏性,可以用于伪狂犬病的早期诊断和定量等方面。