一例类NADC30猪繁殖与呼吸综合征病毒感染的诊断及防控
崔志刚,于合宅
(1.望都县农业农村局,河北 保定 072450;2.望都县畜牧站,河北 保定 072450)
猪繁殖与呼吸综合征(PRRS)在我国猪场十分常见,该病是由猪繁殖与呼吸综合征病毒(PRRSV)感染所导致的一种传染病,又称为蓝耳病[1]。PRRS在临床上主要表现为仔猪呼吸道疾病(发病率和死亡率均较高)和妊娠母猪繁殖障碍(流产、死胎等),该病的流行给我国养猪业造成了巨大的经济损失[2]。
PRRSV属于单股正链RNA病毒,其基因组大小约15 kb,含有至少10个开放阅读框[3]。该病毒基因组部分序列在进化过程中容易发生突变,根据其基因组序列差异,可将全世界流行的PRRSV毒株分为2个基因型,分别为欧洲型和美洲型[4]。2008年美国学者分离到Nsp2基因序列存在131个不连续氨基酸缺失的毒株(命名为NADC30株),随后2012年我国出现与NADC30毒株基因组相似的PRRSV变异毒株(命名为类NADC30株),且当前该毒株在我国大部分地区猪场广泛流行[5-6]。尽管如此,当前我国流行的PRRSV基因型十分复杂,部分地区同时存在高致病性PRRSV毒株、类NADC30毒株和经典型毒株流行[1,7]。当前我国流行的3种PRRSV毒株的致病性存在差异,因此需要借助实验室诊断技术确定猪场流行PRRSV毒株的基因型,其将有利于疫苗的选择和其它防控措施的实施。2021年12月初,河北望都县某规模化猪场暴发疑似PRRS疫情,为确定病因,笔者对病猪进行剖检,取肺脏和淋巴结等组织样品进行实验室诊断,以期对该病的防控提供参考。
1 发病猪场情况
2021年12月初,河北望都县某规模化猪场暴发疑似PRRS疫情。据了解,该场繁殖母猪流产率达12%,仔猪或保育猪因呼吸困难、高热等病死率达40%左右。应猪场负责人的邀请,笔者进入该场发病栏舍,发现发病猪群主要集中于仔猪、保育猪和妊娠母猪。其中妊娠母猪出现流产(图1);保育猪和仔猪出现高热、呼吸困难、耳尖及臀部皮肤有红色斑块(图2);将病死保育猪剖检可见明显间质性肺炎(图3),且全身淋巴结肿大、出血等。根据病猪临床症状及剖检病理变化,可将该病初步判定为PRRS。为进一步对病因进行确诊,无菌采集2头病猪肺脏、淋巴结和扁桃体等组织样品,低温送至实验室进一步进行病原诊断。

图1 妊娠母猪流产

图2 保育猪呼吸困难、扎堆等
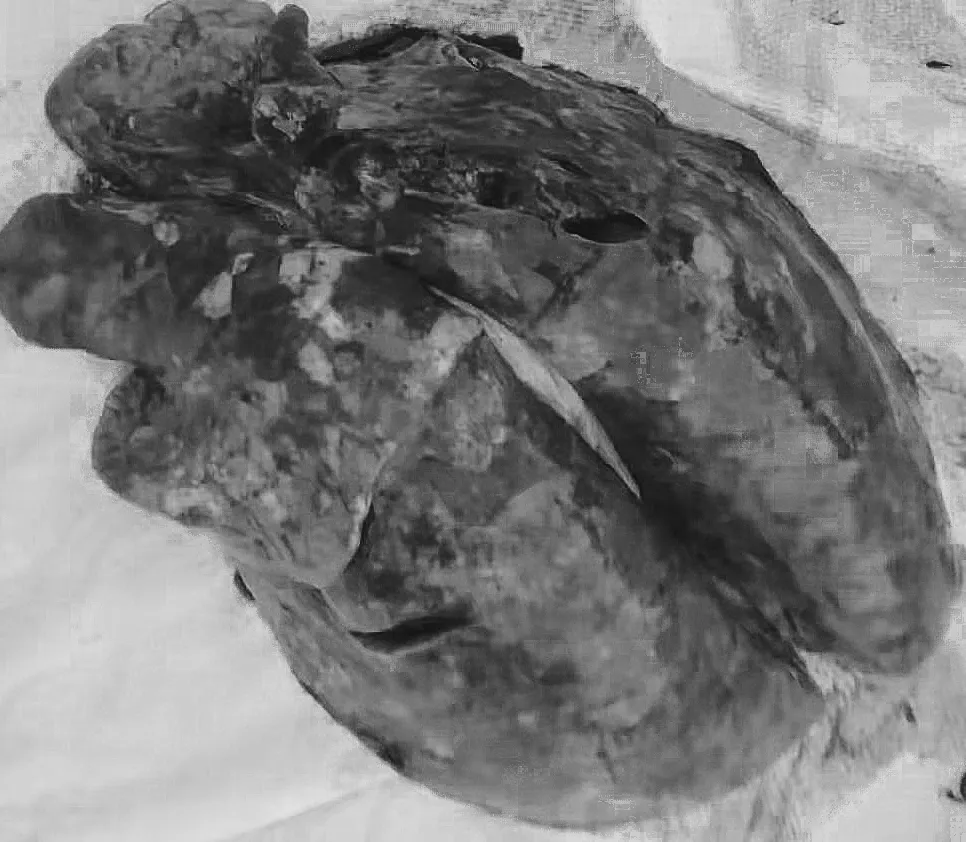
图3 间质性肺炎
2 实验室诊断
2.1 常见病原检测
使用灭菌手术刀切去少量肺脏、淋巴结和扁桃体组织样品共约2 g,切碎后移至研钵内,加入少量生理盐水,充分研磨后反复冻融3次。其后吸取上清液,高速(12 000 r/min)低温(4 ℃)离心5 min,取上清液用于基因组提取。使用DNA/RNA基因组提取试剂盒提取组织上清液基因组,操作步骤和注意事项参考试剂盒说明书,将最后获得的基因组保存于-80 ℃;取10 μL基因组使用反转录试剂盒将RNA反转录为cDNA,其后将cDNA保存于-20 ℃,备用。
以获得cDNA或DNA基因组为模板,使用商业化荧光定量PCR检测试剂盒分别对常见RNA病毒(猪繁殖与呼吸综合征病毒、猪瘟病毒、乙脑病毒)和DNA病毒(猪圆环病毒2型、猪伪狂犬病病毒和猪细小病毒)进行检测。每次检测均设置阴性对照和阳性对照,其中阴性对照为无RNA酶水,阳性对照为各检测体系对应病毒核酸,依据最终样品对应CT值判断检测样品对应病毒的阴性或阳性,其中CT值≤35则为阳性,CT值>35或无CT值则判定为阴性。结果发现2份样品均为PRRSV核酸阳性,但其它检测病原均为阴性。
2.2 细菌性病原检测
将部分上清液通过平板划线法接种于鲜血琼脂固体培养基,其后将固体培养基分别置于37 ℃恒温箱和厌氧环境下37 ℃恒温箱内,培养16~24 h后观察培养基表面是否出现疑似菌落。若有,则蘸取少量菌落进行革兰氏染色,根据细菌大小、形态和颜色等对其进行形态学鉴定。结果发现,两种环境下培养基表面均未出现疑似菌落,提示该猪场未出现细菌性疾病。
2.3 PRRSV ORF5基因序列扩增及分析
为进一步确定该场PRRSV流行株的基因型,应用RT-PCR法对该毒株ORF5基因序列进行扩增与分析。其引物序列为:PRRSV-ORF5-F:5'-CCTGAGACCATGAGGTGGGG-3',PRRSVORF5-R:5'-TTTGGGCATATATCATCACTGG-3',引物委托郑州擎科智美生物科技有限公司合成。RT-PCR反应体系(50 µL)包括2×PCR mix 25 µL、上下游引物各2.0 µL、cDNA模板3.0 µL及无核酸污染水18.0 µL,每次反应均设置阳性和阴性对照,其模板分别为已知PRRSV基因组和无核酸污染水。反应条件为:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 20 s,共35个循环;72 ℃ 7 min。反应结束后取5.0 µL扩增产物进行琼脂糖凝胶电泳,并将阳性产物送至测序公司测序,并对测序结果进行分析。
结果如图4所示,2份样品均成功扩增出PRRSV ORF5基因片段,凝胶电泳结果显示,2个毒株ORF5基因序列大小约530 bp,且阴性和阳性对照均成立。进一步测序结果表明,2个毒株ORF5基因序列大小为564 bp,核苷酸序列同源性分析结果发现从该场获得的2个PRRSV毒株ORF5基因同源性为99.8%,与PRRSV疫苗株(如MLV)ORF5基因序列同源性为82.8%~82.9%,与高致病性PRRSV毒株(如JXA1)同源性为85.6%~85.7%,与经典型PRRSV毒株(如FJFS)同源性为83.7%~84.0%。与GenBank收录的NADC30毒株同源性相对较高,为93.4%~94.6%,与国内流行的类NADC30毒株(如CHSD)同源性最高,为98.4%~98.5%。
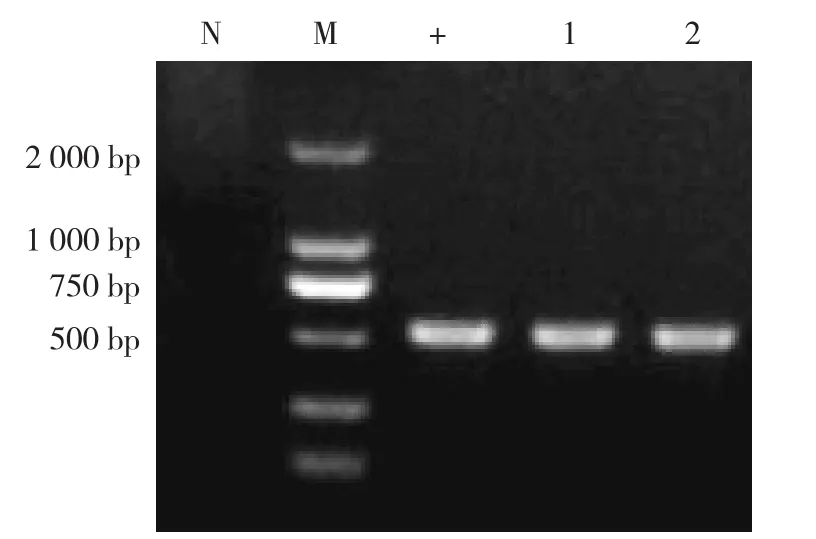
图4 PRRSV毒株ORF5基因序列RT-PCR扩增产物凝胶电泳结果
3 诊断结果
根据病猪临床症状、病理变化和实验室诊断结果,可判定该场发病是由PRRSV感染所引起,且该PRRSV毒株与国内流行的类NADC30毒株同源性最高。
4 防控措施
使用PRRSV疫苗对该场不同发育阶段猪群进行紧急免疫接种。其中对经产母猪、后备母猪和公猪紧急免疫接种PRRSV灭活疫苗4 mL,2周后对以上猪群再次接种疫苗2 mL,其后每3个月免疫接种疫苗1次,每次2 mL;对15日龄哺乳仔猪免疫接种1次(1 mL);对断奶保育猪免疫接种1次(2 mL)。
使用阿莫西林和替米考星等药物对不同发育阶段猪群进行药物治疗,以防止猪群继发感染:在饲粮中添加20%替米考星(2 kg/t)、10%阿莫西林(2 kg/t)和电解质多维(2 kg/t)对经产母猪、后备母猪和公猪进行饲喂,连续用药7 d;在饲粮中添加25%万乐霉素(800 g/t)、10%强力霉素(1 kg/t)和电解质多维(1 kg/t),给保育猪进行饲喂,自由采食,连用7 d。
提高饲养管理水平,如提高猪场消毒频率、实行带猪消毒,对粪污及时清除;在猪场内持续开展灭鼠等活动;持续对猪场PRRSV流行情况和抗体水平进行监测。
开展以上防控措施2周后进行回访,负责人反馈该场PRRS疫情已基本有效控制。基本未发现繁殖母猪流产和死胎等现象,少数仔猪存在呼吸困难和高热,但临床症状不严重,病死率相对较低。
5 讨论
近年来,PRRS的流行仍然对我国养猪业健康发展造成巨大威胁。该病原感染生猪可导致母猪流产、断奶仔猪呼吸困难、高热等,同时PRRSV感染可导致病猪出现严重的免疫抑制,容易出现继发感染其它病原。由于PRRSV在我国广泛流行,且该病毒基因组在进化过程中易突变,导致当前我国流行的PRRSV毒株基因型十分复杂,甚至部分地区同时流行多种基因型PRRSV毒株,但类NADC30毒株所占比例较高[1]。不同基因型PRRSV毒株对病猪的致病性存在差异,同时疫苗对不同基因型的防控效果也存在差异,因此我们需要确定发病猪场流行的PRRSV毒株基因型,这样有利于疫苗的选择和相关防控措施的制定和实施。
诚然,根据发病猪群临床症状及病理变化可初步判定为PRRSV感染,但仅通过临床诊断无法确定该场流行的PRRSV基因型,同时也无法确定发病猪群是否混合感染其它病原。为确定发病原因,我们对获得样品进行实验室诊断,初步诊断结果表明该场发病由PRRSV单一感染引起。进一步对该毒株ORF5基因序列进行扩增与测序发现,该毒株属于类NADC30毒株,且与国内流行的类NADC30 PRRSV山东株同源性相对最高,提示该场发生疫情可能是由于引种不当或生物安全水平较差导致PRRSV毒株进入猪场。
已有文献表明,当前PRRSV灭活疫苗对PRRSV类NADC30株具有很好的防治效果[8],但对于PRRSV的防控不能仅依赖于疫苗紧急免疫。为此,我们建议猪场对不同发育阶段猪群进行紧急免疫的同时,还需要在饲料中添加抗生素(如阿莫西林和替米考星等)饲喂猪群,以防止猪群出现继发感染。结果也证实实施以上措施后,对类NADC30 PRRSV具有很好的防治效果。