南疆枣园土壤产铁载体细菌的群落结构
赵 文,王利娜,刘伟锋,魏喜喜,刘丰鸣,黄 瑶,孙 佳,万 胜,李建贵,张国林
(1.新疆农业大学 a.草业与环境科学学院;b.林学与风景园林学院;c.实习林场,新疆 乌鲁木齐 830052;2.新疆红枣工程技术研究中心,新疆 乌鲁木齐 830013;3.新疆大学 资源与环境科学学院,新疆 乌鲁木齐 830046)
铁是植物生长发育所必需的微量元素之一[1]。然而,在自然环境中,铁主要以不溶性Fe3+(10-18mol/L,pH 7.0)的形式存在[2]。土壤本底中铁的含量虽然较高,但在通气性特别好的土壤中,特别是在碱性土中,可供植物吸收并利用的铁非常少。世界上约1/3 的土壤为碱性,在南疆红枣主要种植区内均为碱性土壤,植物对土壤中铁的利用效率较低。因此,铁是红枣种植中常见的限制性因素之一,也是影响新疆红枣产业发展的因素之一。对土壤中铁的生物性能的改善已成为南疆枣园土壤养分和枣树营养改善的研究重点。随土壤盐分含量增加,土壤中有效铁含量进一步降低,仅凭自身作用吸收的铁元素远不能满足植物的需要[3]。由于氧化作用和碱性土壤环境,铁肥中的铁元素易形成难降解的氢氧化铁,不利于作物的吸收和利用。因此,当土壤中缺铁或铁元素有效性较低时,为植物提供一种新形式的铁肥以促进植物的正常生长发育是很重要的[4]。
在低铁环境下,细菌、真菌和植物的常见策略之一是分泌铁载体。铁载体(Siderophore)是一种低相对分子质量且对Fe3+具有高亲和力的天然铁螯合剂[5-8]。目前,已经有500 多种铁载体被报道过,根据其配位结构的特点,可以分为羟基盐、儿茶酚酸盐、羧酸盐等类型[9]。在铁缺乏的环境中,微生物分泌合成的铁载体使微生物能够获得铁并维持其生长。一些植物根际促生菌(PGPR)也能合成铁载体,并且能够与病原菌竞争获得与铁载体螯合的铁,抑制病原菌的生长[10-12]。在碱性土壤环境下,许多微生物为了克服铁有效性低的问题,自行合成和分泌高铁载体。释放到土壤中的高铁载体通过配位基团的螯合反应释放不溶性铁(如氧化铁、氢氧化铁),形成铁载体与铁的螯合物,提高了土壤中铁的生物有效性,从而满足微生物生长的需要[13]。在铁胁迫下,大麦、黑麦和小麦等能够分泌和吸收铁载体的植物,比玉米、高粱和水稻具有更好的选择优势。但植物产生的铁载体对Fe3+的亲和力较低,由植物生成的铁载体所络合Fe3+的稳定性低于由微生物所生成的铁载体,其在存在其他微生物所产生的高铁载体环境中没有竞争力。
属于植物根际促生菌的细菌类群达20 多个属,根际细菌和菌根真菌互作可以提高植物的生物量,促进植物生长,改善植物及其根际土壤的养分含量,影响根际土壤微生物环境[14]。植物促生菌产生与Fe3+形成稳定螯合物的铁载体,可以被植物直接吸收利用[15],其中最具有应用前景的是假单胞菌属Pseudomonas和芽孢杆菌属Bacillus。土壤微生物群落结构被认为是土壤生态系统的预警和敏感性指标之一[16]。其在维持植物的生长方面起着极其重要的作用,并且可以调节土壤养分,维持生态系统的平衡[17]。土壤微生物的空间分布和物种组成与环境条件息息相关[18],其在较大程度上受到土壤环境条件,特别是土壤理化因子的影响[19]。
本研究中主要以南疆产铁载体细菌群落分析为切入点,进行原位土壤取样,采用由Schwny 和Neiland 于1987年提出的CAS(chrome azurol S)法来筛选铁载体产生菌[20],并使用16S rDNA 高通量测序,对产铁载体细菌群落进行分析,旨在为枣树种植过程中微生物铁肥的研制与应用提供参考,从而提高新疆红枣的营养品质,促进红枣产业的健康发展。
1 材料与方法
1.1 研究区概况
选择新疆南疆地区红枣主产区作为研究区。研究区地势平坦,自然坡度较小,土地平整开阔,地下水位偏低。土壤为砂壤土,pH 为8.1 ~9.2,电导率为130.57 ~1 144.33 μS/cm。土壤中碱解氮质量分数为18.43 ~238.23 mg/kg,速效磷质量分数为11.27 ~324.50 mg/kg,速效钾质量分数为198.62 ~387.93 mg/kg,有机质质量分数为3.2 ~19.2 g/kg。土壤中有效铁质量分数为2.12 ~30.58 mg/kg,全铁质量分数为12.4 ~34.0 g/kg,铁转化率为0.011%~0.184%。
1.2 土样采集
根据张梅等[21]对南疆红枣适生区的研究结果,选择在新疆和田(策勒县、墨玉县)、喀什(岳普湖县、麦盖提县、泽普县)、阿克苏(阿拉尔市、沙雅县)、巴州(若羌县、且末县)4 个地区9 个县(市)的22 个枣园采集土样(表1)。
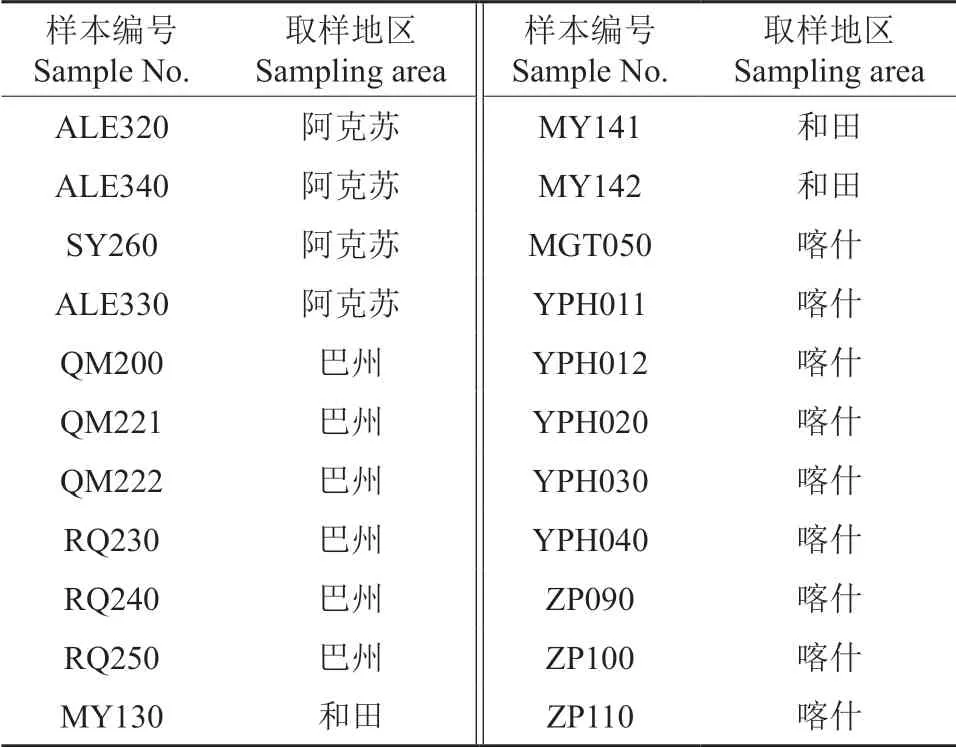
表1 南疆枣园土壤样品来源Table 1 Source of soil samples from jujube orchards in southern Xinjiang
在枣园中选取5 棵长势一致且树龄相近的枣树,用小铲子除掉枣树周围表层土壤和杂物,采用三点取样法采集土壤样品。取30 cm 左右深处的土壤,挖取枣树根系及其上黏附的土壤。用无菌毛刷将根上黏附的细土扫落到无菌袋中,贴上标签。将土样用冰盒迅速带回实验室,置于-26 ℃冰箱中保存备用。
1.3 试剂和培养基制备
1)CAS 溶液。取65 mg CAS 溶于50 mL去离子水中,取72.9 g 十六烷基三甲基溴化铵(HDTMA)溶于40 mL 去离子水中,将2 种溶液与10 mL 1 mmol/L 的FeCl3溶液(溶剂为10 mmol/L 盐酸)混合,定容至100 mL,混匀,pH调至6.8,121 ℃条件下灭菌20 min,常温避光保存。
2)牛肉膏蛋白胨液体培养基。每升培养基中加入牛肉膏3 g、蛋白胨10 g、氯化钠5 g、琼脂18 g,加入适量去离子水,边加热边充分搅拌溶解,最后补足所失水分。121 ℃条件下灭菌25 min。
3)固体培养基基础。取葡萄糖100 g、蛋白胨20 g、七水硫酸镁0.5 g、氯化钙0.5 g、琼脂粉20 g,溶于1 000 mL 去离子水中。121 ℃条件下灭菌20 min。
4)CAS 检测培养基。取6.04 g 无水哌嗪溶于150 mL 去离子水中,加入10×MM9 盐溶液(Na2HPO430 g、KH2PO41.5 g、NH4Cl 5 g 溶于500 mL 去离子水中)20 mL,混匀后调节pH 至6.8±0.2,于121 ℃条件下灭菌20 min。待冷却至60 ℃时,取100 mL 加入刚灭菌的固体培养基基础中,再加入保温至60 ℃的CAS 检测液100 mL,即为CAS 检测培养基。
5)LB(Luria-Bertani)培养基。每升培养基中加入胰蛋白胨10 g、酵母提取物5 g、NaCl 10 g,调节pH 为7.0 左右,121 ℃条件下灭菌20 min。
1.4 产铁载体菌分析
1.4.1 菌落筛选
称取适量新鲜土样,加入装有灭菌生理盐水的锥形瓶中,在恒温摇床中振荡30 min(28 ℃,170 r/min)。从振荡好的菌悬液中,吸取0.1 mL悬浊液,加入牛肉膏蛋白胨液体培养基中,在恒温摇床中培养24 h(37 ℃,130 r/min),对菌悬液中的细菌进行活化。
吸取0.1 mL 活化后的菌悬液,均匀涂抹于CAS 检测培养基上,置于28 ℃培养箱中培养48 h。使用接种针挑取铁载体螯合圈半径大于菌落直径且长势较好的菌落,放入盛有LB 液体培养基的锥形瓶中,在恒温摇床中扩繁培养48 h(28 ℃,120 r/min)。吸取1 mL扩繁后的菌悬液于冻存管中,加入1 mL 无菌甘油(121 ℃灭菌25 min),摇匀后放入-26 ℃冰箱中保存,待测。
1.4.2 16S rDNA 测序
将产铁载体细菌群落样本送至杭州联川生物技术股份有限公司,对序列进行PCR 扩增和16S rDNA 测序。所用引物序列见表2。
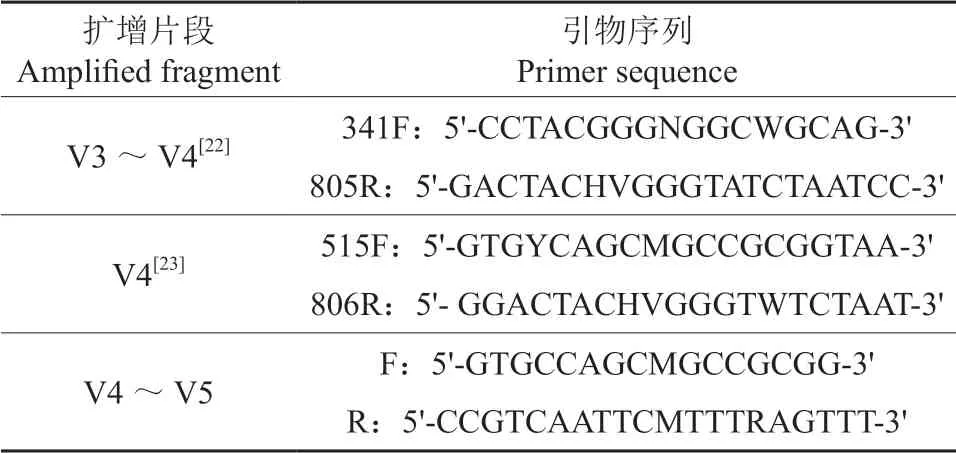
表2 南疆枣园土壤产铁载体细菌PCR 扩增引物Table 2 Primers for PCR amplification of siderophore bacteria in jujube orchard soil of Southern Xinjiang
1.5 数据处理
使用Microsoft Office Professional Plus 2019软件对数据进行计算和整理。基于16S rDNA 测序产生的原始数据,构建类OTU 表,获得最终的特征表以及特征序列,采用Blast 软件进行序列比对,用SILVA 数据库对特征序列进行注释,使用R 语言软件对16S rDNA 测定数据进行分析和绘图。采用Alpha 多样性分析中的香农(Shannon)指数和辛普森(Simpson)指数进行种群多样性分析[24],采用主成分分析(principal component analysis,PCA)、主坐标分析(principal coordinates analysis,PCoA)和非多维尺度分析(multidimensional scaling,NMDS)3 种方式进行种群差异分析。
2 结果与分析
2.1 南疆枣园土壤中产铁载体细菌的群落结构
通过对经16S rDNA 测序生成的物种注释信息进行处理,对南疆枣园土壤中产铁载体菌群相对丰度处于前10 位的菌属进行分析,其分布状况如图1所示[25]。由图1可以看出,南疆枣园土壤中相对丰度排名在前10 位的产铁载体细菌分属变形菌门Proteobacteria 和厚壁菌门Firmicutes。其中,阿克苏、和田和喀什地区枣园土壤中产铁载体菌群以变形菌门为主,巴州地区以厚壁菌门为主。
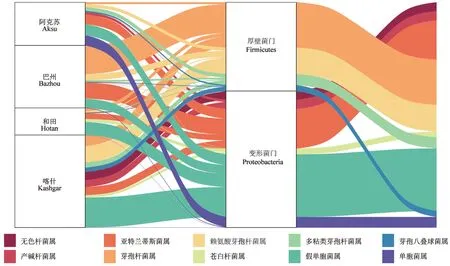
图1 南疆枣园土壤中产铁载体细菌(相对丰度前10 位)的菌属分布Fig.1 Abundance of siderophores producing bacteria (top 10 abundance) in soil of jujube orchards in southern Xinjiang at phylum level and genus level
从门水平来看,4 个地区产铁载体细菌整体上呈现出大致相同的特征。在占比最大的5 个菌属中,芽孢杆菌属、赖氨酸芽孢杆菌属Lysinibacillus和多粘类芽孢杆菌属Paenibacillus3 个菌属为厚壁菌门,亚特兰蒂斯菌属Atlantibacter和假单胞菌属2 个菌属为变形菌门。总体上,假单胞菌属在各地区的分布占比均相对较高,但各地区存在独有的相对丰度较高的菌属。巴州厚壁菌门中芽孢杆菌属的相对丰度最高,变形菌门中亚特兰蒂斯菌属的相对丰度最高;喀什地区厚壁菌门中赖氨酸芽孢杆菌属的相对丰度最高,变形菌门中假单胞菌属的相对丰度最高;和田地区厚壁菌门中芽孢杆菌属的相对丰度最高,变形菌门中假单胞菌属的相对丰度最高;阿克苏地区厚壁菌门中多粘类芽孢杆菌属的相对丰度最高,变形菌门中假单胞菌属的相对丰度最高。
总体上,占比最大的假单胞菌属为变形菌门,占比次之的亚特兰蒂斯菌属同样为变形菌门,与亚特兰蒂斯菌属占比相当的芽孢杆菌属为厚壁菌门。
2.2 南疆枣园土壤中产铁载体细菌群落分布的差异
根据获得的特征值丰度,计算各样品共有特征(feature)的数量,并通过Venn 图直观呈现。南疆4 个地区枣园土壤中产铁载体细菌群落的分布特征如图2所示。从图2A 可以看出,4 个地区的产铁载体细菌均有其特有的种群分布,且互有重叠。从图2B 可以看出,总体上南疆枣园土壤中产铁载体细菌分属19 个门类,其中10 个门类为4 个地区所共有,巴州、和田和阿克苏地区分别有1 个特有门类,阿克苏与巴州有2 个共有门类、与喀什有1 个共有门类,喀什、和田和阿克苏有1 个共有门类,喀什、阿克苏和巴州有1 个共有门类,和田、喀什和巴州有2 个共有门类。从图2C可以看出:4 个地区一共有230 个菌属,其中4 个地区共有的菌属达到了50 个;各地区均有其特有的菌属,其中喀什特有的菌属最多,达到了75 个,而其余地区所特有菌属相对较少。
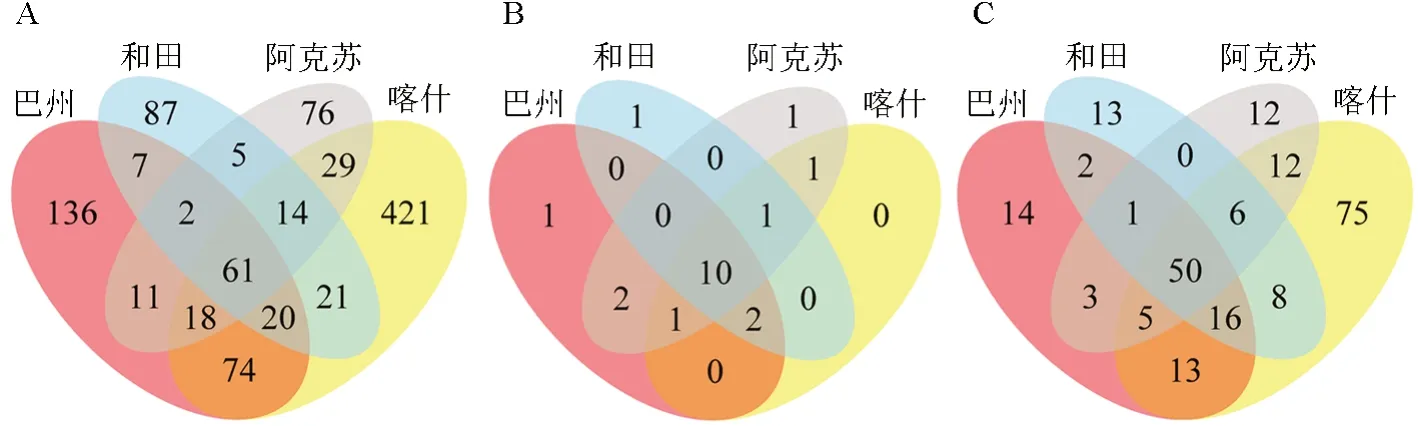
图2 枣园土壤中产铁载体细菌在南疆4 个地区的分布特征Fig.2 Distribution characteristics of siderophore bacteria in jujube orchard soil in four regions of southern Xinjiang
结合样品相对丰度,根据门水平和属水平相对丰度最高的5 个群落组成,采用布雷柯蒂斯(Bray-Curtis)距离对样品进行聚类分析。各样本间门水平和属水平相对丰度处前5 位种群的聚类情况如图3所示。从图3可以看出,同一地区土壤样本间产铁载体细菌种群的相似性并非均较高,非同一地区的部分样本的产铁载体细菌在群落组成上存在一些相似性。RQ240 与YPH020 间、ALE320 与RQ230 间、QM200 与ZP090 间相对丰度较高的5 个门的丰度水平基本一致;SY260 和YPH030 间相对丰度较高的5 个属的丰度水平基本一致。各地区内,各样本的产铁载体细菌群落总体上具有相似性,但个别样本群落具有特异性。巴州的QM221 和RQ250、喀什地区的ZP100,在门水平上几乎全部为厚壁菌门,在属水平上有各自的特点。QM221 以芽孢杆菌属为主,赖氨酸芽孢杆菌属次之;RQ250 几乎全部为芽孢杆菌属;ZP100 几乎全部为赖氨酸芽孢杆菌属。喀什地区的YPH012 和YPH011、和田地区的MY141、阿克苏地区的SY260,在门水平上以变形菌门为主,在属水平上,YPH012 和MY141 以假单胞菌属为主,其中MY141 的假单胞菌属丰度水平比YPH012 的较低,YPH011 和SY260 以其他为主,YPH011 存在一定比例的假单胞菌属。

图3 南疆枣园土壤样本间产铁载体细菌种群(相对丰度前5 位)的聚类Fig.3 Clustering of siderophore producing bacteria (top 5 relative abundance) among soil samples from jujube orchards in southern Xinjiang
南疆地区间枣园土壤中产铁载体细菌种群(相对丰度前5 位)的聚类如图4所示。从图4可以看出:在门水平上,巴州、喀什、和田、阿克苏4 个地区的变形菌门的相对丰度依序递增;在属水平上,巴州、喀什、和田、阿克苏4 个地区的总体丰度水平较高的5 个菌属的总丰度水平依序递减,说明其他属的部分菌类为变形菌门,但其丰度水平未排到前5 位。说明4 个地区的产铁载体细菌群落在总体上具有相似性,但是也存在一定的多样性。
同时,各地区在总体相对丰度较高的5 个门或属的丰度水平上差异相对较大。虽然和田地区和喀什地区的产铁载体细菌种群在门水平上较为相似,阿克苏地区和喀什地区的产铁载体细菌种群在属水平上较为相似,但是从图4可以看出,各种群的相对丰度有一定的差异。
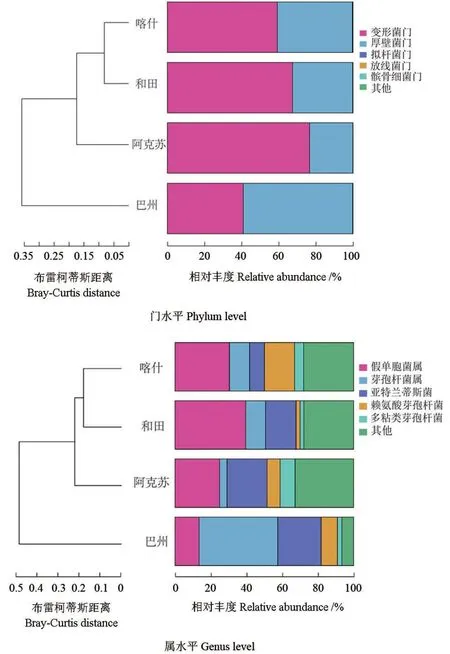
图4 南疆地区间枣园土壤中产铁载体细菌种群(相对丰度前5 位)的聚类Fig.4 Clustering of siderophore bacteria (top 5 relative abundance) in jujube orchard soil in southern Xinjiang
在门水平和属水平上的聚类结果有所不同。在门水平上,各样本总体上可以分为4 类,属水平上可以分为5 类。聚类分析结果表明:大多数样本在门水平上较为相近,但在属水平上相距较远,或在属水平上较为相近,但在门水平上相距较远;不同地区的样本在空间上距离较远,但其产铁载体细菌群落结构有一定的相似性。
2.3 南疆枣园土壤中产铁载体细菌群落的多样性
南疆枣园土壤中产铁载体细菌种群的多样性如图5所示。从图5可以看出,除喀什地区的2个样本、和田地区的1 个样本和巴州地区的1 个样本的产铁载体细菌种群多样性较低外,4 个地区的物种多样性均值较为一致,且除阿克苏地区外,物种多样性指数较为平均,且足够丰富。

图5 南疆枣园土壤中产铁载体细菌种群的多样性指数Fig.5 Diversity index of siderophore producing bacteria in soil of jujube garden in southern Xinjiang
对南疆各地区间产铁载体细菌的种群分布进行对比,结果如图6所示。从图6可以看出,采用PCA、PCoA 和NMDS 这3 种分析方法得出的结果较为一致,4 个地区间产铁载体细菌群落分布的差异不大,有较强的相似性,其中阿克苏地区各样点间群落分布的差异最大,和田地区各样点间群落分布的差异最小,喀什地区各样点间群落分布的差异不大。
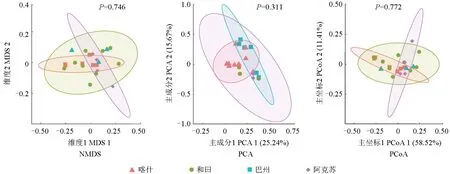
图6 南疆地区间枣园土壤中产铁载体细菌种群分布的差异性Fig.6 Differences in the distribution of siderophore producing bacteria in jujube orchards in southern Xinjiang
3 结论与讨论
综合以上分析结果可知,在所测定的22 份土壤样本的产铁载体细菌群落中,占比最大的为变形菌门的假单胞菌属和厚壁菌门的芽孢杆菌属,南疆各地区产铁载体细菌群落虽然总体上呈现较为相似的构成,但仍具有多样性,各地区保持了其独特的群落构成。
铁是最早被发现的植物必需微量元素之一,参与植物的多种生理过程。在新疆的碱性土壤环境中,铁的利用效率不高,因此很有必要筛选产铁载体微生物。通过对22 份土壤样本中产铁载体细菌群落的16S rDNA 测序,可以看出南疆4 个地区枣园土壤中产铁载体细菌主要为变形菌门和厚壁菌门2 类,在属水平上假单胞菌属占比最大,这与Manninen 等[26]的研究结果相符。在属水平上,还有变形菌门的亚特兰蒂斯菌属和厚壁菌门的芽孢杆菌属。芽孢杆菌属也是产铁载体细菌的主要种群,Zhang 等[27]从小麦根际提取出多种芽孢杆菌属的产铁载体细菌。
通过对比可以发现,南疆4 个地区枣园土壤中产铁载体细菌群落虽然有较强的相似性与共通性,但也保持了其特有的群落,说明不同地区土壤中产铁载体细菌具有差异性。巴州枣园土壤中产铁载体细菌群落与其他地区有所不同,可能是因为巴州地区的土壤情况与其他3 个地区有较为明显的差别,且可能与巴州地区红枣种植的管理模式有关。而且同一地区样本的相似性并非均较高,非同一地区的部分样本在群落组成上存在一些相似性。
大多数研究结果表明,产铁载体细菌大多为变形菌门的假单胞菌属和厚壁菌门的芽孢杆菌属,因此在气候和土壤养分条件等不同的地区,产铁载体细菌群落可能有相似性。南疆枣园土壤中产铁载体细菌群落的多样性分析结果证实了上述观点。南疆枣园土壤中产铁载体细菌种群的多样性分析结果表明,4 个地区的物种多样性均值较为一致,除阿克苏地区外,其他地区产铁载体细菌种群的多样性均较为丰富且均匀。通过对种群的差异性分析可以看出:阿克苏地区各样点间群落分布的差异最大,可能是阿拉尔市枣园与其他枣园的管理水平存在差异所导致;和田地区各样点间群落分布的差异最小,可能是因为和田地区枣园土质较为相似,且均为干旱滴灌。虽然喀什地区的特有菌属最多,但其样点间群落分布的差异不大,说明同地区管理水平相近的枣园土壤中产铁载体细菌群落较为相似。枣园的管理模式会对枣园土壤中产铁载体细菌群落产生影响,这与吴菲等[28]的研究结果一致,人类活动的干扰会导致土壤微生物和土壤环境因子发生显著变化。
本研究中采集了南疆红枣主要种植区的土壤样本进行分析,但采样点不够丰富,样点分布不够平均,使得分析结果具有一定的局限性。在后续研究中,可以扩大采样范围,增加采样点位,进行更加全面深入的研究。另外,假单胞菌属具有易于培养和产铁载体种类丰富的特性,可以用来研制微生物铁肥。

