三硫二苄基通过抑制JAK/STAT3信号通路抑制A549细胞的增殖和转移
张路,高二可,金齐力,韩晓静,钱峰
(蚌埠医学院,安徽 蚌埠 233004)
肺癌(Lung cancer)是一种发病率和死亡率均高的人类恶性肿瘤[1]。根据组织学分型,肺癌主要分为小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC),其中非小细胞肺癌约占80%~85%[2]。目前NSCLC的主要治疗方法是手术、化疗、放疗和靶向治疗[3]。虽然总体的治疗方案有很大的进步,比如手术结合EGFR靶向酪氨酸激酶抑制剂(TKI)取得了令人满意的治疗效果,但NSCLC的预后仍然较差,5年生存率约为15%[4-5]。为提高NSCLC患者的生存率,急需寻找治疗NSCLC的有效药物。
转移是癌症相关死亡的主要原因,预防和治疗转移是改善临床治疗效果的关键之一[6]。上皮间质转化(EMT)相关程序被证明在转移期间被激活,该过程可通过增强移动性、侵袭性和对凋亡刺激的抗性赋予癌细胞转移特性[7]。EMT发生的主要标志为上皮标记物,如E-钙黏蛋白(E-cadherin)、角蛋白等表达降低;间质标记物,如N-钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)等表达增加。EMT相关转录因子(EMT-TFs)如Snail,可抑制E-cadherin及其调控因子如钠、钾-ATP酶的β亚基等的表达,促进EMT并提高细胞转移能力[8]。值得注意的是,EMT已被证明可以在癌细胞中诱导其他特性,如获得干细胞样表型、化疗耐药性、免疫逃避等,从而使这些细胞难以根除[9]。因此,抑制EMT过程不仅会抑制癌细胞的扩散和转移,而且会使癌症细胞对各种形式的治疗更加敏感,鉴于这些特性EMT过程已被视为致癌的关键标志之一,靶向EMT相关途径也成为了一种有吸引力的癌症治疗策略[10]。
Janus激酶/信号转导和转录激活因子(JAK/STAT)信号通路与许多癌症的发生和进展有关。研究结果表明,异常活跃的信号转导和转录激活因子3(STAT3)在各种癌症(包括NSCLC)的发生、耐药和转移中发挥重要作用[11-14]。JAK/STAT3信号通路在慢性炎症患者和造血系统相关的肿瘤或实体瘤患者中异常激活[15],肿瘤微环境中多种细胞类型可产生IL-6,进而导致肿瘤细胞和肿瘤免疫浸润细胞中的JAK/STAT3信号激活,促进肿瘤细胞增殖、存活、侵袭和转移[16]。靶向JAK/STAT3信号通路相关因子可以抑制肿瘤细胞生长,减弱肿瘤微环境中的免疫抑制作用[16]。除了直接影响肿瘤细胞外,JAK2/STAT3激活后可通过上调EMT相关转录因子(Snail、Zeb1等)诱导EMT过程从而增强转移[17-18]。总之,靶向JAK/STAT3信号通路已被证明对治疗人类多种癌症有益,对于抑制肿瘤生长和恢复抗肿瘤免疫具有相当大的应用前景。
三硫二苄基(Dibenzyl trisulphide,DTS)是一种从名为Petiveria alliacea L.(Phytolaccaceae)的植物根部分离出来的,具有生物活性的多硫化物次级代谢产物[19],这种药用植物在民间广泛用于治疗哮喘、关节炎和癌症等疾病。大量药理学研究表明,它对各种中枢神经系统疾病也有明显的疗效,如焦虑、疼痛、癫痫发作等[20-21]。已有研究介绍了DTS与其衍生物对乳腺癌、胰腺癌和头颈癌细胞等癌细胞具有抗增殖和细胞毒作用[22-23]。然而,DTS对NSCLC的影响及其相关机制尚未见报道。
在本相研究中,我们证明了DTS可以抑制A549细胞增殖、诱导A549细胞凋亡和抑制A549细胞迁移和侵袭。揭示DTS通过抑制JAK/STAT3信号通路下调EMT的作用。我们的研究结果表明,DTS可能成为NSCLC临床治疗的有效候选药物。
1 材料与方法
1.1 试剂
三硫二苄基(DTS,CAS:6493-73-8)购自中国北京J&K Scientific;RPMI-1640培养基,胰蛋白酶(含EDTA),青霉素-链霉素双抗(100×)购于德国Gibco;胎牛血清(FBS)购自中国Dcell Biologic;二甲亚砜(Dimethyl Sulfoxide,DMSO);特超敏化学发光底物ECL,CCK-8溶液,4% 组织细胞固定液,结晶紫染液,HRP连接的二抗(兔抗,鼠抗)购自中国上海碧云天;兔源性一抗Bcl-2,Bax,E-cadherin,N-cadherin,Snail,p-JAK1(Tyr1034/1035),JAK1,p-JAK2(Tyr1008),JAK2,p-STAT3(Tyr705),SOCS3,GAPDH均购自美国Cell Signaling Technology(CST);蛋白marker购自美国Thermo Fisher Scientifific;硝酸纤维素印迹NC膜(0.45 μm)购自德国GE Healthcare Life science;Annexin V-FITC细胞凋亡检测试剂盒(Apoptosis assay kit)购自中国杭州联科生物;具有8.0 μm聚碳酸酯膜插入物(PCF)的24孔Transwell板(6.5 mm),Matrigel基质胶购自美国Corning;重组人白介素-6(IL-6)购自中国北京Sino Biological,其他试剂购自美国Sigma-Aldrich。
1.2 细胞培养
人非小细胞肺癌细胞A549(美国菌种保藏中心)用含10% FBS血清、1% 青霉素-链霉素双抗的RPMI-1640完全培养基,放于37 ℃,5% CO2培养箱进行培养。当细胞生长至对数生长期时,进行传代、实验及冻存。
1.3 克隆形成实验
收集A549细胞,调整细胞浓度为2×103/mL,每孔300 μL接种于6孔板(孔中细胞数为600),培养箱中培养6 h。用0、0.1、0.2、0.4 μmol·L-1的DTS处理细胞,每个克隆细胞团细胞数大于50个(约10 d)即可。PBS洗涤两次,每孔加入1 mL的4% 组织细胞固定液,固定15 min后培养板中每孔加入1 mL结晶紫染液,染色20 min,漂洗染液后置于空气中干燥2 h。计数克隆细胞团数,每孔计数5遍取平均值。
1.4 CCK-8实验
收集A549细胞,调整细胞浓度为1×105个·mL-1,96孔板接种细胞(100 μL·孔-1),培养箱中培养6 h。用0、5、10、20 μmol·L-1的DTS处理培养48 h。随后用完全培养基配置10% 的CCK-8溶液,每孔加入100 μL,继续培养1 h,酶标仪测定各孔在450 nm处的OD值,并计算细胞活力。
1.5 细胞凋亡检测
收集A549细胞,调整细胞浓度为1×106个·mL-1,6孔板接种细胞(400 μL·孔-1),培养箱中培养6 h。用0、5、10、20 μmol·L-1的DTS孵育48 h,800 r·min-1,离心4 min,收集细胞沉淀。用PBS洗涤细胞两次,重悬细胞后,加入500 μL Binding Buffer,再加入5 μL Annexin V-FITC、10 μL PI染色液,避光孵育5 min。流式细胞仪(Beckman CytoFLEX flow cytometer;Beckman Coulter Biotechnology)用于检测和分析细胞凋亡。
1.6 Western blot 免疫印迹分析
收集A549细胞,调整细胞浓度为1×106个·mL-1,6孔板接种细胞(400 μL·孔-1),培养箱中培养6 h。用0、5、10、20 μmol·L-1的DTS孵育48 h。预冷的PBS洗细胞,3次。每孔加入1×loading buffer(含染液)200 μL后。细胞刮刀充分裂解细胞。按照10% SDS-聚丙烯酰胺凝胶(PAGE)的制备方法制备分离凝胶和浓缩凝胶。
电泳:取等量上述蛋白样,加入胶孔中,设置电压为80 V,电泳30 min。将样品压缩至分离胶和浓缩胶的边界。后设电压为110 V,电泳1 h。转膜:停止电泳后,采“垫片纸-凝胶片-NC膜-垫片纸”法,冰水浴中200 mA转膜2 h。封闭:将膜放入5% 脱脂牛奶中,室温摇床上封闭1~2 h。用相应的一抗在4 ℃过夜孵育。
用含20% Tween的洗膜液以8 min·次-1,洗膜3次,再用相应HRP连接二抗室温条件下结合1.5 h。A液∶B液=1∶1配好的ECL显影液滴在目的条带上,使用仪器Tanon-5200进行拍照。使用Tanon配套灰度分析软件进行灰度值分析。
1.7 划痕实验
收集A549细胞,调整细胞浓度为1×106个·mL-1,6孔板接种细胞(500 μL·孔-1),培养箱中培养6 h,待细胞汇合形成单层细胞,饥饿培养(无FBS培养基)10~12 h,然后用移液器尖端刮擦以形成1条直线作为划痕。用0、0.2、0.4、0.8 μmol·L-1的DTS(无FBS)处理细胞。使用成像系统(Leica Microsystems;Leica),显微镜下(50×)拍照,记录0和48 h划痕变化。使用Image-J软件,计算0~48 h之间划痕面积的变化。计算公式为迁移率(%)=(0 h划痕面积-48 h划痕面积)/0 h划痕面积。每组进行5个独立实验。
1.8 Transwell侵袭试验
用无FBS的培养基将基质胶稀释为300 μL·mL-1,并取100 μL稀释后基质胶至Transwell小室底部。将铺胶后的小室放在干净的工作台上过夜晾干。收集A549细胞,调整细胞浓度为1×105个·mL-1(无FBS),小室内接种200 μL·孔-1,下室加入含有10% FBS的培养基500 μL·孔-1在培养箱中培养6 h。小室上室加入0、0.2、0.4、0.8 μmol·L-1的DTS(无FBS),下室加入含有10% 血清培养基500 μL·孔-1,培养箱中培养48 h。取出小室用棉签擦拭膜上层的细胞,4% 组织细胞固定液固定20 min,后用结晶紫溶液染色30 min。冲洗染液置于空气中干燥2~3 h。显微镜下(200×)拍照,计数穿至下室的细胞数。每个小室在5个不同视野中拍照,取平均值计数分析。
1.9 统计分析
2 结果
2.1 DTS抑制A549细胞的增殖活性
DTS是一种多硫化合物,其化学结构如图1A所示。为了揭示DTS在非小细胞肺癌中的抗增殖作用,我们对A549细胞系进行了克隆形成测定。如图1B所示,在0、0.2、0.4、0.8 μmol·L-1的DTS处理10 d后,A549细胞的增殖受到显著抑制,而克隆数的定量分析表明,DTS以剂量依赖性方式阻碍了A549细胞的增殖(图1C)。CCK-8是用来评价细胞活性,反映细胞毒性的实验。因此,我们利用CCK-8评估了DTS对A549细胞的细胞毒性作用。图1 D 表明DTS在0.25 μmol·L-1浓度下具有一定的细胞毒性。用同样的方法,我们得到了DTS对A549细胞的抗增殖作用的抑制曲线,并计算其IC50值为2.72±0.91 μmol·L-1(图1E)。
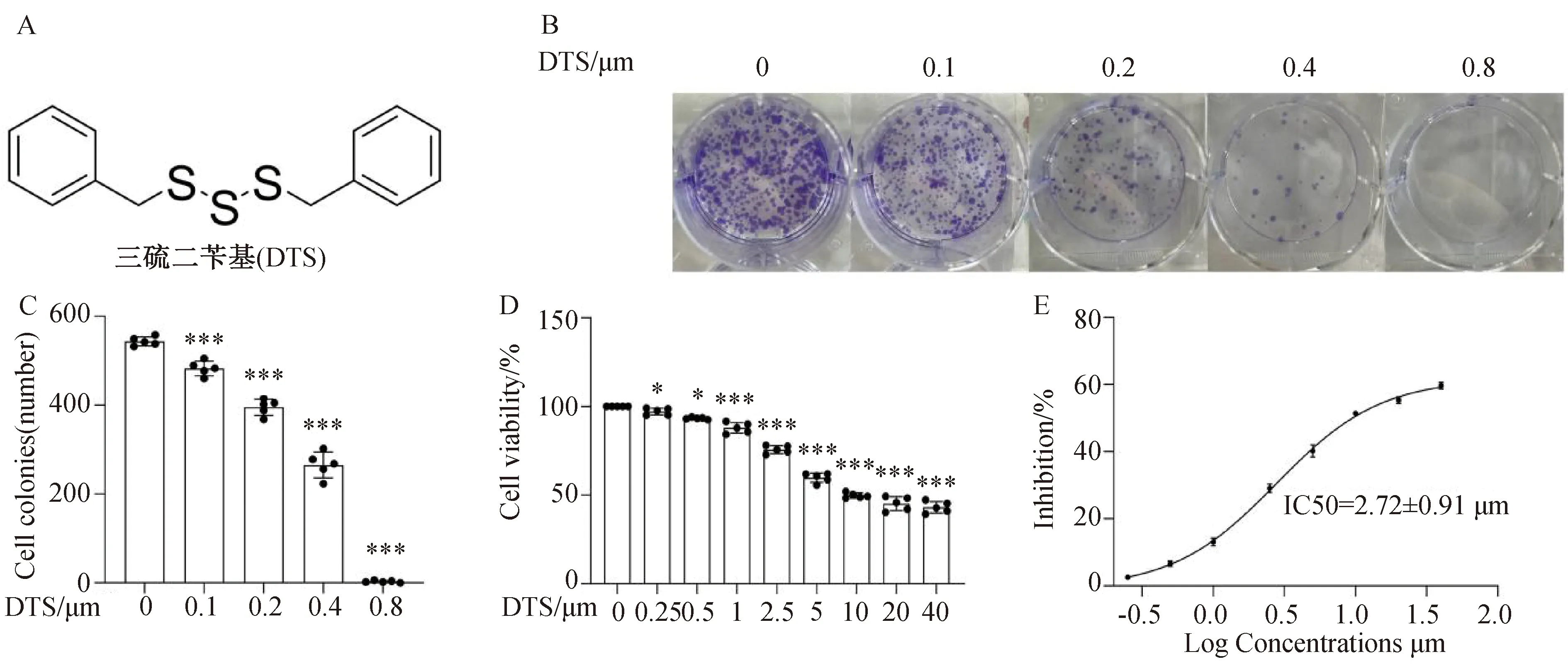
A:DTS化学结构式(MW:278.46);B,C:克隆形成结果;D:细胞活力结果;E:细胞活力抑制率曲线。*P <0.05,***P <0.001 与 0 μmol·L-1组相比。图1 DTS抑制A549细胞的增殖活性
2.2 DTS促进A549细胞的凋亡
通过抑制肿瘤细胞增殖过程,促进肿瘤细胞的凋亡是抗肿瘤药物发挥作用的主要方式之一,为探究DTS对非小细胞肺癌细胞A549凋亡的作用,我们采用流式细胞术分析Annexin V-FITC/PI双染色法。A549细胞凋亡率(右上象限及右下象限之和)随药物浓度增加而增加(图2A)。统计分析显示,经20 μmol·L-1DTS处理后,细胞凋亡数量显著增加,A549细胞凋亡率为62.61%(图2B)。结果说明,DTS能够显著诱导A549细胞凋亡,且具有剂量依赖性。
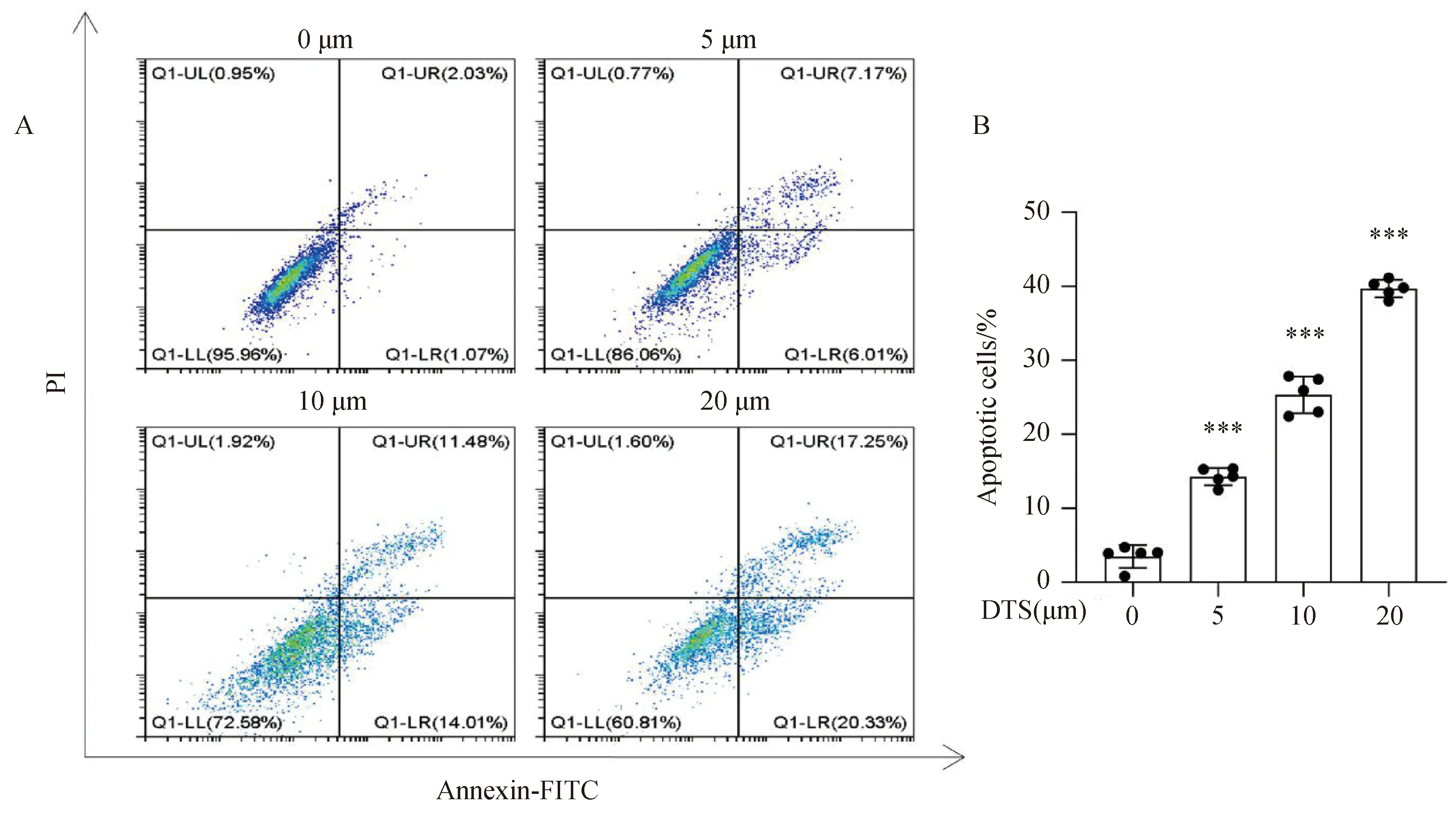
A:Annexin V-FITC/PI双染色法凋亡结果;B:凋亡率统计;***P <0.001 与 0 μmol·L-1 组相比。图2 DTS促进A549细胞的凋亡
2.3 DTS调控A549细胞凋亡相关蛋白表达
细胞凋亡相关通路中,Bax基因促进凋亡同时Bcl-2基因抵抗凋亡,二者在凋亡这一表型中发挥着至关重要的作用[24]。因此,本实验采用免疫印迹法检测这两种蛋白的表达,结果显示,DTS处理可显著上调A549细胞的Bax蛋白表达量,同时下调Bcl-2蛋白的表达量(图3A),且这种效应具有剂量依赖性(图3B、图3C)。
综上结果,DTS可显著抑制A549细胞的增殖活性,促进A549细胞凋亡。并且DTS可作用于凋亡相关通路,上调Bax的表达,下调Bcl-2的表达。
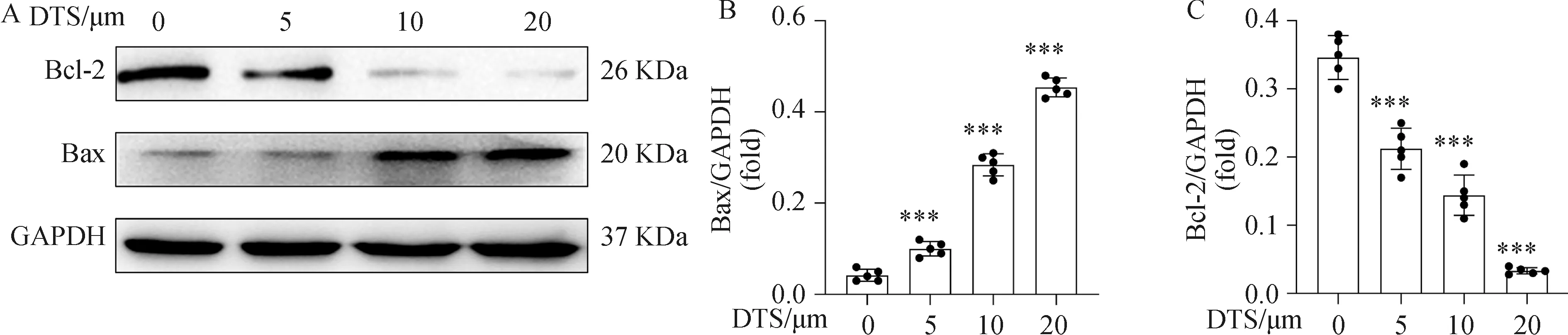
A:免疫印迹结果;B:Bax与GAPDH灰度值比较;C:Bcl-2与GAPDH灰度值比较;***P <0.001 与 0 μmol·L-1 组相比。图3 DTS调控A549细胞凋亡相关蛋白表达
2.4 DTS抑制A549细胞的迁移和侵袭能力
为了确定DTS对A549细胞转移的影响,我们使用划痕试验进行研究。根据前一部分CCK-8的结果,我们发现高浓度的DTS(1 μmol·L-1)可以抑制A549的细胞活力(图1)。为了排除DTS对细胞活力的影响,本实验采用低浓度的0、0.2、0.4、0.8 μmol·L-1的DTS来进行迁移和侵袭相关的实验。结果表明,A549细胞的迁移能力在DTS处理下明显受到抑制(图4A)。迁移面积的量化显示了DTS对迁移的抑制作用呈剂量依赖性(图4B)。接下来,我们使用Transwell侵袭试验研究了细胞侵袭是否受到DTS的影响。结果显示A549细胞的侵袭能力在DTS处理下明显受到抑制(图4C、图4D)。结果表明,DTS可以显著抑制A549细胞的迁移和侵袭能力。
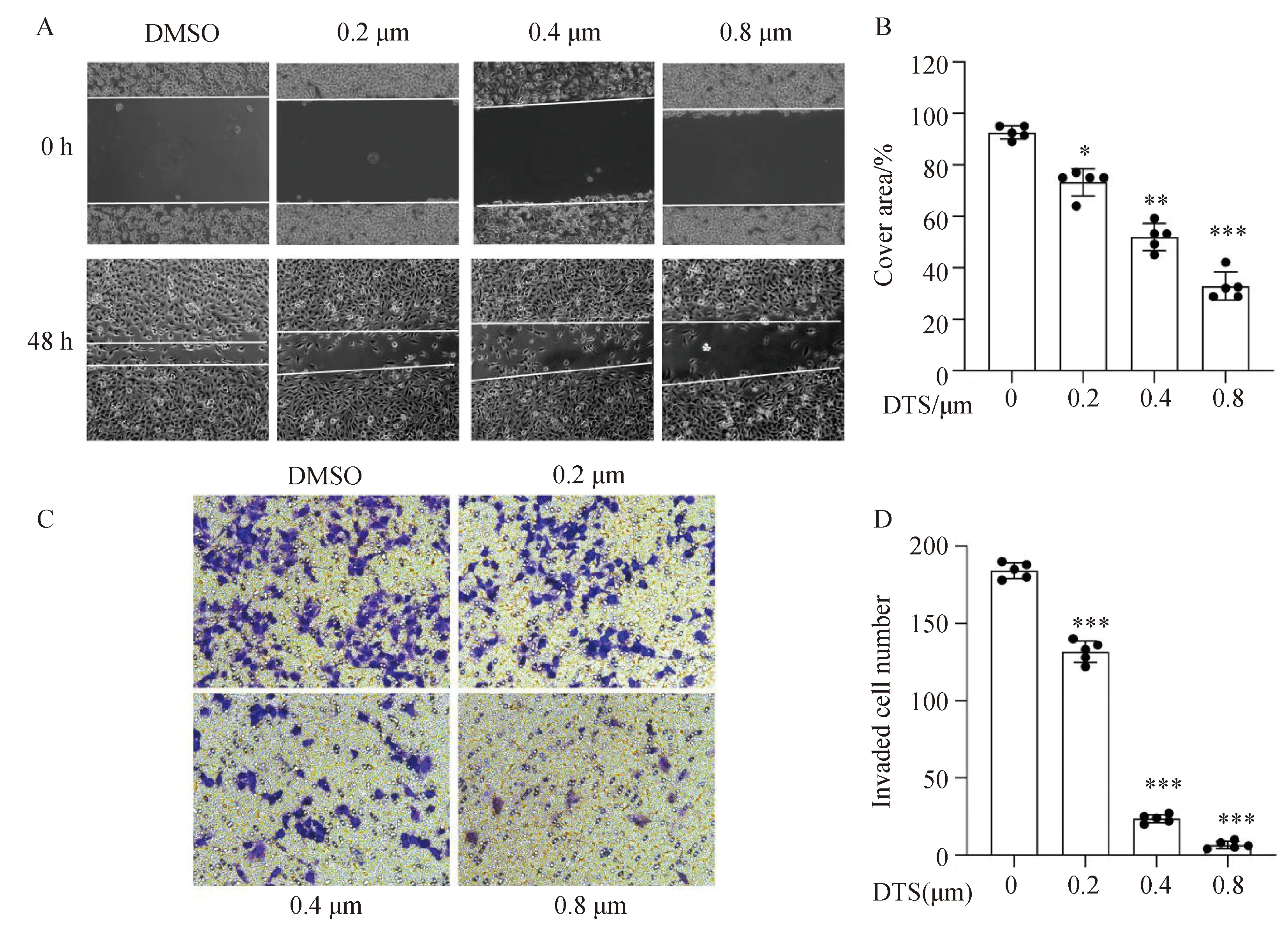
A,B:细胞划痕结果;C,D:Transwell侵袭结果;*P <0.05、**P <0.01、***P <0.001与 0 μmol·L-1 组相比。图4 DTS抑制A549细胞的迁移和侵袭能力
2.5 DTS可抑制A549细胞中的EMT信号通路
EMT这一生物学过程在促进肿瘤转移中起着至关重要的作用。为了探索DTS是否影响A549细胞中的EMT过程,我们通过免疫印迹法进行检验(图5A)。结果显示,仅在5 μmol·L-1DTS处理后,间充质标志物(包括N-cadherin和Snail蛋白)的表达降低,上皮标志物E-cadherin的表达增加(图5B~图5D)。结果表明,DTS抑制了A549细胞中的EMT信号通路。
综上结果表明,DTS可以显著抑制A549细胞的迁移和侵袭能力,并且抑制EMT相关通路。

A:免疫印迹结果;B:E-cadherin与GAPDH灰度值比较;C:N-cadherin与GAPDH灰度值比较;D:Snail与GAPDH灰度值比较;**P <0.01、***P <0.001 与 0 μmol·L-1 组相比。图5 DTS抑制A549细胞中的EMT信号通路
2.6 DTS抑制A549细胞中的JAK/STAT3信号通路
前面的实验表明,DTS能够抑制A549细胞增殖,促进细胞凋亡,并且抑制细胞的迁移和侵袭能力。为了进一步阐明DTS抗肿瘤活性的潜在机制,我们通过免疫印迹法检测了在0、5、10、20 μmol·L-1的DTS,处理48 h后JAK1、JAK2和STAT3(Tyr 705)的磷酸化表达水平以及SOCS3表达水平(图6A)。灰度条带分析用于分析JAK1、JAK2、STAT3的磷酸化水平和SOCS3的表达水平。结果表明,5 μmol·L-1DTS可以降低p-JAK1、p-JAK2(Tyr 1007)和p-STAT3(Tyr 705),并上调SOCS3的表达(图6B~图6E)。以上结果表明DTS可以抑制A549细胞中的JAK/STAT3信号通路。

A:免疫印迹结果;B:p-JAK1与JAK1灰度值比较;C:p-JAK2与JAK2灰度值比较;D:p-STAT3与STAT3灰度值比较;E:SOCS3与GAPDH灰度值比较;**P <0.01、***P <0.001 与 0 μmol·L-1 组相比。图6 DTS抑制和A549细胞中的JAK/STAT3信号通路
2.7 JAK/STAT3通路的激活可挽救DTS抑制的A549细胞转移能力
在之前的研究中,我们发现DTS对JAK/STAT3信号通路有抑制作用。进一步我们反向评估了DTS是否通过该通路对A549细胞转移能力产生影响。在JAK/STAT3信号通路的相关激活因子中,IL-6最为重要,因此我们使用IL-6诱导JAK/STAT3信号通路的激活,并采用免疫印迹法、划痕试验和Transwell侵袭试验检测JAK/STAT3信号通路的激活是否可以挽救A549的转移能力。结果显示,与20 μmol·L-1DTS组相比,20 μmol·L-1DTS+IL-6组可以上调JAK1、JAK2、STAT3的磷酸化(图7A~图7D)。划痕结果显示,与0.8 μmol·L-1DTS组相比,0.8 μmol·L-1DTS+IL-6组可以挽救A549细胞的迁移能力(图6E、图6F)。此外,Transwell侵袭试验表明,与0.8 μmol·L-1DTS组相比,0.8 μmol·L-1DTS+IL-6组可以挽救A549细胞的侵袭能力(图7G、图7H)。以上结果表明,JAK/STAT3通路的激活可挽救DTS抑制的A549细胞转移能力,反向验证了DTS对A549细胞转移的抑制作用与JAK/STAT3通路相关。

A:免疫印迹结果;B:p-JAK1与JAK1灰度值比较;C:p-JAK2与JAK2灰度值比较;D:p-STAT3与STAT3灰度值比较;E,F:细胞划痕结果;G,H:Transwell侵袭结果;***P <0.001 与 DTS 组相比。图7 JAK/STAT3通路的激活可挽救DTS抑制的A549细胞转移能力
3 讨论
我们的研究发现,活性硫化物DTS对非小细胞肺癌细胞系A549细胞具有明显的增殖抑制、凋亡诱导、抑制迁移和侵袭的作用。DTS作用后,A549细胞中Bax表达升高,Bcl-2表达降低,并呈剂量依赖性。此外,N-cadherin和转录因子Snail表达下降,E-cadherin表达升高。进一步研究表明,DTS诱导的对细胞转移的抑制作用部分归因于对JAK/STAT3信号通路的抑制作用。我们的研究表明,DTS是治疗转移性非小细胞肺癌的潜在药物。
据报道,DTS对许多癌症如头颈癌、胃癌以及胰腺癌具有抑制作用[21-25]。本研究结果也表明,DTS在非小细胞肺癌细胞系A549细胞中具有抗增殖活性,证实了DTS对非小细胞肺癌具有抑制作用。然而,我们发现DTS对A549细胞的迁移和侵袭也具有显著的抑制作用。目前,有关于DTS抗肿瘤相关作用机制的研究较少,尚未有研究对其关于癌细胞的转移作用机制进行具体阐述,因此对其转移相关作用机制进行深入探索具有重大的意义。研究人员发现,DTS对于神经母细胞瘤细胞中的丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)的酪氨酸残基去磷酸化作用具有抑制性,从而引起癌细胞的微管发生解聚,使得癌细胞生长抑制[25-26]。而DTS类似物,对氟苄基三硫醚(氟莱哌素)能够与β-微管蛋白结合,抑制微管聚合过程,破坏微管的稳定性,最终引起细胞凋亡[19]。与已有研究结果不同的是,我们的研究显示了DTS对转移的抑制与EMT信号通路具有相关性,同时DTS诱导的抑制作用可归因于JAK/STAT3信号通路的抑制。因此,我们的发现丰富了DTS在抗肿瘤尤其是抗转移的相关作用机制。
EMT过程的标志是上皮标志物如E-cadherin表达的丧失,间充质标志物表达增加,例如N-cadherin和Vimentin蛋白,并伴有转移性表型发生[27]。EMT-TFs(尤其是Snail),Snail高表达与较差的人类癌症治疗结果相关度高,同时Snail在促进肿瘤增殖、转移等方面发挥重要作用[28],靶向Snail对许多转移性肿瘤具有潜在的治疗作用。CYD19是一种结构性CBP/p300-Snail蛋白相互作用抑制剂,是第一个报道的直接靶向Snail的抗肿瘤生长和转移的候选化合物[29],但CYD19仍处于早期研究阶段。我们的研究证实DTS抑制EMT信号通路并下调Snail的表达,这可能为进一步探索DTS治疗转移性癌症提供新线索。
大量研究表明,通过抑制JAK/STAT3通路可以抑制肺癌的转移作用,提示JAK/STAT3可作为治疗肺癌转移的有效靶点[15,17,30]。该途径的激活也与抗肿瘤免疫反应有关。因此,靶向这一信号可能会通过抑制肿瘤细胞生长和刺激抗肿瘤免疫来使癌症患者受益。越来越多的JAK/STAT3通路抑制剂开始投入肺癌治疗的研究。STAT3已被证明难以直接靶向,因此,其上游激活剂,如JAK,已作为癌症治疗的潜在靶点[31]。美国FDA首个批准的JAK抑制剂鲁索替尼(Ruxolitinib),可抑制JAK1/2的活性[32]。相关作用机制是竞争性的与JAK1/2激酶ATP结合位点的亚基结合,从而抑制JAK1/2的活性;AZD1480是一种小分子靶向药物,抑制JAK1/2的活性[33]。研究表明,AZD1480可抑制小鼠荷瘤模型中肿瘤的生长,但研究也发现其对神经系统具有较强的毒副作用,最终导致整体疗效不佳[34-36]。另一种JAK2抑制剂AG490,该药物的作用机制是通过抑制JAK2的磷酸化水平进而抑制STAT3的活化[37],从而导致肺癌细胞的生长、侵袭、肿瘤组织血管生成和上皮间质转化过程的抑制[38-40]。我们的研究结果表明,DTS以剂量依赖性方式显著降低A549细胞中JAK1、JAK2和STAT3的磷酸化水平,同时促进JAK/STAT3通路负调控因子SOCS3的表达。SOCS3是STAT3靶基因,可以抑制STAT3的磷酸化[41]。本实验中我们用IL-6诱导STAT3活化,证实IL-6可以挽救DTS对A549细胞转移能力的抑制作用。综上所述,与已有该通路相关抑制剂及相关药物相比,DTS可以促进STAT3上游靶基因SOCS3的表达,从而抑制STAT3的磷酸化。我们的发现揭示了DTS作为潜在抗肿瘤药物的作用机制,为非小细胞肺癌提供了新的治疗方案。然而,本研究中尚未阐明DTS是否特异性靶向JAK/STAT3信号通路,且没有明确具体的作用方式,因此在后续研究中将进一步明确其具体作用靶点及靶向方式从而完善其作用机制。
4 结论
本研究结果表明,DTS抑制了A549细胞增殖活性,促进了细胞凋亡,同时抑制了A549细胞的迁移和侵袭能力。具有EMT抑制的JAK/STAT3信号通路参与DTS诱导的对于A549细胞的转移抑制作用。总体而言,我们的研究结果证明了DTS具备潜在抗癌作用,可能成为新型抗肿瘤药物。

