重度子痫前期患者血清血管内皮生长因子和白细胞介素-4水平与新生儿窒息的相关性
张 璋,孙翠翠,黎晓曦
(信阳市中心医院妇产科,河南 信阳 464000)
子痫前期是妊娠期特有的一种多系统进展性疾病,其主要临床特点是妊娠20周后出现新发高血压和蛋白尿,或出现新发高血压和终末器官功能障碍伴或不伴蛋白尿,可严重影响母婴健康。重度子痫前期(severe preeclampsia,sPE)常导致多种不良妊娠结局,其中以新生儿窒息最为常见。新生儿窒息可引起新生儿出现多系统器官功能损害,且常遗留永久性神经后遗症,是导致新生儿病死和伤残的重要原因。有研究显示,新生儿窒息的病死率为2.3%~12.7%[1]。因此,寻找与sPE患者新生儿窒息发生有关的临床指标十分必要。有研究指出,sPE的病理发生机制主要是滋养层细胞的浅着床造成胎盘缺血缺氧和血管内皮损伤激活[2]。血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种二聚体糖蛋白,可诱导血管新生,在血管内皮损伤和修复中有重要作用,且可增加血管内皮通透性,增强内皮细胞增生速度、迁移能力及存活时间[3]。有研究表明,母胎之间免疫平衡的建立与维持对新生儿的健康十分重要,辅助性T细胞(helper T cell,Th)2所产生的体液免疫反应对妊娠的维持有保护作用[4]。白细胞介素-4(interleukin-4,IL-4)是Th2分泌的细胞因子,可促进巨噬细胞分泌抗炎因子,促进组织重构、血管生成,利于胎盘血管形成,改善胎盘浅着床,从而保护母体妊娠过程[5]。基于此,本研究旨在探讨sPE患者血清VEGF、IL-4水平与新生儿窒息的相关性,以期为临床治疗提供参考。
1 资料与方法
1.1 一般资料选择2017年1月至2021年1月信阳市中心医院妇产科收治的sPE患者作为研究对象。病例纳入标准:(1)符合《妊娠期高血压疾病诊治指南(2015)》[6]中sPE的诊断标准;(2)单胎妊娠;(3)初产妇。病例排除标准:(1)自然分娩前终止妊娠者;(2)合并自身免疫性疾病;(3)合并糖尿病、高血压、血液系统疾病、恶性肿瘤;(4)患有甲状腺功能亢进或结缔组织病;(5)近期有感染症状。本研究共纳入300例sPE患者,患者入院后均按照《妇产科学》[7]中治疗方案实施治疗至分娩,胎儿娩出后,参照《新生儿窒息诊断和分度标准建议》[8]评估是否发生新生儿窒息,并根据评估结果分为新生儿窒息组(n=19)和非新生儿窒息组(n=281)。新生儿窒息组:年龄24~28(26.22±1.05)岁;分娩时孕周25~32(27.19±1.11)周;孕次1~2(1.20±0.38)次;孕前体质量指数18.04~25.84(22.62±2.01)kg·m-2;分娩方式:剖宫产10例,阴道分娩9例;孕期定期产检:是17例,否2例。非新生儿窒息组:年龄22~29(26.08±1.20)岁;分娩时孕周25~35(27.22±1.08)周,孕次1~2(1.17±0.35)次,孕前体质量指数17.45~28.49(22.58±1.92)kg·m-2;分娩方式:剖宫产162例,阴道分娩119例;孕期定期产检:是263例,否18例。2组患者的年龄、分娩时孕周、孕次、孕前体质量指数及分娩方式、孕期定期产检分布比例比较差异无统计学意义(P>0.05),具有可比性。本研究获医院医学伦理委员会审核批准,患者及家属均知情同意并签署知情同意书。
1.2 酶联免疫吸附法检测血清VEGF、IL-4水平于分娩前采集2组患者空腹静脉血5 mL,3 000 r·min-1离心10 min(离心半径 15 cm),取上层血清,使用酶联免疫吸附试剂盒(南京森贝伽生物科技有限公司)测定血清中VEGF、IL-4水平,严格按照试剂盒说明书进行操作。
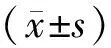
2 结果
2.1 2组患者血清VEGF、IL-4水平比较结果见表1。新生儿窒息组患者血清中VEGF、IL-4水平均显著低于非新生儿窒息组,差异有统计学意义(P<0.05)。
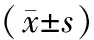
表1 2组患者血清VEGF、IL-4水平比较
2.2 sPE患者血清VEGF、IL-4水平与新生儿窒息发生的logistic回归分析结果见表2。以sPE患者新生儿窒息发生情况为因变量,以血清VEGF、IL-4水平为自变量进行logistics回归分析,结果显示,sPE患者血清VEGF、IL-4水平过表达是新生儿窒息发生的保护因素(P<0.05)。
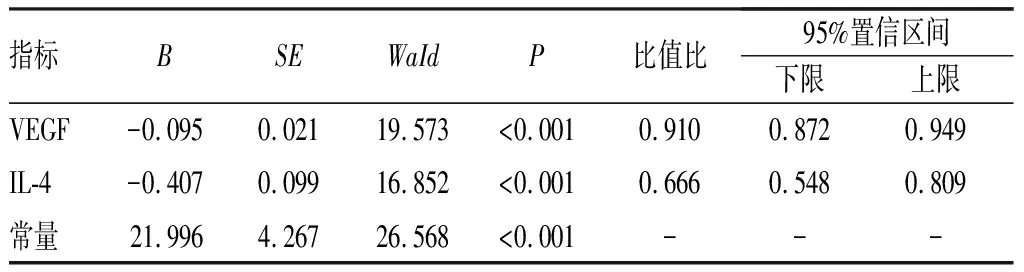
表2 sPE患者血清VEGF、IL-4水平与新生儿窒息发生的相关性logistic回归分析
2.3 sPE患者血清VEGF、IL-4水平对新生儿窒息发生的预测价值结果见图1。将sPE患者入院时血清VEGF、IL-4水平作为检验变量,新生儿窒息发生情况作为状态变量绘制ROC曲线,结果显示,sPE患者血清VEGF、IL-4水平预测新生儿窒息发生的AUC分别为0.889(95%置信区间为0.835~0.943;P<0.001)、0.809(95%置信区间为0.709~0.909;P<0.001),特异度分别为0.842、0.526,灵敏度分别为0.815、0.954,约登指数分别为0.657、0.480。

图1 sPE患者血清VEGF、IL-4水平预测新生儿窒息发生的ROC曲线
3 讨论
新生儿窒息可引起不同程度的神经系统问题,给家庭带来沉重的经济负担,同时新生儿窒息也是引起新生儿死亡的重要原因[9]。伍绍文等[10]研究发现,2 812 例sPE患者分娩的2 812例新生儿中,有176例发生新生儿窒息,发生率为6.26%(176/2 812)。本研究结果显示,300例sPE患者中发生新生儿窒息19例,发生率为6.33%(19/300),与上述研究结果相似,提示sPE患者有较高的新生儿窒息发生风险。因此,寻找与sPE患者新生儿窒息发生相关的指标十分必要。
有研究指出,血管内皮损伤是子痫前期患者病理生理改变的中心环节,且与患者的围生儿结局密切相关,包括胎儿生长受限、新生儿窒息等[11]。VEGF作为一种糖蛋白二聚体,可促进血管内皮细胞分化,同时也是调控胎盘血管生成的重要细胞因子[12-13]。有研究发现,VEGF可作用于血管内皮细胞,刺激血管内皮细胞的有丝分裂,提高血管通透性,促进血管形成[14-15]。有研究发现,子痫前期患者的细胞免疫向Th1明显偏移[16]。IL-4是Th2型细胞因子,具有多种生物学活性,可通过免疫调节,使Th1/Th2保持平衡状态,从而维持正常妊娠[17]。同时,在IL-4的作用下,Th0可向Th2分化,增强体液免疫[18-19]。本研究发现,新生儿窒息组患者的血清VEGF、IL-4水平显著低于非新生儿窒息组,说明sPE患者血清VEGF、IL-4低表达可能与新生儿窒息发生有关。原因可能为:VEGF可通过参与血管内皮功能损伤,在sPE中发挥作用,且VEGF已被证实在sPE的发生、发展过程中有重要作用[19];在妊娠状态下,VEGF可促进胎盘血管生成,为胎儿生长提供保障,当血清VEGF水平受到抑制,则不能诱导血管新生,促使滋养细胞对胎盘螺旋小动脉的侵袭表现异常,导致螺旋小动脉的脉管腔狭小,造成缺血、缺氧,增加新生儿窒息发生风险[20]。此外,IL-4可抑制Th1分泌促炎因子,当IL-4低表达时,可能会引起Th1/Th2的免疫平衡向Th1偏移,分泌大量炎症介质,损伤血管内皮功能,增加微血管通透性,使组织水肿,增加新生儿窒息发生风险[21]。
本研究通过logistic回归分析发现,sPE患者血清VEGF、IL-4水平过表达是新生儿窒息发生的保护因素;ROC曲线结果显示,血清VEGF、IL-4水平预测sPE患者新生儿窒息发生风险的AUC均>0.80,有一定的预测价值。因此,建议临床可监测sPE患者入院时的血清VEGF、IL-4水平,若二者异常低表达,提示有新生儿窒息发生高风险,可及时调整治疗方案,降低新生儿窒息发生风险。
综上所述,sPE患者有较高的新生儿窒息发生风险,可能与血清中VEGF、IL-4的异常低表达有关,sPE患者血清VEGF、IL-4水平对新生儿窒息发生风险有一定的预测价值,临床可针对性采取治疗措施,以降低新生儿窒息发生风险。

