产花色苷果胶酶菌株的筛选与鉴定
杨 荣,张 健,2,崔可栩,王艳君,4,赵现方,4,卫玉梅,李静思,赵庆桃,南立军,4*,李雅善,4*
(1.楚雄师范学院资源环境与化学学院,云南楚雄 675000;2.昆明理工大学食品科学与工程学院,云南昆明 650500;3.香格里拉酒业股份有限公司,云南香格里拉 674400;4.云南省高校葡萄与葡萄酒工程技术研究中心,云南楚雄 675000)
随着经济的发展,人们生活水平的提高,健康越来越受到人们的重视,目前有关花色苷和果胶酶的研究主要集中在其各自领域的研究[1-3],有关产花色苷果胶酶菌株的研究却很有限,产花色苷果胶酶不仅是上述两个独立的整体集中体现,而且在食品发酵工业中将会有很大的发展空间和潜力。
果胶酶是能降解果胶物质的复合酶类总称,具有提高色素和单宁稳定性的作用[4-5]。果胶酶广泛分布于高等植物和微生物体内,但高等植物的果胶酶产量低、难以提取,且绝大多数不含花色苷。微生物生长速度快、生长条件简单,是果胶酶的良好来源[6-8],故可通过微生物固态和液态发酵生产果胶酶。
工业生产果胶酶最常用的菌种是黑曲霉。产果胶酶菌株的筛选主要有高碘酸法、刚果红法和溴酚蓝法[9-10],均是利用产生水解圈作为筛选依据。高碘酸法只适用于酶具有活性和底物含有淀粉的情况,溴酚蓝法使用的条件必须为酸性,刚果红法具有操作简单、使用条件广泛的优点。花色苷在酸性和碱性条件下有不同的显色反应,高碘酸和溴酚蓝的使用条件会在一定程度上影响花色苷显色。因此本试验主要采用的是刚果红法。果胶酶生产菌多采用经典法和分子生物学方法相结合对新分离菌株进行鉴定[4-8]。
花色苷是一种类黄酮色素,是深色果蔬、果蔬汁中呈色的重要化合物,是植物体内次生代谢的物质,通过苯丙氨酸代谢途径合成,其结构和含量的稳定性直接影响果蔬汁的外观及食用价值。花色苷是由花色素和糖苷键结合形成的配糖体化合物,花色苷中花青素母核上的羟基可以发生酰基化反应,使花色苷种类多样化[11-12]。与人工合成花色苷相比,天然花色苷生理功能多样,且用途和提取方法有所不同。花色苷易溶于水,在强酸性条件下呈稳定的红色,在弱酸性至中性条件下呈紫红色,在碱性条件下呈蓝色。花色苷性质极不稳定,很少以游离态形式存在于自然界中。
不同葡萄品种的花色苷和果胶酶含量不同,即使是同一葡萄品种,也会因为地理条件和成熟度等差异导致花色苷和果胶酶含量存在差异。通常果胶酶在葡萄酒中具有加速澄清、提高出汁率、促进花色苷等酚类物质的释放、提取生物活性物质和改善酒品质等功能[13-16]。果胶酶能浸提花色苷,同时也能促进单宁的浸提,单宁具有抗氧化活性,能防止花色苷氧化,且能与花色苷结合形成稳定的复合物,所以果胶酶能起到稳定色素的作用[17]。以葡萄皮、葡萄园土壤和葡萄酒等为原料,从微生物角度开展产花色苷果胶酶的研究,能最大程度降低提取成本、节约时间。
本试验以刚果红法为菌株的筛选方法,通过形态外观和显微镜观察鉴定菌株,经液态深层发酵获得发酵液,离心后得到粗酶液,进一步采用pH 示差法测定花色苷含量,综合试验获得相关数据,最终得到目的产物,用于提高和稳定葡萄酒品质的研究,主要解决葡萄酒色素不稳定给葡萄酒的品质带来消极影响的问题,稳定葡萄酒颜色、提高葡萄酒品质、减少葡萄酒酿造工艺环节、降低生产成本。
1 材料与方法
1.1 试验材料
1.1.1 材料
‘赤霞珠’葡萄,采摘于香格里拉产区。葡萄园土壤取样于香格里拉产区的斯农。葡萄酒购买于香格里拉酒业赤霞珠葡萄酿造的干红葡萄酒。
1.1.2 试剂
蛋白胨、琼脂,生物试剂,北京奥博星生物技术有限责任公司;牛肉膏、葡萄糖,分析纯,天津市大茂化学试剂厂;氯化钠、硫酸镁、磷酸二氢钾,分析纯,天津市风船化学试剂科技有限公司;磷酸氢二钾,生物试剂,天津市大茂化学试剂厂;酵母浸粉,生物试剂,天津市大茂化学试剂厂。
1.2 仪器与设备
SPX-100B-Z 型电热恒温培养箱、立式蒸汽高压灭菌锅,上海博迅实业有限公司;离心机,KDC-140HR,云南科仪化玻有限公司;恒温培养震荡器,BSD-100,上海博迅实业有限公司;紫外分光光度计,UV-5500,上海元析仪器有限公司;生物显微镜,WMS-1030,上海豫光仪器有限公司;生物安全柜,BSC 系列,北京东联哈尔仪器制造有限公司。
1.3 样品处理方法
1.3.1 赤霞珠葡萄皮粉末的制备
将赤霞珠葡萄皮剥下,放入鼓风干燥箱55 ℃烘干,研磨至粉末状,用40 目筛过滤,干燥保存备用。
1.3.2 葡萄园土壤培养液的制备
称取5 g 葡萄园土壤于45 mL 无菌水中,160 r/min震荡培养3 h,梯度稀释备用。
1.3.3 葡萄酒培养液
无需处理,直接使用。
1.4 菌株的初筛和复筛
参考华宝玉等[17]的研究,略作修改。
1.5 菌株的初步鉴定
参照尹乐斌等[18-19]的方法,略作修改。观察菌株在平板上的菌落形态,用生物显微镜进行菌落形态特征的观察,参考魏景超[20]的《真菌鉴定手册》进行初步的分类。将培养筛选出的菌落进行初步的形态学观察和显微镜观察,记录实验数据。
1.6 指标测定
1.6.1 花色苷的测定
参照王贝等[10]和刘洪海等[22]的方法,略作修改。分别取0.2 mL 粗酶液于两支5 mL 试管中,分别加入3.8 mL pH 1.0 的KCl 缓冲液和pH 4.5 的CH3CO2Na·3H2O 缓冲液,避光稳定20 min,用光路直径为1 cm 的比色皿在波长为520、700 nm 下测定吸光度值。通过吸光度值差,结合Fuleki T 公式(1)(2),计算得到样品花色苷含量。

式中,M为二甲花翠素葡萄糖苷分子量,493.5;Df为稀释倍数,22.5;ε为二甲花翠素葡萄糖苷消光系数,28000;W为花色苷含量,mg/L;L为比色皿的光程长度,1 cm。
1.6.2 半乳糖醛酸标准曲线的绘制
取标准D-半乳糖醛酸溶液0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6 mL,分别置于9 只25 mL 具塞比色管中,分别用蒸馏水补足至2 mL,各加入DNS 试剂3 mL,置沸水浴中煮沸10 min,然后以流动水迅速冷却,用蒸馏水定容至25 mL,充分混匀,用紫外分光光度计在520 nm 处测定吸光度值,以吸光度值(A)为横坐标,半乳糖醛酸浓度(B,mg/mL)为纵坐标,绘制标准曲线。
1.6.3 酶活力测定
于甲、乙两支25 mL 比色管中分别加入1.8 mL 质量分数为1%的果胶溶液(用pH 4.8 乙酸-乙酸钠缓冲液配制),甲管中加入0.2 mL 稀释粗酶液,立即摇匀,在50 ℃水浴中准确反应30 min,再向乙管中加0.2 mL 稀释粗酶液,立即放入沸水浴中煮沸10 min,终止反应,冷却;再分别向甲、乙管加入3 mL DNS 试剂,混合,沸水浴煮沸10 min,取出,立即冷却。加蒸馏水定容至25 mL,以煮沸灭活的稀释粗酶液为空白,在520 nm 处测定两试管的吸光度(OD值),用测得的(OD甲-OD乙)值在标准曲线上查得相应的D-半乳糖醛酸的量。果胶酶活力公式见式(3)。

式中,D为酶活力,U/mL;B为酶作用生成的D-半乳糖醛酸,mg/mL;C 为样品稀释倍数;v为测定酶活时取反应液的量,mL;t为反应时间,min。
1.7 数据处理
采用Excel 2010 数据分析计算法进行数据处理。
2 结果与分析
2.1 菌株的筛选
2.1.1 初筛
初筛根据菌株生长时利用果胶使平板产生水解圈能力,挑选出Dp/Dc 值较大的菌株,作为复筛的出发菌株,结果见表1(见下页)。葡萄酒样品筛选得到的菌株编号为1 号、2 号和3 号;葡萄园土壤筛选得到的菌株编号为4 号、5 号和6 号;葡萄皮中筛选得到的菌株编号为7号、8 号和9 号。通过平板菌落观察,发现菌株3 号、5 号和8 号菌株直径均为0.53 cm,颜色都为乳黄色,透明且表面光滑,初步判定为同一种菌,统一编号为3-1 号。4号和7 号直径均为0.2 cm,为乳黄色,不透明且表面光滑,判定为同一种菌,统一编号为4-1 号。最终筛选得到的菌株有6 种降解果胶能力较好的菌株。
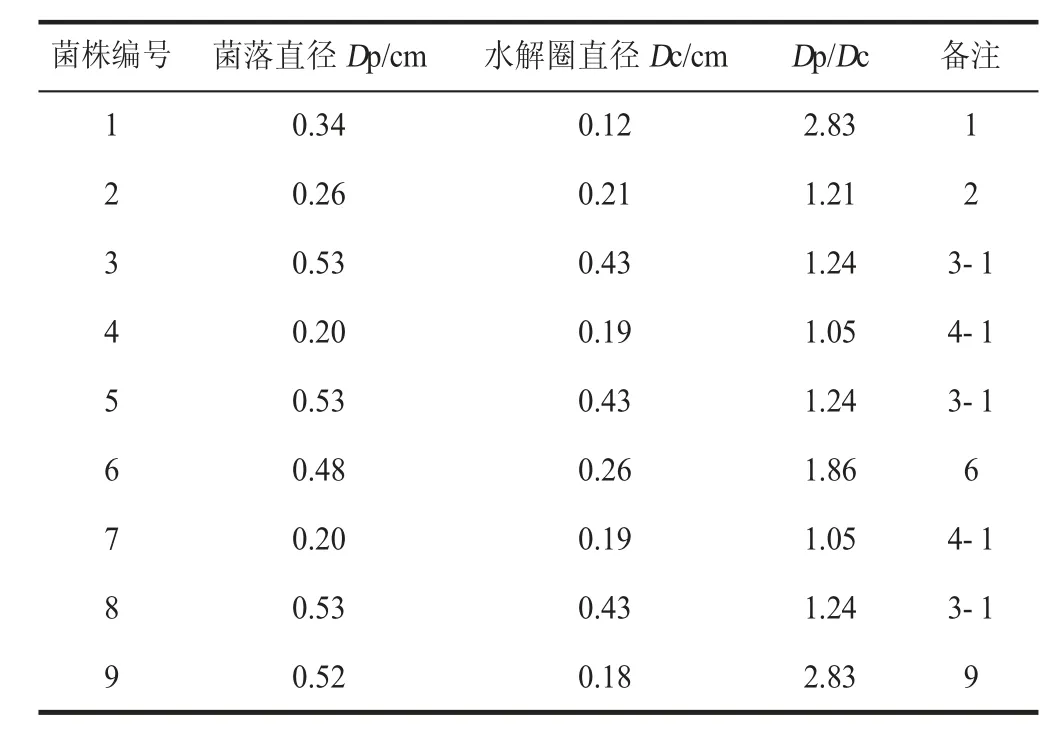
表1 葡萄皮、葡萄园土壤和葡萄酒菌株初筛水解圈直径(Dp)与菌落直径(Dc)及其比值Table 1 Grape skin,vineyard soil and wine strains Initial screening hydrolysis circle diameter (Dp) to colony diameter(Dc) and their ratios
(1)葡萄酒筛选得到的菌株
从葡萄酒中筛选出3 种不同形态的单菌落,直径范围在0.26~0.53 cm 之间,颜色为乳白色、乳黄色和白色,以半透明和透明为主,1 号和3 号表面光滑,2 号表面粗糙。如表2 所示,菌株经刚果红染色,获得较大透明圈的菌株序号为1 号。

表2 葡萄酒中单菌落外观形态Table 2 Appearance and morphology of single colonies in wine
(2)葡萄园土壤筛选得到的菌株
从葡萄园土壤中筛选出3 种不同形态的单菌落,直径范围在0.20~0.53 cm 之间,颜色为乳白色、乳黄色和浅黄色,透明度分别为不透明、半透明和略透明,均表面光滑。如表3 所示,菌株经刚果红染色,获得较大透明圈的菌株序号为6 号。

表3 葡萄园土壤中单菌落外观形态Table 3 Appearance of single colonies in vineyard soils
(3)葡萄皮筛选得到的菌株
由表4 可知,从葡萄皮中筛选出3 种不同形态的单菌落,直径范围在0.20~0.53 cm 之间,颜色为乳白色、乳黄色和粉紫色,以不透明和透明为主,均为表面光滑。菌株经刚果红染色,获得较大透明圈的菌株序号为9 号。

表4 葡萄皮中单菌落外观形态Table 4 Appearance of single colonies in grape skins
对比1 号、6 号和9 号菌落的透明圈大小,1 号和9号菌落的透明圈最大,成为目的菌株的可能性更大,作为复筛中重点观察的菌株。
2.1.2 复筛
将初筛得到的6 种菌株接种于种子培养基上,30 ℃、160 r/min 震荡培养24 h,使其活力增强,再取3 mL 种子培养液接种于50 mL 发酵培养基中,30 ℃、160 r/min 发酵培养48 h 后,发酵液于4 ℃、8 000 r/min 离心15 min,取上清液为粗酶液。
2.2 果胶酶活测定
2.2.1D-半乳糖醛酸标准曲线方程
DNS 法测定D-半乳糖醛酸浓度标准曲线方程为B=0.657 3A+0.040 7,R2=0.996。
2.2.2 三种样品获得降解果胶能力较好菌株粗酶液的酶活
由表5 可知,三种样品获得降解果胶能力较好菌株粗酶液的酶活中,9 号的酶活最高,为307.75 U/mL,然后依次为1、6、3-1、4-1、2。

表5 三种样品获得降解果胶能力较好菌株粗酶液的酶活Table 5 Three samples obtained enzymatic activity of the initial enzyme solution of strains with good degradation ability of pectin
2.3 花色苷含量测定
将初筛得到的6 种菌株分别接种于种子培养基上,30 ℃震荡培养24 h 后,取3 mL 种子培养液接种于50 mL 发酵培养基上,30 ℃、160 r/min 震荡培养48 h。发酵液经4 ℃、6 000 r/min 离心15 min 后,吸取上清液获得果胶酶粗酶液,测定粗酶液中花色苷含量如表6 所示。3-1号菌株来源于葡萄酒、葡萄园土壤和葡萄皮,其花色苷含量为5.95 mg/L;4 号菌株来源于葡萄园土壤和葡萄皮,花色苷含量为5.95 mg/L;1 号和2 号菌株来源于葡萄酒,花色苷含量分别为8.72 mg/L 和6.35 mg/L;6 号菌株来源于葡萄园土壤,花色苷含量为8.33 mg/L;9 号菌株来源于葡萄皮,花色苷含量为14.28 mg/L。果胶酶能浸提花色苷,同时也能促进单宁的浸提,单宁具有抗氧化活性,能防止花色苷氧化,且能与花色苷结合形成稳定的复合物,所以果胶酶能起到稳定色素的作用[23]。综上分析可得,三种原料筛选得到的产果胶酶菌株中均检测得到花色苷,其含量如表6 所示,数据显示9 号菌株产花色苷果胶酶的粗酶液花色苷含量最高,最终确定出最佳原料为葡萄皮。
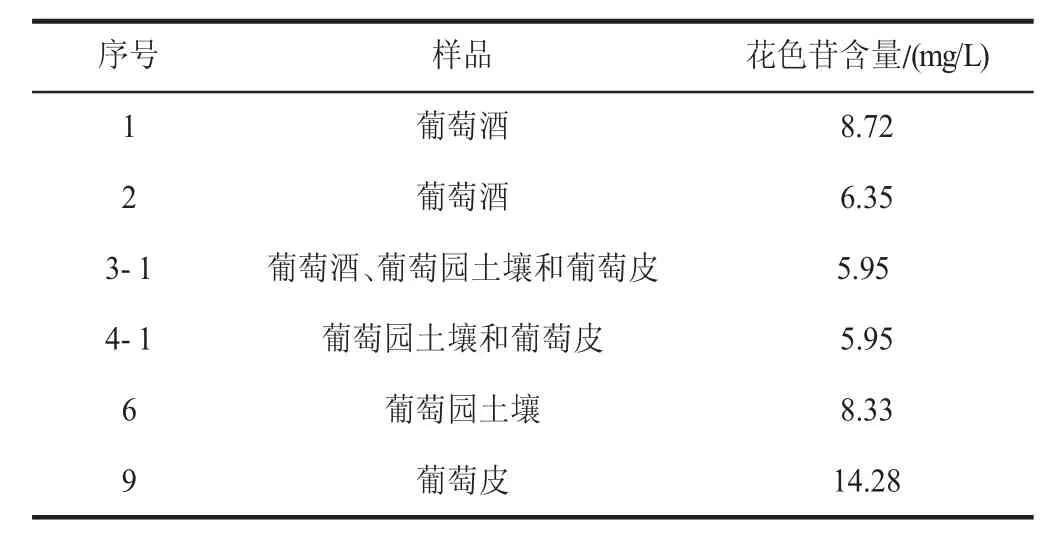
表6 粗酶液中花色苷含量Table 6 Anthocyanin content in crude enzyme solution
3 结论
本研究以香格里拉的‘赤霞珠’葡萄、葡萄园土壤及葡萄酒作为原料,菌株根据其利用果胶产生水解圈(变色圈)的能力,三种原样品各分离得到3 种产透明圈菌株。结合初步的菌落形态及显微镜结构观察分析,将菌株3 号、5 号和8 号菌株判定为同一种菌,编号为3-1号。4 号和7 号同一种菌,编号为4-1 号。最终筛选得到的菌株有6 种降解果胶能力较好的菌株作复筛的出发菌株。初步得到粗酶液,用DNS 法测定出酶活力最强的一组为葡萄皮中筛选出的9 号菌株;用pH 示差法测定出花色苷含量最高的一组为葡萄皮中筛选出的9 号菌株。因此,葡萄皮是产花色苷果胶酶的最佳原料。

