黄鳝Ⅰ型α螺旋细胞因子中6个白介素基因的序列特征及表达分析
谢梦,张哲华,周江,许巧情,邹远超
1.长江大学教育部湿地生态与农业利用工程研究中心,荆州 434024;2.内江师范学院生命科学学院/长江上游鱼类资源保护与利用四川省重点实验室,内江 641100
细胞因子是免疫调节的重要因子,参与脊椎动物免疫系统的各种调节过程[1]。根据其结构,细胞因子可分为5类[2],其中,Ⅰ型α螺旋细胞因子包括大量白细胞介素(interleukin,IL)和集落刺激因子(colony stimulating factor,CSF),前者可细分为IL-2 亚家族、IL-6 亚家族和IL-12 亚家族。IL-12 亚家族是以α 亚基(p19、p28 或p35)和β 亚基(p40 或EBI3)通过二硫键连接而成的异二聚体分子,其中p40 与p35 和p19分别形成IL-12和IL-23,EBI3与p28、p35和p19分别形成IL-27、IL-35和IL-39[3]。
白介素作为Ⅰ型α螺旋细胞因子主要部分,能够参与炎症反应和多种细胞间的相互作用,通过促进免疫细胞的活化、增殖及分化,对机体抵抗外界病原起着调控功能[4]。研究表明,IL-6不仅参与炎症和感染反应,而且参与代谢、再生和神经过程的调节[5]。IL-12 通过调节T 细胞诱导细胞免疫的激活从而保护鱼类免受感染[6-7]。IL-15是促进鱼类Ⅰ型免疫反应和NK 细胞激活的关键调节因子,对鱼类免疫系统激活抗菌防御和干扰素诱导基因的能力有深远的影响[8]。硬骨鱼中细菌和病毒可增强EBI3 的表达,增强后的EBI3 可提高外周血白细胞对细菌感染的抵抗力,具有免疫调节和抗菌防御特性[9]。IL-34 对巨噬细胞谱系起平衡作用,对炎症刺激很敏感,一旦表达上调,可能会调节巨噬细胞的生物学行为[10]。
黄鳝(Monopterus albus)是我国重要的淡水底层经济鱼类,随着养殖规模的扩大,黄鳝疾病逐渐增多,其中细菌性疾病,如嗜水气单胞菌(Aeromonas hydrophila)、维氏气单胞菌(A. veronii)和迟缓爱德华氏菌(Edwardsiella tarda)感染,不断威胁着黄鳝的可持续生产,给黄鳝养殖业造成巨大的经济损失[11-13]。目前研究发现,维氏气单胞菌可引起黄鳝IL-10 家族和IL-17 家族基因显著上调并表现出败血症,造成组织损伤和死亡,表明维氏气单胞菌能够引起黄鳝白介素家族积极参与抵抗病原体感染,同时对黄鳝有较强致病性[14-15]。因此,研究黄鳝Ⅰ型α螺旋细胞因子中白介素的特征和表达模式,对促进疾病的预防和控制具有重要意义。笔者从所在实验室测定的黄鳝转录组库中筛选获得了il-6、il-12p35、il-12p40、il-15、ebi3、il-34共6 个包含完整开放阅读框(open reading frames,ORF)的白介素基因序列,并对这些基因及其在健康和维氏气单胞菌感染后黄鳝中的表达模式进行系列生物信息学分析,旨在为深入研究白介素在黄鳝抗维氏气单胞菌感染过程中的分子机制奠定基础。
1 材料与方法
1.1 试验材料
从长江大学黄鳝研究中心收集体质量(47.0±1.2)g 的黄鳝,在水温为26~28 ℃和水深约10 cm 的水槽中避光养殖。每天喂食2次商业颗粒饲料,让黄鳝适应实验室条件2 周。选取健康无病理症状的黄鳝用于试验。所有试验遵循中国实验动物管理法,并经长江大学动物伦理委员会批准。
1.2 序列分析
黄鳝il-6、il-15、il-12p35、il-12p40、ebi3和il-34的序 列 从 黄 鳝 基 因 组(GenBank 登 录 号AONE00000000.1)和笔者所在实验室测定的黄鳝转录组库中查找获得,并通过基因克隆确定序列的正确性,来自其他物种的相同基因的序列从NCBI数据库(https://www.ncbi.nlm.nih.gov/)下载,在Expasy(https://www.expasy.org/)利用ProParam 进行预测对应编码蛋白质的物理化学性质,包括分子质量、氨基酸组成和理论等电点,利用Ident and Sim 网站(http://www.bioinformatics.org/sms2/ident_sim.ht⁃ml)分析黄鳝和其他物种之间的基因相似性,利用MEGA 6 软件中的邻接法构建黄鳝和其他物种基因的系统进化树。
1.3 健康黄鳝的组织取样
为了确定组织表达模式并鉴定mRNA 表达水平的差异,从6 尾健康黄鳝中无菌收集脑(BR)、心脏(H)、肠(I)、肝(L)、脾(SP)、肾(K)、皮肤(SK)和肌肉(M)8 种不同的组织,放入Trizol 试剂中并在−80 ℃条件下保存、用于提取总RNA。将提取的总RNA 用MonScriptTMRTIII Super Mix with dsDN⁃ase(Monad,中国苏州)试剂盒进行反转录合成第一链cDNA。
1.4 细菌攻毒试验和样品收集
为了研究细菌感染后黄鳝6 个白介素基因的表达变化,选择维氏气单胞菌进行注射感染试验。在预感染后,从单个有症状的鱼中重新分离细菌,并在培养前进行生化确认和PCR 分子鉴定。然后,在液体LB培养基中,37 ℃220 r/min培养维氏气单胞菌过夜。按10倍梯度稀释1 mL 细菌溶液,并将稀释液点在LB 琼脂平板上,测定维氏气单胞菌的浓度。试验鱼腹腔注射200 μL 非致死浓度(1×107CFU/mL)的维氏气单胞菌,将黄鳝随机分为感染后0(对照组)、1、4、24和72 h组,每组10尾,在相同条件下(避光、水温26~28 ℃、pH 6.5~8.5、溶解氧≥3 mg/L、氨<0.1 mmol/L、无硫化氢)养殖。结合组织表达结果,在注射后的每个时间点,从5尾黄鳝中收集试验鱼的肾脏(K)、脾脏(SP)和中间段肠道(I)等免疫组织。所有样品都储存在−80 ℃冰箱用于提取RNA。将提取的总RNA 用MonScriptTM RTIII Super Mix with dsDNase(Monad,中国苏州)试剂盒进行反转录合成第一链cDNA。
1.5 荧光定量PCR(qRT-PCR)
基于6 个白介素基因序列,使用Primer Pre⁃mier 5.0 设计用于qRT-PCR 的特异性引物,并进行预试验,以确保所有引物都能扩增cDNA(表1)。为了比较不同基因的相对表达水平,利用双标准曲线法,选择EF-1α为内参基因,计算基因相对表达量[14]。

表1 本研究所用的主要引物Table 1 Primers used in the study
1.6 统计分析
所有数据均表示为“平均值±标准误差”,用SPSS 16.0 软件对数据进行非配对样本差异显著性检验分析(One-Way ANOVA,Duncan’s 法),*P<0.05、**P<0.01 表示达到显著水平,具有统计学意义,使用GraphPad Prism 8软件绘图。
2 结果与分析
2.1 序列特征
6 个白介素基因的GenBank 登录号、开放阅读框(ORF)、编码氨基酸的长度、蛋白质理论分子量和理论等电点(pI)的数据见表2。开放阅读框长度从612 bp 到1 059 bp 不等,分别编码203~352 个氨基酸,分子质量23.26~40.50 ku,蛋白质理论等电点位于5.20~8.95。
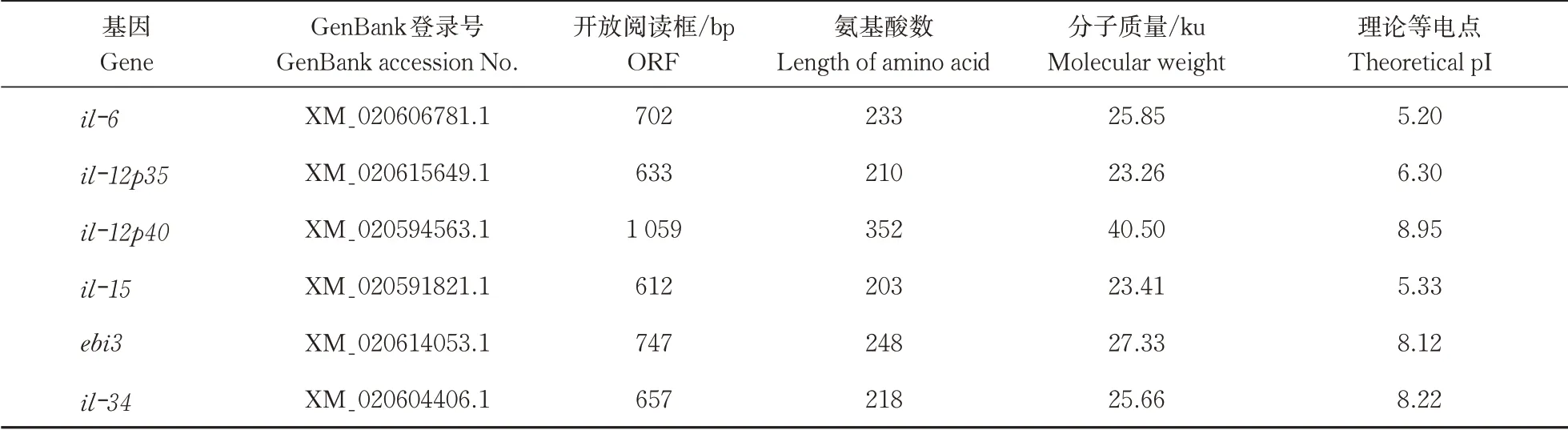
表2 黄鳝6个白介素基因序列特征Table 2 Sequence characterization of six interleukins in swamp eel
2.2 系统发育关系和相似性分析
系统进化树显示,黄鳝的6种白介素蛋白与其他物种的相应蛋白聚在同一分支,高度一致(图1)。在脊椎动物Ⅰ型α螺旋细胞因子的白细胞介素中,根据它们的系统发育关系,有4组,包括IL-6和IL-12p35;IL-15;IL-34;IL-12p40 和EBI3。黄鳝的6 种白介素与尼罗罗非鱼(Oreochromis niloticus)的对应基因进化关系最近,其次是其他鱼类,最后是热带爪蟾(Xenopus tropicalis)和人类。
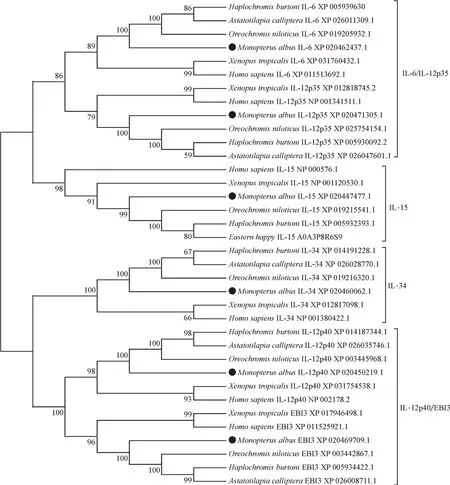
图1 黄鳝和其他物种中6个白介素蛋白的系统进化树Fig.1 Phylogenetic trees of six interleukin proteins in swamp eel and other species
在蛋白质相似性分析中,IL-6、IL-12p35、IL-15、IL-12p40、EBI3和IL-34与来自其他物种的同源蛋白质相似,相似度为27.05%~81.19%(表3)。相似性分析结果与系统发育分析结果一致,黄鳝6个白介素蛋白与尼罗罗非鱼相应蛋白的相似性最高,其中黄鳝IL-34 蛋白与尼罗罗非鱼IL-34 蛋白的相似性最高,达到81.19%。
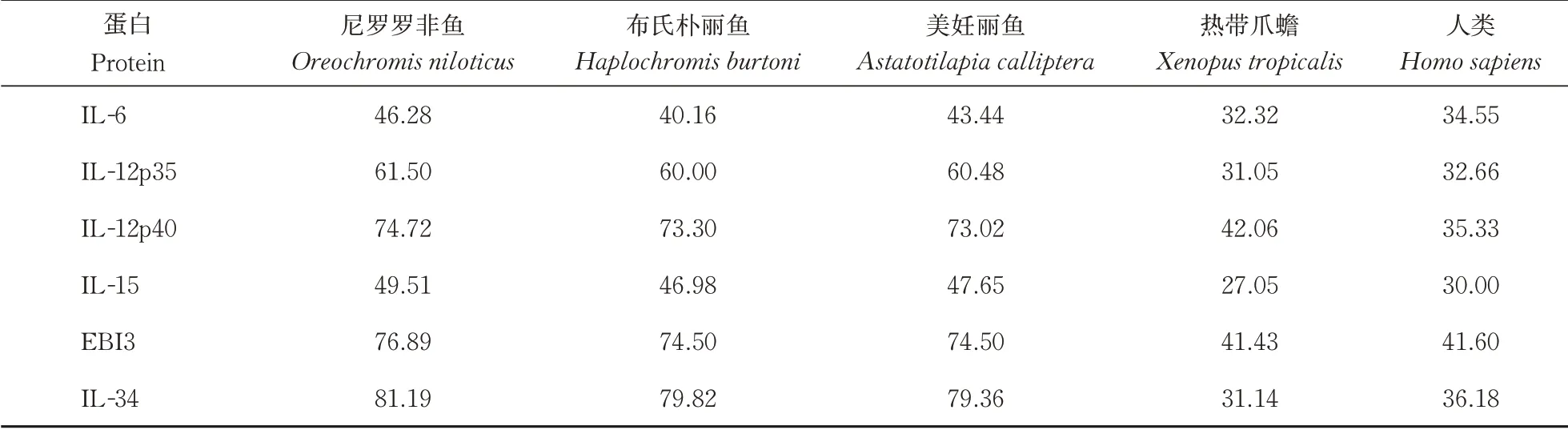
表3 脊椎动物与黄鳝6个白介素蛋白的相似性比较Table 3 Similarity comparison between vertebrate six interleukin proteins %
2.3 基因组基因结构和共线性分析
利用NCBI和Ensembl数据库分析6个黄鳝白介素的基因组基因结构。结果显示,这6个黄鳝白介素基因的基因组结构与尼罗罗非鱼、布氏朴丽鱼(Hap⁃lochromis burtoni)和美妊丽鱼(Astatotilapia callip⁃tera)相似。黄鳝il-6具有5 个外显子和4 个内含子(图2A),il-12p35、il-12p40和il-34包含7个外显子和6个内含子(图2B、2C和2F),il-15和ebi3具有6个外显子和5个内含子(图2D和2E)。
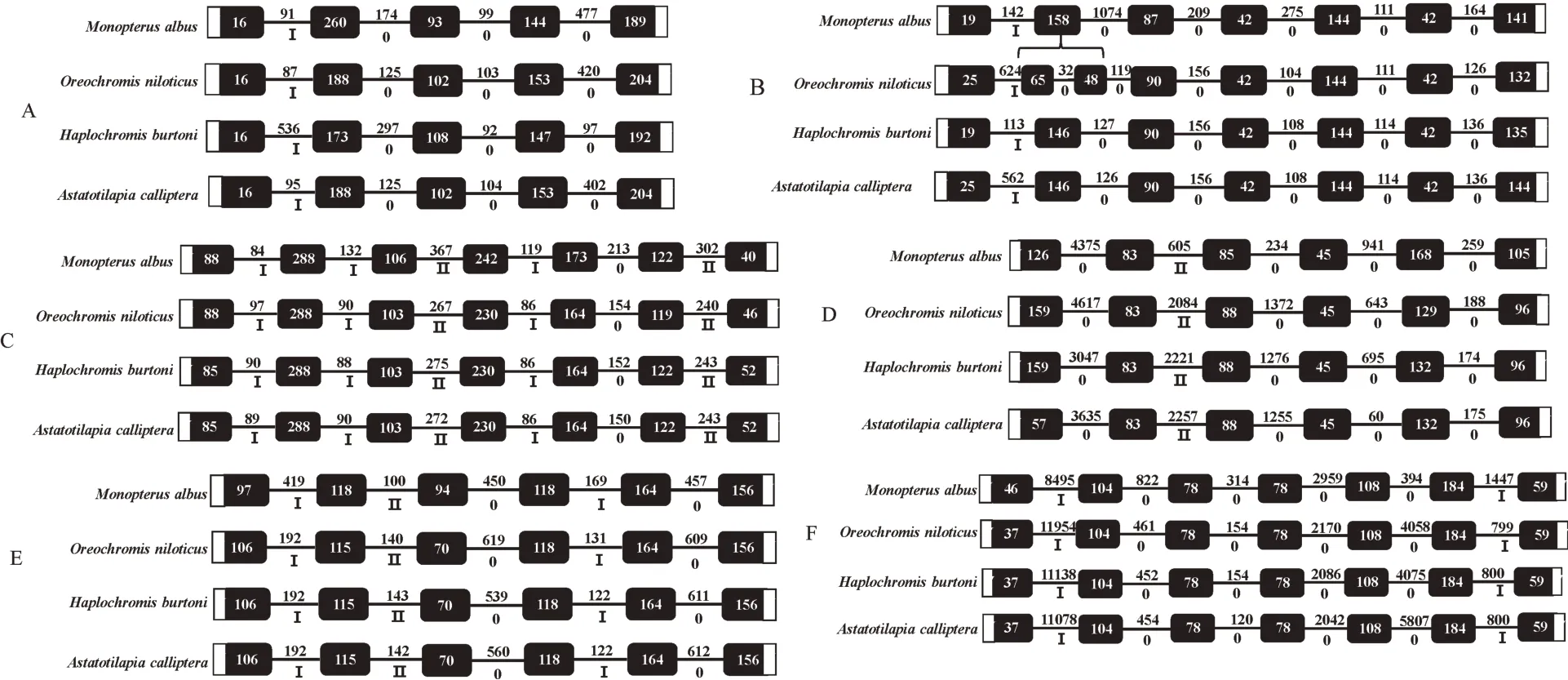
图2 黄鳝与其他动物6个白介素基因的结构示意图Fig.2 Genomic gene organization of six interleukin genes in swamp eel and other animals
对黄鳝的6个白介素基因进行分析,并与其他脊椎动物的相应基因进行比较,以确定基因的顺序和转录方向(图3)。il-6在鱼类中的上游基因RAP⁃GEF5和在脊椎动物中的下游基因TOMM7是保守的(图3A)。il-12p35的上游基因SCHIP1保守,而下游基因不太保守(图3B)。il-12p40基因仅在鱼类中是完全保守的,包括上游基因(ABLIM3、SH3TC2和ADRB2A)和 下 游 基 因(EBF1、CLINT1A和LSM11)(图3C)。除了人和红原鸡中下游基因GAB1和USP38的顺序和转录方向不同之外,大多数il-15基因是保守的(图3D)。ebi3在鱼类中仅对于其下游基因ODF312A和CRLF1A是保守的(图3E)。il-34的上游基因SF3B3在脊椎动物中保守(图3F)。
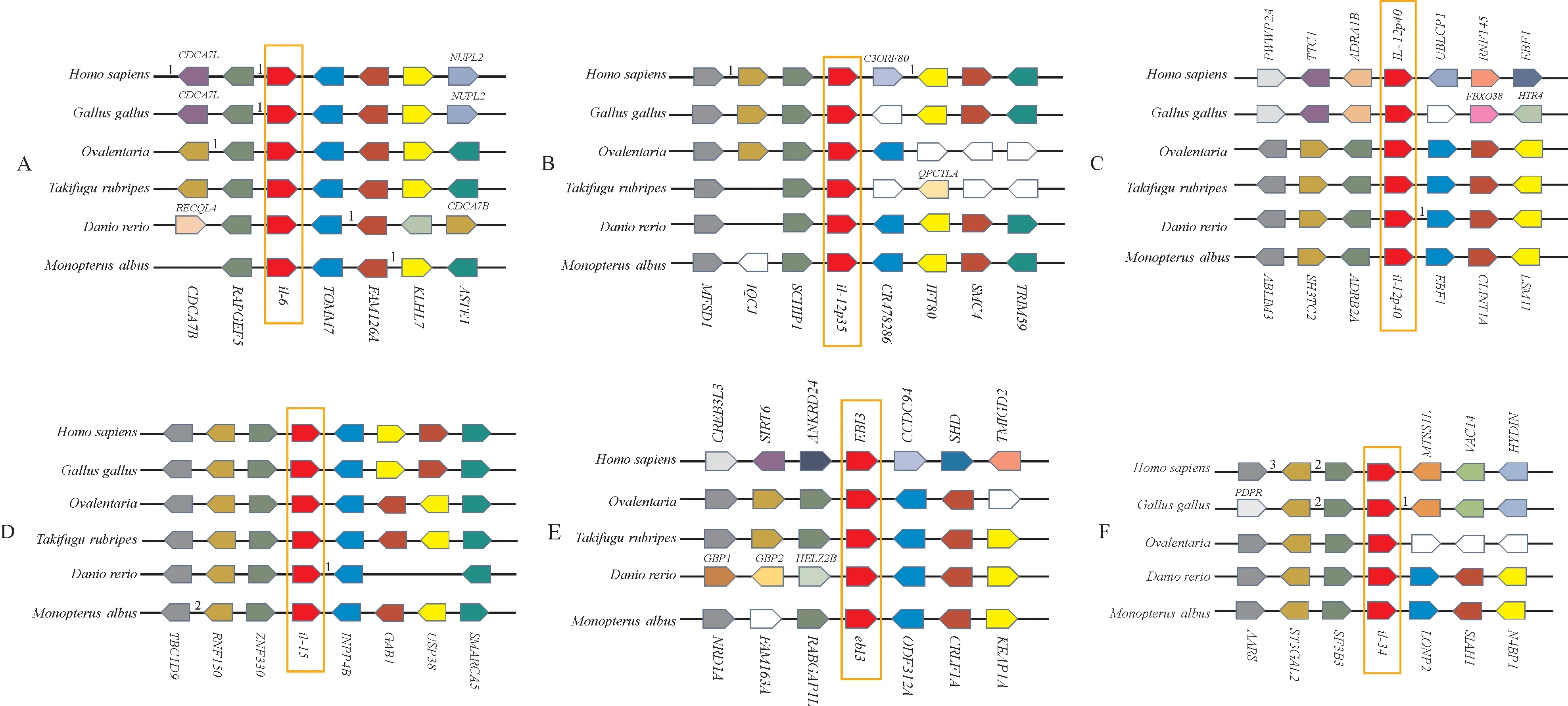
图3 基因共线性示意图Fig.3 Schematic representation of gene synteny
2.4 体内组织表达模式分析
为了检测il-6、il-12p35、il-12p40、il-15、ebi3和il-34在黄鳝中的组织表达模式,使用qRT-PCR 对这些基因的表达水平进行定量。这6 个基因在健康黄鳝的所有8 个组织中表达(图4),其中,il-6在脑中较肝脏中显著表达(图4A)。相比之下,il-12p35在肠中的表达明显高于除皮肤和脑之外的其他组织(图4B)。与其他组织相比,il-12p40在肾和肌肉中显著表达(图4C)。此外,il-15和ebi3在几乎所有组织中高表达,其中il-15在心脏、脑和肌肉中的表达显著高于肝脏(图4D),ebi3在脾和脑中的表达显著高于肝脏(图4E)。il-34在心脏中的表达显著高于肾脏并具有最高的表达量(图4F)。
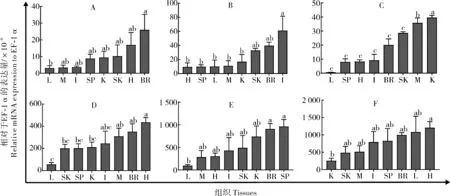
图4 健康黄鳝不同组织中6个白介素基因的表达模式Fig.4 Expression pattern of six interleukin genes in various tissue in healthy swamp eel
2.5 响应细菌感染的基因表达变化
维氏气单胞菌感染后,黄鳝身体出现不同程度的弯曲并失去平衡;体表黏液的分泌减少,血液更加黏稠;部分脾脏肿大且呈海绵状,肾脏充血肿大,肠道充血并伴有分节现象;大部分基因的表达与未感染的对照组相比发生了显著变化(图5)。在维氏气单胞菌感染后1 h,il-12p35在3 个组织均显著表达(P<0.05),除此之外,il-15在肠道显著上调,il-12p40和ebi3在脾脏和肾脏显著上调,il-6在肾脏显著上调;在感染后4 h,仅il-15在肠道显著上调,il-6和ebi3在脾脏和肾脏显著上调,il-12p40在脾脏显著上调;在感染后24 h,il-12p40在3 个组织均显著表达,il-34在脾脏显著上调,il-6和il-15在肾脏显著上调;在感染后72 h,il-12p40在3 个组织均显著表达并达到该基因表达峰值,il-6、ebi3和il-34在肠道显著上调,il-15和il-34在脾脏显著上调。
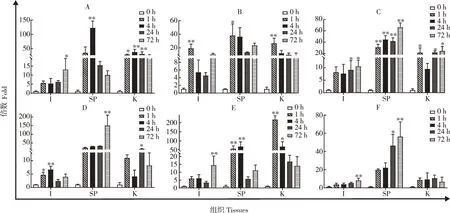
图5 6个白介素基因在维氏气单胞菌感染后的表达变化Fig.5 Gene expression of six interleukin genes in response to A.veronii challenges
3 讨 论
细胞因子是造血、免疫、过敏、炎症、组织重塑、血管生成和胚胎发育的关键介质[16]。然而,细胞因子中白介素的功能和特性在鱼类中还没有得到充分研究,虽然已经在许多硬骨鱼中研究了IL-6、IL-12和IL-15,但是关于EBI3 和IL-34 的研究很少[9,17]。本研究分析了黄鳝Ⅰ型α 螺旋细胞因子(IL-6、IL-12p35、IL-12p40、IL-15、EBI3 和IL-34)的序列特征、基因结构、系统进化关系、组成型表达和诱导表达规律。
6 个基因的基因结构分析表明,尼罗罗非鱼中有一个额外的外显子,这是由于剪接突变导致普通外显子2中的一段外显子序列缺失,从而将普通外显子2 分为外显子2、内含子2 和外显子3,说明在尼罗罗非鱼进化过程中,il-12p35基因结构演化时出现了基因突变[18],在河鲀(Takifugu rubripes)的IL-34也有类似的现象发生[10]。其他基因的外显子与内含子数量和时相与所比较物种的保持一致,说明了基因在演化时基因结构的保守性。共线性用于描述同一染色体上基因的位置关系,6 个基因的物种间基因共线性分析表明IL-15是其中在进化上相对保守的基因。
组织表达结果显示,在健康的黄鳝中il-6的表达似乎是组织依赖性的,其在大脑中的转录水平最高,表明il-6和神经组织之间存在相关性。据报道,在浪浦斯鱼(Cyclopterus lumpusL.)和大西洋大比目鱼(Hippoglossus hippoglossusL.)的大脑中也有高水平的il-6[19]。同时在先前的研究中,硬骨鱼的正常肝脏显示较低水平的il-6表达[20],这与本研究结果一致:il-6在肝脏中的表达最低,分析原因为IL-6 是促炎细胞因子,高水平作用于肝脏组织细胞,将导致肝脏病变,并且目前IL-6 已作为判断患者肝脏疾病严重程度的重要指标。此外,研究发现il-10和il-20l在黄鳝的肝脏中也有低水平表达现象[22]。il-12p35在健康黄鳝肠道中高表达,与黄鳝il-17a/f1的研究结果一致,说明其可能参与了黏膜免疫,对外来的病原体具有一定免疫作用[14]。il-12p40在肾脏中的表达量最高,肾脏是鱼类的造血器官与免疫器官,是细胞免疫与体液免疫的中心,表明其与黄鳝的特异性免疫反应有关。il-15和il-34在几乎所有组织中都高度表达,并且在心脏中具有最高的显著表达水平,与黄鳝il-17d的表达模式类似[21],这表明可能在血液循环系统中起作用。ebi3在免疫组织脾脏中高度表达,这与人和小鼠的ebi3表达相似[21],脾脏是鱼类的造血组织,又是重要的外周免疫器官,ebi3在脾脏中表达量最高可能与其参与体液免疫和炎症免疫有关。
为了探究外来病原感染时黄鳝6 个白介素基因的免疫防御作用,本试验用维氏气单胞菌腹腔注射感染黄鳝,检测6个白介素基因的表达变化。结果显示,与对照组相比,维氏气单胞菌的刺激能够影响6个白介素基因的表达,表明它们在黄鳝抵抗外界病原免疫活动中的潜在关键作用。黄鳝il-6应对维氏气单胞菌的表达模式与团头鲂(Megalobrama ambly⁃cephala)il-6对嗜水气单胞菌的表达模式相似[22],分别在感染后4 h 和6 h 时在脾脏中获得最显著的表达,并且在树鼩(Tupaia belangeri)中脂多糖(LPS)刺激后3 h 获得最高表达[23],这表明il-6在细菌感染的早期阶段被更大程度地诱导表达,可能是由于维氏气单胞菌感染后其细菌外膜上的脂多糖诱导NFκB 和MAPK 通路中先天免疫信号的激活,上调IL-6、TNFα等促炎细胞因子的表达。il-12p35在感染后1 h 时在黄鳝的3 个组织中达到最大显著表达,il-12p40在3 个组织中的表达持续上升,这一结果与鲤(Cyprinus carpio)在LPS 刺激下il-12p35的表达在感染后2 h 达到高峰而il-12p40的表达逐渐增加的结果一致[24],表明il-12p35参与了对抗细菌的天然免疫反应的早期阶段,而il-12p40持续响应细菌防御活动。黄鳝il-15在感染维氏气单胞菌后的表达效果与团头鲂相似[25],并且在脾脏和肾脏中被高度诱导和表达,表明其参与抵抗这些组织中病原体感染的免疫反应。EBI3是一种具有促炎和抗炎特性的多效性细胞因子,其不同功能取决于免疫环境[26]。ebi3在黄鳝肠道中的表达逐渐增加,但分别于感染后1 h 和4 h时在肾脏和脾脏中达到最高水平。在感染后1 h 时肾脏中的表达倍数变化最高,达到216.07倍,EBI3可能通过调节iNKT 细胞(invariant nature killer T cell,iNKT)的功能促进Th2 免疫反应,诱导Th2 介导的炎症发生,抵抗胞外病原体感染[27]。il-34在黄鳝肠道和脾脏中的表达持续增加并显著表达,然而在肾脏中没有显著表达,而草鱼感染柱状黄杆菌(Flavo⁃bacterium columnare)后,脾脏中il-34的表达量也持续增加并在感染后72 h达到最大值,但在感染后12 h的肾脏中表达量显著增加[28],分析可能是由于设置不同的分组时间点和使用不同的细菌病原体造成的。黄鳝IL-34可能通过与CSF-1R结合后触发多条信号通路,从而调节巨噬细胞的黏附等功能,增强对细菌的清除[29]。此外,黄鳝受维氏气单胞菌感染后IL-10 家族和IL-17 家族基因的表达均显著上调[14-15],表明黄鳝白介素基因参与了先天免疫反应的相关通路,保护黄鳝免受胞外病原体的侵袭,并在应对病原体刺激时具有不同的作用。
综上,本研究分析了黄鳝6 个白介素基因,揭示这些基因在鱼类进化中具有较高的保守性。维氏气单胞菌能调节这6个白介素基因的表达,说明了白介素在黄鳝抵抗细菌的防御过程中能发挥重要作用,这可为深入探讨白介素基因的功能奠定理论基础。

