下调IL-32γ表达降低自然杀伤细胞对食管癌细胞的杀伤作用
虞伟妃,汪笑秋,赵丽萍,周珏伊,冯继红
虞伟妃,汪笑秋,赵丽萍,周珏伊,冯继红,浙江中医药大学研究生院 浙江省杭州市 310053
虞伟妃,丽水市人民医院肿瘤放化疗科 浙江省丽水市 323000
0 引言
肿瘤微环境在肿瘤的发生和进展中具有关键作用.肿瘤相关基质细胞释放的多种细胞因子、生长因子和炎症介质可直接影响肿瘤细胞的生物学行为,也可通过诱导生长信号的改变或激活细胞毒性淋巴细胞来间接影响肿瘤细胞的生物学行为[1,2].细胞因子在肿瘤的发展和进展中起着重要的作用,比如白细胞介素(interleukin,IL)-6、IL-8和IL-22具有增强致瘤活性的作用[3-5],而IL-1和IL-21则能抑制肿瘤的生长[6,7].IL-32是一种由活化的T淋巴细胞、自然杀伤(natural killer,NK)细胞、上皮细胞和单核细胞产生的细胞因子[8].据报道,IL-32可参与调节胃癌、肺癌、乳腺癌和结直肠癌等多种肿瘤的发生与发展,比如,IL-32可促进肺癌和胃癌细胞的生长与迁移[9,10],而在结直肠癌和乳腺癌中则能发挥抑癌作用[11,12].造成这种情况的原因可能与IL-32的亚性多样性以及不同癌种相关.目前发现IL-32具有α、β、γ、δ、ε、η、s、θ和ζ 9种亚性,其中IL-32γ的活性最强[8].IL-32γ已被证明在食管癌患者的癌细胞、活化的NK细胞以及T细胞中高表达[13].但IL-32γ在NK细胞中高表达对其食管癌的作用并不清楚.因此,本研究分析IL-32γ在NK细胞表达水平与食管癌细胞之间的联系.
1 材料和方法
1.1 材料 RPMI-1640培养基(上海中乔新舟生物科技有限公司);胎牛血清(浙江天杭生物科技股份有限公司);IL-2细胞因子(北京百普赛斯生物科技有限公司);靶向IL-32γ的短发夹RNA(short hairpin RNA,shRNA)(shIL-32γ#1和shIL-32γ#2)以及对照shNC(上海生工生物工程有限公司);细胞计数试剂8(cell counting kit-8,CCK-8)试剂盒(广州研创生物技术发展有限公司);Annexin V/PI细胞凋亡试剂盒(武汉普诺赛生命科技有限公司);5-乙炔基-2'-脱氧尿苷(5-Ethynyl-2'-deoxyuridine,EDU)试剂(苏州宇恒生物科技有限公司);IL-32γ抗体(克隆号KU32-52,美国Biolegend公司);shRNA转染试剂以及肿瘤坏死因子受体超族成员6(tumor necrosis factor receptor superfamily member 6,FAS)、死亡受体3(death receptor 3,DR3)和肿瘤坏死因子受体2(tumor necrosis factor receptor 2,TNFR2)抗体(美国Santa Cruz Biotechnology公司);B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2-associated X,Bax)、天冬氨酸特异性半胱氨酸蛋白酶-3(cysteine-containing aspartate-specific proteases 3,Caspase 3)抗体(美国Cell Signaling Technology公司);辣根过氧化物标记的山羊抗兔或抗小鼠二抗体(万类生物科技有限公司).
1.2 方法
1.2.1 细胞培养: NK-92细胞和食管癌细胞株Eca9706和TE-1购自武汉普诺赛生命科技有限公司.将NK-92细胞置于含10%胎牛血清和10 ng/mL IL-2的RPMI-1640培养基中,将Eca9706和TE-1细胞分别置于含10%胎牛血清的RPMI-1640培养基中,在37 ℃的CO2培养箱中常规培养.共培养体系: 分别将Eca9706或TE-1细胞接种在不同规格(96孔和6孔)Transwell共培养体系(孔经0.4 μm,培养基为含10%胎牛血清和10 ng/mL IL-2的RPMI-1640培养基)的下室,待细胞贴壁后,按照效靶比(1:1、2:1和5:1)的比例将NK-92细胞接入上室,共培养48 h.
1.2.2 细胞转染: 将NK-92细胞置于含10%胎牛血清和10 ng/mL IL-2的RPMI-1640培养基中生长过夜,次日达到80%汇合时,更换无血清培养基孵育6 h,并按shRNA转染试剂的转染方案说明书步骤,将shIL-32γ#1、shIL-32γ#2以及对照shNC分别转入NK-92细胞.6 h后,更换完全培养基并继续培养48 h.Western blot检测转染效率后,将细胞用于后续实验.
1.2.3 细胞活性检测: 分别将Eca9706或TE-1细胞接种于96孔Transwell共培养体系(5000细胞/孔)的下室,细胞贴壁后,上室按不同效靶比接入转染或未转染的NK-92细胞,共培养48 h.将含NK-92细胞的插入小室取出,加10 μL CCK-8试剂入下室,孵育2 h后,酶标仪波长490 nm处检测吸光度值.
1.2.4 细胞增殖检测: 分别将Eca9706或TE-1细胞接种于96孔Transwell共培养体系(5000细胞/孔)的下室,细胞贴壁后,上室按效靶比5:1(即2.5×104细胞/孔)接入转染的NK-92细胞,共培养48 h.将含NK-92细胞的插入小室取出,加50 μM EDU试剂入下室,孵育2 h后,荧光显微镜观察EDU阳性细胞.
1.2.5 细胞凋亡检测: 分别将Eca9706或TE-1细胞接种于6孔Transwell共培养体系(1.5×105细胞/孔)的下室,细胞贴壁后,上室按效靶比5:1(即7.5×105细胞/孔)接入转染的NK-92细胞,共培养48 h.将含NK-92细胞的插入小室取出,收集下室EC9706或TE-1细胞.按照试剂盒说明书步骤,分别对Eca9706或TE-1细胞在暗室孵育Annexin V和PI试剂,流式细胞仪分析细胞凋亡比例.1.2.6 蛋白表达检测: 分别将Eca9706或TE-1细胞接种于6孔Transwell共培养体系(1.5×105细胞/孔)的下室,细胞贴壁后,上室按效靶比5:1(即7.5×105细胞/孔)接入转染的NK-92细胞,共培养48 h.将含NK-92细胞的插入小室取出,收集下室EC9706或TE-1细胞.用RIPA裂解细胞并提取蛋白.将蛋白通过Western blot转印系统转移至PVDF膜.将膜用5%脱脂乳封闭后,室温分别孵育IL-32γ、FAS、DR3、TNFR2、Caspase-3和β-actin抗体(均1:1000)2 h,洗膜后,分别孵育对应的二抗.用化学发光法显示条带,并用化学发光成像系统采集图像,并用自带软件分析蛋白相对表达量.
统计学处理用SPSS 19.0分析软件进行所有数据统计分析.数据表示为均值±标准差(mean±SD).采用方差分析各组的差异,用事后检验法对各组均数进行多重比较.P<0.05表示具有统计学意义.
2 结果
2.1 NK-92细胞与Eca9706或TE-1细胞的效靶比选择如图1所示,与对照组(效靶比0:1)比较,在NK-92细胞与Eca9706或TE-1细胞的效靶比1:1、2:1和5:1时,Eca9706或TE-1细胞的细胞活性均降低(P<0.05或P<0.01),且效靶比5:1时效果差异最为明显,后续选择效靶比5:1.

图1 NK-92细胞对食管癌细胞的细胞活性的影响.A: NK-92细胞对Eca9706细胞活性的影响;B: NK-92细胞对TE-1细胞活性的影响.mean±SD,n=3,与对照组(效靶比0:1)相比,aP<0.05,bP<0.01.
2.2 敲降N K-92细胞中I L-32γ增加共培养体系中Eca9706或TE-1细胞的细胞活性 如图2A所示,与对照组或sh-NC转染组相比,转染shIL-32γ(shIL-32γ#1和shIL-32γ#2)能抑制IL-32γ表达.将NK-92细胞与Eca9706或TE-1细胞按效靶比(5:1)共培养48 h,与NK-92共培养组(NK-92与Eca9706或TE-1细胞共培养体系)比较,NK-92-shIL-32γ#1或shIL-32γ#2共培养组(shIL-32γ#1或shIL-32γ#2转染的NK-92与Eca9706或TE-1细胞共培养体系)中Eca9706和TE-1细胞的活性明显增加(P<0.01,图2B和C).同时,EDU法显示,NK-92-shIL-32γ#1/shIL-32γ#2共培养组Eca9706或TE-1细胞中的EDU阳性细胞数相对NK-92共培养组增多(图2D和E).

图2 敲降NK-92细胞中IL-32γ能逆转NK-92对食管癌细胞增殖的抑制作用.A: shIL-32γ转染效率鉴定;B,C: 各组共培养体系中Eca9706(B)和TE-1(C)细胞的细胞活性;D,E: 各组共培养体系中Eca9706(D)和TE-1(E)细胞的EDU阳性细胞染色图.mean±SD,n=3,与对照组相比,aP<0.01;与NK-92共培养组相比,bP<0.01.IL-32γ: 白细胞介素-32γ;EDU: 5-乙炔基-2’-脱氧尿苷.
2.3 敲降NK-92细胞中IL-32γ能抑制NK-92诱导的食管癌细胞凋亡 如图3所示,与NK-92共培养组比较,NK-92-shIL-32γ#1或shIL-32γ#2共培养组的Eca9706和TE-1细胞的凋亡明显降低(P<0.01,图3A和B),Eca9706(图3C和D)和TE-1细胞(图3E和F)中Bcl-2的表达均明显增加(P<0.01),Bax和Cleaved caspase-3表达明显降低(P<0.01).
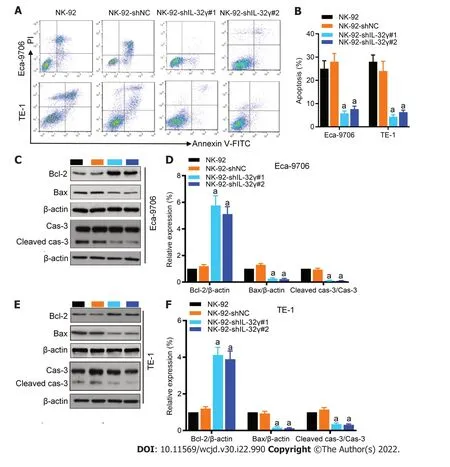
图3 敲降NK-92细胞中IL-32γ能抑制NK-92诱导的食管癌细胞凋亡.A,B: 流式细胞术检测各组细胞凋亡;C,D: Western blot检测各组Eca9706细胞中Bcl-2、Bax和Cleaved caspase-3表达;E,F: Western blot检测各组TE-1细胞中Bcl-2、Bax和Cleaved caspase-3表达.mean±SD,n=4,与NK-92共培养组相比,aP<0.01.IL-32γ: 白细胞介素-32γ;Cleaved caspase-3: 裂解的天冬氨酸特异性半胱氨酸蛋白酶-3;Bcl-2: B淋巴细胞瘤-2;Bax: Bcl-2相关X蛋白.
2.4 敲降NK-92细胞中IL-32γ能抑制共培养体系中食管癌细胞死亡受体相关蛋白表达 如图4所示,与NK-92共培养组比较,NK-92-shIL-32γ#1或shIL-32γ#2共培养组Eca9706(图4A和B)和TE-1(图4C和D)细胞中FAS、DR3和TNFR2表达均明显降低(P<0.01).
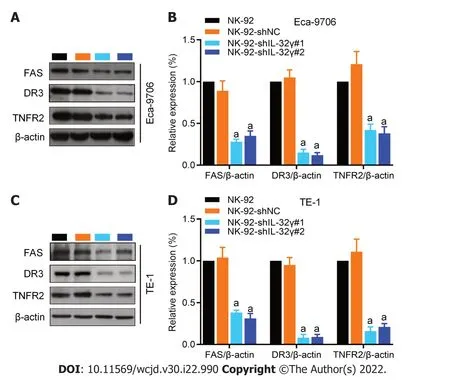
图4 敲降NK-92细胞中IL-32γ能抑制共培养体系中食管癌细胞死亡受体相关蛋白表达.A,B: Western blot检测各组Eca9706细胞中FAS、DR3和TNFR2表达;C,D: Western blot检测各组TE-1细胞中FAS、DR3和TNFR2表达.mean±SD,n=4,与NK-92共培养组相比,aP<0.01.FAS: 肿瘤坏死因子受体超族成员6;DR3: 死亡受体3;TNFR2: 肿瘤坏死因子受体2.
3 讨论
食管癌是严重影响人类健康的的常见肿瘤类疾病之一,约90%的食管癌为食管鳞状细胞癌,其早期症状不明显,易错诊[14].虽然近年来食管癌诊治手段有所进步,但晚期食管鳞状细胞癌患者的总体治疗效果仍不令人满意[15],因此,对其有更深入的认识并积极寻找其他有效的治疗方法迫在眉睫.
NK细胞可通过产生细胞因子和细胞毒性来清除肿瘤细胞,其在肿瘤的天然免疫防御中发挥重要作用[16].IL-2、IL-12和IL-18虽然被发现其能活化NK细胞和增强抗肿瘤效应,但这些细胞因子在高剂量系统给药后具有明显的毒性[17,18].IL-32γ在活化的NK细胞中过表达,并且能诱导分泌肿瘤坏死因子(tumor necrosis factor,TNF)-α[19],且IL-32γ过表达可增强NK细胞的易感性,并增加IFNγ和TNF-α的生成[20].另外研究显示,TNF-α又可通过TNFR2来激活NK细胞毒性[21].但NK细胞中IL-32γ表达是否对其发挥抗食管癌的作用的影响目前尚不清楚.本研究显示,敲降NK-92细胞中IL-32γ表达后,NK-92细胞对食管癌细胞的杀伤作用降低,提示IL-32γ是NK-92细胞发挥抗肿瘤效应的必要细胞因子.活化的NK细胞能释放如TNF-α/β、FASL等多种TNF配体[22,23].这些配体成员与对应的TNF受体(又称死亡受体)结合后,能通过死亡结构域招募并激活caspase-8,活化的caspase-8能直接活化caspase-3也可通过影响Bcl-2和Bax表达随后激活下游效应caspase-9、-7和-3[24,25].本进一步对敲降IL-32γ的作用机制进行探索,结果显示,在与转染shIL-32γ的NK-92细胞构成共培养体系的食管癌细胞中死亡受体家族成员FAS、DR3和TNFR2以及凋亡相关蛋白Bax和Cleaved caspase-3表达降低,同时Bcl-2表达增加.以上结果说明,敲降NK-92细胞中IL-32γ表达能减弱NK-92细胞对食管癌细胞的杀伤作用,且此作用可能与降低食管癌细胞中死亡受体表达和caspase-3通路激活有关.
4 结论
综上所述,IL-32γ是NK细胞在发挥抗食管癌效应的必要细胞因子,缺失IL-32γ能导致NK细胞对食管癌细胞的杀伤作用减弱.另外,这一结果还提示了: 也许IL-32γ给药可能是治疗食管癌的潜在方法之一,但这一方法仍需大量研究验证.
文章亮点
实验背景
活化的自然杀伤(natural killer,NK)细胞对肿瘤细胞具有杀伤作用,但NK细胞的活化又受到肿瘤微环境中的细胞因子、生长因子和炎症介质的影响.
实验动机
白细胞介素(interleukin,IL)-32γ已被发现其在活化的NK细胞表达升高,但并不清楚NK细胞中IL-32γ的表达水平是否影响其对食管癌细胞的杀伤作用.
实验目标
研究NK细胞中IL-32γ的表达水平对其杀伤食管癌细胞的影响,并分析其中涉及的机制.
实验方法
用基因干扰法敲降NK-92细胞中IL-32γ的表达后,将其分别与食管癌细胞EC9706和TE-1(靶细胞)构成共培养体系,检测EC9706和TE-1细胞的活性、增殖和凋亡情况以及死亡受体途径和凋亡相关蛋白的表达.
实验结果
敲降NK-92细胞中IL-32γ的表达能促进靶细胞EC9706和TE-1的活性和增殖、抑制细胞凋亡,并减弱死亡受体途径以及天冬氨酸特异性半胱氨酸蛋白酶-3(cysteinecontaining aspartate-specific proteases 3,caspase-3)的激活.
实验结论
敲降IL-32γ能降低NK细胞对食管癌细胞的杀伤作用.
展望前景
靶向过表达NK细胞中IL-32γ表达可能是食管癌治疗的潜在策略之一.

