肺癌患者血浆外泌体microRNAs标志物的筛选
刘 霞,高孜博,丁丽华,吴拥军
(郑州大学公共卫生学院,河南 郑州 450001)
随着对外泌体生物学的深入理解,外泌体的临床应用成为目前的研究热点。外泌体是30~150 nm的细胞外囊泡,广泛存在于各种体液中,并携带脂质、蛋白质、mRNA和微小RNA(microRNA,miRNA)等生物分子[1]。外泌体不仅可以通过靶向递送生物活性物质参与许多生理病理过程进而介导细胞间通信,也是肿瘤微环境重要的组成部分[2]。外泌体的内容物不是细胞质单纯的复制,而是由特定的蛋白质和核酸被选择性地分选到外泌体中[3]。越来越多的研究表明,外泌体中的生物活性物质反映其细胞起源和疾病状态,因此外泌体是疾病诊断和预后评估的潜在生物标志物[4]。近年来,在研究癌症发生发展有关的分子途径方面,miRNA引起了广泛关注。除了细胞功能外,外泌体miRNA可能是癌症筛查或辅助诊断的潜在生物标志物[5]。最近,人们尝试利用血浆外泌体miRNA作为癌症筛查和辅助诊断生物标志物,但至今尚未发现可用于肺癌筛查的miRNA生物标记物。
1 材料与方法
1.1 研究对象
本研究纳入肺癌患者男性、女性各3例,平均年龄(65.2±9.3)岁,其中腺癌3例、鳞癌2例、小细胞癌1例。健康对照组男性、女性各2例,平均年龄(66.3±10.0)岁。入选的受试者基本临床信息见表1所示。病例组来源于2018年12月—2019年12月某三甲医院的住院患者。纳入标准:①经病理学或细胞学被证实为原发性肺癌;②入组前未接受放化疗、药物治疗或手术治疗;③无主要脏器功能衰竭;④未合并其他恶性肿瘤;⑤未处于妊娠或哺乳期。对照组全血样本来源于2019年6—9月该院体检中心的正常健康者。纳入标准:①无肝炎、梅毒、HIV等传染病病史、性疾病史和恶性肿瘤史;②无糖尿病、高血压、心脑血管疾病及免疫系统疾病史;③与实验组年龄和性别相匹配;④无主要脏器功能衰竭;⑤未合并其他肺部及呼吸系统疾病;⑥未处于妊娠或哺乳期。
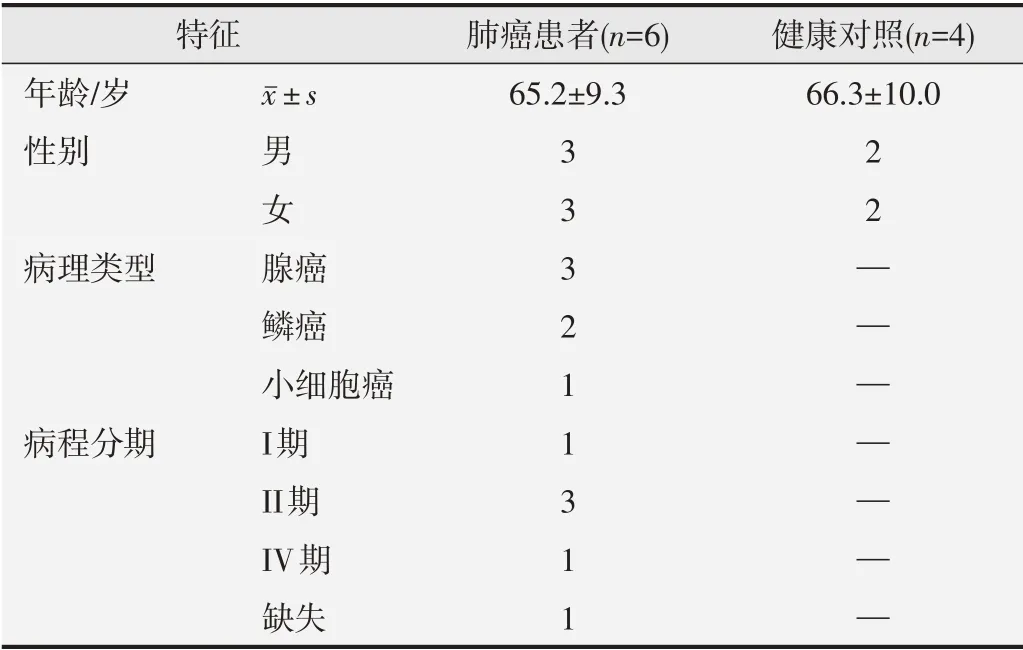
表1 肺癌患者和健康对照者的临床特征
1.2 主要实验试剂与仪器
兔抗人CD63抗体购于Abcam 公司;鼠抗人HSP70抗体、鼠抗人TSG101抗体、兔抗鼠IgG-HRP抗体购于成都正能生物技术有限责任公司;羊抗兔IgG-HRP抗体购于北京爱必信生物技术有限公司。
Agilent 2100生物分析仪,购于美国安捷伦科技有限公司;透射电子显微镜购于日本Hitachi公司;纳米颗粒跟踪分析仪购于英国马尔文帕纳科有限公司;超速离心机购于贝克曼库尔特公司。
1.3 样本采集与处理
本研究取得郑州大学生命科学伦理审查委员会的批准(ZZURIB 2021-106),研究对象均已签署知情同意书。每位患者采集3 mL全血样本于EDTA抗凝管中,在4℃下4 000 r/min离心后收集1.5 mL血浆,置于冻存管中于-80℃冰箱中保存备用。
1.4 肺癌患者和健康对照者血浆外泌体的分离与鉴定
1.4.1 外泌体分离采用超速离心法提取血浆外泌体,首先37℃水浴溶解样本,随后4℃条件下先后经过2 000 g、30 min,10 000 g、45 min离心后收集上清液;然后用0.22μm滤膜过滤,经100 000 g离心70 min,用PBS重悬,再次100 000 g离心70 min,用预冷的PBS重悬外泌体沉淀,冻存于-80℃冰箱中。
1.4.2 外泌体鉴定取10μL外泌体溶液滴在铜网上,室温下静置自然风干。用2%磷钨酸进行负染,多余染液用滤纸吸干,室温晾干。使用透射电子显微镜在120 kV工作电压下观察外泌体形态。
将提取的外泌体原液按30~100倍稀释,将稀释液加入1 mL注射器内,再将其加入检测槽中,利用纳米颗粒跟踪分析仪检测外泌体粒径分布和浓度。
使用Western blot实验BCA法检测蛋白浓度,按常规方法进行PAGE凝胶电泳并转移至PVDF膜,封闭后分别加入稀释后的CD63、HSP70、TSG101一抗孵育过夜,洗涤3次后再孵育二抗,膜上滴加ECL发光液后上机曝光,获得条带并保存。
1.5 肺癌患者和健康对照者血浆外泌体miRNA提取及质量检验
在外泌体中加入1~2 mL TRIzol,反复吹打使外泌体充分裂解;加入200 mL氯仿,剧烈震荡后4℃、13 000 r/min离心15 min;在最上层水相RNA溶液中加入等体积异丙醇,混匀静置,再次离心;75%的乙醇溶液洗涤RNA,然后4℃、13 000 r/min离心5 min,弃上清,干燥;沉淀溶解于无RNA酶水,重悬沉淀,即可得到RNA溶液。用Agilent Bioanalyzer 2100对总RNA进行质量检测,使用琼脂凝胶电泳法考察样品总RNA的完整性。
1.6 血浆外泌体miRNA高通量测序及数据分析
每个样本使用1μg RNA,用于建立血浆外泌体miRNA库,经过3′端接头,5′端接头,反转录和PCR扩增后,使用胶分离技术收集建立Small RNA(sRNA)文库,使用Agilent Bioanalyzer进行质检,根据结果确认文库的长度及质量。经Cutadapt(1.14版)、FASTX_Toolkit(0.0.13版)、NGS QC Toolkit(2.3.3版)软件计算处理后得到高质量clean reads用于后续分析。对筛选后的sRNA进行长度分布统计。将筛选后的clean reads比对到人类参考基因组序列,统计能比对到基因组上的reads百分比。使用Bowtie(1.1.1版)软件,对clean reads同Rfam(10.0版)数据库进行比对,提取R≤0.01的结果,注释出rRNA、snRNA、snoRNA、tRNA等序列。将这些注释到Rfam数据库的序列进行过滤去除,并去除能比对上转录本的序列且长度在15~41 bp范围之外的reads。根据鉴定的已知的成熟体miRNA以及新预测的miRNA的序列,采用高通量测序技术进行表达量统计,miRNA表达量计算采用TPM(transcript per million)计算外泌体miRNA表达量。采用R包中的DEG差异算法计算P值,筛选出P<0.05、 |log2( FC) |≥1(FC:差 异 倍 数)的miRNA。用TargetScan、PITA、miRNAorg 3个数据库,采用Miranda软件(3.3a版)进行靶基因预测。靶基因的KEGG和GO分析采用R软件的超几何分布检验,并对P值经Benjamini&Hochberg多重检验纠正后得到误报率(false discovery rates,FDR)。
2 结果
2.1 肺癌患者和健康对照者血浆外泌体表征分析
根据国际胞外囊泡协会标准对分离的外泌体进行表征。Western blot检测结果见图1,外泌体膜蛋白CD63和TSG101对应的相对分子质量分别在约30 ku和48 ku处,以及外泌体内蛋白HSP70对应的相对分子质量约70 ku处均可见相应的蛋白条带。电镜结果见图2,可观察到形态完整、大小均一的椭球形杯盘状囊泡,直径在100 nm左右。纳米颗粒跟踪分析结果见图3,健康对照者血浆外泌体平均直径为80.49 nm,颗粒浓度为3.49×109个/mL,肺癌患者血浆外泌体平均直径为75.20 nm,颗粒浓度为3.84×109个/mL。由此可见,所分离的外泌体符合要求,可进行后续的质量检验和高通量测序。

图1 外泌体标志蛋白表达

图2 电镜下外泌体形态及大小
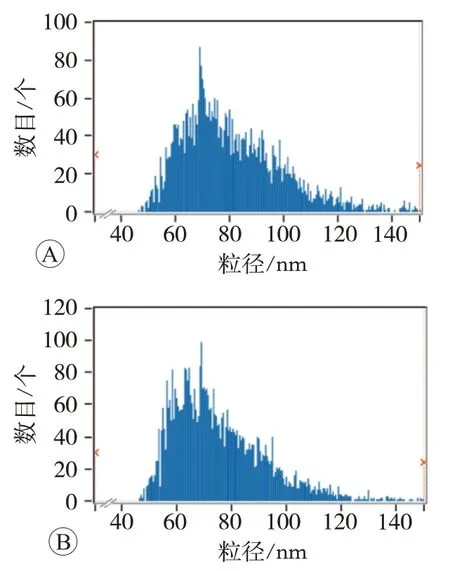
图3 血浆外泌体的粒径检测结果
2.2 肺癌患者和健康对照者血浆外泌体miRNA的质量检验
由于外泌体样本的特殊性,RNA含量低,本研究提取了10例血浆样本的总RNA,选用Agilent Bioanalyzer 2100对总RNA浓度进行检测,并表征电泳结果,评价RNA质量。检测结果见表2和图4,该实验成功对10例血浆外泌体样本提取了总RNA,由结果可知肺癌患者血浆外泌体提取的总RNA含量整体高于健康对照者。
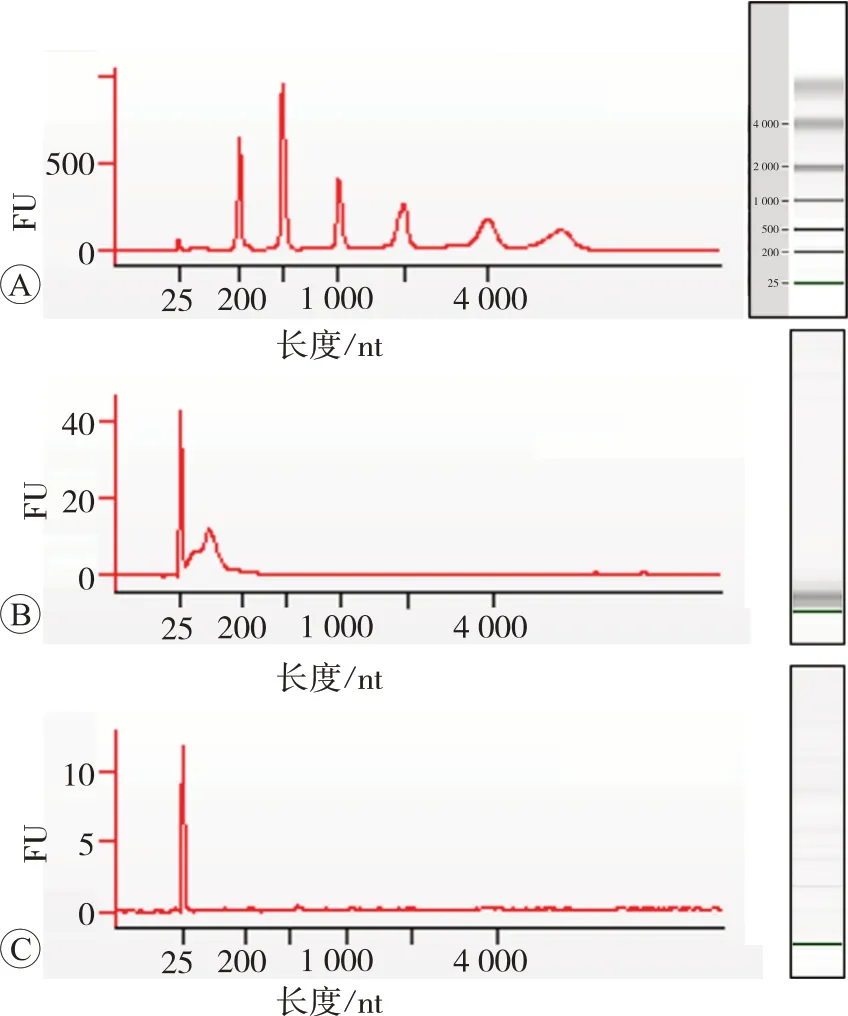
图4 Agilent Bioanalyzer 2100检测峰图与电泳结果
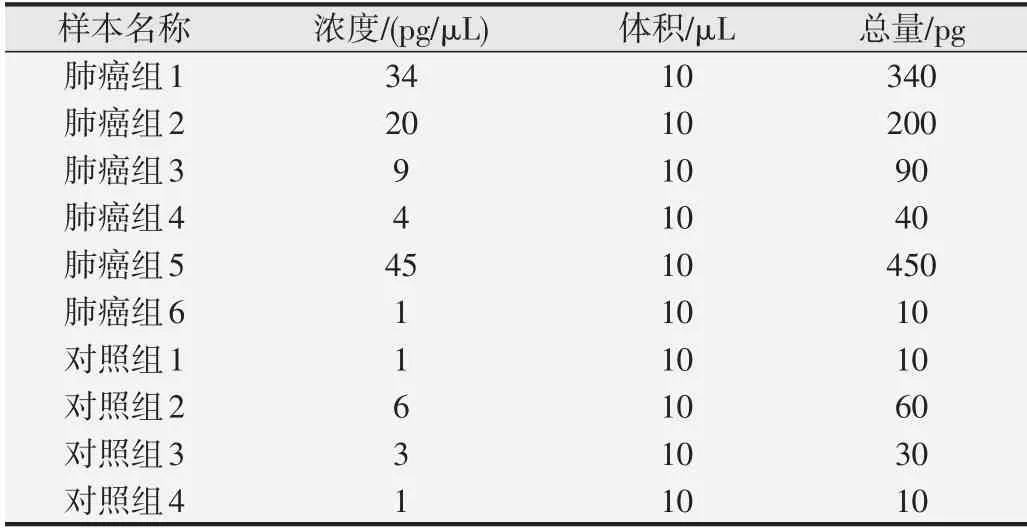
表2 血浆外泌体RNA的提取结果
2.3 血浆外泌体miRNA高通量测序数据分析
通过高通量测序直接获得原始数据的序列条数reads。肺癌组和健康对照组的最终reads数据量分别为19 978 985和17 216 884。外泌体sRNA进行长度分析见图5,筛选后的sRNA长度集中在20~23 nt,且在22 nt处出现峰值,检测结果表明筛选后的sRNA与miRNA长度分布特征吻合。将筛选后的sRNA定位到人类参考基因序列上,结果显示肺癌组和健康对照组中分别有12 116 998条和11 886 537条reads能比对到参考基因组序列上。
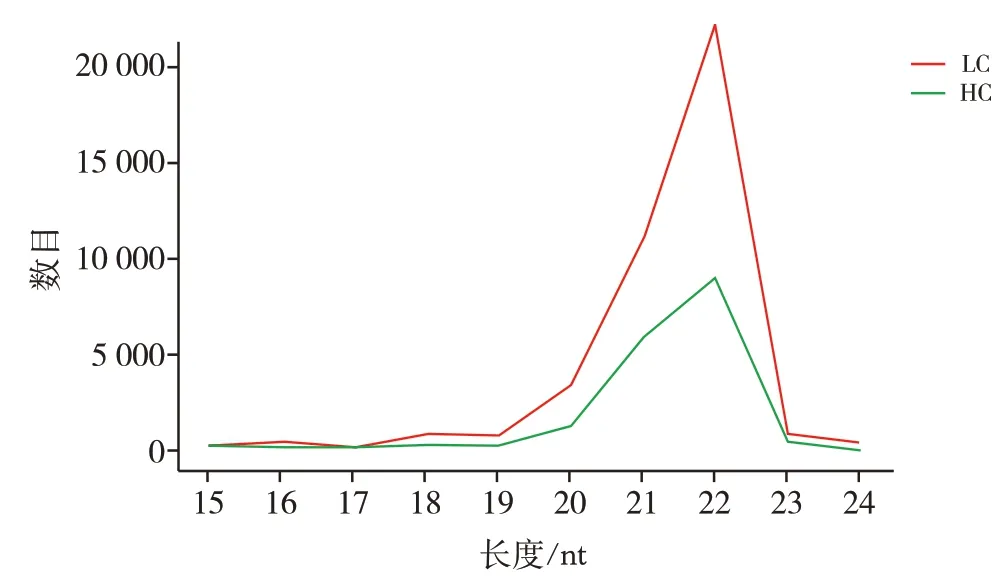
图5 sRNA长度分布图
2.4 生物信息学分析
2.4.1 肺癌患者与健康对照者差异miRNAs表达分析火山图和差异表达统计柱状图见图6,两组间有142个表达差异miRNAs符合筛选标准,其中肺癌中有62个miRNAs表达上调,80个miRNAs表达下调。前20个上调和下调miRNAs的log2(FC)和检验P值见表3,表明这些miRNAs可能在肺癌的发生发展中起重要的调控作用。

图6 肺癌患者与健康对照者差异miRNA筛选
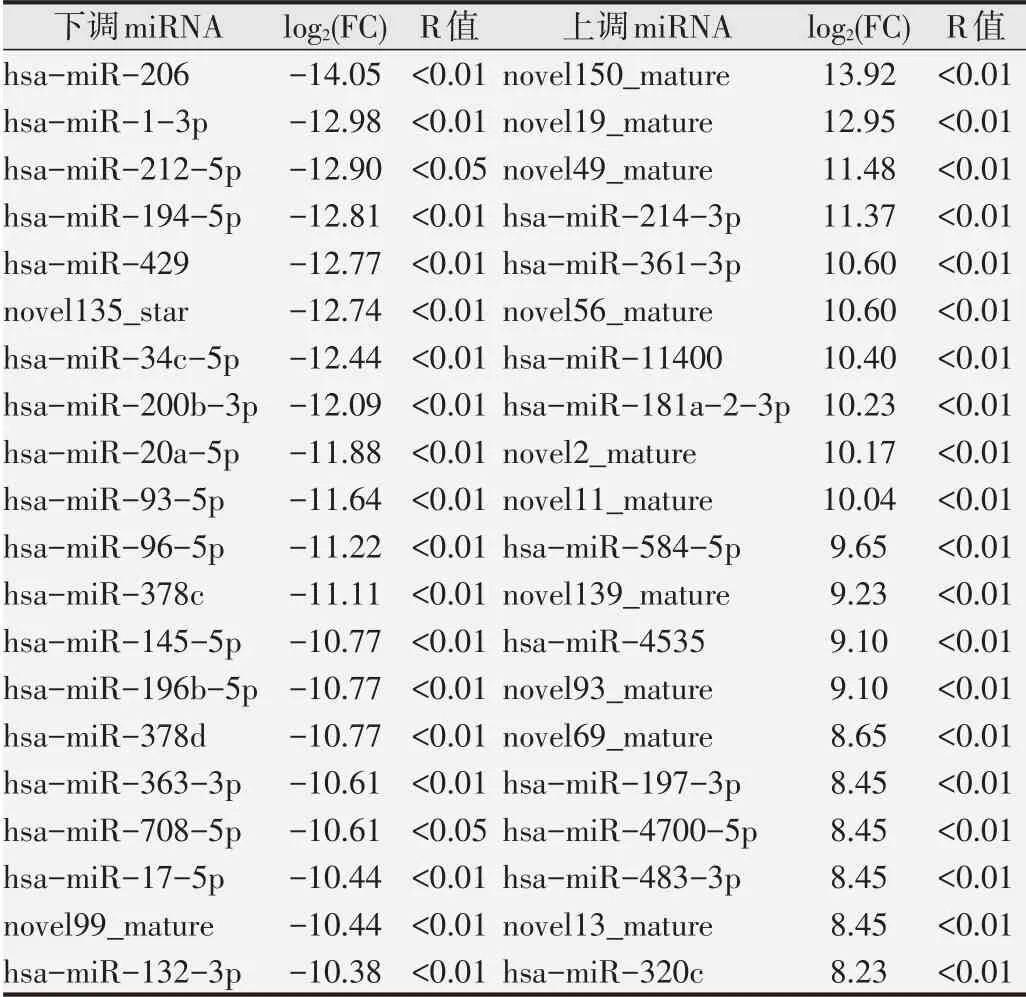
表3 肺癌患者和健康对照者差异表达miRNAs列表(前20)
2.4.2 差异miRNAs靶基因GO及KEGG富集分析GO分析对差异miRNAs靶基因进行功能分类注释,主要包括生物学过程、细胞成分、分子功能3个方面。结果见图7,肺癌患者和健康对照者差异表达的miRNAs靶基因主要参与了以DNA为模板的转录、以DNA为模板的转录调控、信号转导、细胞内信息传递、多细胞生物发育等生物学过程;存在于细胞核、胞浆、细胞质、细胞膜、细胞外外泌体和线粒体等细胞成分中;参与到金属离子结合、ATP结合、核酸结合、蛋白结合、DNA结合转录因子活性、蛋白同源二聚化活性、蛋白丝氨酸/苏氨酸激酶活性等分子功能中。
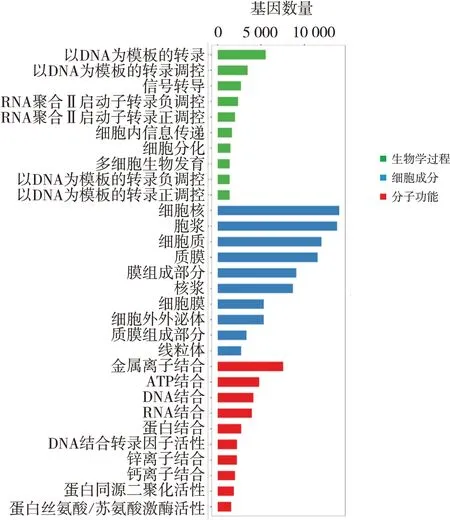
图7 肺癌组与健康对照组差异miRNAs靶基因GO富集分析柱状图
选择KEGG通路分析中富集的前20条绘制气泡图,见图8。差异基因主要富集在肿瘤、内分泌等相关信号通路,包括肌动蛋白细胞骨架调节、钙信号通路、轴突导向信号通路、醛固酮的合成与分泌、胰岛素分泌、黏着斑激酶、人类乳头瘤病毒感染、小细胞肺癌、癌症蛋白聚糖、ErbB信号通路、cAMP信号通路、Rap1信号通路等。
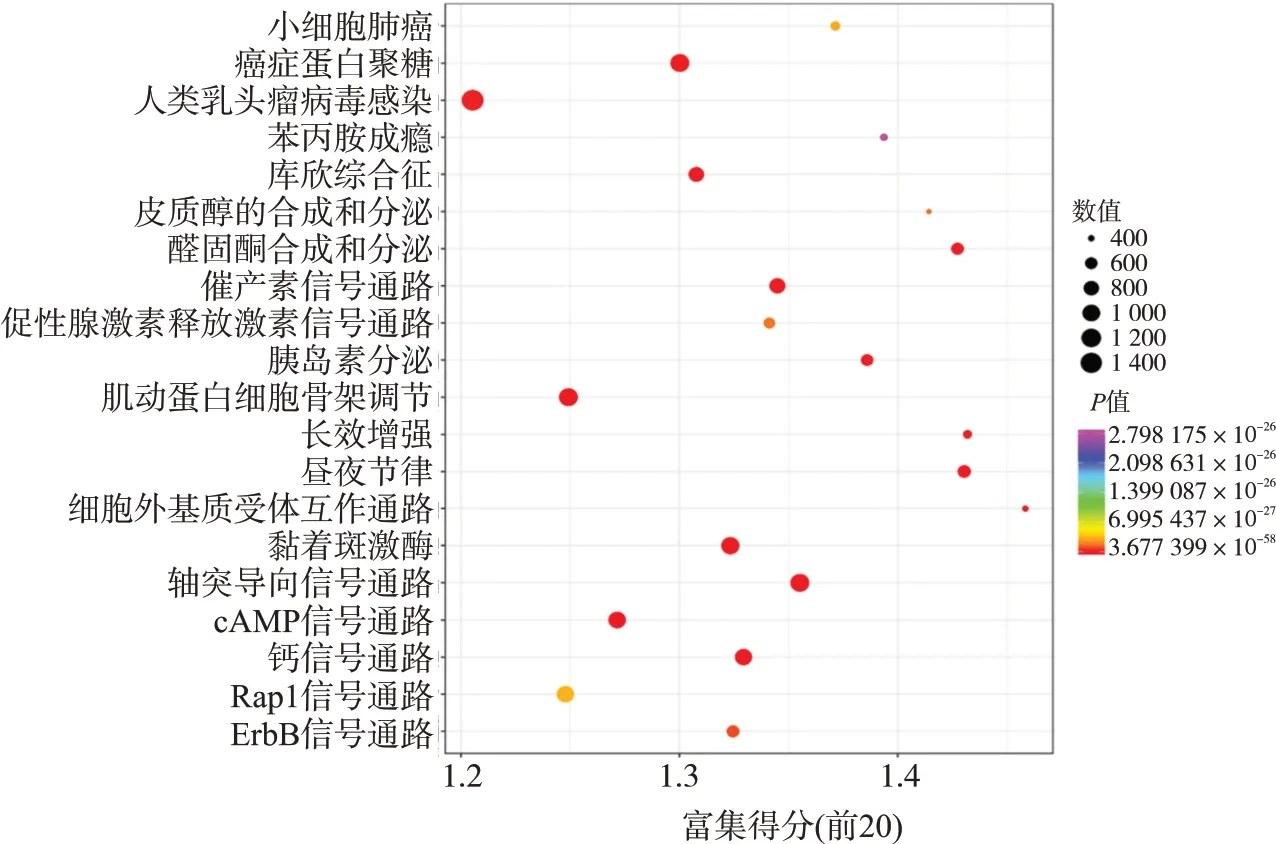
图8 肺癌组与健康对照组差异miRNAs靶基因KEGG富集分析气泡图
3 讨论
最初的研究认为外泌体是细胞的垃圾箱[6],现已证实其在细胞间的交流中发挥了关键作用。在这些过程中,外泌体可以调节靶细胞的特性,以此抑制或促进癌症进展[7]。且已有研究表明,消除外泌体可抑制肿瘤的进展[8]。癌症患者体液中不仅外泌体数量升高,其内容物如miRNAs、蛋白质等,也发生显著改变[9]。因此,本研究通过对肺癌患者和健康对照者的血浆外泌体miRNAs进行高通量测序,筛选差异表达外泌体miRNAs,期望筛选出可用于辅助肺癌筛查的肿瘤标志物,为肺癌患者的筛查与监测提供新靶标与新方向[10]。
本研究选用6例肺癌样本,包括3例腺癌、2例鳞癌和1例小细胞肺癌样本,4例健康对照样本。对外泌体miRNAs进行了筛选,结果显示142个miRNAs的表达差异具有统计学意义,其中肺癌患者中62个miRNAs表达上调,80个miRNAs表达下调。课题组前期对文献中筛出的差异表达miRNA进行验证,提出10个血浆miRNAs(miR-21-5p、miR-20a-5p、miR-210-3p、miR-145-5p、miR-126-5p、miR-223-3p、miR-197-3p、miR-30a-5p、miR-30d-5p、miR-25-3p)可作为肺癌标志物[11],本研究的肺癌患者血浆外泌体中miRNA-126-5p、miRNA-197-3p同样表达上调。所筛选出差异表达的多个外泌体miRNAs,在现有研究中有些被证实具有一定的肺癌筛查与诊断价值。Yang等[12]发现肝内胆管癌组织中miR-206表达下调,并证明miR-206是肝内胆管癌的抑制剂。Zottel等[13]发现在恶性胶质瘤细胞系和星形胶质细胞中miR-1-3p与肾细胞癌和甲状腺癌有关,但在其相应的细胞外囊泡中却无明显差异。Wang等[14]对大鼠血浆外泌体高通量RNA测序筛出的miR-29b-3p、miR-96-5p、novel 99-mature、novel 150-mature与本研究结果一致,但miR-142-3p、novel 39-mature结果却相反,经查阅文献miR-142-3p在结直肠癌[15]、特发性肺纤维化[16]外泌体中高表达,可能与样本不同有关,需进一步验证。miR-486-5p、miR-21-5p[17]也分别被证实在非小细胞肺癌患者、男性前列腺癌患者中表达失调,是潜在的肿瘤标志物。同时,所筛选出的几种差异外泌体miRNA在现有研究中表现出对肺癌转移同样具有的良好预判潜力。Zhang等[18]研究显示miR-214在肺腺癌中高表达,这与本研究结果相一致。Wang等[19]研究中,miRNA-320a与其他两种血浆外泌体miRNAs被成功用于识别转移性非小细胞肺癌。在非小细胞肺癌患者的临床预后判断模型中加入血浆外泌体miR-10b-5p水平的检测,将显著提高模型检测效能[20]。
对筛选出的差异miRNAs进行GO富集分析,发现生物学过程类富集程度最高的前3种miRNAs类型为:以DNA为模板的转录、以DNA为模板的转录调控、信号转导;细胞成分类富集程度最高的前3种miRNAs类型为:细胞核、胞浆、细胞质;分子功能类富集程度最高的前3种miRNAs类型为:金属离子结合、ATP结合、DNA结合。KEGG通路分析结果显示差异基因主要富集在肿瘤和内分泌等相关信号通路,其中,轴突导向信号通路、钙信号通路、肌动蛋白细胞骨架调节、黏着斑激酶、癌症蛋白聚糖、cAMP信号通路、人类乳头瘤病毒感染、Rap1信号通路富集的差异基因数目最多。上述通路主要参与细胞增殖分化与凋亡、肿瘤细胞转移性扩散、细胞迁移与黏附、炎症反应、趋化因子调节、细胞代谢与免疫反应等功能。因此,本研究筛选出的肺癌患者血浆外泌体miRNAs有望成为肺癌筛查标志物。
本研究通过对肺癌患者和健康对照者血浆外泌体miRNAs进行高通量测序,筛选出有望成为肺癌筛查和辅助诊断的差异表达miRNA。但本研究对筛选的差异表达miRNA虽进行生物信息学分析,但并未使用荧光定量PCR对差异miRNA进行验证。此外,所筛选出的多个差异miRNAs,部分已被证实对肺癌筛查与诊断具有一定的临床应用价值,但还有一些miRNA与文献中相反,因此尚需后期扩大临床样本量验证这些差异miRNA,进一步深度挖掘其在临床中的应用价值。

