双氢青蒿素与火把花根配伍对佐剂性关节炎模型大鼠的保护作用
何沛霖, 涂如霞, 梅小利, 张 莉, 黄崇刚, 占敏霞, 陈 慧
(重庆市中药研究院药理毒理研究所,重庆 400065)
青蒿素及其衍生物是目前抗疟药物中作用最快和疗效最高的一线抗疟药物[1-2]。虽然目前对青蒿素药理作用的研究有了重要进展,但其确切的机制仍有待阐明[3-6]。青蒿素除了具有抗寄生虫的作用外,还具有抗炎、抗氧化、抗病毒等药理作用。双氢青蒿素是水溶性好、吸收快、毒性较小及抗疟作用明显的具有良好开发前景的药物[7-9]。火把花根片是由昆明山海棠去皮和根芯后而研制成的中成药,具有抗炎、镇痛及抑制病理性免疫反应作用,已被广泛用于自身免疫性疾病的治疗[10-12]。
类风湿性关节炎是一种病因不明以炎性滑膜炎为主的慢性全身性疾病,以慢性、对称性、多滑膜关节炎和关节外病变为主要临床表现[13],但其具体机制仍不明确。前期研究显示双氢青蒿素与火把花根配伍的免疫抑制作用强于单独用药,且毒性更低,但其作用机制尚不明确[14-15],本文拟研究双氢青蒿素与火把花根配伍对佐剂性关节炎模型大鼠的保护作用及其可能的作用机制,以期为两者联合用药在临床治疗中的应用提供理论和实验依据。
1 材料
1.1 药物 双氢青蒿素(片),昆药集团重庆武陵山制药有限公司,批号C00120181113,含量100.4%,配制时滴加2~3滴吐温-80碾磨后再用0.5% CMC-Na混匀稀释至实验所需质量浓度;火把花根浸膏,重庆市中药研究院中药化学研究所,批号GST190501,每1 g浸膏含生药量15.67 g,使用时加入0.5% CMC-Na碾磨混匀至实验所需质量浓度。
1.2 动物 SPF级雄性SD大鼠,由辽宁长生生物技术股份有限公司提供,实验动物生产许可证号SCXK(辽)2015-0001,动物质量合格证号211002300046310、211002300048140。检疫及适应性饲养合格后用于实验,大鼠饲养环境为温度(22±2)℃,相对湿度50%~70%,自由饮食和饮水,所有实验动物的使用和喂养均严格遵照动物保护协会所规定的有关条款,该动物实验经重庆市中药研究院实验动物福利伦理审查委员会审查通过。
1.3 试剂 弗氏完全佐剂(FCA)、戊巴比妥钠,美国Sigma公司,批号SLBK7817V、P1302716;TNF-α、IFN-γ、IL-1β、IL-6、VEGF试剂盒,深圳欣博盛生物科技有限公司,批号R190929-102a、R190929-101a、R190929-007a、R190929-003a、R190929-103a;MMP-1试剂盒,武汉伊莱瑞特生物科技股份有限公司,批号3W33F4DAXU;VEGFA、MMP-1、MIF抗体,英国Abcam公司,批号GR3200812-2、GR242901-33、GR270048-26;兔SP试剂盒、DAB显色试剂盒,北京中杉金桥生物技术有限公司,批号K216713D、K217721A;RNA提取试剂盒、反转录试剂盒、实时定量PCR试剂盒,日本TaKaRa公司,批号AI12244A、AJ12464A、AHF1910A。
1.4 仪器 R2000-3型电子计重计数天平,奥豪斯仪器(常州)有限公司;BS224S型电子天平,北京赛多利斯仪器系统有限公司;PV-200型足跖容积测量仪,成都泰盟科技有限公司;ST-360型酶标仪,上海科华试验系统有限公司;电泳仪,美国Bio-Rad公司;Tanon-5200型凝胶成像系统,上海天能科技有限公司;图像分析系统,美国Labworks公司;实时荧光定量PCR仪,美国ABI 公司;高级智能脱水机、石蜡包埋机、轮转切片机,德国徕卡公司;光学显微镜,日本奥林巴斯公司;Mias-2000型病理图像处理系统,四川大学图像图形研究所。
2 方法
2.1 模型建立及给药 取10只雄性SD大鼠设为正常组,不作处理;其余大鼠于右后足跖皮内注射FCA 0.1 mL/只[16-17],注射后第14天,将造模成功的大鼠随机分为4组,即模型组、双氢青蒿素+火把花根配伍组(0.05 g/kg+3.75 g/kg)、双氢青蒿素(0.1 g/kg)组、火把花根(7.5 g/kg)组,每组10只。给药组分别灌胃给予相应药物,正常组和模型组灌胃给予等体积0.5% CMC-Na溶液,容量1 mL/100 g,每天1次,连续给药21 d。
2.2 关节肿胀度检测
2.2.1 测量足跖容积 造模前、给药前和给药第7、14、21天分别测量大鼠左后足(继发病变侧)及右后足的容积1 次,测量范围为踝关节及以下,计算关节肿胀率。
2.2.2 关节指数 给药前和给药第7、14、21天根据大鼠前后肢踝关节、趾关节红肿程度及受影响关节指数进行评分。0分,正常,无红肿;1分,1个关节红肿;2分,2个及2个以上关节红肿;3分,踝关节以下足掌严重红肿;4分,包括踝关节在内的全部足爪红肿且不能负重。四肢分别进行评分,累计总和即为关节指数。
2.3 ELISA法检测炎症细胞因子水平 末次给药后1 h,大鼠麻醉后腹主动脉采血,离心得血清,用酶联免疫吸附法检测TNF-α、IFN-γ、IL-1β、IL-6、VEGF、MMP-1水平。
2.4 HE染色观察关节滑膜组织病理学改变 将大鼠的右足跖关节固定在10%甲醛中16 h以上,10% EDTA脱钙,脱水,浸蜡,包埋,切片,HE染色。镜下观察关节滑膜增生及炎症程度,并进行半定量评分,评分标准见表1。

表1 组织半定量评分标准
2.5 Western blot检测足跖关节滑膜组织VEGF、MMP-1及MIF蛋白表达 收集各组大鼠右足跖关节滑膜组织,提取蛋白,BCA检测总蛋白浓度,SDS-PAGE电泳,转膜,封闭,一抗(VEGF及MMP-1,1∶1 000)4 ℃孵育过夜,二抗(1∶1 000)室温孵育2 h,TBST清洗,曝光显影,采用Tanon-5200成像系统检测条带灰度值,计算目的蛋白与内参蛋白的灰度比值。
2.6 RT-qPCR检测VEGF、MMP-1、MIFmRNA表达 提取各组大鼠右足跖关节滑膜组织RNA,并逆转录为cDNA。按照SYBR Green荧光染料法进行定量PCR检测,引物由苏州金唯智生物科技有限公司合成,引物序列见表2。PCR反应条件为95 ℃ 30 s;95 ℃ 5 s,60 ℃ 31 s,40个循环。采用2-△△CT法进行半定量分析。


表2 引物序列
3 结果
3.1 双氢青蒿素-火把花根配伍对佐剂性关节炎模型大鼠足跖容积的影响 与正常组比较,模型组大鼠左后足、右后足关节肿胀率均升高(P<0.01),说明造模成功;与模型组比较,给药第14、21天,配伍组大鼠左后足、右后足关节肿胀率降低(P<0.05),提示双氢青蒿素与火把花根配伍对弗氏完全佐剂所致的关节炎模型有明显抑制作用,见表3~4。
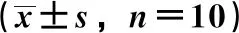
表3 双氢青蒿素-火把花根配伍对佐剂性关节炎模型大鼠左后足关节肿胀率的影响
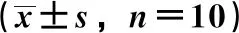
表4 双氢青蒿素-火把花根配伍对佐剂性关节炎模型大鼠右后足关节肿胀率的影响
3.2 双氢青蒿素-火把花根配伍对佐剂性关节炎模型大鼠关节指数的影响 与正常组比较,模型组大鼠关节指数升高(P<0.01);与模型组比较,给药第21天,配伍组大鼠关节指数降低(P<0.05),见表5。
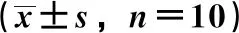
表5 双氢青蒿素-火把花根配伍对佐剂性关节炎模型大鼠关节指数的影响
3.3 双氢青蒿素-火把花根配伍对佐剂性关节炎模型大鼠血清中炎症细胞因子水平的影响 与正常组比较,模型组大鼠血清中炎症细胞因子水平升高(P<0.01);与模型组比较,配伍组大鼠血清IFN-γ、VEGF及MMP-1水平降低(P<0.05,P<0.01),双氢青蒿素组和火把花根组VEGF及MMP-1水平降低(P<0.05,P<0.01),见表6。
3.4 双氢青蒿素-火把花根配伍对佐剂性关节炎模型大鼠关节滑膜组织病理改变的影响 如图1所示,模型组大鼠关节囊结缔组织坏死、水肿伴炎细胞浸润和纤维组织增生;与模型组比较,配伍组大鼠踝关节囊结缔组织坏死、炎细胞浸润程度明显减轻,纤维组织增生降低。组织半定量评分结果如表7所示,与模型组比较,配伍组大鼠组织评分结果降低(P<0.05)。提示,双氢青蒿素-火把花根配伍对模型大鼠造模处软组织损伤有明显改善和修复作用。
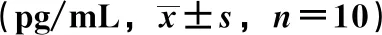
表6 双氢青蒿素-火把花根配伍对佐剂性关节炎模型大鼠炎症细胞因子的影响
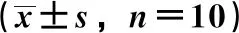
表7 双氢青蒿素-火把花根配伍对佐剂性关节炎模型大鼠组织半定量评分的影响
3.5 双氢青蒿素-火把花根配伍对佐剂性关节炎模型大鼠关节滑膜组织VEGFA、MMP-1及MIF蛋白表达的影响 如图2所示,与正常组比较,模型组大鼠关节滑膜组织VEGFA、MMP-1及MIF蛋白表达升高(P<0.01);与模型组比较,各给药组VEGFA、MMP-1及MIF蛋白表达降低(P<0.01)。
3.6 双氢青蒿素-火把花根配伍对佐剂性关节炎模型大鼠关节滑膜组织VEGF、MMP-1及MIFmRNA表达的影响 如图3所示,与正常组比较,模型组大鼠关节滑膜组织VEGF、MMP-1及MIFmRNA表达升高(P<0.01);与模型组比较,各给药组大鼠关节滑膜组织VEGF、MMP-1及MIFmRNA表达降低(P<0.01),见图3。
4 讨论
类风湿性关节炎是一种以炎症细胞浸润和滑膜组织增生、肥厚以及骨损伤为特征的慢性全身性自身免疫疾病。佐剂性关节炎模型是一种与人类风湿性关节炎病理极为相似的一种免疫炎症模型,作为研究人类风湿关节炎常用的实验模型。本研究显示,模型组大鼠足关节肿胀率、关节指数升高,造模处踝关节有明显的病理变化,且血清中炎症因子水平升高,表明佐剂性关节炎模型制备成功;双氢青蒿素-火把花根配伍降低佐剂性关节炎模型大鼠关节肿胀率、关节指数,明显改善和修复造模处软组织损伤,且配伍组修复效应强于单独用药组,提示配伍用药具有增效的作用。
在类风湿性关节炎的发病过程中,促炎性与抑炎性细胞因子失去平衡会导致滑膜炎症。IFN-γ通过活化巨噬细胞从而介导局部炎症的免疫应答,在炎症反应中起到重要调节作用[18]。TNF-α通过诱导内皮细胞表达黏附分子,以促进血管内皮和白细胞黏附渗透,导致局部炎症引起组织损伤,并同时促进成纤维细胞和滑膜巨噬细胞增殖,从而直接导致软骨和骨损伤[19]。IL-1β与机体炎症程度呈正相关,能诱导IL-6的产生,IL-6参与机体的免疫反应,诱导抗体的合成,从而引起免疫功能紊乱[20-21]。本研究结果显示,佐剂性关节炎模型大鼠炎症因子水平升高,经配伍组治疗,大鼠血清炎症因子水平降低,表明双氢青蒿素-火把花根配伍能抑制佐剂性关节炎模型的炎症反应。
血管生成在类风湿性关节炎的发病过程中会加剧软骨和骨的破坏,VEGF是促进类风湿性关节炎新血管生成和分化的主要因子[22]。MMPs是细胞外基质(ECM)成分降解过程中必不可少的酶,可促进血管新生[23]。MIF通过活化巨噬细胞并抑制其移动,增强巨噬细胞在炎症局部的聚集和浸润,从而极大地促进炎症和免疫反应[24]。本研究结果显示,双氢青蒿素-火把花根配伍抑制大鼠关节滑膜组织VEGF、MMP-1及MIF表达,降低血清中炎症因子水平,提示双氢青蒿素-火把花根配伍改善大鼠类风湿性关节炎炎症反应与抑制VEGF、MMP-1及MIF表达有关。
综上所述,双氢青蒿素-火把花根配伍对大鼠佐剂性关节炎具有治疗作用,其机制可能是通过抑制VEGF、MMP-1及MIF的表达,调节相关炎症因子产生和分泌,进而抑制炎症细胞的浸润、滑膜组织的增生及新血管的生成,减轻软骨和骨破坏,从而发挥治疗类风湿性关节炎的作用,本研究将为双氢青蒿素-火把花根治疗类风湿性关节炎提供实验基础,为临床应用中两者联合用药提供理论依据,具有潜在的应用前景。

