秋、冬季长江口及邻近海域生源二甲基硫化物的时空分布及其对海水酸化和营养盐添加的响应❋
李聪颖, 高旭旭, 马乾耀, 杨桂朋,2❋❋
(1. 中国海洋大学 化学化工学院, 海洋化学理论与工程技术教育部重点实验室, 山东 青岛 266100;2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室, 山东 青岛 266237)
二甲基硫(DMS)是海洋中最重要、含量最丰富的挥发性生源硫化物,在全球硫循环中起着重要作用[1]。大气DMS的化学过程可能会对全球气候产生负反馈调节——DMS在大气中的氧化产物可以促进新粒子的生成或改变云的物理性质,促进云的形成并增加云的辐射反射率,进而减少全球辐射吸收,减缓全球变暖过程[2]。二甲基巯基丙酸内盐(DMSP)是海洋中DMS的主要前体物质,可通过藻类和细菌的生物作用裂解为DMS,并释放到海水中[3]。研究发现,DMSP在生物细胞中发挥防冻剂、抗氧化剂和细胞渗透压调节剂的作用[4-5]。基于DMSP在细胞中一系列的生理功能,许多学者认为细胞裂解DMSP产生DMS的驱动力是盐度、温度、海水酸度及营养盐限制等环境压力[6-9]。微生物消耗、光化学氧化和海-气扩散是表层海水中DMS主要的去除途径:海洋中的DMS主要通过微生物消费和光化学氧化过程在海洋内部循环,只有约10%的DMS被释放到大气中[10-13]。
自工业革命以来,人为排放使大气中二氧化碳(CO2)的浓度持续增加,而海洋作为重要的碳汇[14],吸收了约1/3人为排放的CO2[15-17],由此引发了海水中H+浓度的升高,导致了海洋酸化。Caldeira和Wickett的研究表明,与工业革命前的观测数据相比,本世纪初期海水的pH值下降了0.1,以现在的碳排放水平推测,预计到2100年海洋表面pH值会降低0.3~0.5[18]。海水pH的变化会对多种浮游生物尤其是钙化生物的生理过程产生影响,进而影响海水中生源活性气体的释放及全球气候变化过程。近年来国际上对海洋酸化的关注逐渐提升,但不同学者在探究海洋酸化对二甲基硫化物的影响时得到的结论并不一致[19-20],其反馈机制尚不明确。
长江口海域面积达180万km2,水文条件相对复杂,同时受冲淡水、陆地污染物排放和多种海水水团的影响,往往伴随着高频率的物质交换和复杂的生物活动。长江口海域受长江冲淡水、台湾暖流、东海沿岸流和黄海沿岸流的共同影响[21]。同时,长三角地区经济发达,人口稠密,伴有频繁的工、农业生产活动,该地区水文环境和浮游生物生理过程受到显著影响[22]。研究表明,长江口及其邻近海域长期受到氮、磷等营养盐输入的影响,海水富营养化水平严重[23],有数据表明,长江口口门附近可溶性无机氮在近五十年来浓度增加了四倍以上,可溶性活性磷酸盐浓度增加了两倍左右[24]。同时,大量工业活动释放的过量CO2也可能导致该海区海洋酸化的加重。研究表明,由于近海的富营养化现象,沿岸地区的海洋酸化过程相较于开阔大洋加速了约12%[25]。富营养化和海水酸化可能是该海区未来面临的主要环境问题,而生源二甲基硫化物对富营养化和海水酸化耦合条件下的响应尚无定论,亟需探究。
目前国内学者对中国近海海域DMS和DMSP的空间分布格局和季节变化特征已经有了一定程度的研究,但是对于DMS和DMSP对海洋酸化和不同比值营养盐输入响应的探究大多停留在实验室模拟阶段,缺乏现场环境下的模拟培养数据。本研究主要通过两个航次的现场调查,研究了DMS和DMSP的空间分布及季节变化,丰富了二甲基硫化物的观测数据,并通过船基培养实验,探究了不同pH和营养盐输入耦合条件对DMS和DMSP释放量的影响,有助于更好地理解未来环境条件下长江口及其邻近海域生源二甲基硫化物的变化趋势及其对气候的影响,服务国家应对气候变化这一重大战略需求。
1 材料与方法
1.1 航次简介
分别于2020年10月(秋季)和2021年3月(冬季)搭乘“润江号”和“浙渔科”科考船前往长江口及其邻近海域进行调查取样。其中秋季航次包括15个断面(分别为A1~A13,B和C断面),共59个站位,冬季航次包括9个断面(分别为A1~A7,B和C断面),共43个站位。每个站位均采集表层海水测定DMS和DMSP的浓度,探究其水平分布特征。秋季航次采集C断面和A6断面、冬季航次采集C断面和A5断面不同深度的海水样品,对DMS和DMSP的垂直分布特征进行探究。此外,在冬季航次A1-7站位进行了海水酸化和营养盐添加的船基培养实验。
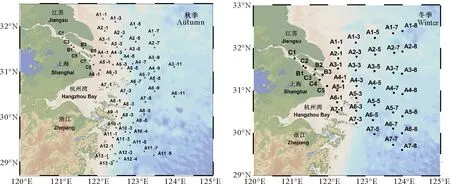
图1 2020年10月(秋季)和2021年3月(冬季)长江口及其邻近海域调查站位
1.2 样品采集与保存
通过12 L Niskin采水器采集所有观测站位海水样品。DMS属于易挥发痕量气体,因此使用与溶解氧相同的采样方法[26],并在样品采集半小时内进行测定。移取4 mL海水样品至5 mL聚丙烯连盖离心管中,后添加40 μL 1∶1 H2SO4溶液完全抑制生物活动并氧化海水中原有的DMS,作为测定海水中总DMSP(DMSPt)含量的样品。对于溶解态DMSP(DMSPd)样品,使用内置有0.7 mm×47 mm的Whatman GF/F玻璃纤维滤膜的Gelman囊式过滤器对少于10 mL的海水样品进行重力过滤,舍弃最初几滴滤液,后收集4 mL滤液至5 mL聚丙烯连盖离心管中,同样添加40 μL 1∶1 H2SO4溶液。DMSP样品在4 ℃环境下密封避光冷藏,回实验室后测定。
1.3 样品分析
1.3.1 DMS的测定 DMS样品采用冷阱吹扫捕集-气相色谱法进行现场测定[27-28],使用5 mL移液枪移取2 mL海水样品注入西林瓶,并以聚四氟乙烯内衬的铝盖密封。六通阀调整为进样状态时,样品瓶中通入流速为50 mL·min-1的高纯氮气作为载气进行吹扫,载气携带着样品经Nafion干燥器去除水分,后经过六通阀富集于浸于液氮中的1/16 Teflon捕集管中;3 min吹扫结束后将捕集管从液氮中取出,迅速放入沸水中并调整六通阀为进样状态,此时捕集管中的气体被载气携带进入配置火焰光度检测器(FPD)的气相色谱仪(GC-201,岛津,日本)进行检测。该方法精密度为3.3%~5.0%,对海水的最低检出限为0.15 ng S[29]。
1.3.2 DMSP的测定 DMSP可在pH≥13的碱性条件下以1∶1的比例转化为DMS,因此通过测定碱解后样品中DMS的含量,间接得到DMSP的含量。用移液枪移取2 mL DMSPt和DMSPd样品,各加入200 μL 10 mol·L-1的KOH溶液,为确保样品中DMSP完全转化为DMS,将处理后的样品在4 ℃黑暗条件下保存24 h确保DMSP完全碱解,随后使用DMS的测定方法测定样品中DMS的含量。颗粒态DMSP(DMSPp)的含量为DMSPt和DMSPd含量的差值。
1.3.3 叶绿素a(Chla)的测定 现场采集300 mL海水,经0.7 μm玻璃纤维滤膜(Whatman GF/F,直径47 mm)过滤,后将滤膜装入由锡纸包裹的15 mL离心管中,置于-20 ℃冷冻保存。测定时,首先在低温避光条件下向离心管中加入10 mL体积分数为90%的丙酮萃取24 h;萃取结束后,将离心管置于高速离心机离心(4 000 r·min-1)10 min;最后取上清液4 mL置于石英比色皿中,使用F-4500分子荧光仪(日本日立)对样品进行测定[30]。该方法最低检出限为0.01 μg·L-1,标准测定采用外标法。
1.4 船基培养实验
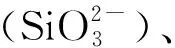
表1 船基培养实验初始pH和营养盐浓度Table 1 Initial pH and nutrient concentrations of the ship-based incubation experiments
2 结果与讨论
2.1 长江口及其邻近海域表层海水中DMS和DMSP的水平分布
长江口及其邻近海域秋季和冬季表层海水中DMS、DMSP及环境参数的水平分布分别如图2、3所示。长江口及其邻近海域秋季和冬季海表面温度差异较大,其平均值分别为21.76(19.79~23.48) ℃和11.78(8.40~16.95) ℃。秋季海表面温度自西向东逐渐升高,等温线大致与海岸线平行,而冬季海表面温度分布总体呈现自北向南逐渐升高、近岸低外海高的趋势。结合盐度水平分布图可以看出,长江冲淡水在秋季呈现向东北方和东南方向双向延伸的特征;而冬季长江冲淡水扩展范围较小,对东海的入侵程度较小,此时调查海域东南部主要受到寡营养盐、高温的台湾暖流影响,总体呈现出高温高盐的水文特征[31]。
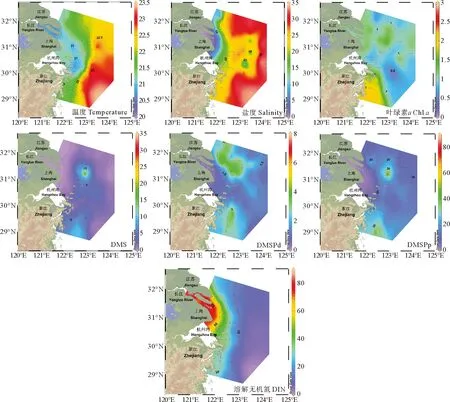
图2 秋季长江口表层海水温度(℃)、盐度、Chl a(μg·L-1)、DMS、DMSPd、DMSPp(nmol·L-1)和DIN(μmol·L-1)水平分布图
调查海域秋季和冬季Chla的平均浓度分别为1.16(0.23~2.77)μg·L-1和0.77(0.29~1.67)μg·L-1。秋季Chla的高值出现在调查海域南部的舟山群岛以东区域(A13-3站位),而冬季主要出现在长江口内海域,呈现出由近岸向外海逐渐降低的分布趋势。秋季和冬季DIN的分布都呈现近岸高远海低的分布特征,平均浓度分别为28.56(0.77~88.00)μmol·L-1和6.08(0.26~24.65)nmol·L-1。秋季DIN浓度水平明显高于冬季,且DIN随长江冲淡水向南扩展,为该区域浮游植物的生长提供了充足的营养物质。
秋季表层海水DMS、DMSPd和DMSPp的平均浓度分别为2.91(0.06~16.10)、1.95(0.04~7.59)和15.44(0.39~80.02) nmol·L-1;冬季表层海水DMS、DMSPd和DMSPp的平均浓度分别为0.70(0.04~7.29)、1.80(0.15~4.24)和13.21(0.72~42.40) nmol·L-1。秋季DMS、DMSP浓度水平明显高于冬季,该结果与前人的观测研究基本一致[32-33]。秋季DMS和DMSPp的浓度变化范围较大,二者浓度最高值均出现在A4-7站位。A4-7站位处于长江冲淡水锋面区,该区域适宜的温盐条件和长江冲淡水带来的丰富的营养物质为浮游植物提供了适宜的生长环境,因此该区域呈现出较高的Chla浓度水平,浮游植物生物量和生物活动的增强进一步促进了生源二甲基硫化物的释放。DMS和DMSP浓度的次高值出现在舟山群岛东部附近的A12-4站位,陆源输入和闽浙沿岸流[34]为该区域带来了充足的营养盐补充,为浮游植物和细菌提供了适宜的生长环境。冬季调查海域较低的海表面温度使得浮游植物和细菌的生物活动减弱,不利于生源二甲基硫化物的生产,因此冬季长江口及其邻近海域生源二甲基硫化物的浓度水平总体上低于秋季。冬季DMS和DMSPp浓度的最高值出现在调查海域东南部的A7-7和A7-8站位,该站位处于台湾暖流影响范围,呈现出高温、高盐、低营养盐的水文特征。
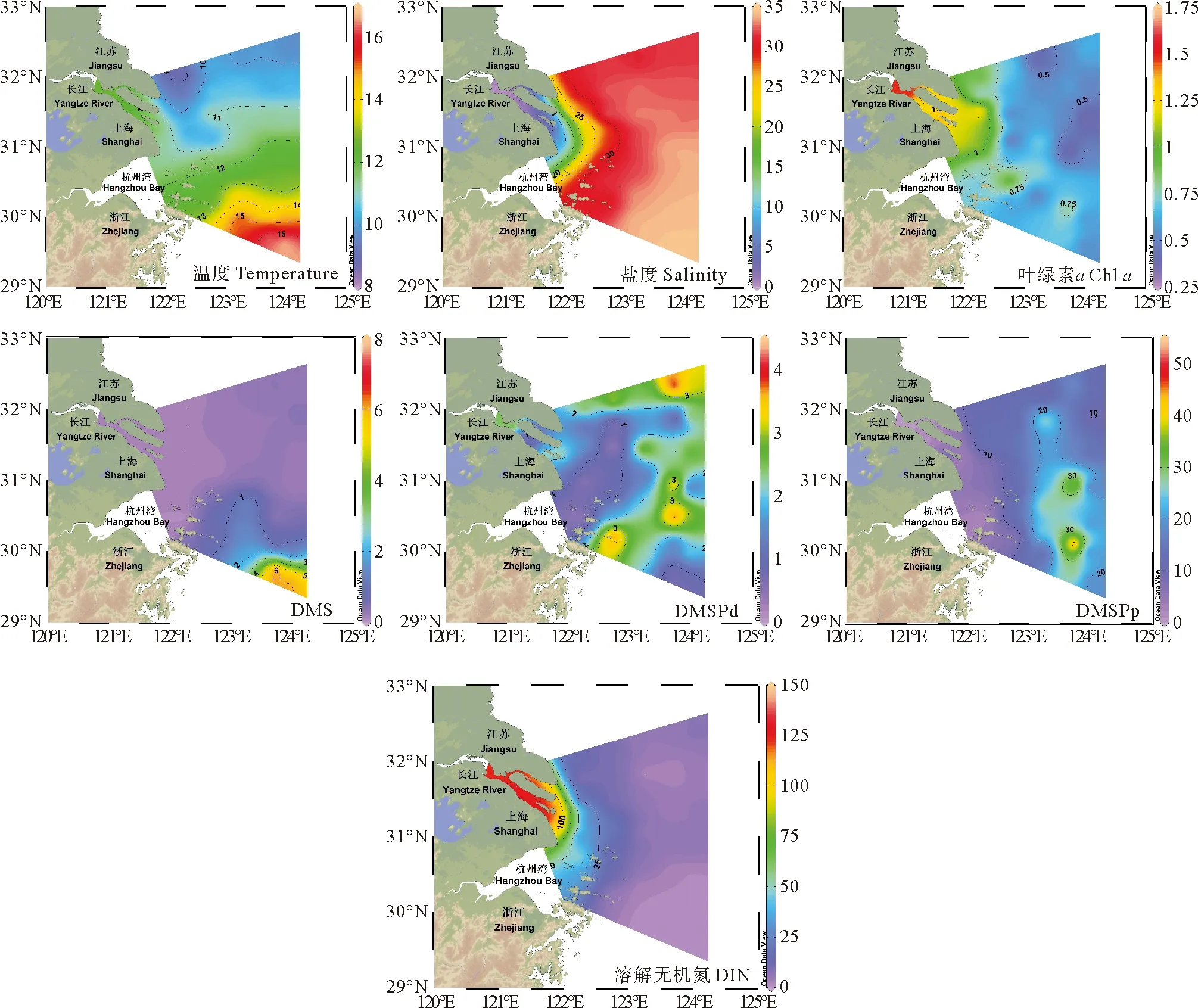
图3 2021年冬季长江口表层温度(℃)、盐度、Chl a(μg·L-1)、DMS、DMSPd、DMSPp(nmol·L-1)和DIN(μmol·L-1)水平分布图
通常使用DMS/Chla和DMSP/Chla的值来表征DMS和DMSP的单位浮游植物生产量,以衡量浮游植物对DMS和DMSP的生产能力。秋季表层海水DMS/Chla和DMSPp/Chla的平均值分别为2.65(0.03~11.30)和13.05(0.40~37.39)mmol·g-1,冬季表层海水中DMS/Chla和DMSPp/Chla的平均值分别为1.08(0.07~12.05)和23.30(0.54~144.89)mmol·g-1,具体分布如图4所示。DMS/Chla和DMSPp/Chla的值在不同季节差异较大,冬季DMSPp/Chla的值明显高于秋季,这可能是由于DMSP在细胞中起到冷冻保护剂的作用。冬季海水温度降低时,DMSPp/Chla比值较秋季显著升高,这表明浮游植物细胞增强了对DMSP的合成作用以抵御低温环境。秋季DMS/Chla和DMSPp/Chla的水平分布特征相似,二者的高值均出现在调查海域中部及南部区域,该区域受到苏中沿岸流和台湾暖流的影响[35],该范围内DMS高产藻的生物活动强烈。冬季表层海水中DMS/Chla的分布特征与DMS相似,高值出现在调查海域南部。DMSPp/Chla的高值仅出现在调查海域中部地区,舟山群岛以东及其南部海域甲藻的细胞丰度在冬季偏低,硅藻比例提升[36],因此单位藻密度的DMSP合成能力降低。
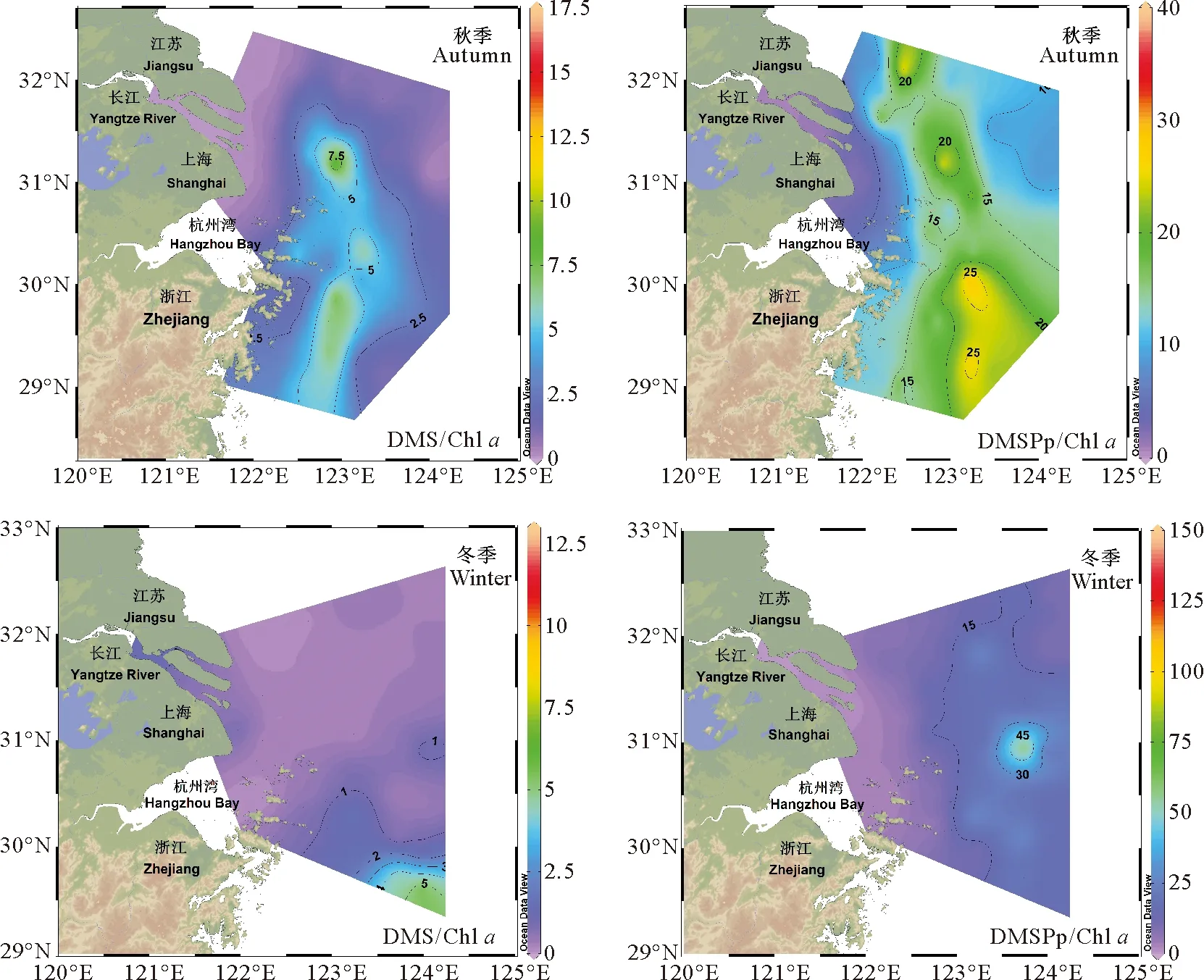
图4 秋季和冬季长江口及其邻近海域表层海水DMS/Chl a和DMSPp/Chl a的分布
2.2 长江口内至外海断面DMS、DMSP浓度的垂直分布
秋季长江口口内至外海断面(C-A6断面)温度、盐度、Chla、DMS、DMSP、DMSPp和DMSPd的垂直分布如图5所示。该断面自长江口内沿狭长的区域延伸到崇明岛西南的长兴岛和横沙岛,并继续向东南方向延伸至外海。该断面涵盖了长江淡水、东海海水以及淡水和海水的混合区域,物质交换频繁,浮游植物生物活动强烈,是研究长江冲淡水对生源二甲基硫化物迁移转化影响过程的代表性断面。冬季航次选取C-A5断面进行垂直分析,以便更好地与秋季航次进行季节变化对比研究(见图6)。
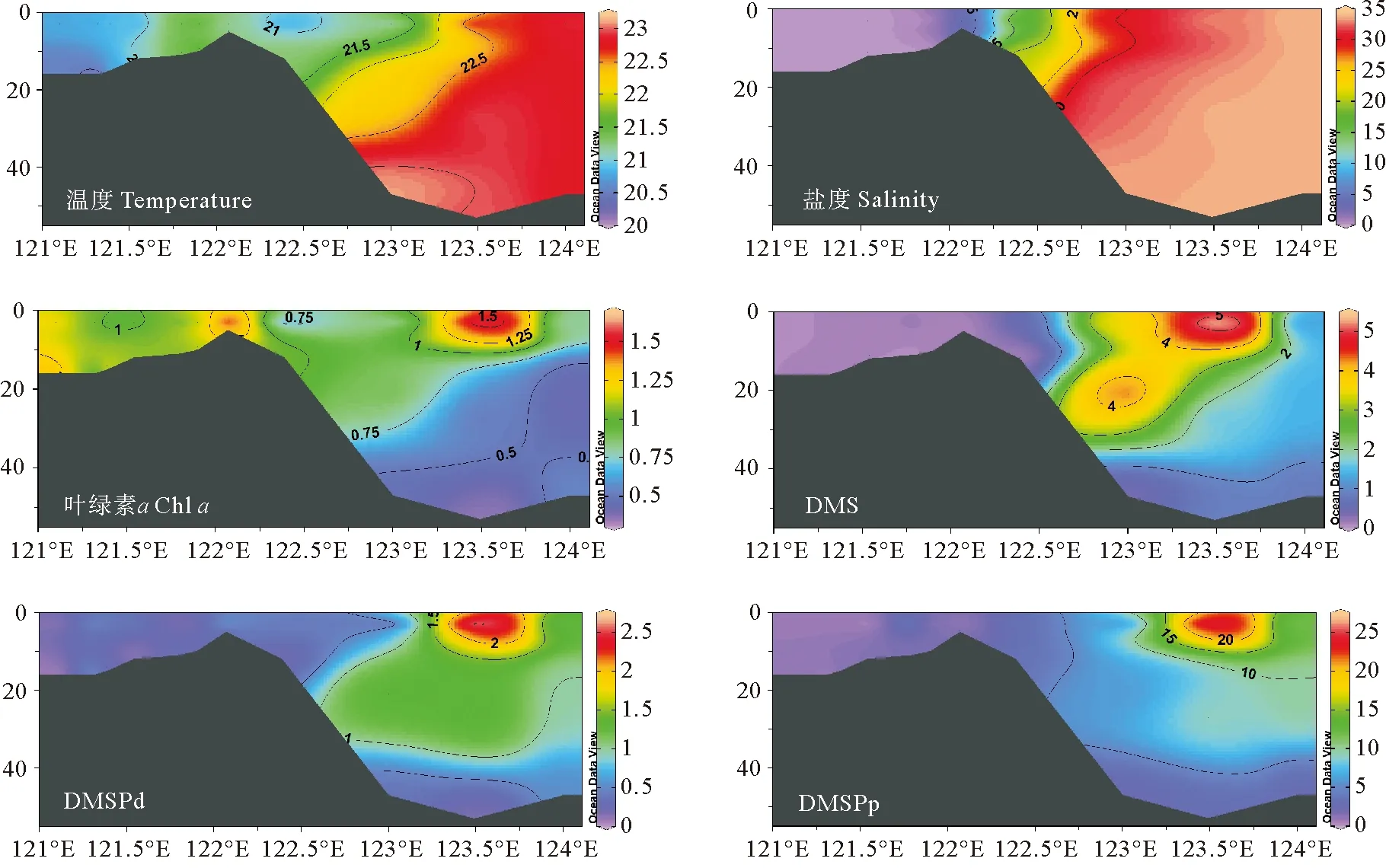
图5 2020年10月秋季长江口C-A6断面温度(℃)、盐度、Chl a(μg·L-1)、DMS、DMSPd和DMSPp(nmol·L-1)的垂直分布图
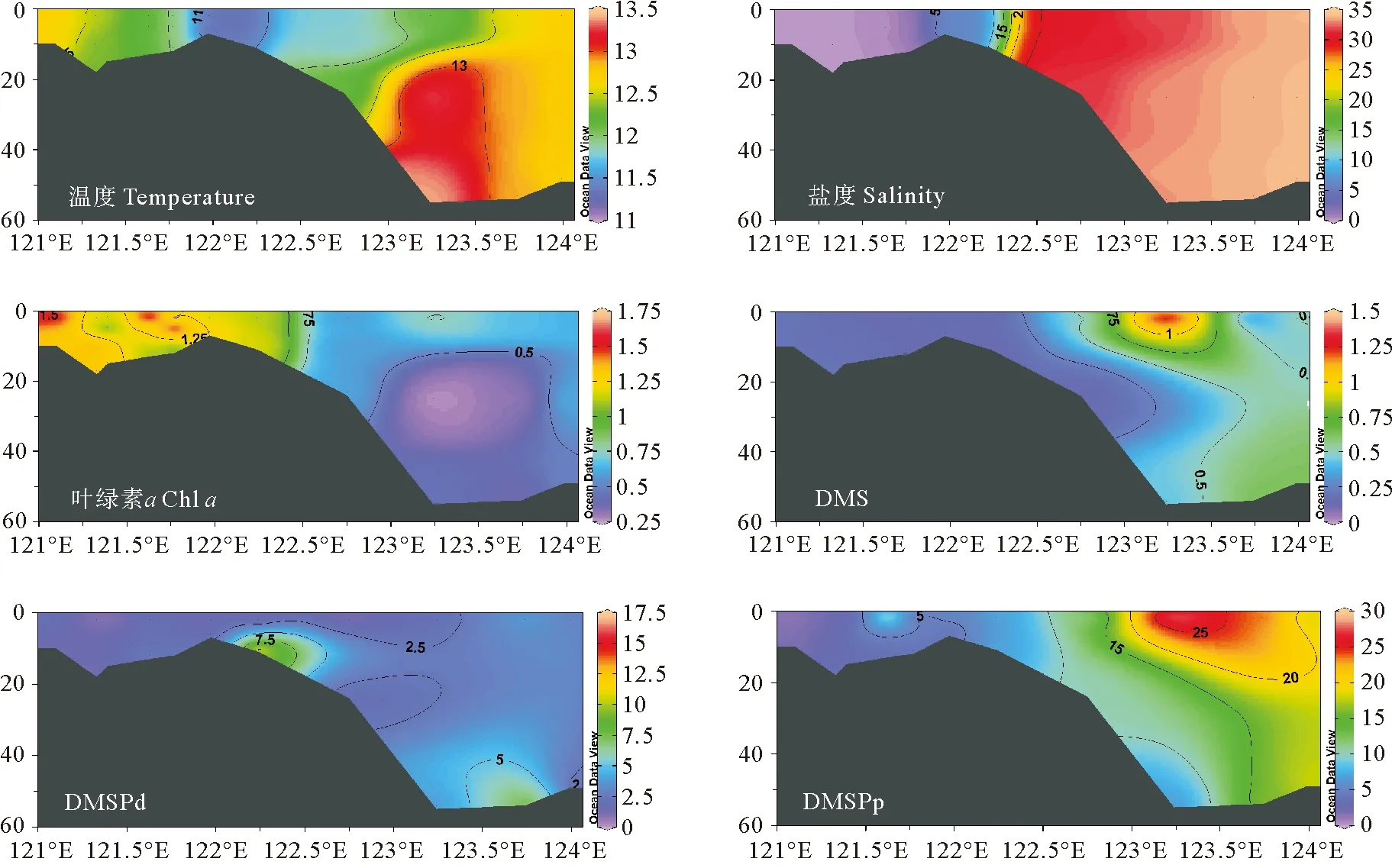
图6 2021年3月冬季长江口C-A5断面温度(℃)、盐度、Chl a(μg·L-1)、DMS、DMSPd和DMSPp(nmol·L-1)的垂直分布图
秋季长江口C-A6断面的温度、盐度呈现明显的由近岸向远海递增的分布趋势。长江口内水位较浅,上下水体交换充分,无层化现象,因此温度、盐度垂直分布较为均匀。但是长江口内过高浊度限制了浮游植物的光合作用,进而影响二甲基硫化物的生产过程。冬季调查断面盐度分布趋势与秋季大致相同,但温度明显低于秋季,高温水域出现在受到台湾暖流爬升影响的123.3°E底层海水附近[37]。长江冲淡水携带大量悬浮颗粒物沿C断面向外海输送,在长江口附近海域形成了一片高浊度、低透明度的区域,较低的光照水平不利于浮游植物的生长[38]。秋季Chla浓度呈斑块状分布,冬季Chla浓度呈现近岸高,远海低的分布特征。长江口内受到沿岸地区人类活动的影响,水体中存在大量营养盐物质,展现出较高的Chla浓度水平。调查研究表明冬季长江冲淡水的扩散不会超过123°E[39],因此这些营养物质随着长江冲淡水在冬季沿岸南下,其扩散区域被限定在一个相对狭长的范围内[40],因此外海地区受到营养盐限制,整体呈现出较低的Chla水平。
DMS、DMSPd和DMSPp秋季和冬季的垂直分布特征整体上较为接近,表现为长江口内浓度较低,外海区域浓度高。二甲基硫化物的浓度在秋季呈现由表层向深层逐渐降低的趋势,整体分布特征与Chla相似。DMS最大值分别出现在秋季的A6-9站位和冬季的A5-5站位的表层,均位于123.3°E附近。长江冲淡水与外海海水在123.3°E附近发生混合,该区域适宜的温盐条件、较好的透光性以及长江冲淡水携带的营养盐有利于浮游植物的生长,因此此处出现Chla、DMS和DMSP的最高值。在冬季,DMS、DMSPd和DMSPp的分布主要受到温度影响,外海海域适宜的温度促进了二甲基硫化物的生成,其浓度最高值出现在123.5°E附近表层水域,次高值出现在水深40 m左右的底层。
2.3 生源硫化物与环境参数的相关性分析
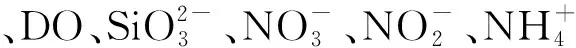
表2 秋季和冬季长江口表层海水中二甲基硫化物及环境参数间的相关关系
分析结果表明,秋季和冬季长江口及其邻近海域生源二甲基硫化物的主控因素存在着较大差异。总体上,生源二甲基硫化物在秋季与Chla表现出相关性,而在冬季并未展现这种相关关系;盐度在两个季节均与DMSP展现出正相关关系;营养盐与DMS和DMSP呈现出负相关关系。
秋、冬两季DMS和DMSP均与海水盐度呈现出正相关关系。考虑到DMSP在细胞中起到渗透压保护剂的作用[41],可能是由于海水盐度的变化影响到浮游植物优势藻种的变化,进而影响浮游植物生产二甲基硫化物能力的变化,从而表现出正相关。结合秋、冬两季的DMSP和盐度水平分布图可以清晰地看出,DMSP在低盐度的长江淡水区域呈现出较低浓度水平,而在盐度较高的外海呈现出较高浓度水平。这可能是因为在低盐度环境中细胞不需要额外的渗透压维持过程;而细胞处在高盐度的外海海域时需要合成或累积大量的渗透压保护剂以保持正常的细胞体积,这些渗透压保护剂包括硫基的DMSP、氮基的甜菜碱(GBT),因此高盐度环境通常会促进浮游植物对DMSP的生产过程。另外,DMS和DMSP与硝酸盐也展现出显著负相关关系。一方面,当细胞处于氮限制环境中时,细胞会更倾向于合成硫基的DMSP,而不是氮基的GBT作为渗透压保护剂,因此氮限制条件下会促进DMSP的合成过程;另一方面,当细胞处于氮限制环境中时可能会触发潜在的“Overflow”机制[42],即当外界氮源不能满足细胞需求时,细胞会通过降解体内过量的甲硫氨酸作为细胞内过量碳的汇并实现氮元素的再利用,而甲硫氨酸是DMSP的前体物质,因此其降解过程会增强细胞内DMSP的生产。
秋季长江口及其邻近海域DMS和DMSP与Chla均呈现正相关,这表明该季节海区内浮游植物的生理代谢过程与生源二甲基硫化物的生产存在着密切联系。而Chla与其它环境参数——特别是营养盐均无相关性,表明在该季节海域内浮游植物的生长并未受营养盐水平限制。一方面,尽管长江口冲淡水携带大量的营养盐,但是其较高的浊度并不利于浮游植物的生长过程,因此Chla并未在长江口区表现出高浓度水平;另一方面,该季节东海海区仍保持着适宜浮游植物生长的营养盐浓度水平,因此浮游植物生长过程被非营养盐的未知条件限制。冬季长江口及其邻近海域Chla展现出强烈的营养盐依赖性。Chla高值主要分布在高营养盐的长江口内,低值主要分布在远海海域。而正如上文讨论,生长于长江口内的浮游植物体内不需要大量合成DMSP以维持渗透压。因此浮游生物大量聚集的低盐度长江口区域仅呈现出较低的DMSPp浓度水平,而较高浓度水平的DMS和DMSP则出现在远海海域,这导致了冬季长江口及其邻近海域Chla与DMS和DMSP无显著相关性。
2.4 酸化和营养盐对DMS生产的影响
为进一步探究海水酸化和营养盐结构变化对DMS、DMSP产生的影响,于冬季航次A1-7站位采集表层海水,进行了为期10天的船基培养实验。向各培养组内添加了不同浓度水平的硝酸盐和磷酸盐,并且控制各培养组的pH(见表1),以探究不同营养盐结构对生源二甲基硫化物释放的影响以及营养盐与海水酸化的耦合效应。
实验中OA组DMS的平均浓度(3.64 nmol·L-1)相较于对照组(4.02 nmol·L-1)降低了9%,与Jian[42]和Avgoustudi等[44]的研究结果一致,即海水中高CO2会导致DMS浓度降低,Six等[45]同样发现海水酸化会抑制DMS的生产释放,并推测出到本世纪末因为海洋酸化引起的DMS释放减少可能会导致全球温度升高0.23~0.48 K。培养实验过程中,对照组和OA组中Chla的浓度分别在第8天和第9天达到最大值,随后迅速下降,且OA组Chla的最大值(11.48 μg·L-1)低于对照组(12.85 μg·L-1)。这与DMS的变化趋势并不一致,DMS的变化相较于Chla存在1~2天的滞后性,该现象与Gabric等[46]的研究结果一致,可能是由于酸化条件对DMS的生产消费速率产生了影响。对照组DMSPd的最大值出现在第8天,随后迅速下降,而OA组DMSPd在培养期间持续上升。DMSPp的变化趋势与Chla基本一致,但OA组DMSPp最大值略高于对照组。总体来看,OA组DMSPd和DMSPp的平均浓度相比于对照组分别降低了45%和16%。这说明酸化对DMSP生成的抑制作用比DMS大,且对DMSP向DMS的转化过程有很大影响。
营养盐添加组中Chla、DMS和DMSPp浓度的平均值均表现为R32组(7.42 μg·L-1、10.82和151.02 nmol·L-1)高于R16组(6.01 μg·L-1、8.72和110.34 nmol·L-1)和对照组(3.40 μg·L-1、4.02和83.28 nmol·L-1)。该结果表明适量的营养盐添加有利于浮游植物生长及二甲基硫化物的产生,且N/P比值为32时的促进作用要比N/P比值为16时的促进作用更为明显。但R32组DMSPd的最大值(13.88 nmol·L-1)和平均值(4.82 nmol·L-1)低于R16组(19.05和5.99 nmol·L-1),可能此环境下磷的限制阻碍了浮游植物细胞产生的DMSP向海水中释放。
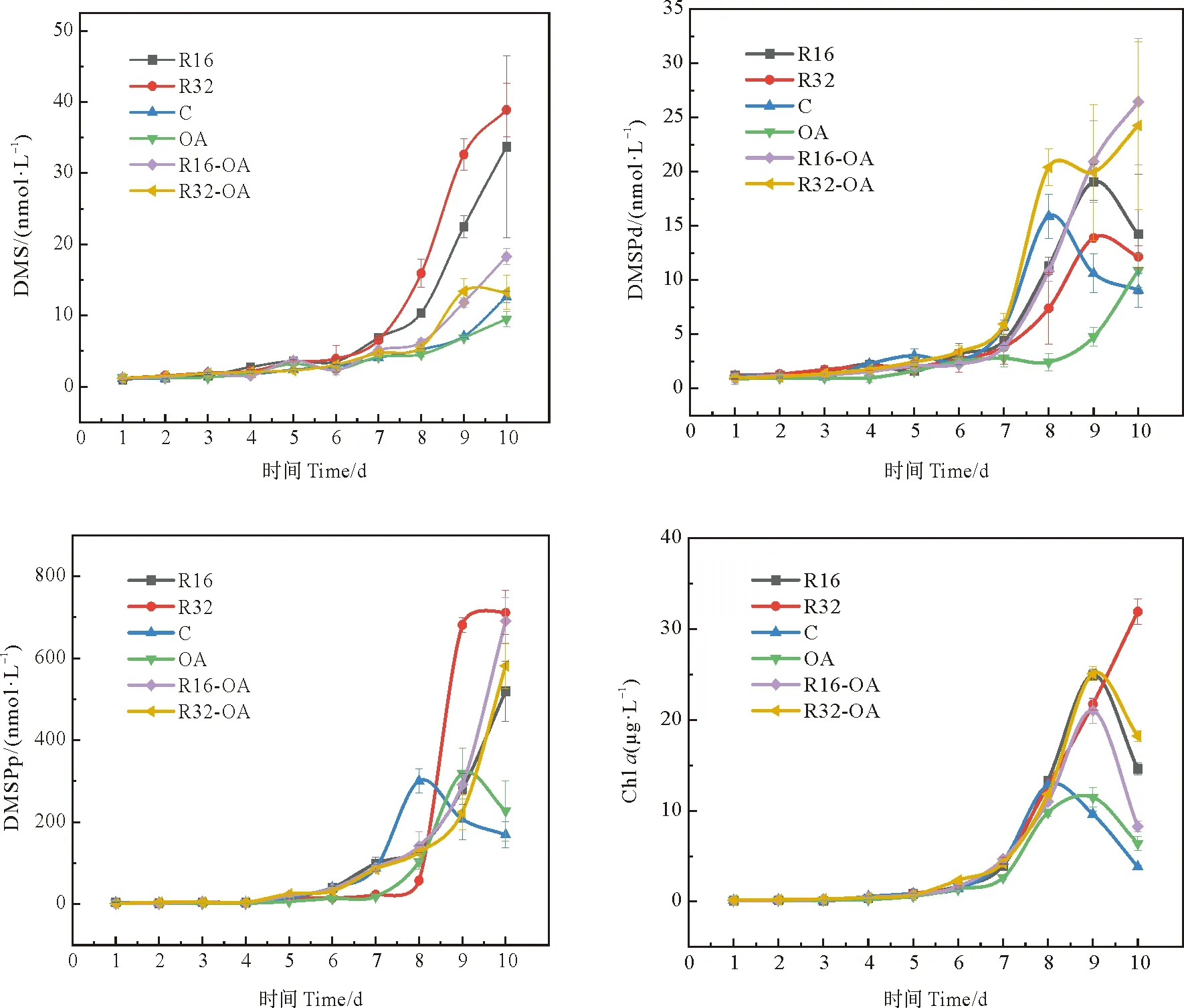
图7 培养过程中各组DMS(nmol·L-1)、DMSPd(nmol·L-1)、DMSPp(nmol·L-1)和Chl a(μg·L-1)的浓度变化
与OA组相比,酸化条件下营养盐的输入对DMS的释放具有显著促进作用。R32-OA和R16-OA组中Chla、DMS和DMSPd的浓度自第7天起明显高于OA组,DMSPp变化情况较为复杂,OA组DMSPp的浓度在第9天超过两个酸化营养盐添加组并达到最大值后迅速下降,最终低于R32-OA和R16-OA组。但两个酸化条件下的营养盐添加组中Chla和三种二甲基硫化物的浓度数据差距不大,经常出现交错上升的趋势,这说明酸化条件下营养盐比例的变化在整体上不会对二甲基硫化物的生成造成显著影响。R32-OA和R16-OA组DMS/Chla的平均值比OA组分别降低了32%和19%,但这两组DMSPp/Chla的平均值相对于OA组分别增加了15%和55%。酸化条件下营养盐的添加会削弱单位浮游植物释放DMS的产量,但浮游植物细胞内合成DMSP的能力得到提升。
培养实验结果表明,高CO2条件会抑制二甲基硫化物的生成,但营养盐添加会抵消这种抑制作用。正常海水pH条件下,当N/P为32时营养盐对浮游植物生成二甲基硫化物的促进作用最强;而在酸化条件下,不同比例营养盐的添加对二甲基硫化物的生成均表现促进作用,但营养盐添加组之间差异甚小。这表明尽管海洋酸化会抑制二甲基硫化物的释放,但近岸富营养化对浮游植物生成二甲基硫化物的促进作用可以弥补海水酸化造成的损失。这与Gypens等[47]根据模型研究得出的结论一致。
3 结论
本文对2020年秋季和2021年冬季长江口及其邻近海域海水中DMS、DMSPd和DMSPp的浓度分布进行了调查研究,结果如下:
(1)秋季长江口及其邻近海域表层海水中二甲基硫化物的浓度高值出现在舟山群岛以东的外海海域,冬季三种硫化物高值出现在调查海域的南部。秋季表层海水中DMS、DMSPd和DMSPp的浓度要高于冬季。秋季二甲基硫化物分布主要集中在表层,且浓度随水深增加逐渐下降,冬季二甲基硫化物的高值出现在表层,在40 m以下的深水区出现次高值。
(2)在秋季,浮游植物是影响二甲基硫化物分布的主要因素;在冬季,温度对二甲基硫化物分布的影响最为显著,盐度次之。
(3)船基培养实验的结果表明,海水酸化抑制了二甲基硫化物的生产释放,但营养盐的添加可促进二甲基硫化物的释放并可抵消海水酸化的抑制作用。在当前海水pH条件下,氮磷比的升高会促进二甲基硫化物的释放;酸化条件下不同比例营养盐的添加没有表现出显著差异。

