季节性不对称模拟增温对青藏高原高寒草甸群落特征的影响
王 婧,刘雄洲,金冠芳,斯确多吉,次仁曲宗,尹淑霞*,杨智永*
(1.北京林业大学草业与草原学院,北京 100083;2.中国科学院青藏高原研究所西藏那曲高寒草地生态系统国家野外科学观测研究站,北京 100101)
青藏高原作为“世界屋脊”,有“世界第三极”之称,平均海拔4 000 m以上[1-2],占我国国土面积的26.8%左右[3]。在全球气候变暖趋势下,预计到2100年全球平均气温将升高1.8℃~4.0℃[4]。北半球高纬度地区比低纬度地区增温速度快[5],高原升温的时间比北半球更早,增温速率大[6],青藏高原对全球气候变暖的反应非常明显[7],呈现出冬季变暖现象比夏季更明显的非对称趋势[8],随着气候变暖现象加剧,这种趋势将更加明显[9]。青藏高原变暖的现象已广泛引起关注。高寒草甸(Alpine meadow)是在青藏高原极端环境影响下所形成的产物,属于典型的高原地带性和山地垂直地带性植被[10],占高寒草地的49.3%[11]。作为高寒生态系统的重要组成部分[12],高寒草甸的生态功能十分脆弱,对人类活动干扰和全球气候变化极其敏感,与全球气候变化有着密切的关系[13],一旦遭受破坏则很难在短期修复,并且很可能引起草地退化以及荒漠化[14]。
因此,研究高寒草甸在全球气候变化中的响应十分重要。许多学者进行了模拟增温试验,研究气候变暖背景下植物群落结构、植被物候期、生物量和生产力等变化[15-18]。已有研究表明,高寒草甸的群落结构在较低程度的增温下不会改变,但较高程度的增温会降低群落的丰富度[19];增温使植物的返青期提前、枯黄期延迟,生长季延长[20];增温还使高寒草甸的地下生物量增多[21],但当高寒草甸的升温超过一定限度时,群落的生产力会受到抑制,加剧草地退化[22];同时,温度升高将导致退化草地初期恢复更加困难[23]。然而,尽管增温对高海拔地区生态系统具有明显影响,但目前就季节性不对称增温对高寒草甸生态系统影响的研究却相对较少[24],多数试验拘泥于研究恒定增温或者梯度增温对植物群落的影响[25],忽略了高寒草甸气候变暖的季节不对称性。本文就高寒草甸群落特征对季节性不对称增温的适应和响应特征展开研究与探讨,为预测未来气候季节性不对称变暖下高寒草甸生态系统结构和功能的变化提供依据。
开顶式生长室(Open-top chambers,OTC)可以使增温小室内与外界的空气流通减弱,热量不易散失,并且阳光可以很好地穿透OTC挡板使室内温度升高,同时其开放的顶部可以保持内外空气流通,减小了增温小室与外界环境的差异[26],且基本不会干扰破坏原本的土壤条件;与其他增温方式相比,具有低成本、易操作的优点,是研究全球气候变化与陆地生态系统关系的主要方法之一,目前在青藏高原地区广泛应用[20]。为研究青藏高原高寒草甸的群落特征对季节性温度升高的响应,在青藏高原典型高寒草甸采用OTC增温方式设置不同季节的增温处理,探讨季节性不对称增温对植物群落的影响。
1 材料与方法
1.1 试验区概况
本试验样地位于西藏那曲高寒草地生态系统国家野外科学观测研究站,地理位置(东经91°54′00″ 北纬30°22′12″,海拔4 512 m),地处冈底斯山脉和念青唐古拉山以北的西藏自治区那曲市色尼区罗玛镇凯马村[27]。试验地属于典型高原大陆性气候[28],气候寒冷,温度低,昼夜温差大,太阳辐射强。年平均气温为—2.1℃,年平均降雨量为406 mm,主要集中在6—9月[29]。植被类型为典型高寒草甸,主要植物为高山嵩草(Kobresiapygmaea)、矮嵩草(Kobresiahumilis)、紫花针茅(Stipapurpurea)、雪白委陵菜(Potentillanivea)等。
1.2 试验设计
试验于2016年8月开始采用OTC(Open-top chambers)增温方式,处理组使用高度为80 cm的OTC设置上下边长分别为57 cm和81 cm的六边形围栏(图1),OTC围栏正中固定放置50 cm×50 cm的网格样方框(网格个数为10×10)。共设3组不同季节的增温处理:全年增温(T1)、夏秋冬季增温(T2)、春夏秋季增温(T3);以不增温处理(T0)为对照组,每组处理设4个重复,共计16个样方。其中T2处理的OTC增温时间为每年6月下旬到次年4月中旬,T3处理的OTC增温时间为每年4月中旬到植被完全枯黄。试验中T1处理将年平均地表温度从4.5℃升高到6.6℃,升高了2.1℃;T2将夏秋冬平均地表温度从3.6℃升高到5.5℃,升高了1.9℃;T3将春夏秋平均地表温度从8.0℃升高到9.5℃,升高了1.5℃。

图1 OTC示意图
1.3 群落特征的测定与计算
在植物生长旺盛季(2021年8月中旬)使用针刺法与目测法相结合进行观测,在每个样方中分别测定每种植物的高度、频度、盖度。针刺法为使用标有刻度的竹签按照从左到右、从上到下的顺序依次垂直落于样方框中每个网格的右下角,记录竹签触碰到的所有植物的高度及触碰到该物种的次数,以出现次数与所有物种出现总次数的比值计为物种的频度;使用目测法测定样方内植物的盖度。群落高度为样方调查中所测得的所有植物的平均高度。根据样方调查的结果计算每种植物的重要值(IV)[30],以此确定植物群落中的优势种和伴生种[31];计算α多样性指数,包括Patrick丰富度指数(R0)[32]、Shannon-wiener多样性指数(H′)、Pielou均匀度指数(J)[33]以及Simpson优势度指数(D)[34];计算公式如下:
IV=(相对高度+相对盖度+相对频度)/3
R0=S
H′=—ΣPilnPi
J=H′/lnS
Pi=IVi/IVtotal
式中S为样方内的物种数;Pi为物种i的相对重要值;IVi为物种i的重要值;IVtotal为种i所在样方内所有物种的重要值之和。
1.4 数据处理
对不同增温处理下的植物群落特征的各项数值使用Excel2021进行计算,增温处理间数据的差异性使用SPSS26.0中的one-way ANOVA进行单因素方差分析。并利用Origin2021进行数据制图。
2 结果与分析
2.1 不同增温处理下植物群落的物种组成及重要值
试验所在的高寒草甸生态系统中共有草地植物约40种,但在同一处理下所有样方中全部出现的常见种共分为莎草科植物、禾本科植物、杂类草植物3个功能群,共计9个物种。如表1所示,与不增温处理相比,增温处理后植物群落的优势种和伴生种均发生了一定程度的变化。
经T1及T2处理后,群落优势种由高山嵩草变为高山嵩草与紫花针茅,T3增温处理下群落的优势种为紫花针茅。T0增温的群落优势种高山嵩草的重要值为0.405,与其他物种的重要值存在显著差异(P<0.05);其重要值在增温后表现为下降趋势,在T3增温处理下显著下降(P<0.05),成为伴生种。而伴生种紫花针茅的重要值在增温后虽上升不明显,但成为了优势种,尤其是经T3处理后代替高山嵩草成为唯一的优势种(表1)。
同时,增温会使植物群落的伴生种发生改变。T0处理下群落的主要伴生种为禾本科的紫花针茅;而经增温处理后群落的主要伴生种则为莎草科植物以及杂类草。不同伴生种的重要值在各增温处理下有所改变,如雪白委陵菜在T1增温的重要值最高,为0.102,是该处理下植物群落中的主要伴生种;短穗兔耳草(Lagotisbrachystachya)是T2处理群落中的主要伴生种,重要值为0.107,高于T2处理,但经T3处理后则从群落中消失。肉果草(Lanceatibetica)在不同季节增温处理后重要值的下降程度不同,在T1和T3增温处理后表现为显著下降(P<0.05)。此外,经增温处理后也有一些植物出现或消失,如在T1处理的群落中出现了二裂委陵菜(Potentillabifurca),多裂委陵菜(Potentillamultifida)则出现于经T2和T3增温的群落中,青藏苔草(Carexmoorcroftii)在经T1及T3增温从群落中消失(表1)。

表1 不同增温处理下植物群落物种组成及其重要值
2.2 不同增温处理下物种多样性的变化
增温处理后植物群落的Patrick丰富度、Shannon-Wiener多样性指数以及Pielou均匀度指数均与T0相比有所降低,且三者在不同季节增温处理下的变化趋势一致,并且在增温处理中T2增温下三者的值最高;T3增温次之;T1增温处理下最低(图2A,B,D)。T1和T3增温下群落的丰富度和多样性指数与T0相比均显著降低(P<0.05),两个增温处理下的群落丰富度分别降低了2.50和2.25,多样性指数分别降低了0.32和0.24;T2增温下群落丰富度和多样性指数降低则不显著。均匀度指数在不同季节增温后变化不显著,T0增温下最低,但仅比不增温降低了0.06,T2和T3分别降低了0.02和0.03。Simpson优势度指数也在增温后发生了变化,T1与T0相比降低了0.09,但二者之间表现出显著差异(P<0.05);T2和T3增温处理与T0相比未表现出明显升高或降低(图2C)。
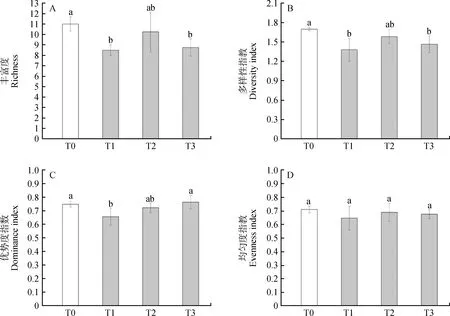
图2 不同增温处理下植物群落的丰富度(A)、多样性指数(B)、优势度指数(C)、均匀度指数(D)
2.3 增温对高寒草甸群落盖度和高度的影响
不同增温处理后的群落盖度略有变化。T0处理下群落盖度为85.00%,T1增温的群落盖度升高至86.25%,而T2和T3增温的群落盖度降低,分别为76.25%和73.75%(图3A)。增温处理后禾本科的平均盖度升高,尤其是T1和T3增温后显著增加(P<0.05),但莎草科的平均盖度降低,杂类草的平均盖度几乎无变化(图4A)。
不同季节增温处理均使群落高度增加(图3B)。T0的植物群落平均高度仅为3.83 cm,T1和T3增温处理下的群落高度分别达到了9.16 cm和7.94 cm,与T0存在显著差异(P<0.05);T2增温的群落高度升高至5.91 cm,但与对照间未表现出明显差异。由图4B可知,不同功能群平均高度的变化与群落高度的变化趋势一致,均表现为T1最高,T3次之,T2最低,但增温后较不增温处理均有所增加。其中,禾本科的平均高度在增温后表现为显著上升,且T1和T3的平均高度显著高于T2(P<0.05);杂类草的平均高度在T1增温处理下显著高于T0和T2(P<0.05)。

图3 不同增温处理下植物群落的盖度(A)和高度(B)

图4 不同增温处理下各功能群的平均盖度(A)和平均高度(B)
3 讨论
3.1 增温与植物重要值的关系
青藏高原由于其特殊的地理位置,植物的生长条件相对于低海拔地区十分严苛,环境温度普遍低于植物生长所需的最适温度[21],这造成了当地植物类型的特殊性。温度升高虽在一定程度上满足了植物生长对热量的需求,但是地表温度升高也加速了土壤水分的蒸发,降低土壤湿度,加重了干旱程度,从而影响植物群落的物种组成[35]。物种重要值的改变在一定程度上反映出了群落结构的变化,也可由此看出草地群落变化中每种植物在群落中的作用[36]。本研究发现增温处理后高寒草甸植物群落中物种的重要值有不同程度的变化,特别是经春夏秋季增温后,莎草科植物高山嵩草在群落中的重要值下降,禾本科植物紫花针茅的重要值上升。这与Dorji等[37-38]在西藏纳木措地区的研究结果类似,由于高山嵩草属于浅根植物,根系分布在土壤浅层,在温度升高并且水分减少的环境中,其生长受到抑制,因此在群落中的优势度降低;而紫花针茅属于深根植物[39],具有良好的耐旱性,在温度升高后分蘖能力和光合作用有所增加,更加适应增温环境[22],从而成为群落的优势种。说明增温处理会影响高寒草甸群落中各种植物的优势度,且每种植物的变化程度有所不同;植物群落的物种组成会因温度升高而发生改变,不同季节的增温处理下群落的组成存在差异,尤其是春夏秋季增温后群落优势种发生替换,使群落发生演替。
3.2 增温与植物群落结构和群落特征的关系
群落物种多样性是在特定生境条件下形成的,即生境的变化制约着该地区植物群落的空间分布格局,其中海拔、纬度梯度是决定生境差异的主导因子[40]。尤其是在海拔较高的青藏高原地区,当温度变化后高寒草甸的群落结构更会随之改变。OTC的设置改变了增温小室中植物群落的小气候环境,植物对土壤水分和养分的吸收受到影响[41],植物的光合、呼吸速率、冠层高度等也发生变化,影响植物的生长发育,进而群落结构和特征随温度变化发生改变[10]。研究表明,短期增温可以增加青藏高原矮嵩草草甸植物群落的高度,并且群落高度与环境温度存在正相关关系[42]。植被的生长环境以及小气候对温度升高有不同程度的响应,植物的生长发育也发生变化,进而改变了物种组成,这些因素综合影响了群落的高度。
本研究表明,增温处理会降低高寒草甸生态系统的物种多样性,这与Klein等[43]的结果相一致。增温使Patrick丰富度和Shannon-Wiener多样性指数有所降低,且不同季节增温后群落多样性的变化不同,全年增温与春夏秋增温对多样性指数具有显著影响;Simpson优势度指数在全年增温下显著降低;而增温对Pielou均匀度指数则无显著影响。这可能是高寒草甸在低温环境中发育形成,其对温度变化的响应十分敏感,温度升高引起高寒草甸植物群落的小气候改变,超过了某些高寒植物的耐热限度,因此在增温后适应性较弱的植物在群落中的地位下降,导致物种的多样性指数降低[25]。也可能是温度升高,一部分物种的种间竞争作用更加明显,另一部分的竞争减弱[44],导致不具有优势的伴生种的功能减弱甚至从群落中消失,竞争能力强的物种(如紫花针茅)高度和盖度增加、优势度上升、个体增多,从而发生群落演替。
4 结论
通过对青藏高原高寒草甸季节性不对称模拟增温的研究发现,温度升高后优势种高山嵩草的优势度降低,主要伴生种紫花针茅的优势度有所上升,甚至成为优势种;不同季节增温后除群落的Pielou均匀度指数无明显变化外,Patrick丰富度、Shannon-Wiener多样性指数、Simpson优势度指数均有不同程度的变化;增温处理使群落高度增加,而群落盖度无显著变化。

