复合垂直流人工湿地基质细菌群落结构变化特征
夏国栋,朱四喜,赵 伟,王 众
(1.贵州民族大学生态环境工程学院,贵州 贵阳 550025;2.贵州民族大学国家民委喀斯特环境地质灾害防治重点实验室,贵州 贵阳 550025;3.国家海洋局秦皇岛海洋环境监测中心站,河北 秦皇岛 066000)
近年来,人工湿地因其成本低、处理效果和稳定性好而被用于生活污水的处理〔1〕。人工湿地对水质的净化与植物和微生物之间的协同作用密切相关〔2-3〕,湿地微生物的代谢直接影响到有机物的降解与转化〔4-6〕。由于土壤微生物独特的敏感性,可以通过微生物群落多样性来表现土壤活力〔7-8〕。作为污染物与微生物的主要堆积场所,人工湿地基质对微生物有很强的吸附能力,会与其发生一系列物理化学反应,使得微生物群落特征发生改变,同时对碳、氮、磷等营养元素有一定的截留和过滤能力〔9-11〕。
由于单一人工湿地对污水的处理能力有限,近年来学者们构建了复合流人工湿地,既提高了湿地污水处理的效率与稳定性,又增加了湿地水力负荷和抗冲击能力。目前对于单一人工湿地系统的细菌群落结构特征研究很多,但是对于复合垂直流人工湿地中细菌多样性变化以及驱动因子的研究却很少。基于此,本研究拟利用Illumina Miseq PE300 平台进行基因测序,对复合流人工湿地细菌群落结构与多样性进行研究,并结合湿地基质理化因子分析,为复合垂直流人工湿地的高效脱氮及其维护管理提供理论依据。
1 材料与方法
1.1 样品采集
湿地基质样本取自贵州喀斯特地区瓮安县建中镇复合垂直流人工湿地中的各级人工湿地,人工湿地于2019 年8 月投入使用。喀斯特地区生境恢复力弱,存在水土流失、易被腐蚀等问题,同时受岩溶作用影响,湿地稳定性差且容易受到污染〔12〕。
该地区对于生活污水的处理流程如图1(a)所示,污水流经预处理单元(格栅池、厌氧池、生物接触氧化池)后按顺序进入湿地系统各级处理单元A(一级垂直流下行池)、B(一级垂直流上行池)、C(二级垂直流下行池)、D(二级垂直流上行池)、E(生物稳定塘)。该湿地系统占地240 m2,如图1(b)所示,每个池子自上而下分别填充细沙(d=0.2~0.4 cm)层20 cm、粗砂(d=1~2 cm)层20 cm、砾石(d=3~5 cm)层40 cm,植物配置为鸢尾(Iris tectorum Maxim)+菖蒲(Acorus calamus L)。在A、B、C、D、E 共计5 处设置采样点,采样温度为12 ℃,采样深度为距表层10 cm 处,每个采样点采集3 个平行样。用于测定细菌的样品放入便携式冰柜冷藏运输至实验室后于-80 ℃保存以待后续实验。用于测定基质养分的样品放于自封袋,带回实验室后等待自然风干用于检测。

图1 复合流人工湿地示意Fig.1 Schematic diagram of the composite flow constructed wetland
1.2 DNA 抽提和PCR 扩增
根据E. Z. N. A.®soil DNA Kit(Omega Bio-tek,Norcross,GA,US)说明书进行微生物群落总DNA 抽提,使用1%的琼脂糖凝胶电泳检测DNA 的提取质量,使用NanoDrop2000 测定DNA 浓度和纯度;使用338F 和806R 对16S rRNA 基因V3~V4 可变区进行PCR 扩增。每个样品设置3 个平行样。
1.3 Illumina Miseq 测序
将同一样本的PCR 产物混合后,使用2%琼脂糖凝胶回收PCR 产物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,Union City,CA,USA)进行回收产物纯化和2%琼脂糖凝胶电泳检测,并用Quantus™Fluorometer(Promega,USA)对回收产物进行定量。使用NEXTflexTM Rapid DNA-Seq Kit(Bioo Scientific,美国)建库后,利用Illumina 公司的Miseq PE300 平台进行测序,原始数据上传至NCBI SRA 数据库。
1.4 数据处理
使用Fastp〔13〕软件对原始测序序列进行质控,使用FLASH〔14〕软件拼接后,利用UPARSE〔15〕软件根据97%的相似度对序列进行OTU 聚类并剔除嵌合体〔16-17〕。利用RDP classifier〔18〕对每条序列进行物种分类注释,比对Silva 16S rRNA 数据库(version 138),设置比对阈值为70%。
采用Excel 软件对原始数据进行初步整理;使用SPSS 软件中单因素方差分析(One ANOVA)对土壤养分进行分析;利用Canoco5 软件中的冗余分析(RDA)对理化因子与属水平细菌进行分析。采用Graphpad prism9.0 软件作图,统计显著性水平p=0.05,且表中数据表现形式为(均值±标准误差)。
1.5 理化指标的测定
参照《土壤农业化学分析方法》测定湿地基质养分〔19〕;采用电位法测定pH;采用碘量法测定溶解氧(DO);采用硫酸消煮-水杨酸钠法测定总氮(TN);采用硫酸消煮-钼锑抗法测定总磷(TP);采用水杨酸钠法测定氨态氮(-N);采用硫酸肼还原法测定硝态氮(-N)。
2 结果与分析
2.1 复合流人工湿地基质理化性质分析
各级湿地土壤理化性质见图2。

图2 各级湿地土壤理化性质Fig.2 Physical and chemical properties of wetland soil at all levels
由图2可知,复合垂直流人工湿地基质pH在7.126 7~8.093 3 之间,偏中性和弱碱性,其中一级垂直流上行池基质pH 最高,而生物稳定塘的酸碱度接近中性。
由图2 还可以看出沿程各级人工湿地基质各理化性质的变化趋势。pH 与DO 的变化趋势均比较平稳,pH 在生物氧化塘的值接近中性,DO 最大值出现在一级垂直流下行池,最小值位于一级垂直流上行池。-N 与-N 的变化有相似的规律,-N 峰值为117.21 mg/kg,-N 峰值为0.18 mg/kg,峰值均在二级垂直流下行池中出现。TP 与TN 的最小值均分布在生物氧化塘,TP 存在极大值,分布在一级垂直流上行池与二级垂直流上行池,TN 在二级垂直流上行池达到最高值,次高值位于一级垂直流上行池。
2.2 复合流人工湿地细菌群落多样性指数分析
复合流人工湿地物种Alpha多样性指数分析见表1。
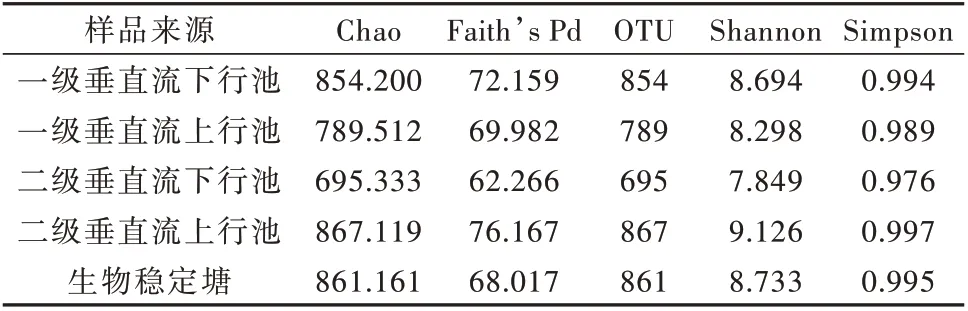
表1 复合流人工湿地物种Alpha 分析Table 1 Species Alpha analysis in compound artificial wetland
由表1 可知,各样品Chao 指数在695~867 之间,Shannon 与Simpson 指 数 分 别 在7.849~9.126 与0.976~0.997 之间。从Alpha 多样性指数分析中可以看出,二级垂直流上行池中物种丰度最高,生物氧化塘次之,但是一级垂直流下行池的微生物丰度要高于一级垂直流上行池和二级垂直流下行池的数据,这可能是由于污水流动过程中将预处理工艺中的微生物带入一级垂直流下行池导致其丰度增加。在该人工湿地环境之中,微生物群落的丰度以及多样性随着人工湿地梯级处理先减小,在二级垂直流下行池达到最低,之后恢复到较高水平,其原因推测为污水经过预处理进入人工湿地系统,将微生物带入湿地系统导致初始丰度增加,之后逐级递减,达到二级垂直流下行池时最低,之后由于水质得到提高,该湿地生态环境中的微生物群落更加丰富化。
图3 是OTU 韦恩图,从韦恩图可以看出各级人工湿地样本OTU 的数目组成相似性和重叠情况。5 个采样点中重叠的OTU 数目为140,每个采样点的OTU数目也各有不同,其中二级垂直流上行池(867)>生物稳定塘(861)>一级垂直流下行池(854)>一级垂直流上行池(789)>二级垂直流下行池(695)。同时从表1 也能看出二级垂直流上行池具有最大多样性与均匀性,Chao 指数以及Shannon 指数分别为867.119与9.126。而二级垂直流下行池物种异质性即多样性最简单,Faith’s Pd 指数与Simpson 指数最小,分别为62.266 与0.976。

图3 OTU 韦恩图Fig.3 OTU Wayne
2.3 复合流人工湿地微生物物种组成
图4为各级湿地微生物在门水平上的相对分布情况。
由图4 可知,湿地整体环境中核心门类为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、绿弯菌门(Chloroflexi)、放线菌门(Actinobacteria)与拟杆菌门(Bacteroidetes),优势菌群占总菌群的比例高于80%。其中,变形菌门在核心门类中表现优异,各取样区内其比例均高于30%,并且随着湿地处理的梯级推进,变形菌门占比呈现先增大后减小的变化趋势,在一级垂直流上行池中表现最优,丰度高于60%。丰度同样呈现先增加再减少变化趋势的还有拟杆菌门。而厚壁菌门、绿弯菌门、放线菌门的丰度随着处理过程的推进均呈现出一个先减小再增大的变化趋势,厚壁菌门在一级垂直流上行池丰度只占不到10%,但是之后的递增可以看出厚壁菌门类细菌也是污水处理的优势菌种。在研究中发现,优势菌门在一级垂直流上行池、二级垂直流下行池中丰度最高,并且各优势门类丰度转折变化的拐点均在一级垂直流上行池与二级垂直流下行池中。

图4 各级湿地微生物在门水平上的相对分布Fig.4 Relative distribution of microorganisms in different levels of wetland at phylum level
所取样品中的菌群在门水平上的热图见图5。
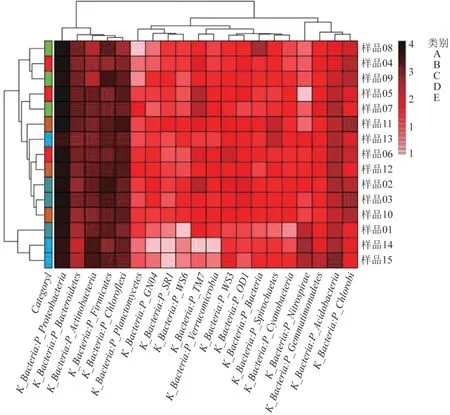
图5 门分类水平热图Fig.5 Heat map of phylum classification level
由图5 可以直观看出各级湿地中3 个平行样与微生物丰度的相关程度,再次验证了变形菌门、厚壁菌门、绿弯菌门、放线菌门与拟杆菌门在总群落中的优势地位。另外需要注意的是,除了以上的优势菌群外,酸杆菌门(Acidobacteria)与绿菌门(Chlorobi)与样品间的相关性也比较显著,相关系数>2。
2.4 复合型人工湿地组间OTU 差异显著分析
图6 所示为LDA 差异贡献分析(LEfSe)的进化分支图(Cladogram)。

图6 进化分支图Fig.6 Cladogram
Cladogram 由内到外辐射的圆圈分别对应界门纲目科属不同的分类层级,层级间的连线代表所属关系。每个圆圈节点代表一个物种,黄色节点代表分组间差异不显著,差异物种跟随组进行着色。有颜色的扇形区域标注了特征微生物的下属分类区间。由图6可知,在复合流人工湿地中变形菌门所包含的特征微生物范围最广,其次是厚壁菌门以及放线菌门。变形菌门中的γ-变形菌纲(Gammaproteobacteria)、δ-变形菌纲(Deltaproteobacteria)、α-变形菌纲(Alphaproteobacteria)丰度最高。进一步分析发现一级垂直流上行池中硫发菌目(Thiotrichales)、着色菌目(Chromatiales)与一级垂直流下行池中的甲基球菌目(Methylococcales)在γ-变形菌纲中有显著性表现。生物稳定塘中δ-变形菌纲中的除硫单胞菌目(Desulfuromonadales)与互营杆菌目(Syntrophobacterales)丰度最高。二级垂直流下行池中的根瘤菌目(Rhizobiales)在α-变形菌纲中表现最优异。放线菌门在目水平上放线菌(Actinomycetales)丰度最高,且多集中在生物稳定塘中。厚壁菌门中梭状芽孢杆菌(Clostridia)丰度最高,乳杆菌(Lactobacillus)与芽孢杆菌(Bacillus)次之,梭状芽孢杆菌与芽孢杆菌多分布在生物稳定塘,而乳杆菌在一级垂直流下行池中分布较多。
图7 为LEfSe 分析LDA 柱形图。

图7 LDA 柱形图Fig.7 LDA histogram
LDA 柱形图中每一横向柱形体代表一个物种。柱形体的长度对应LDA 值,LDA 值越高则差异越大。柱形体的颜色对应该物种组别。由图7 可知,一级垂直流下行池中丰度最高的特征微生物是厚壁菌,之后是梭状芽孢杆菌。δ-变形菌是一级垂直流上行池丰度最高的特征微生物,其次丰度较高的是脱氯单胞菌(Dechloromonas)。二级垂直流下行池的特征微生物有α-变形菌、芽生绿菌(Blastochloris)、黄色杆菌(Xanthobacteraceae)和根瘤菌(Rhizobia⁃les),其丰度大小排序为α-变形菌>芽生绿菌>黄色杆菌>根瘤菌。二级垂直流上行池中γ-变形菌丰度最高,值得注意的是,着色菌在二级垂直流上行池菌群中也占有很大的比例。生物稳定塘中的微生物以乳杆菌为主。此外,由图7还可以看出,微生物多样性从一级垂直流下行池至生物稳定塘的过程中呈现出先减小后增大的变化,这也与Alpha多样性分析相吻合。
2.5 复合流人工湿地菌属与环境因子的关系分析
对属水平的细菌与土壤理化性质之间的相关性进行冗余分析,结果见图8。

图8 属水平细菌与土壤理化性质关系的冗余分析Fig.8 Redundant analysis of the relationship between bacteria at genus and physical and chemical properties of soil
图8 显示,第1、第2 排序轴分别解释了总变异的35.44% 和18.69%。pH 是黄单胞菌属(Xanthomona⁃daceae)与红环菌属(Rhodocyclaceae)的环境驱动因子,而-N、DO 与黄单胞菌属、红杆菌属(Rhodobacter)以及根瘤菌属关系密切,呈现正相关的关系。此外,属于变形菌门的芽生绿菌属、硫杆菌属(Thiocapsa)、博斯氏菌属(Bosea)、着色菌属(Chromatiaceae)以及放线菌属(Actinomycetales)都受到TN 的调控,与TN 正相关。值得一提的是,梭状杆菌属(Clostridium)受-N、-N、TN 的影响,与之呈现出显著的负相关关系。
3 讨论与分析
在复合流人工湿地环境中,细菌群落分布、多样性随污水梯度处理呈现先减小后增大的变化趋势,这也与付家晖等〔20〕对博斯腾湖水体与沉积环境微生物群落的研究结论类似。由于水体具有流动性,会把预处理过程中的微生物带入复合流人工湿地中,再加上沉积环境又给了微生物一个稳定生存的场所〔21〕,使得一级垂直流下行池微生物丰度和多样性暂时呈现最大化。污水中有机物转换、重金属吸附行为都与微生物群落分布及其多样性有重要的关系〔22〕,待污水进入人工湿地之后水质得到改善,细菌菌群多样性特征也随着水质的净化过程发生改变。
在复合流人工湿地环境中,优势菌种为变形菌门、厚壁菌门、绿弯菌门、放线菌门与拟杆菌门,且优势菌门相对丰度占到80%以上,其中,变形菌门相对 丰 度 最 高。I.VAZ-MOREIRA 等〔23〕也 发 现,不 管是自然水体还是人工水体中,变形菌门相对丰度均较高,其在污水处理以及氮磷形态转换方面都起到了十分重要的作用〔24〕。有研究表明,厚壁菌门大量存在于污水净化过程之中〔25〕,在本研究中也发现,厚壁菌门是复合流人工湿地处理污水过程中的优势菌种。此外,具有一定数量的绿菌门与酸杆菌门也是需要注意的菌种,绿菌门参与硫化物的分解以及碳循环过程〔26〕,目前对酸杆菌门的研究较少,但有研究表明酸杆菌的相对丰度与pH 呈现显著负相关关系,并且其对纤维素有一定的降解作用〔27-28〕。
在复合流人工湿地环境中,变形菌门中的γ-变形菌纲、δ-变形菌纲、α-变形菌纲丰度最高,这些都是湿地常见的细菌菌群〔29〕,α-变形菌纲可以对湿地中氨氮进行去除,γ-变形菌纲、δ-变形菌纲对湿地的硝酸盐和亚硝酸盐有去除作用。另外,在一级垂直流上行池发现了变形菌门中的着色菌目,这是一类能够进行光合作用的细菌。厚壁菌门中芽孢杆菌的相对丰度也很高,其对氮和有机物有去除作用,并且对环境有较强的适应能力,此外,还有一定的防病作用〔30-31〕。
研究表明,土壤微生物群落多样性特征受土壤环境因子的调控〔32〕,不同细菌菌群也会受到一个或多个环境因子的调控〔33〕。通过RDA 分析发现,-N 与属于变形菌门的黄色杆菌属、红杆菌属以及根瘤菌属呈现出正相关的关系。而之后的研究发现,变形菌、黄色杆菌与根瘤菌在二级垂直流下行池中丰度最高,而-N 同样在二级垂直流下行池中含量最高,证明-N 是黄色杆菌属、红杆菌属以及根瘤菌属的主要驱动因素之一。RDA 分析也证实了溶解氧与红杆菌属有着显著的正相关关系,这与梁伟光等〔34-35〕的研究结果一致。TN 与属于变形菌门的芽生绿菌属、硫杆菌属、博斯氏菌属、着色菌属以及放线菌门的放线菌属呈现正相关的关系,其在二级垂直流上行池中含量最高,其次较高的浓度出现在二级垂直流下行池中。值得一提的是,二级垂直流下行池中的特征细菌是变形菌以及芽生绿菌,而着色菌在二级垂直流上行池中也占有很大的比例。研究表明,TN 是芽生绿菌属、硫杆菌属、博斯氏菌属、着色菌属的主要驱动因素。此外,通过RDA 分析发现梭状杆菌属与pH、-N、-N、TN 呈现出显著负相关的关系,梭状杆菌大量出现在生物氧化塘中,生物氧化塘内pH、-N、-N、TN 均达到最小值,得出pH、-N、-N、TN 是梭状杆菌的主要驱动因素。
综上所述,复合垂直流人工湿地基质中细菌菌群分布会根据生境的变化而改变,pH、DO 与氮盐是细菌群落分布的主要驱动因素。与此同时,菌群变化特征也对人工湿地处理功效有相应的调控作用,在串联式人工湿地的梯级处理过程中,本研究所识别并讨论的优势细菌在对碳、氮、磷元素的去除中都有所表现,尤其是在每一级湿地中,优势菌群对于氮元素形态的转化都有很大的贡献,由此不难推测,复合垂直流人工湿地对氮元素的去除有一定的优化作用。遗憾的是,一些优势细菌在脱氮过程中的调控作用仍然未知,有待更深入的研究。
4 结论
本研究在复合垂直流人工湿地中,对各级湿地基质的细菌群落特征变化进行了简要分析,得到以下几点结论:
(1)在该复合流人工湿地中,通过对细菌群落多样性的分析发现,物种丰度最高的单元为二级垂直流上行池,二级垂直流下行池微生物多样性最少,其OTU 数目排序为二级垂直流上行池(867)>生物稳定塘(861)>一级垂直流下行池(854)>一级垂直流上行池(789)>二级垂直流下行池(695)。从污水处理工艺来看,微生物群落的丰度以及多样性随着人工湿地梯级处理呈现先减小后增大的变化趋势。
(2)在该复合流人工湿地中,通过对细菌群落多样性组成分析发现,复合流人工湿地中优势菌群总的相对丰度高于80%,优势菌群门类为变形菌门、厚壁菌门、绿弯菌门、放线菌门与拟杆菌门。除优势菌群以外,参与硫化物分解的绿菌门与多存在于重金属污染水体中的酸杆菌门也存在于各级人工湿地中。在该复合流人工湿地中,通过对细菌组间差异性分析可得,复合流人工湿地中变形菌门中的γ-变形菌纲、δ-变形菌纲、α-变形菌纲丰度最高,放线菌门在属水平上放线菌属丰度最高,厚壁菌门中梭状芽孢杆菌丰度最高,乳杆菌与芽孢杆菌丰度次之。
(3)一级垂直流下行池中丰度最高的特征微生物是厚壁菌,一级垂直流上行池中丰度最高的特征微生物是δ-变形菌,二级垂直流下行池特征微生物有α-变形菌、芽绿菌、黄色杆菌以及根瘤菌,二级垂直流上行池中变形菌中的γ-变形菌丰度最高,着色菌也占有一定比例,生物稳定塘中以梭状芽孢杆菌为主。
(4)复合流人工湿地中TN 是芽生绿菌属、硫杆菌属、博斯氏菌属、着色菌属以及放线菌门的放线菌属的主要驱动因子。pH-N、-N、TN 是梭状杆菌属的主要驱动因子。属于变形菌门的黄色杆菌属、红杆菌属以及根瘤菌属受到-N 的调控,而好氧反硝化的红杆菌属受到溶解氧的调控。

