本氏烟半胱氨酸蛋白酶基因家族特征及其在TMV侵染中的功能
裴悦宏,李凤巍,刘维娜,温玉霞,朱鑫,田绍锐,樊光进,马小舟,孙现超
本氏烟半胱氨酸蛋白酶基因家族特征及其在TMV侵染中的功能
裴悦宏,李凤巍,刘维娜,温玉霞,朱鑫,田绍锐,樊光进,马小舟,孙现超
西南大学植物保护学院植物病害生物学重庆市重点实验室,重庆 400715
【目的】明确抗病毒化合物氯吲哚酰肼(chloroinconazide,CHI)诱导的本氏烟()半胱氨酸蛋白酶(cysteine proteinase,CP)在烟草花叶病毒(tobacco mosaic virus,TMV)侵染过程中的作用及其基因家族特征,为理解茄科作物抗病毒分子机制及化学调控提供理论依据。【方法】利用全基因组策略,从茄科作物基因组数据库Sol Genomics Network中检索获得本氏烟NbCP的全家族基因序列,利用生物信息学分析NbCP基因家族的进化关系、Motif基序及启动子顺式作用元件。根据生物信息分析结果,利用实时荧光定量PCR技术分析TMV侵染后NbCP基因的表达,以此筛选出潜在抗病蛋白。使用烟草脆裂病毒(tobacco rattle virus,TRV)介导的基因沉默技术和马铃薯X病毒(potato virus X,PVX)介导的基因过表达技术验证该关键蛋白对TMV-GFP侵染的影响,结合实时荧光定量PCR手段探索该关键蛋白的抗病毒机制。【结果】NbCP家族共有24个成员,根据其染色体定位命名为—。进化关系分析表明NbCP分成5个亚家族,其中Group V含有7个NbCP,而Group I仅含2个NbCP;Motif分析表明不同分支NbCP具有相似的motif分布;启动子顺式作用元件分析表明NbCP家族基因受光调控,并且多个NbCP家族基因启动子含有茉莉酸甲酯、水杨酸甲酯、脱落酸、赤霉素和生长素等激素响应元件。结合生物信息学分析,从上述各个亚家族中分别筛选1个关键潜在抗病相关NbCP基因(、、、、),并利用实时荧光定量PCR技术分析上述基因在TMV侵染第5天的表达,发现表达差异性最大,上升了2.6倍,在叶中的表达量最高,其次是茎和根,在花中的表达量最低。TRV介导的沉默能显著增加TMV-GFP的侵染,而PVX介导的过表达能显著抑制TMV-GFP侵染,表明作为植物正调控因子抑制病毒侵染。沉默显著抑制了水杨酸信号途径相关基因以及茉莉酸信号途径相关基因的表达,但对、以及脱落酸信号途径相关基因和的表达无显著影响;而过表达则显著提高了以及的表达,但对、、和的表达无显著影响。【结论】本氏烟NbCP参与了植物胁迫防御,其中NbCP8在抗TMV防御中起显著作用,其分子机制是通过诱导水杨酸信号途径参与抗病防御,研究结果可为茄科作物抗病毒的分子机制提供证据。
本氏烟;全基因组;半胱氨酸蛋白酶;NbCP8;烟草花叶病毒
0 引言
【研究意义】烟草花叶病毒(tobacco mosaic virus,TMV)是一种RNA病毒,病毒粒体呈杆状,可侵染多种植物,尤其是十字花科和茄科植物,如番茄、辣椒、烟草等,造成严重的经济损失[1-2]。因此,挖掘并探究抗病毒基因对茄科植物的抗病毒品种育种及利用药剂抗病毒靶基因的筛选具有重要意义。【前人研究进展】当病原体入侵植物时,植物体内会激发各种信号来抵御病原体的侵染,例如调节各种酶的活性,而植物的半胱氨酸蛋白酶(cysteine protease,CP)是植物质外体中对抗各种病原体入侵所必需的一种组织蛋白酶。拟南芥中的半胱氨酸蛋白酶缺失突变体对灰霉病菌()更敏感[3];番茄半胱氨酸蛋白酶CYP1能抑制番茄黄曲叶病毒(tomato yellow leaf curl virus,TYLCV)的系统性侵染[4];本氏烟()的木瓜样半胱氨酸蛋白酶(PLCP)在病原体侵染中可产生过敏反应(HR)[3]。同时,各种病原体通过靶向半胱氨酸蛋白酶来促进其侵染[5]。番茄CYP1被TYLCV的RNA沉默抑制子V2靶向和抑制[4,6];拟南芥中RD19被青枯菌()的Ⅲ型效应因子PopP2靶向并诱导其重新入细胞核[7];玉米半胱氨酸蛋白酶CP2被黑穗病菌()效应子Pit2靶向,并抑制其诱发的水杨酸(salicylic acid,SA)抗性途径[8]。SA作为植物重要的抗性小分子化合物,也在植物半胱氨酸蛋白酶的激活与功能发挥中起着重要作用[9-10]。SA处理后的玉米植株中PLCP被激活,而PLCP本身也可激活SA相关基因表达,进而触发免疫防御反应[5,10]。【本研究切入点】前期研究发现新型抗病毒化合物氯吲哚酰肼(chloroinconazide,CHI)能通过靶向降解病毒粒子显著抑制TMV-GFP侵染[11-12]。为进一步探究其抗病毒机制,对氯吲哚酰肼处理本氏烟进行转录组测序,发现植物半胱氨酸蛋白酶家族相关基因的变化最大,多项研究已表明植物半胱氨酸蛋白酶在抵御病原物侵染过程中的作用,但其在植物抗RNA病毒侵染过程中的作用尚不明确[3-4]。【拟解决的关键问题】利用全基因组手段,分析本氏烟半胱氨酸蛋白酶(NbCP)家族特性,并利用实时荧光定量PCR分析响应TMV侵染的关键差异变化NbCP基因。利用病毒介导的基因沉默及过表达技术分析关键NbCP基因在TMV-GFP侵染过程中的作用,为解析NbCP家族在烟草抗病应答中的调控机制提供科学依据,同时为抗病毒作用的遗传选育和抗病毒药剂的靶点开发提供理论依据。
1 材料与方法
试验于2021年3月至2022年4月在西南大学植物保护学院植物免疫与植物病害生态防控实验室完成。
1.1 材料
植物材料:本氏烟种植于恒温培养室(恒温25℃,光照14 h/黑暗10 h,相对湿度75%)中培养至6叶期待用。
菌株与质粒:大肠杆菌()DH5、根瘤土壤农杆菌()GV3101购自上海唯地生物技术有限公司;VIGS沉默载体pTRV2由西北农林科技大学单卫星教授实验室馈赠;烟草花叶病毒GFP荧光侵染性克隆载体TMV-GFP(pSPDK661)和基于PVX改造的瞬时过表达载体pGR106由清华大学刘玉乐老师实验室馈赠[13]。
试剂:植物总RNA提取试剂Trizol、反转录试剂盒047A、PrimeSTAR® GXL DNA Polymerase、DNA连接试剂盒、限制性内切酶购于宝日医生物技术(TaKaRa,日本)有限公司;DNA纯化回收试剂盒、质粒提取试剂盒购于天根生化科技(TIANGEN,北京)有限公司;实时荧光试剂盒SYBR Prime qPCR Set购自重庆葆光生物技术有限公司;其他试剂均为国产分析纯;引物合成及测序由重庆擎科生物公司和生工生物工程(上海)股份有限公司共同完成。
1.2 方法
1.2.1 NbCP基因家族的全基因组鉴定 以实验室前期氯吲哚酰肼处理本氏烟转录组数据库中检索到的半胱氨酸蛋白酶Niben101Scf02763g05012.1为诱饵,在本氏烟基因组数据库Sol Genomics Network(https://solgenomics.net/organism/Nicotiana_benthamiana/genome)中筛选NbCP家族候选蛋白[14]。采用Blastp算法,选取E<1E-10的候选序列[15]。之后使用SMART(http://smart.embl-heidelberg.de/)预测基因结构域[16],含有Inhibitor_I29和Pept_C1保守结构域被鉴定为NbCP家族蛋白[17-18]。
1.2.2 生物信息学分析 根据得到的序列,利用ExPaSy(https://web.expasy.org/protparam/)计算每个蛋白序列的分子量和等电点,并确定其分子式[19]。
将NbCP基因编码序列与几种茄科植物CP氨基酸序列进行同源比较和系统发育分析。采用MEGA 11进行同源比较,其中默认参数不变[20]。基于邻接法(neighbor-joining,NJ),选择Poisson模型,将bootstrap设置为1 000,对系统发育分析结果的置信度进行评估[21]。采用iTOL在线编辑网站(https://itol. embl.de/)对进化树进行美化。
利用TSS提取NbCP家族基因上游的1 500 bp作为启动子序列进行顺式元件分析。使用PlantCare(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测其顺式元件[22],TBtools将结果可视化[23]。
利用MEME软件(http://meme.nbcr.net/meme/ intro.html)对已鉴定的NbCP蛋白中的保守基序进行识别鉴定[24]。优化参数如下:重复次数,any;图案最多15个;每个基序的最佳宽度介于6—50个残基[15]。之后利用TBtools可视化展示Motif结构[23]。
1.2.3使用Trizol法提取本氏烟RNA,操作规程详见https://www.takarabiomed.com.cn/ DownLoad/9108-9109.pdf。采用PrimeSTAR® GXL DNA Polymerase DNA聚合酶扩增,操作详见https:// www.takarabiomed.com.cn/DownLoad/R050A.pdf。将获得的序列连至Zero Background pTOPO-Blunt并转化至大肠杆菌感受态细胞DH5,操作方法详见http://www.aidlab.cn/up_product/big/2017-4-1-10414853596.pdf。将阳性克隆菌液送至生工生物工程(上海)股份有限公司测序。
1.2.4 实时荧光定量PCR 选用qTOWER3.0(ANALYTIKJENA,德国)荧光定量PCR仪,使用SYBR Prime qPCR Set扩增,每个样品设置4个技术重复,每个试验进行3个生物学重复。反应条件:95℃ 3 min;95℃ 10 s,55℃ 30 s,72℃ 20 s,40个循环。利用2-ΔΔCT法计算目标基因对内参基因的相对表达量[25]。序列信息详见表1。
1.2.5 载体构建及农杆菌浸润接种沉默载体的构建基于烟草脆裂病毒(tobacco rattle virus,TRV)改造的沉默体系[26]。首先根据的全长,利用在线工具VIGS Tool(https://vigs.solgenomics.net/)获得的最佳沉默片段[27],以此设计含有酶切位点H I和I的引物,将其连接在同样酶切位点的pTRV2载体上,构建pTRV2:NbCP8载体,序列信息详见表1。以空载体pTRV2为对照,将pTRV1和pTRV2:NbCP8转化至农杆菌GV3101中,28℃ 200 r/min过夜培养,利用重悬液(10 mmol·L-1MES,10 mmol·L-1MgCl2,200 μmol·L-1乙酰丁香酮)重悬至OD600=0.4,等比混合后静止2 h并注射4叶期本氏烟[28]。
过表达载体的构建基于PVX改造的过表达体系。首先根据的全长,设计含有酶切位点Ⅰ和Ⅰ的引物,将其连在同样酶切位点的pGR106载体上,构建PVX:NbCP8载体,以空载PVX:00为对照,将PVX:00和PVX:NbCP8转化至农杆菌GV3101中,28℃ 200 r/min过夜培养,利用重悬液(10 mmol·L-1MES,10 mmol·L-1MgCl2,100 μmol·L-1乙酰丁香酮)重悬至OD600=0.8,静置3 h,注射4—6叶期本氏烟。引物信息见表1。
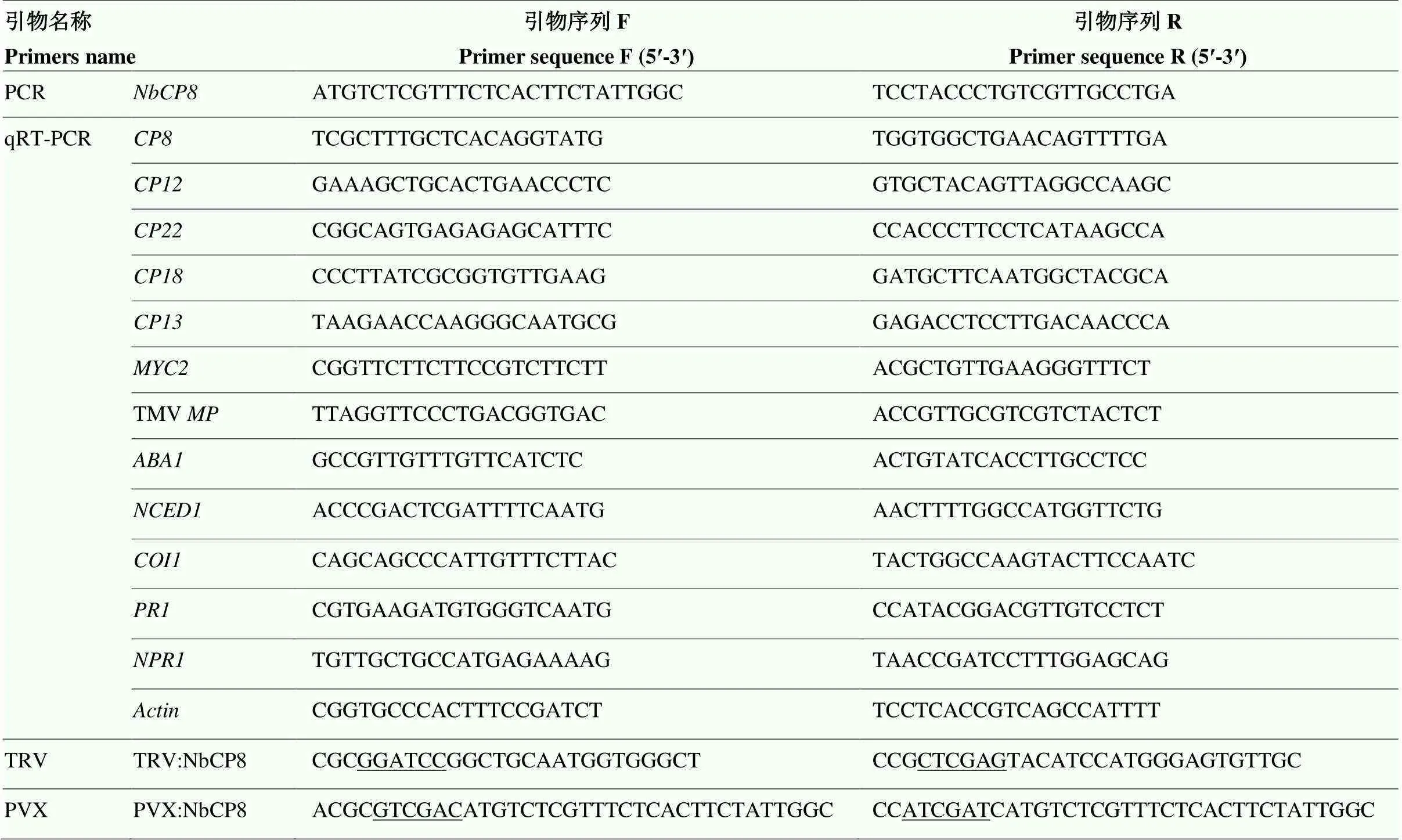
表1 本研究所用引物序列
下划线的碱基为所加酶切位点 The underlined bases were the restriction enzyme sites
1.2.6 病毒接种 取0.1 g被TMV-GFP侵染的本氏烟叶片于研钵中,加入石英砂和pH 7.2—7.4的磷酸缓冲液研磨均匀。将获得的匀浆在5 000×离心机中离心3 min,取上清进行摩擦接种[29]。每片叶片接种100 μL,每株植株接种第5、6叶位叶片。
1.3 数据分析与统计
所有试验至少3个重复,数据表示为平均值±标准误,统计分析采用SPSS软件student’s t检验(*0.01<P<0.05,**0.001<P<0.01,***P<0.001)和ANOVA单因素分析(LSD检验,P<0.05)。
2 结果
2.1 NbCP基因家族的全基因组鉴定
获得了NbCP基因家族的20个候选蛋白。之后使用SMART来确定是否存在Inhibitor_I29和Pept_C1保守结构域。人工筛剔除4个错误预测的NbCP基因模型。剔除冗余序列后,最终获得24个NbCP家族基因,根据其在染色体上的位置,命名为NbCP1—NbCP24(表2)。NbCP家族分子量和等电点相差较大,其中NbCP19的分子量最小(11 947.10 Da),NbCP16的分子量最大(74 678.53 Da);NbCP19的等电点最小(4.37),NbCP15的等电点最大(8.89)。
2.2 NbCP基因家族系统进化关系分析
为明确NbCP的进化关系,利用同样的方法从茄科植物基因组数据库Sol Genomics Network(https:// solgenomics.net/)[14]中检索获得同为茄科的番茄()和辣椒()的半胱氨酸蛋白酶家族基因。番茄中共检索到33个半胱氨酸蛋白酶,命名为SlCP1—SlCP33;辣椒中检索到24个半胱氨酸蛋白酶,命名为CaCP1—CaCP24。3种茄科作物CP蛋白主要分为5个亚家族,番茄和本氏烟CP在5个亚家族均存在,而辣椒CP仅存在于Group II—Group V亚家族。NbCP11和NbCP12属于Group I亚家族;NbCP2、NbCP8、NbCP23和NbCP24属于Group II亚家族;NbCP6、NbCP7、NbCP19、NbCP20和NbCP22属于Group III亚家族;NbCP1、NbCP3、NbCP9、NbCP16、NbCP17和NbCP18属于Group IV亚家族,其余NbCP属于Group V亚家族(图1)。
2.3 NbCP基因家族特征分析
Motif是指在许多蛋白质分子中,有几种具有二级结构的肽在空间上相互接近和相互作用,形成一种折叠的模式,也称为超二级结构[30]。根据MEME分析结果,构建了表示所有NbCP蛋白结构的示意图。如图2所示,motif 1和motif 9存在于除NbCP19外的其他所有NbCP,motif 10存在于除NbCP8、NbCP9和NbCP19外的其他所有NbCP,但同一组内的NbCP成员表现出相似的motif 元件分布,如motif 1、motif 9和motif 10均存在于NbCP11和NbCP12,它们都在同一分支。NbCP蛋白间相似的motif排列表明该组蛋白结构在一个特定的亚家族中是保守的,但大多数保守基序的功能仍有待阐明。总体而言,同一组NbCP成员保守的motif组成和相似的基因结构,结合系统发育分析结果,可以有力地支持群体分类的可靠性。
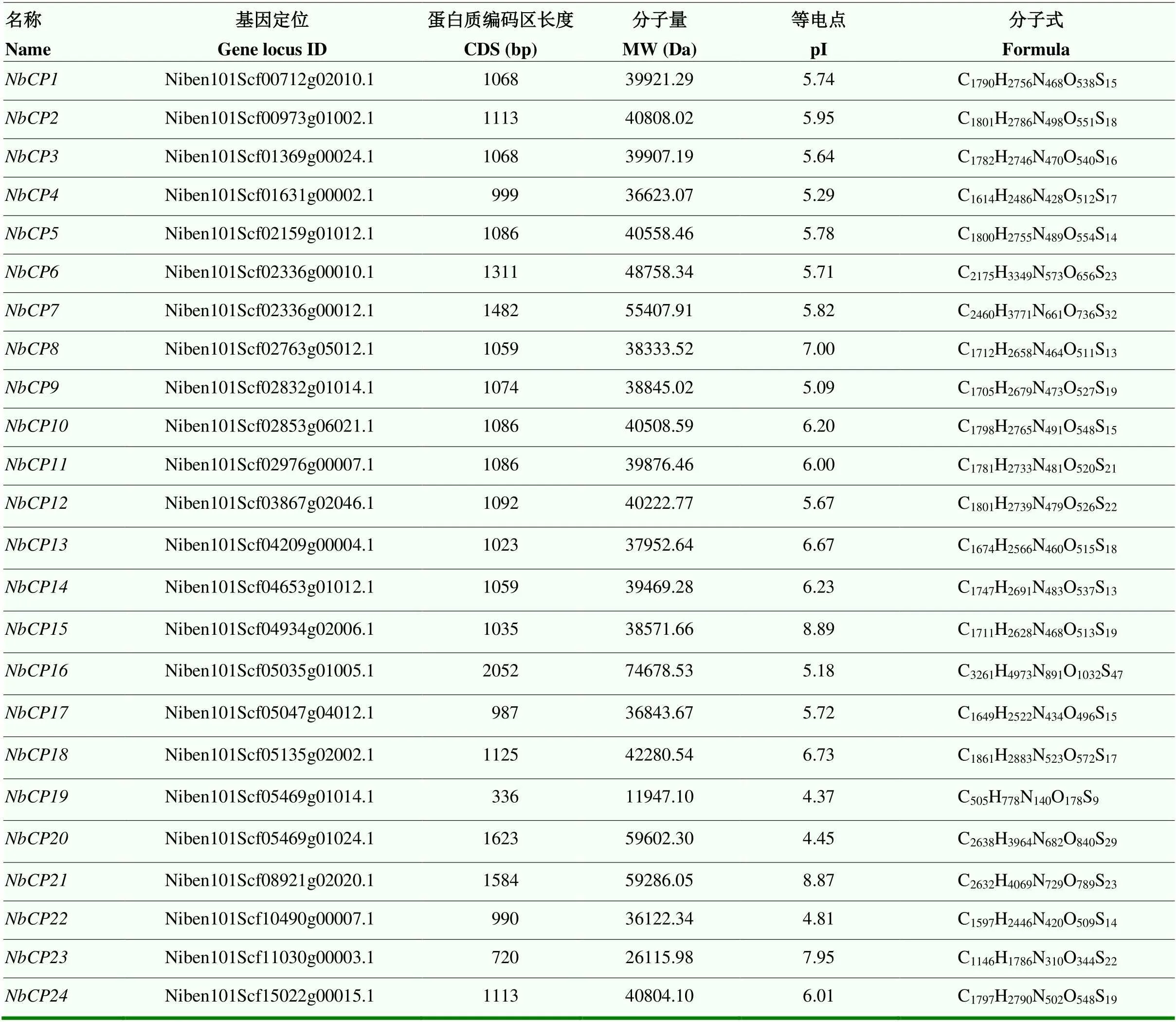
表2 NbCP基因家族鉴定与特征分析
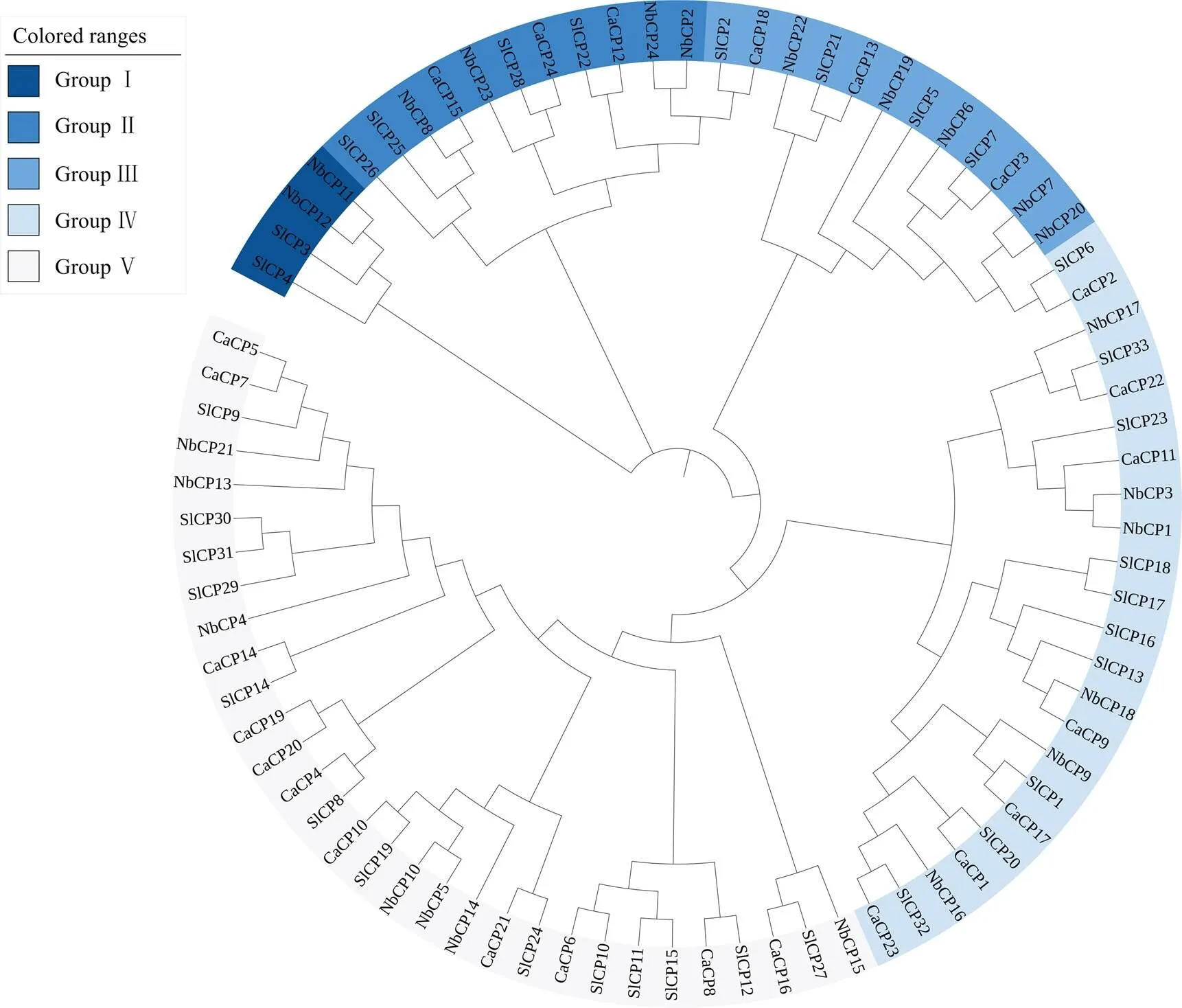
图1 本氏烟、番茄和辣椒CP基因家族系统进化树
对NbCP家族基因的启动子进行顺式作用元件分析,结果显示NbPC家族基因启动子包含35个不同的顺式作用元件,其中光响应元件存在于几乎所有家族中,表明NbCP基因家族受光调控。此外,多个NbCP家族基因启动子含有茉莉酸甲酯(methyl jasmonate,MeJA)、水杨酸甲酯(methyl salicylate,MeSA)、脱落酸(abscisic acid,ABA)、赤霉素(gibberellin,GA)和生长素(auxin,IAA)等激素响应元件(图3),表明NbCP可能受到这些激素的调控。
2.4 TMV侵染后部分NbCP基因的表达分析
为进一步明确NbCP在病毒侵染过程中的作用,结合NbCP启动子的顺式作用元件,从NbCP家族5个亚家族中各挑选出1个NbCP,利用实时荧光定量PCR检测在TMV侵染第5天NbCP基因的表达。结果显示,位于Group II亚家族的和Group I亚家族的在TMV侵染后表达量显著上升,分别上升了2.6倍和1.4倍,其余NbCP基因表达量无显著性差异(图4),表明可能在响应TMV侵染过程中发挥作用。
2.5 NbCP8的克隆与表达分析
上述研究表明表达受到TMV侵染调控,其可能在响应TMV侵染中具有潜在作用。为获得的全长序列,根据茄科作物基因组数据库Sol Genomics Network中报道的序列全长,设计引物克隆得到全长序列。结果显示全长1 059 bp,编码352个氨基酸。上传至NCBI,获得基因序列号ON464162。Cell-PLoc 2.0亚细胞定位预测结果表明NbCP8可能定位于细胞壁和液泡;利用Phyre2预测其蛋白结构,如图5-A所示,发现其与pro-cathepsin h相似性最高,置信度为100%。
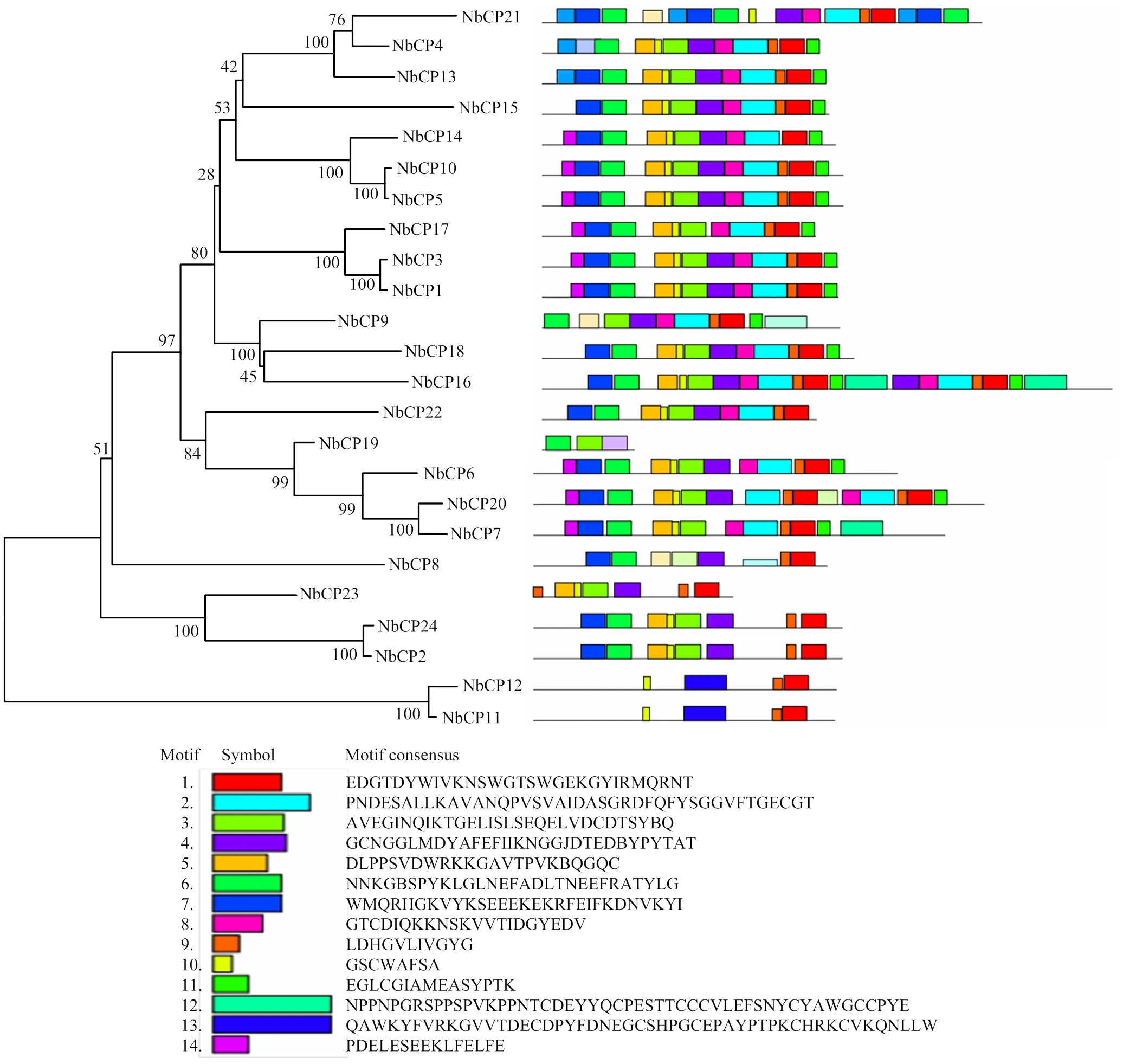
图2 NbCP基因家族的保守基序分析
为明确的表达特征,提取本氏烟根、茎、叶和花的总RNA,实时荧光定量PCR结果显示,在叶中的表达量最高,其次是茎、根和花,且茎、根、花中的表达量相对稳定(图5-B)。
2.6 沉默NbCP8促进TMV-GFP侵染
为进一步明确NbCP8对TMV侵染的影响,利用TRV诱导的基因沉默技术沉默本氏烟内源。以TRV:00为对照,通过农杆菌浸润TRV:NbCP8法对6叶期的本氏烟进行沉默,在沉默14 d后选取系统叶进行实时荧光定量PCR,检测的沉默效率。结果显示,被成功沉默,其表达量仅为对照植株的22%(图6-A)。对沉默植株摩擦接种TMV-GFP,并于接种后第3、4、5天紫外灯下观察沉默对TMV-GFP侵染的影响。结果显示,沉默后TMV-GFP在本氏烟接种叶侵染积累增加,病毒到达系统叶的时间比对照植株早(图6-B),病毒在接种叶及系统叶的含量显著多于对照(图6-C、6-D),表明沉默有利于TMV-GFP侵染,揭示NbCP8可能为植物抗病毒的正调控因子。
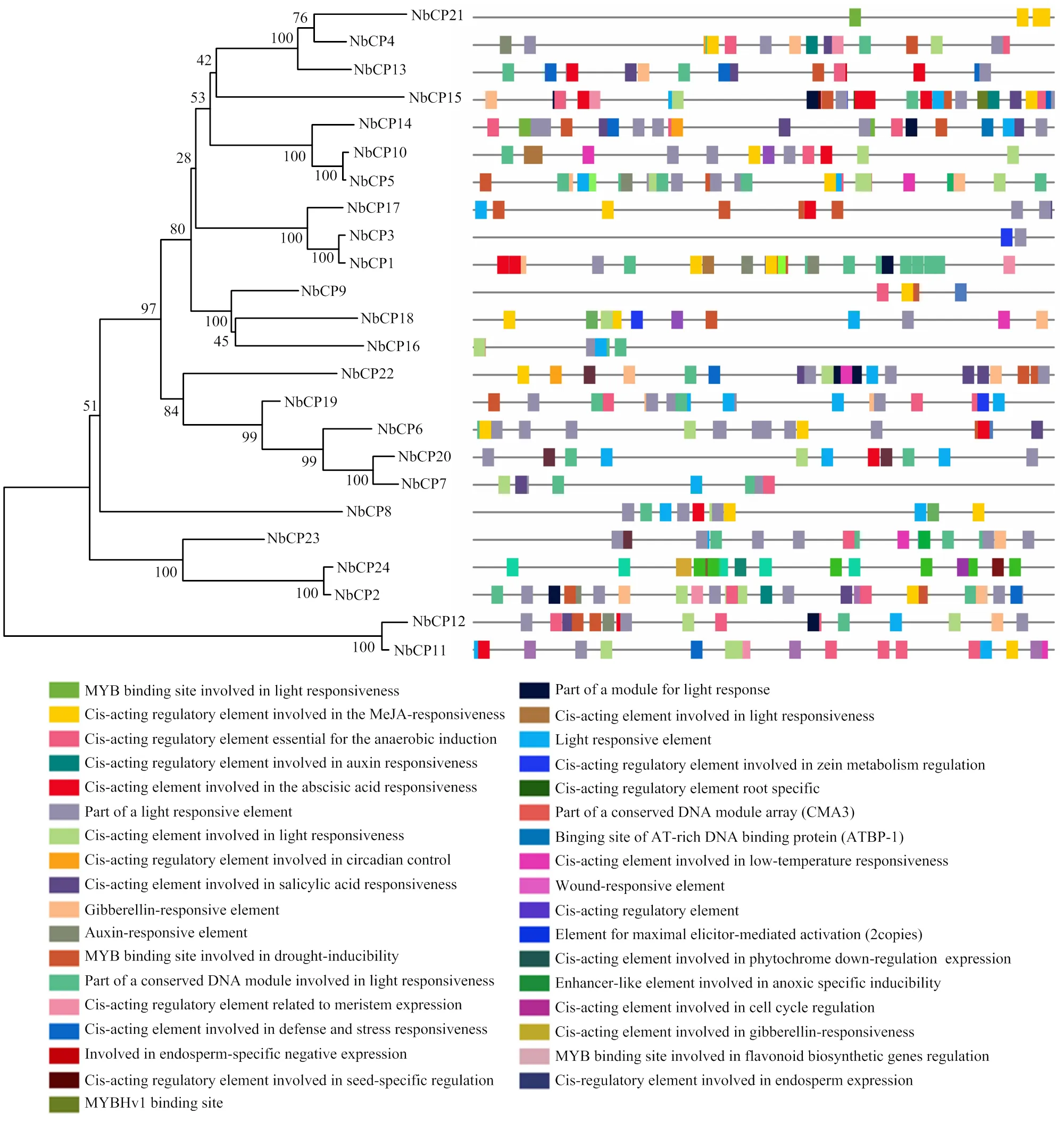
图3 NbCP基因家族启动子顺式作用元件分析
2.7 过表达NbCP8抑制TMV-GFP侵染
为明确过表达对TMV侵染的影响,利用PVX介导的系统过表达技术整株过表达,并在成功过表达植株上进行TMV-GFP接种,以评估过表达对TMV-GFP侵染的影响。结果显示,以空载PVX:00为对照,注射PVX:NbCP8后第10天,处理组中的表达量显著高于对照,为对照的2.1倍(图7-A)。利用摩擦接种法接种TMV-GFP,于接种后第3、4、5天在UV灯下观察TMV-GFP的移动情况,并利用实时荧光定量PCR技术检测TMV-GFP含量。结果如图7-B所示,过表达后接种TMV-GFP第3天,接种叶上的TMV-GFP斑点数明显少于对照,接种TMV-GFP第4、5天时,系统叶上TMV-GFP荧光也明显弱于对照,表明过表达能显著抑制TMV-GFP侵染。实时荧光定量PCR检测发现3 dpi时处理组接种叶TMV-GFP核酸水平显著低于对照,仅为对照的58%;4 dpi时系统叶中TMV-GFP含量也显著低于对照,为对照的70%(图7-C)。Western blot结果显示,5 dpi时过表达植株中TMV-GFP的蛋白含量显著低于对照(图7-D),这与观察到的现象一致。
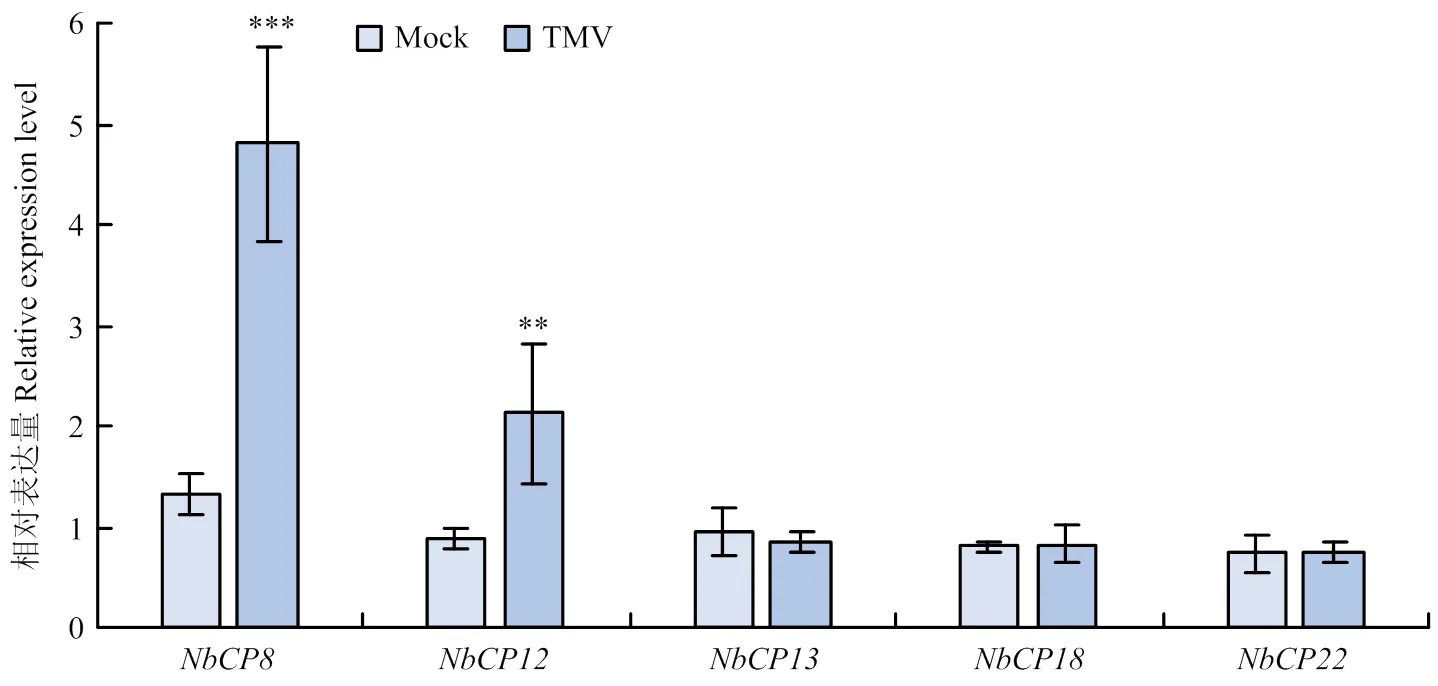
统计分析采用Student’s t检验(**0.001<P <0.01,***P<0.001)。每个处理进行3次生物学重复,每次生物学重复3株植株,数值代表3次生物学重复的平均值±标准误
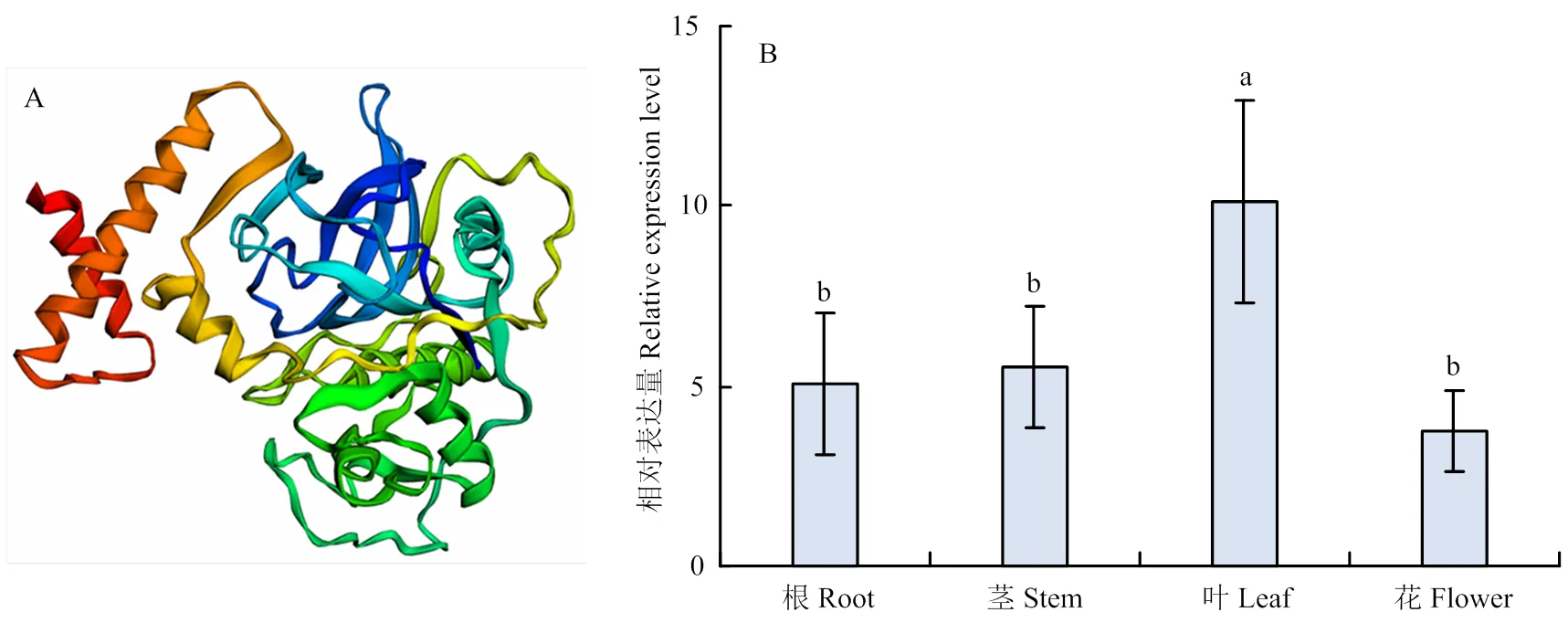
A:NbCP8的蛋白三维结构,模型参数为X:54.411、Y:64.752、Z:55.080 Three-dimensional protein structure of NbCP8, image colored by rainbow N→C terminus, model dimensions (Å): X: 54.411, Y: 64.752, Z: 55.080;B:NbCP8在本氏烟中的组织表达,统计分析采用LSD检验,柱上不同小写字母表示差异显著(P<0.05)。每个处理进行3次生物学重复,每次生物学重复10株植株,数值代表3次生物学重复的平均值±标准误Tissue expression of NbCP8, the statistical analyses were performed using LSD test, different lowercases on the bars indicated significant differences (P<0.05). The experiments were repeated three times with ten plants each time. Values represent means±SE from three biological replications
2.8 NbCP8对植物激素信号途径相关基因表达的影响
为进一步明确NbCP8的抗病毒机制,检测了沉默和过表达后植株中SA信号途径相关基因、,茉莉酸(JA)信号途径相关基因、以及ABA信号途径相关基因和的表达。结果显示,沉默后显著抑制了SA相关基因以及JA相关基因的表达,沉默植株中二者的表达仅为对照植株的1%和50%,对其他基因的表达无显著性影响(图8-A)。过表达后显著提高了和的表达,分别为对照植株的1.7倍和2.4倍,对其他基因的表达无显著性影响(图8-B)。值得注意的是,在沉默和过表达中均呈现显著变化,揭示影响了的表达进而调控SA信号途径,表明可能通过激活SA信号途径参与植株抗病毒防御。
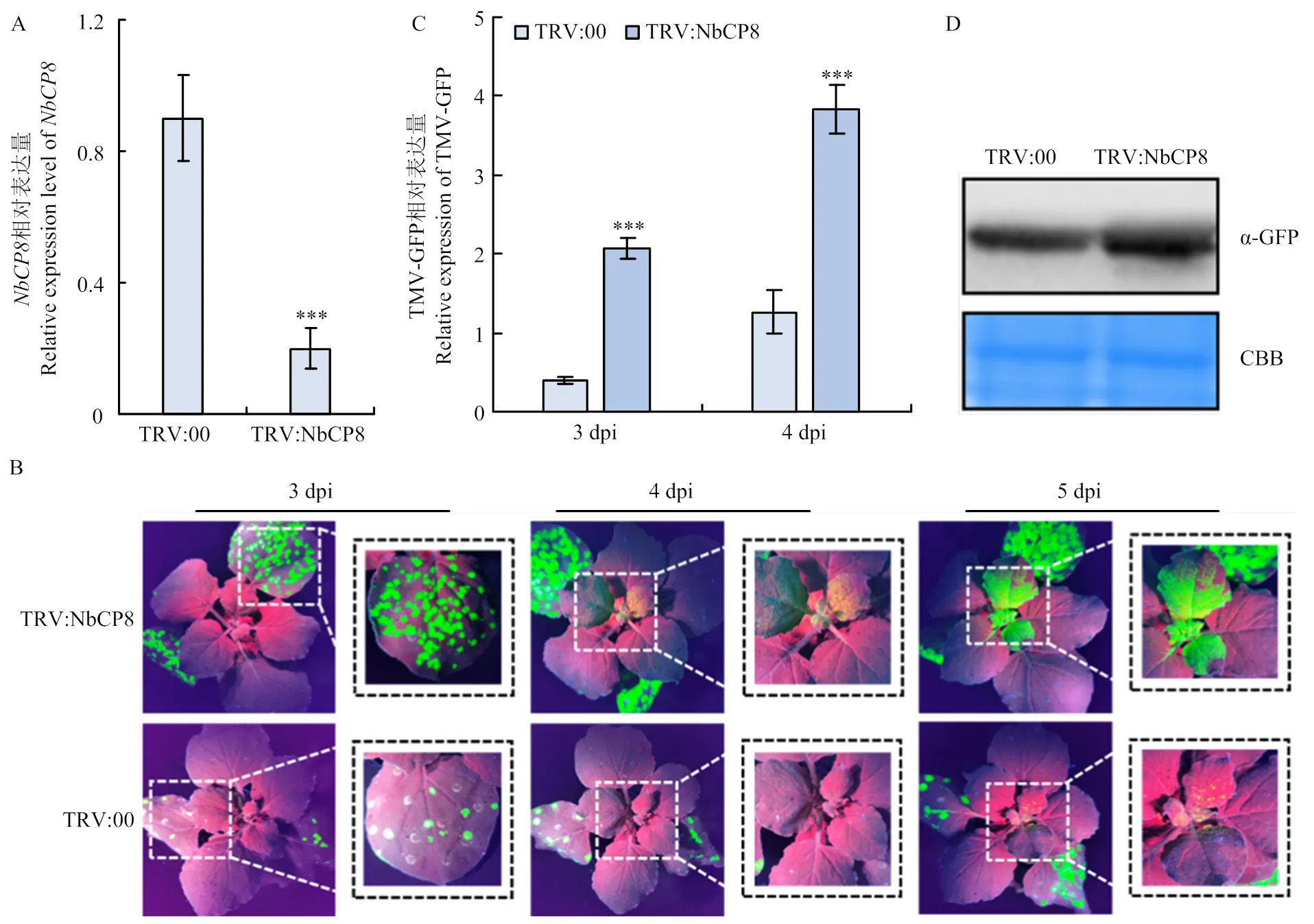
A:TRV:NbCP8的沉默效率检测Silencing efficiency detection in TRV:NbCP8;B:TRV:NbCP8和 TRV:00 接种 TMV-GFP 后的症状图 Symptoms after inoculation with TMV-GFP in TRV:NbCP8 and TRV:00;C:TRV:NbCP8和TRV:00中TMV-GFP含量检测Detection of TMV-GFP content in TRV:NbCP8 and TRV:00;D:Western blot检测TRV:NbCP8和TRV:00接种TMV-GFP后第5天TMV-GFP蛋白含量Western blot detection of TMV-GFP protein content in TRV:NbCP8 and TRV:00。统计分析采用 Student’s t 检验(***P<0.001),每个处理进行 3 次生物学重复,每次生物学重复10株植株,数值代表3次生物学重复的平均值±标准误The statistical analyses were performed using Student’s t-test (***P<0.001). The experiments were repeated three times with ten plants each time. Values represent means±SE from three biological replications
3 讨论
3.1 NbCP参与植物抗病毒响应
TMV是世界范围内危害最为严重的植物病毒之一,被称为“植物癌症”,一旦感染,极难控制[1]。目前仅有少数抗TMV基因被鉴定[31-33],因此,挖掘TMV侵染过程中水平抗性基因至关重要[34]。植物半胱氨酸蛋白酶是一类重要的植物蛋白消化酶,对植物生长发育、衰老和逆境胁迫应答反应起着非常显著的作用[35],低温、干旱、衰老等刺激能不同程度诱导CP基因的表达[36]。烟草在衰老期间的表达显著上升[36];小麦对干旱、高温、低温和高盐胁迫均有显著响应,且对干旱胁迫有强烈的正向响应[37]。本研究发现TMV侵染下和的表达均显著性上升(图4),表明NbCP同样参与响应植物RNA病毒侵染,并且可被小分子抗病毒化学药剂CHI诱导表达。多项研究表明编码植物半胱氨酸蛋白酶基因的启动子常含有胁迫响应元件[38],拟南芥编码半胱氨酸蛋白酶基因和启动子包含ABRE和DRE元件[39],启动子包含ABRE元件,使得这些基因通过介导ABA信号途径参与胁迫响应[40-41],而启动子则包含低温诱导元件CRT,诱导其在低温、干旱和ABA下差异表达[42]。本研究结果表明,NbCP家族基因启动子包含光刺激、干旱、低温等诱导元件,且、、、等多个基因启动子包含MeJA、SA、ABA、GA、IAA等响应元件,揭示这些基因可能受到激素调控(图3)。值得注意的是,启动子包含多个MeJA和ABA响应元件,揭示其可能在植物抗逆胁迫中起到关键作用。
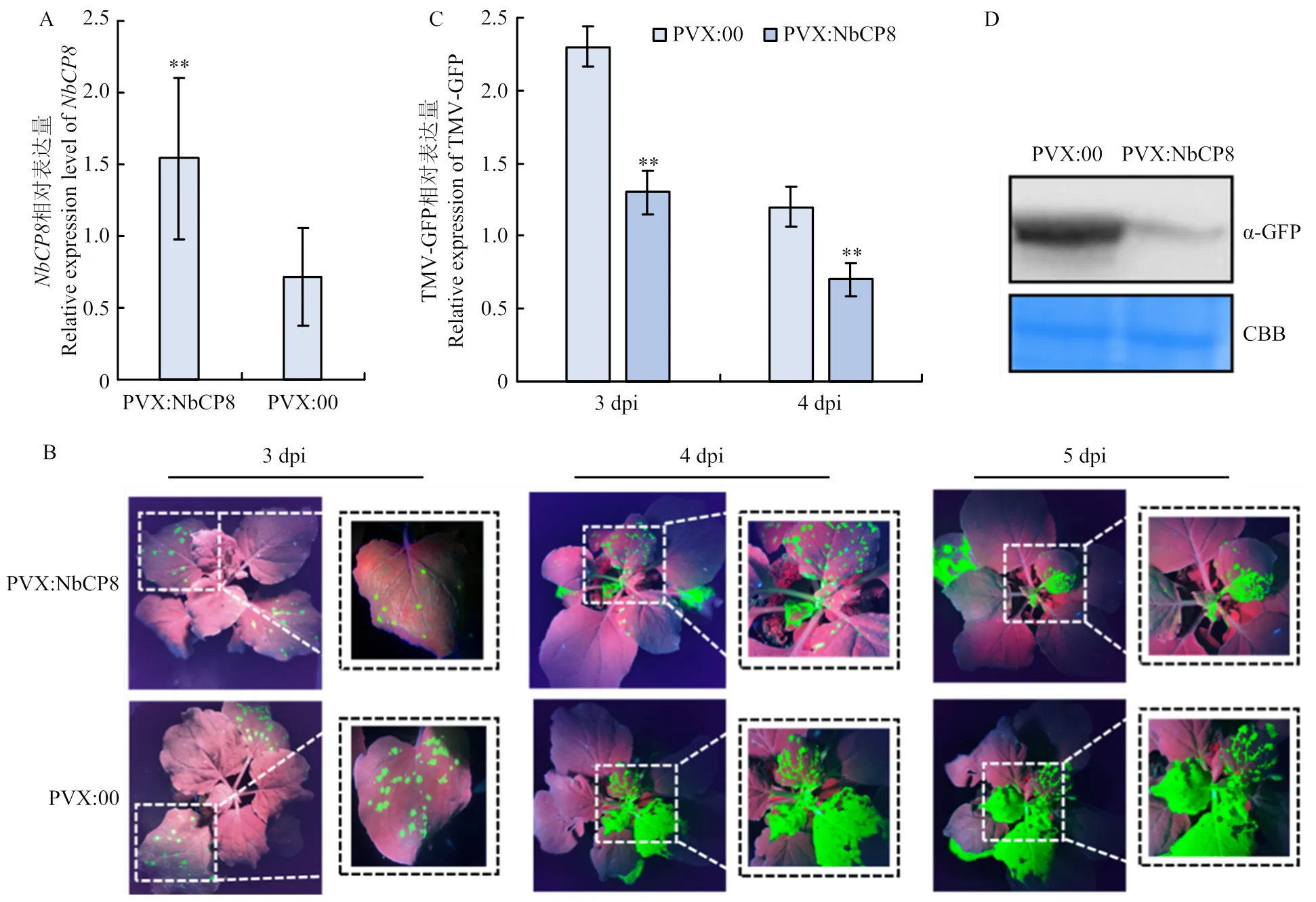
A:PVX:NbCP8 和PVX:00 中NbCP8的表达检测Detection of NbCP8 expression in PVX:NbCP8 and PVX:00;B:PVX:NbCP8和 PVX:00 接种 TMV-GFP 后的症状图 Symptoms after inoculation with TMV-GFP in PVX:NbCP8 and PVX:00;C:PVX:NbCP8和PVX:00 中TMV-GFP含量检测Detection of TMV-GFP content in PVX:NbCP8 and PVX:00;D:Western blot检测PVX:NbCP8和PVX:00接种TMV-GFP后第5天TMV-GFP蛋白含量Western blot detection of TMV-GFP protein content in PVX:NbCP8 and PVX:00。统计分析采用 Student’s t 检验(**0.001<P<0.01),每个处理进行 3 次生物学重复,每次生物学重复10株植株,数值代表3次生物学重复的平均值±标准误The statistical analyses were performed using Student’s t-test (**0.001<P<0.01). The experiments were repeated three times with ten plants each time. Values represent means±SE from three biological replications
3.2 NbCP8为植物抗病毒正调控因子
已有研究表明植物半胱氨酸蛋白酶参与多种生物与非生物胁迫。小麦的表达受水分胁迫、盐胁迫以及低温胁迫[43],柑橘也受脱水胁迫、盐胁迫以及低温胁迫的诱导表达[44]。玉米、和表达受到黑穗病菌效应蛋白Pit2和半胱氨酸蛋白酶抑制物CC9抑制[8-9],其活性与SA相关的植物防御直接相关;烟草和在炭疽病菌()侵染72 h后被诱导表达,而沉默这两个基因则增强了炭疽病菌的侵染[45]。同样,半胱氨酸蛋白酶在植物病毒侵染过程中起重要作用。番茄SlCYP1与TYLCV的V2互作,可能影响V2诱导的基因沉默[6,46]。上述结果表明,植物半胱氨酸蛋白酶在植物抗性防御中起正调控作用。在本研究中,和的表达受TMV侵染诱导(图4),并且沉默促进TMV-GFP侵染(图6),而过表达抑制TMV-GFP侵染(图7),表明NbCP8同样也作为植物正调控因子抑制RNA病毒的侵染。
3.3 NbCP8通过诱导SA途径参与抗病毒防御
植物激素是植物内源性微量生长调节分子的总称,其化学结构简单,但生理作用极其复杂。温玉霞等研究表明本氏烟激素通路网络可参与抵抗病毒侵染[47],其中SA是植物中最重要的抗逆激素[48]。SA是一种酚类激素,是植物响应生物和非生物胁迫的重要信号分子,可诱导植物对这些胁迫产生抗性和防御[49]。PR蛋白被称为致病相关蛋白,对植物抗性防御至关重要[50]。当病原菌侵染植物时,会诱导植物体内PR蛋白的表达,PR蛋白的产生在一定程度上增强了植物的防御能力[51]。PR蛋白一般在植物侵染部位形成,不同的PR蛋白具有不同的功能,但这些PR蛋白都被认为是SA途径的重要标志[52]。其中PR1具有抑制病毒扩散、防止真菌入侵和保护植物免受逆境胁迫的作用[53]。本研究结果显示,沉默抑制了的表达,而过表达则促进了的表达(图8)。同样,黑穗病菌效应子 Pit2 靶向玉米半胱氨酸蛋白酶CP2,其活性与SA相关的植物防御直接相关[8],这些结果表明植物半胱氨酸蛋白酶会诱导SA途径参与植物抗性防御。前期试验表明CHI依赖于SA途径诱导本氏烟抗病毒[11-12],NbCP8可能是CHI参与SA途径的一个靶点,这为利用化合物调控作物抗病性提供了参考。
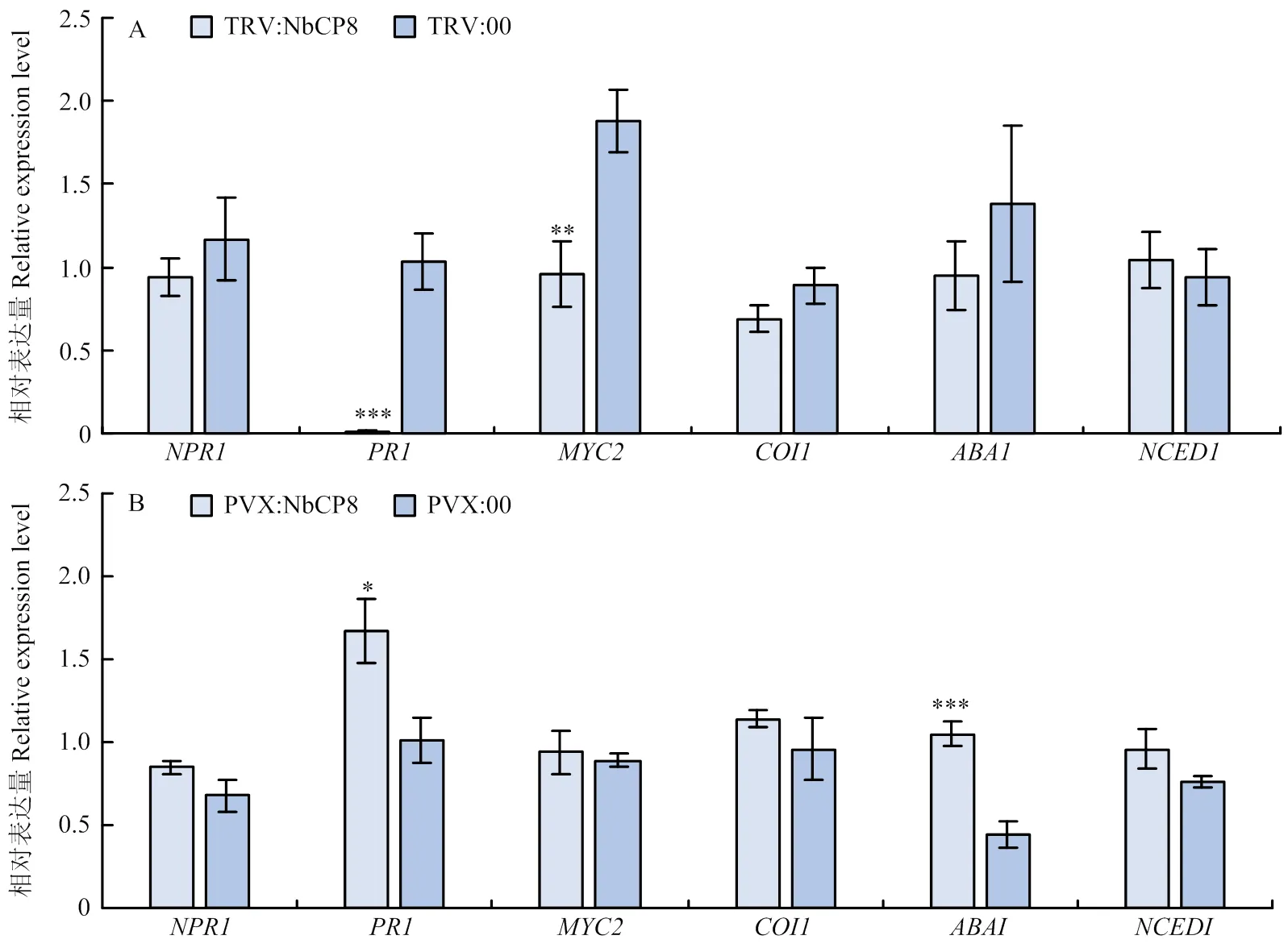
A:TRV:NbCP8中水杨酸、茉莉酸和脱落酸相关基因的表达Expression of SA-, JA- and ABA-related genes in TRV:NbCP8 plant;B:PVX:NbCP8中水杨酸、茉莉酸和脱落酸相关基因的表达Expression of SA-, JA- and ABA-related genes in PVX:NbCP8 plant。统计分析采用 Student’s t 检验(*0.01<P<0.05,**0.001<P<0.01,***P<0.001),每个处理进行 3 次生物学重复,每次生物学重复10株植株,数值代表3次生物学重复的平均值±标准误The statistical analyses were performed using Student’s t-test (*0.01<P<0.05, **0.001<P<0.01, ***P<0.001). The experiments were repeated three times with ten plants each time. Values represent means±SE from three biological replications
4 结论
本氏烟NbCP基因家族共有24个成员,分列5个亚家族,每个亚家族拥有相似的Motif结构。来自不同亚家族的、、、、不同程度响应了TMV侵染,其中响应程度最强。在叶中的表达量最高,沉默促进TMV-GFP侵染,而过表达则通过诱导SA信号途径抑制TMV-GFP侵染。NbCP8通过介导SA信号途径参与植物抗RNA病毒。
[1] Scholthof K B, Adkins S, Czosnek H, Palukaitis P, Jacquot E, Hohn T, Hohn B, Saunders K, Candresse T, Ahlquist P, Hemenway C, Foster G. Top 10 plant viruses in molecular plant pathology. Molecular Plant Pathology, 2011, 12(9): 938-954.
[2] CREAGER A N, Scholthof K B, Citovsky V, Scholthof H B. Tobacco mosaic virus: pioneering research for a century. The Plant Cell, 1999, 11(3): 301-308.
[3] Shindo T, Misas-Villamil J C, Hörger A C, Song J, van der Hoorn R A L. A role in immunity forcysteine protease RD21, the ortholog of the tomato immune protease C14. PLoS ONE, 2012, 7(1): e29317.
[4] Bar-Ziv A, Levy Y, Hak H, Mett A, Belausov E, Citovsky V, Gafni Y. The tomato yellow leaf curl virus(TYLCV) V2 protein interacts with the host papain-like cysteine protease CYP1. Plant Signaling & Behavior, 2012, 7(8): 983-989.
[5] Misas-Villamil J C, van der Hoorn R A L, Doehlemann G. Papain-like cysteine proteases as hubs in plant immunity. New Phytologist, 2016, 212(4): 902-907.
[6] Bar-Ziv A, Levy Y, Citovsky V, Gafni Y. The tomato yellow leaf curl virus(TYLCV) V2 protein inhibits enzymatic activity of the host papain-like cysteine protease CYP1. Biochemical and Biophysical Research Communications, 2015, 460(3): 525-529.
[7] Bernoux M, Timmers T, Jauneau A, Brière C, De Wit P, Marco Y, Deslandes L. RD19, ancysteine protease required for RRS1-R-mediated resistance, is relocalized to the nucleus by thePopP2 effector. The Plant Cell, 2008, 20(8): 2252-2264.
[8] Mueller A N, Ziemann S, Treitschke S, Aßmann D, Doehlemann G. Compatibility in the-maize interaction requires inhibition of host cysteine proteases by the fungal effector Pit2. PLoS Pathogens, 2013, 9(2): e1003177.
[9] van der Linde K, Mueller A N, Hemetsberger C, Kashani F, van der Hoorn R A L, Doehlemann G. The maize cystatin CC9 interacts with apoplastic cysteine proteases. Plant Signaling & Behavior, 2012, 7(11): 1397-1401.
[10] van der Linde K, Hemetsberger C, Kastner C, Kaschani F, van der Hoorn R A L, Kumlehn J, Doehlemann G. A maize cystatin suppresses host immunity by inhibiting apoplastic cysteine proteases. The Plant Cell, 2012, 24(3): 1285-1300.
[11] Lv X, Xiang S, Wang X, Wu L, Liu C, Yuan M, Gong W, Win H, Hao C, Xue Y, Ma L, Cheng D, Sun X. Synthetic chloroinconazide compound exhibits highly efficient antiviral activity against tobacco mosaic virus. Pest Management Science, 2020, 76(11): 3636-3648.
[12] Lv X, Yuan M, Pei Y, Liu C, Wang X, Wu L, Cheng D, Ma X, Sun X. The enhancement of antiviral activity of chloroinconazide by aglinate-based nanogel and its plant growth promotion effect. Journal of Agricultural and Food Chemistry, 2021, 69(17): 4992-5002.
[13] Liu Y, Schiff M, Marathe R, Dinesh-Kumar S P. Tobacco,andlike genes are required for-mediated resistance to tobacco mosaic virus. The Plant Journal, 2002, 30(4): 415-429.
[14] Fernandez-Pozo N, Menda N, Edwards J D, Saha S, Tecle I Y, Strickler S R, Bombarely A, Fisher-York T, Pujar A, Foerster H, Yan A, Mueller L A. The Sol Genomics Network (SGN)—from genotype to phenotype to breeding. Nucleic Acids Research, 2015, 43(Database issue): D1036-D1041.
[15] Liu C, Peng H, Li X, Liu C, Lv X, Wei X, Zou A, Zhang J, Fan G, Ma G, Ma L, Sun X. Genome-wide analysis of NDR1/ HIN1-like genes in pepper (L.) and functional characterization ofunder biotic and abiotic stresses. Horticulture Research, 2020, 7: 93.
[16] Letunic I, Khedkar S, Bork P. SMART: recent updates, new developments and status in 2020. Nucleic Acids Research, 2021, 49(D1): D458-D460.
[17] Olonen A, Kalkkinen N, Paulin L. A new type of cysteine proteinase inhibitor—the salarin gene from(L.) and(). Biochimie, 2003, 85(7): 677-681.
[18] Yamamoto Y, Kurata M, Watabe S, Murakami R, Takahashi S Y. Novel cysteine proteinase inhibitors homologous to the proregions of cysteine proteinases. Current Protein & Peptide Science, 2002, 3(2): 231-238.
[19] Peng H, Pu Y, Yang X, Wu G, Qing L, Ma L, Sun X. Overexpression of a pathogenesis-related geneconfers resistance totobacco mosaic virus inby potentially activating the jasmonic acid signaling pathway. Plant Science, 2019, 283: 147-156.
[20] Tamura K, Stecher G, Kumar S. MEGA11: molecular evolutionary genetics analysis version 11. Molecular Biology and Evolution, 2021, 38(7): 3022-3027.
[21] Liu C, Pu Y, Peng H, Lv X, Tian S, Wei X, Zhang J, Zou A, Fan G, Sun X. Transcriptome sequencing reveals that photoinduced geneaffects the expression ofto response to virus infection in. Physiological and Molecular Plant Pathology, 2021, 114: 101613.
[22] Lescot M, Déhais P, Thijs G, Marchal K, Moreau Y, Van de Peer Y, Rouzé P, Rombauts S. PlantCARE, a database of plant cis-acting regulatory elements and a portal to tools foranalysis of promoter sequences. Nucleic Acids Research, 2002, 30(1): 325-327.
[23] Chen C, Chen H, Zhang Y, Thomas H R, Frank M H, He Y, Xia R. TBtools: an integrative toolkit developed for interactive analyses of big biological data. Molecular Plant, 2020, 13(8): 1194-1202.
[24] Bailey T L, Boden M, Buske F A, Frith M, Grant C E, Clementi L, Ren J, Li W W, Noble W S. MEME Suite: tools for motif discovery and searching. Nucleic Acids Research, 2009, 37(Web Server issue): W202-W208.
[25] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtmethod. Method, 2001, 25(4): 402-408.
[26] Liu Y, Nakayama N, Schiff M, Litt A, Irish V F, Dinesh- Kumar S P. Virus induced gene silencing of a DEFICIENS ortholog in. Plant Molecular Biology, 2004, 54(5): 701-711.
[27] Fernandez-Pozo N, Rosli H G, Martin G B, Mueller L A. The SGN VIGS tool: user-friendly software to design virus-induced gene silencing (VIGS) constructs for functional genomics. Molecular Plant, 2015, 8(3): 486-488.
[28] Liu C, Tian S, Lv X, Pu Y, Peng H, Fan G, Ma X, Ma L, Sun X.asparagine synthetase associates with IP-L and confers resistance against tobacco mosaic virus via the asparagine-induced salicylic acid signalling pathway. Molecular Plant Pathology, 2022, 23(1): 60-77.
[29] 彭浩然, 潘琪, 魏周玲, 蒲运丹, 张永至, 吴根土, 青玲, 孙现超. 番茄抗性相关基因的克隆、表达与抗病毒功能. 中国农业科学, 2017, 50(7): 1242-1251.
PENG H R, PAN Q, WEI Z L, PU Y D, ZHANG Y Z, WU G T, QING L, SUN X C. Cloning, expression and anti-virus function analysis of tomato resistance-related gene. Scientia Agricultura Sinica, 2017, 50(7): 1242-1251. (in Chinese)
[30] Zhang J, Zou A, Wen Y, Wei X, Liu C, Lv X, Ma X, Fan G, Sun X., a novelcalmodulin-like gene, negatively regulates plant immunity topathogens. Scientia Horticulturae, 2022, 299: 111049.
[31] Huang C. From player to pawn: viral avirulence factors involved in plant immunity. Viruses, 2021, 13(4): 688.
[32] 刘昌云, 李欣羽, 田绍锐, 王靖, 裴悦宏, 马小舟, 樊光进, 汪代斌, 孙现超. 番茄的克隆、表达与抗病毒功能. 中国农业科学, 2021, 54(20): 4348-4357.
LIU C Y, LI X Y, TIAN S R, WANG J, PEI Y H, MA X Z, FAN G J, WANG D B, SUN X C. Cloning, expression and anti-virus function analysis of. Scientia Agricultura Sinica, 2021, 54(20): 4348-4357. (in Chinese)
[33] Whitham S, Dinesh-Kumar S P, Choi D, Hehl R, Corr C, Baker B. The product of the tobacco mosaic virus resistance gene: Similarity to toll and the interleukin-1 receptor. Cell, 1994, 78(6): 1101-1115.
[34] Marathe R, Anandalakshmi R, Liu Y, Dinesh-Kumar S P. The tobacco mosaic virus resistance gene,. Molecular Plant Pathology, 2002, 3(3): 167-172.
[35] 张洁琳, 付畅. 半胱氨酸蛋白酶及半胱氨酸蛋白酶抑制剂对逆境胁迫的应答. 分子植物育种, 2018, 16(13): 4453-4459.
Zhang J l, Fu C. Response of cysteine protease and cysteine protease inhibitor to adverse stress. Molecular Plant Breeding, 2018, 16(13): 4453-4459. (in Chinese)
[36] Ueda T, Seo S, Ohashi Y, Hashimoto J. Circadian and senescence-enhanced expression of a tobacco cysteine protease gene. Plant Molecular Biology, 2000, 44(5): 649-657.
[37] 张炳慧, 高翔, 杨明明, 王宪国, 何庆梦, 姚晓露, 李晓燕, 赵万春, 董剑. 小麦基因的克隆及其参与非生物胁迫的表达分析. 麦类作物学报, 2019, 39(5): 513-519.
ZHANG B H, GAO X, YANG M M, WANG X G, HE Q M, YAO X L, LI X Y, ZHAO W C, DONG J. Cloning ofgene and its expression in abiotic stress. Journal of Triticeae Crops, 2019, 39(5): 513-519. (in Chinese)
[38] 闫龙凤, 杨青川, 韩建国, 刘志鹏. 植物半胱氨酸蛋白酶研究进展. 草业学报, 2005, 14(5): 11-19.
YAN L f, YANG Q c, HAN J g, LIU Z p. Summary of cysteine protease in plants. Acta Prataculturae Sinica, 2005, 14(5): 11-19. (in Chinese)
[39] Narusaka Y, Nakashima K, Shinwari Z K, Sakuma Y, Furihata T, Abe H, Narusaka M, Shinozaki K, Yamaguchi-Shinozaki K. Interaction between two cis-acting elements, ABRE and DRE, in ABA-dependent expression ofgene in response to dehydration and high-salinity stresses. The Plant Journal, 2003, 34(2): 137-148.
[40] Yamaguchi-Shinozaki K, Shinozaki K. A novel cis-acting element in angene is involved in responsiveness to drought, low-temperature, or high-salt stress. The Plant Cell, 1994, 6(2): 251-264.
[41] Uno Y, Furihata T, Abe H, Yoshida R, Shinozaki K, Yamaguchi-Shinozaki K.basic leucine zipper transcription factors involved in an abscisic acid-dependent signal transduction pathway under drought and high-salinity conditions. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(21): 11632-11637.
[42] Baker S S, Wilhelm K S, Thomashow M F. The 5′-region ofhas cis-acting elements that confer cold-, drought- and ABA-regulated gene expression. Plant Molecular Biology, 1994, 24(5): 701-713.
[43] Zang Q W, Wang C X, Li X Y, Guo Z A, Jing R L, Zhao J, Chang X P. Isolation and characterization of a gene encoding a polyethylene glycol-induced cysteine protease in common wheat. Journal of Biosciences, 2010, 35(3): 379-388.
[44] 马岩岩, 张军, 陈娇, 张凌云, 朱世平, 闫树堂, 钟广炎. 柑橘半胱氨酸蛋白酶基因的分离、亚细胞定位及表达分析. 园艺学报, 2014, 41(4): 621-630.
MA Y y, ZHANG J, CHEN J, ZHANG L y, ZHU S p, YAN S t, ZHONG G y. Isolation, subcellular localization and expression analysis of a citrus cysteine protease gene,. Acta Horticulturae Sinica, 2014, 41(4): 621-630. (in Chinese)
[45] Hao L, Hsiang T, Goodwin P H. Role of two cysteine proteinases in the susceptible response oftoand the hypersensitive response topv.. Plant Science, 2006, 170(5): 1001-1009.
[46] Li M, Li C, Jiang K, Li K, Zhang J, Sun M, Wu G, Qing L. Characterization of pathogenicity-associated V2 protein of tobacco curly shoot virus. International Journal of Molecular Sciences, 2021, 22(2): 923.
[47] 温玉霞, 张坚, 王琴, 王靖, 裴悦宏, 田绍锐, 樊光进, 马小舟, 孙现超. 本氏烟的克隆、表达及在TMV侵染过程中的功能. 中国农业科学, 2022, 55(18): 3543-3555.
WEN Y X, ZHANG J, WANG Q, WANG J, PEI Y H, TIAN S R, FAN G J, MA X Z, SUN X C. Cloning, expression and anti-TMV function analysis of. Scientia Agricultura Sinica, 2022, 55(18): 3543-3555. (in Chinese)
[48] Pieterse C M J, Leon-Reyes A, Van der Ent S, Van Wees S C M. Networking by small-molecule hormones in plant immunity. Nature Chemical Biology, 2009, 5(5): 308-316.
[49] Ding P, Ding Y. Stories of salicylic acid: a plant defense hormone. Trends in Plant Science, 2020, 25(6): 549-565.
[50] Bol J F, Linthorst H J M, Cornelissen B J C. Plant pathogenesis-related proteins induced by virus infection. Annual Review of Phytopathology, 1990, 28: 113-138.
[51] Cutt J R, Harpster M H, Dixon D C, Carr J P, Dunsmuir P, Klessig D F. Disease response to tobacco mosaic virus in transgenic tobacco plants that constitutively express the pathogenesis- relatedgene. Virology, 1989, 173(1): 89-97.
[52] 魏周玲, 彭浩然, 潘琪, 张永至, 蒲运丹, 吴根土, 青玲, 孙现超. 核糖体失活蛋白(-MC)亚细胞定位及对TMV的抑制作用. 中国农业科学, 2017, 50(5): 840-848.
WEI Z L, PENG H R, PAN Q, ZHANG Y Z, PU Y D, WU G T, QING L, SUN X C. Subcellular localization of the ribosome-inactivating protein-MC and its antiviral effect on TMV. Scientia Agricultura Sinica, 2017, 50(5): 840-848. (in Chinese)
[53] Rauscher M, Ádám A L, Wirtz S, Guggenheim R, Mendgen K, Deising H B. PR-1 protein inhibits the differentiation of rust infection hyphae in leaves of acquired resistant broad bean. The Plant Journal, 1999, 19(6): 625-633.
Characteristics of cysteine proteinase gene family inand its function during TMV infection
PEI YueHong, LI FengWei, LIU WeiNa, WEN YuXia, ZHU Xin, TIAN ShaoRui, FAN GuangJin, MA XiaoZhou, SUN XianChao
Chongqing Key Laboratory of Plant Disease Biology, College of Plant Protection, Southwest University, Chongqing 400715
【Objective】The objective of this study is to identify the effects ofcysteine proteinase (CP) induced by the antiviral compound chloroinconazide (CHI) on the infection of tobacco mosaic virus (TMV) and its gene family characteristics, and to provide a theoretical basis for understanding the antiviral molecular mechanism and chemical regulation of Solanaceae crops.【Method】Genome-wide analysis of NbCP genes was identified from Sol Genomics Network and the evolutionary relationships, motifs and promoter cis-acting elements of NbCP gene family were analyzed by bioinformatics. According to the results of bioinformatics analysis, the expression of NbCP genes after TMV infection was analyzed by real-time fluorescence quantitative PCR (qRT-PCR), so as to screen out potential disease-resistant protein. The effect of this key protein on TMV-GFP infection was verified by gene silencing mediated by tobacco rattle virus (TRV) and gene overexpression mediated by potato virus X (PVX). qRT-PCR and biochemical methods were combined to determine the antiviral mechanism of this key protein.【Result】There were 24 NbCP genes in, which were named-according to their chromosome location. The phylogenetic analysis showed that the NbCPs were divided into five subfamilies, of which Group V contained seven NbCPs, while Group I contained only two NbCPs. Motif analyses showed that NbCPs of different branches had similar motif distribution. Promoter cis-acting elements analysis showed that NbCP family genes were all regulated by light, and several NbCP family gene promoters contained hormone response elements such as methyl jasmonate (MeJA), methyl salicylate (MeSA), abscisic acid (ABA), gibberellin (GA) and auxin (IAA).Combined with bioinformatics analysis, five key potential disease-resistant related NbCP genes (,,,, and) were screened from the above subfamilies, and the expression of these NbCP genes under TMV infection at the 5th day was analyzed by qRT-PCR, and it was found that the expression difference ofwas the greatest, which increased 2.6 times. The expression ofwas highest in leaves, followed by stems and roots, and lowest in flowers. TRV-mediatedsilencing significantly increased TMV-GFP infection, while PVX-mediatedoverexpression significantly inhibited TMV-GFP infection, suggesting that NbCP8 acts as a positive regulatory factor in plant to inhibit virus infection. Furthermore, silencingsignificantly inhibited the expression of salicylic acid (SA) signaling pathway related geneand jasmonic acid (JA) signaling pathway related gene, while the expressions of,, and ABA related genes,were not significantly affected. The overexpression ofenhanced the expression ofand, but had no significant effect on expression of,,and. 【Conclusion】NbCPs are involved in plant stress defense, while NbCP8 plays a key role in TMV defense, which can induce SA signaling pathway to participate in the defense. The research results will provide evidence for the molecular mechanism of antiviral in Solanaceae crops.
;genome-wide; cysteine proteinase (CP); NbCP8; tobacco mosaic virus (TMV)

10.3864/j.issn.0578-1752.2022.21.008
2022-06-28;
2022-07-19
国家自然科学基金(31870147)、中国烟草总公司重庆公司科技项目(A20201NY02-1306,B20202NY1338,B20211-NY1315)、广西中烟工业有限责任公司项目(2021450000340029)、国家大学生创新创业训练项目(202210635030)
裴悦宏,E-mail:pjustdoit@163.com。通信作者孙现超,E-mail:sunxianchao@163.com
(责任编辑 岳梅)

